先天性免疫作为机体抗感染免疫的第一道防线,在机体的抗病毒过程中发挥了重要的作用。机体通过细胞的模式识别受体(Pattern recognition receptors,PRRs)识别病毒的遗传物质病原体相关分子模式(Pattern associated molecular patterns,PAMPs)[1],进一步激活NF-κB、IRF-3、IRF-7等诱导Ⅰ型干扰素的产生,Ⅰ型干扰素通过识别细胞干扰素受体激活JAK/STAT信号通路,诱导数百种干扰素下游基因的表达,从而发挥抗病毒作用。其中,Viperin作为干扰素激活信号通路下游基因,具有广谱的抗病毒作用。Viperin(Virus inhibitory protein,Endoplasmic reticulum-associated,Interferon-inducible)是内质网相关的干扰素诱导的病毒抑制蛋白,被干扰素刺激基因RSAD2(Radical SAM domain-containing 2)所编码[2]。该蛋白存在于机体多种组织细胞内,病毒感染后可通过IFN依赖途径和非依赖途径诱导Viperin的大量表达。研究证明,该蛋白对多种病毒具有抵抗作用。其中,包括肿大细胞病毒[3]、疱疹病毒[4]、森林脑炎病毒[5]、人免疫缺陷病毒(HIV)[6]、狂犬病毒[7]、丙型肝炎病毒(HCV)[8]、西尼罗病毒(WNV)[9]、登革热病毒(DENV)[10-11]、基孔肯雅病毒(CHIKV)[12]、甲型流感病毒(Influence A virus)[13]、人巨细胞病毒(HCMV)[14-15]、呼吸道合胞病毒[16] 、马传染性贫血病毒(EIAV)[17]等。该蛋白抑制了病毒的入胞、复制与转录、出芽等各个过程。前期相关猴源Viperin在MARC-145细胞内的抗病毒作用的研究[18]证明,其对PRRSV复制具有显著的抗病毒作用。
为了进一步研究猪源Viperin蛋白在猪体内对各种病毒的抵抗作用与相关抗病毒机制,并为开发新的抗病毒药物提供思路。本试验成功克隆了猪源Viperin基因,选取抗原性较好的蛋白区段进行表达,制备了鼠抗猪Viperin蛋白的多克隆抗体,旨在为后续试验奠定基础。
1 材料和方法
1.1 细胞与载体
MARC-145细胞(非洲绿猴肾细胞系)、PK-15细胞(猪肾传代细胞系)、大肠杆菌DH5α、BL21、pET-28a+原核表达载体、表达猴源和猪源Viperin蛋白的真核表达载体pVAX-mVIP和pCI-sVIP,均由南京农业大学动物医学院传染病实验室制备保存。9日龄的BABL/c小鼠购自南通大学实验动物中心。
1.2 主要试剂
DMEM细胞培养液、新生小牛血清购自GibcoTMA公司,琼脂糖凝胶回收试剂盒、质粒提取试剂盒购自Axygen公司,RNA提取试剂盒购自OMEGA公司,M-MLV反转录酶购自Promega公司,pEASY-Blunt Simple Cloning Kit购自北京全式金生物技术有限公司,Prime STAR SH高保真预混酶、T4连接酶购自南京诺唯赞生物技术公司,羊抗鼠HRP-lgG二抗、IFIT标记的羊抗鼠荧光二抗购自上海碧云天生物公司,ECL化学发光试剂盒购自Pierce公司,HindⅢ、XhoⅠ、DNA Marker、琼脂糖、胰蛋白胨、酵母提取物等购自大连TaKaRa生物有限公司。其他常规试剂为国产或进口分析纯。
1.3 干扰素处理PK-15细胞
将PK-15细胞接种至24孔板,平均每孔5×105个细胞,次日待细胞融合度达到100%时,更换新鲜的含10%小牛血清的DMEM培养液;每孔加入终浓度为3 000 U/mL的IFN-α-2b,于37 ℃,5%CO2培养12 h后用PBS缓冲液清洗3次;每孔加入100 μL预冷的裂解液,冰上裂解10 min后收集液体,提取细胞总RNA。
1.4 引物设计与合成
参考猪Viperin 基因序列(GenBank登录号分别为NM_213817),根据基因阅读框设计猪Viperin全基因组PCR扩增引物,引物序列如下。SV-Fwd:5′-ATGTGGACACTGGTACCTGTCACCTTTGCC-3′,SV-Red:5′-TCACCAGTCCAGCTTCAGGTCCGCCTTGCT-3′。将猪的Viperin基因采用DNAStar进行序列分析,选取免疫原性好的区段设计Viperin表达引物,引物序列而如下。Swine Hind Ⅲ-Fwd:5′-CCGAAGCTTTGTGACAGCTTTGATGAGCAGGTCA-3′;Swine XhoⅠ-Red:5′-CCCCTCGAGTCACCAGTCCAGCTTCAGGTCCG-3′,将引物序列送上海Invitrogen公司合成。
1.5 猪Viperin基因的扩增
采用RNA提取试剂盒提取细胞总RNA,采用M-MLV(Promega)反转录酶,按说明书操作步骤进行。依次加入下游引物0.5 μL,5×M-MLV 反转录缓冲液2 μL,10 nmol/L dNTP 2 μL,加入RNA模板4 μL,70 ℃水浴10 min后,置于冰上放置2 min,加入M-MLV 反转录酶 100 U,37 ℃水浴1 h,-70 ℃保存备用。以cDNA为模板,采用prime STAR SH高保真预混酶进行PCR扩增,具体反应体系如下:prime STAR SH高保真酶12.5 μL,上游引物0.5 μL,下游引物0.5 μL,模板cDNA 2 μL,双蒸水9.5 μL,总计25 μL。PCR 反应条件:98 ℃预变性1 min;98 ℃ 10 s,55 ℃ 5 s,72 ℃ 1 min,共进行35个循环,最后72 ℃延伸10 min。将PCR产物经0.8%琼脂糖凝胶电泳,紫外灯下观察扩增结果。
1.6 猪Viperin基因的克隆与序列分析
将PCR产物经琼脂糖凝胶电泳后,在紫外灯下切下目的条带,并采用琼脂糖凝胶回收试剂盒回收PCR产物,具体步骤按照试剂盒说明书进行。将纯化后的目的片段连接至pEASY-Blunt Simple 平末端克隆载体,连接体系为:pEASY-Blunt Simple载体预混酶1 μL,PCR片段4 μL,25 ℃作用20 min。
按照说明书要求转化Trans1-T1感受态细胞,涂布氨苄青霉素抗性Amp+(50 μg/mL)的LB平板。37 ℃培养12 h后挑取单菌落接种3 mL Amp+液体LB培养基,37 ℃、200 r/min振荡培养过夜,采用pEASY-Blunt Simple Cloning Kit通用鉴定引物进行PCR鉴定,将阳性克隆提取质粒送公司进行测序后,采用DNAStar软件进行同源性比较分析。
1.7 pET-sVIP表达载体的构建
以pEASY-sVIP为模板,采用Prime STAR SH高保真预混酶进行猪Viperin基因片段的扩增,具体反应体系如下:Prime STAR SH高保真酶12.5 μL,上游引物0.5 μL,下游引物0.5 μL,pEASY-sVIP 2 μL,双蒸水9.5 μL,总计25 μL。PCR 反应条件:98 ℃预变性1 min;98 ℃ 10 s,55 ℃ 5 s,72 ℃ 1 min,共进行 35个循环;最后72 ℃延伸10 min。将PCR产物经0.8%琼脂糖凝胶电泳,紫外灯下观察扩增结果。将PCR扩增片段进行琼脂糖凝胶电泳,并利用凝胶回收试剂盒进行纯化回收后,连接pET-28a+大肠杆菌表达载体后,转化至DH5α感受态细胞,提取质粒后用HindⅢ、XhoⅠ进行酶切鉴定,将鉴定阳性的质粒转化至大肠杆菌BL21感受态细胞,挑取阳性克隆菌提取质粒,使用HindⅢ、XhoⅠ进行酶切鉴定,将鉴定结果正确的阳性质粒命名为pET-sVIP。
1.8 猪Viperin主要抗原区段在大肠杆菌中的表达及抗体制备
1.8.1 猪Viperin蛋白在大肠杆菌中的表达 将鉴定正确的质粒转化大肠杆菌BL21(DE3)感受态表达菌,次日挑取单个菌落接种Amp+液体LB培养基,振荡 12~16 h后,取40 μL菌液转接Amp+液体LB培养基,待菌液浓度达到0.4~0.6 OD后,加入终浓度为0.1 mmol/L的IPTG进行诱导培养,并设置未加诱导剂的空白对照。于37 ℃振荡培养6 h,收集菌液于12 000 r/min离心1min,用无菌PBS洗涤沉淀3次,用500 μL PBS缓冲液重悬菌体,将菌体用超声裂解仪进行破碎,破碎后菌液12 000 r/min离心1 min,分离上清与沉淀后,用200 μL PBS重悬沉淀,分别在上清和沉淀中按比例加入5×Loading Buffer,煮沸10 min,然后进行10%SDS-PAGE凝胶电泳,检测猪Viperin蛋白表达情况。
1.8.2 包涵体纯化 将表达目的蛋白的阳性菌株转接3 mL Amp+液体LB培养基中,振荡培养12 h,后用IPTG诱导培养6 h。收集菌液并于5 000 r/min离心10 min,弃上清,用PBS洗涤沉淀3次,后用10 mL PBS重悬沉淀,用超声裂解仪进行破碎,收集沉淀,采用常规包涵体纯化方法进行纯化后取样进行SDS-PAGE电泳分析。
1.9 猪Viperin多克隆抗体制备
将纯化蛋白与等体积弗氏完全佐剂充分乳化后,背部皮下多点注射9日龄的BALB/c小鼠,首免每只小鼠50 μg;首免后14 d进行二次加强免疫,将纯化蛋白与弗氏不完全佐剂充分混合乳化后,每只小鼠背部皮下多点注射50 μg。加强免疫后14 d将所有免疫小鼠摘除眼球采血,将血液置于37 ℃、1 h待血清充分析出后,5 000 r/min离心10 min,小心吸取上清进行免疫原性鉴定。
1.9.1 Western Blot检测抗体特异性 将确定表达猪、猴源Viperin蛋白的真核表达质粒pCI-sVIP、pVAX-mVIP转染MARC-145细胞,转染后24 h,裂解细胞,进行SDS-PAGE电泳,采用Western Blot试验检测制备抗体特异性。
1.9.2 IFA检测抗体特异性 将MARC-145细胞接种至24孔板,每孔5×105个细胞,待细胞融合度达到100%后,转染表达Viperin蛋白的阳性质粒pCI-sVIP。转染36 h后细胞用PBS清洗3次。吸干孔内液体,每孔加入100 μL甲醇∶丙酮(1∶1)细胞固定液,固定后细胞用PBS洗涤3次。用PBS 1∶100稀释制备阳性血清,每孔加入100 μL,37 ℃作用1 h后细胞用PBS洗涤3次。加入1∶200稀释好的FITC标记的羊抗鼠二抗,37 ℃作用1h后用PBS洗涤3次。吸干孔内液体,置于倒置荧光显微镜下观察,并通过荧光强度读数仪读取荧光强度。
2 结果与分析
2.1 猪Viperin基因的扩增、克隆与序列分析
2.1.1 PCR扩增结果 从PK-15细胞中提取细胞总RNA后,经RT-PCR扩增获得猪Viperin基因,经过1%琼脂糖凝胶电泳后观察,在1 089 bp的位置获得目的条带,和预期大小一致(图1)。
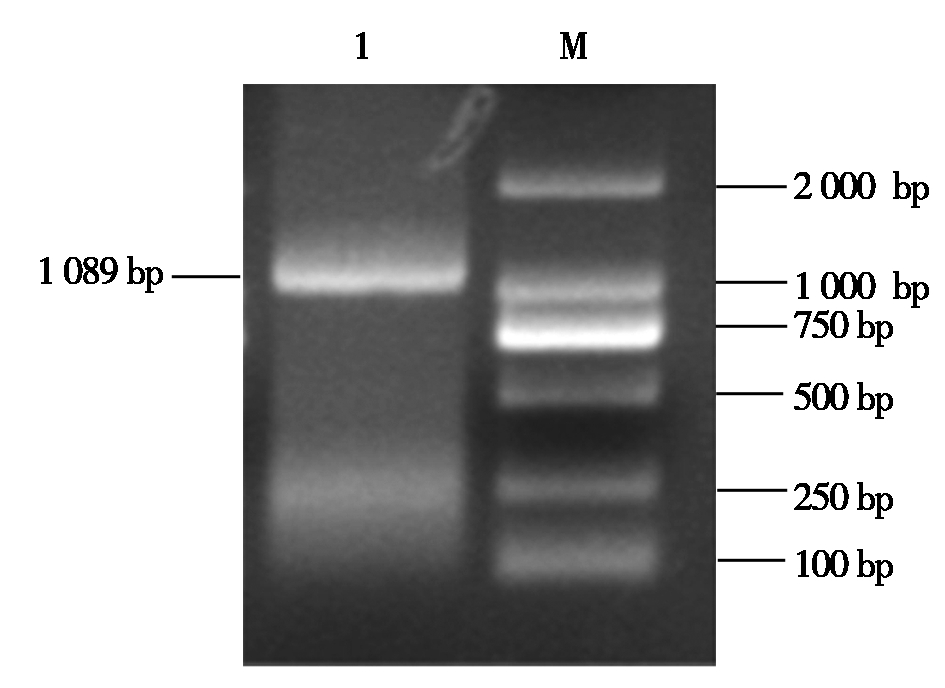
M.Marker 2000;1.sViperin 基因PCR扩增产物。 M.Marker 2000; 1.sViperin gene PCR product.
图1 猪Viperin基因的扩增
Fig.1 Amplification of swine Viperin gene
2.1.2 pEASY-SV重组质粒菌液PCR鉴定 将转化的菌液,采用pEASY-Blunt Simple Cloning Kit通用鉴定引物对克隆载体pEASY-sVIP重组质粒进行菌液PCR扩增,扩增产物进行琼脂糖凝胶电泳,观察在预期位置出现目的条带(图2)。
2.1.3 猪Viperin基因的序列测定与分析 序列测定结果表明,猪Viperin序列与预测结果一致,核酸序列1 089 bp,猪核苷酸序列编码362个氨基酸,采用Bioedit软件于人、猴的Viperin蛋白氨基酸序列比较,其中猴和人的Viperin基因序列同源性为98.0%,而猪和猴Viperin的氨基酸同源性为81.2%(图3)。
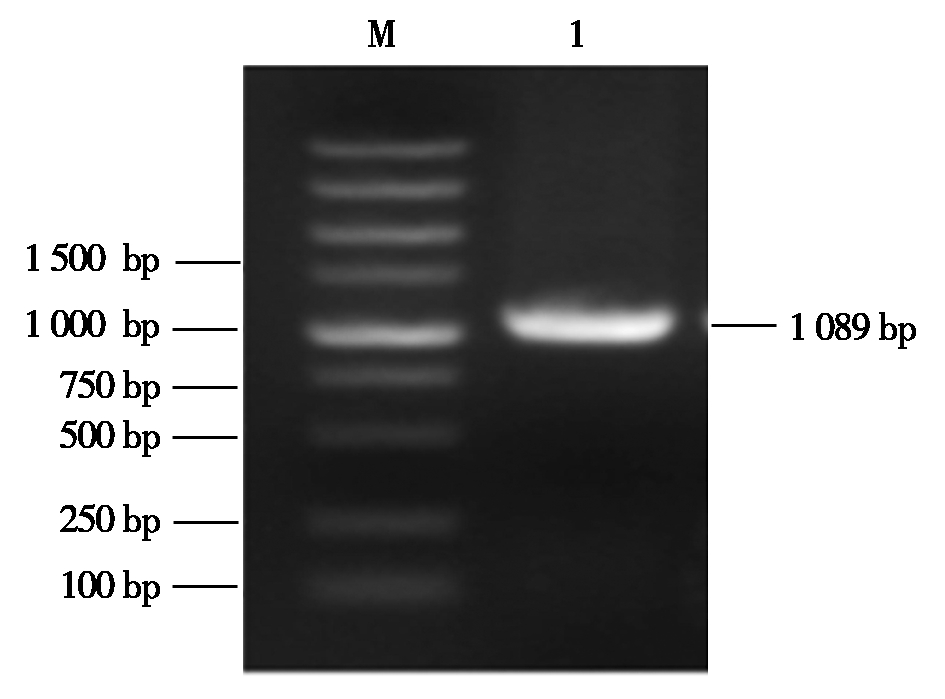
M.Marker 2000;1.sViperin 基因PCR鉴定结果。 M.Marker 2000; 1.Identification of insertion of sViperin gene.
图2 pEASY-SV重组质粒的菌液PCR鉴定
Fig.2 Identification of recombinant plasmid pEASY-SV by PCR

图3 人、猴、猪Viperin蛋白氨基酸序列比较分析
Fig.3 Analysis and alignment of amino acid sequence of human,monkey,swine Viperin
2.2 猪Viperin氨基酸的抗原性分析
用DNAStar软件对猪Viperin蛋白进行免疫原性和疏水性分析,选取较保守、抗原性较好、亲水性较强的区段设计引物,用大肠杆菌表达系统进行表达,制备针对猪Viperin的多克隆抗体。结果显示,191-362位氨基酸抗原性较好。
2.3 猪Viperin大肠杆菌表达载体pET-sVIP的构建
2.3.1 RT-PCR结果 以pEASY-SV为模板,经PCR扩增获得目的片段,经1%琼脂糖凝胶电泳后,在紫外灯下观察条带大小为548 bp,与预期结果相符(图4)。
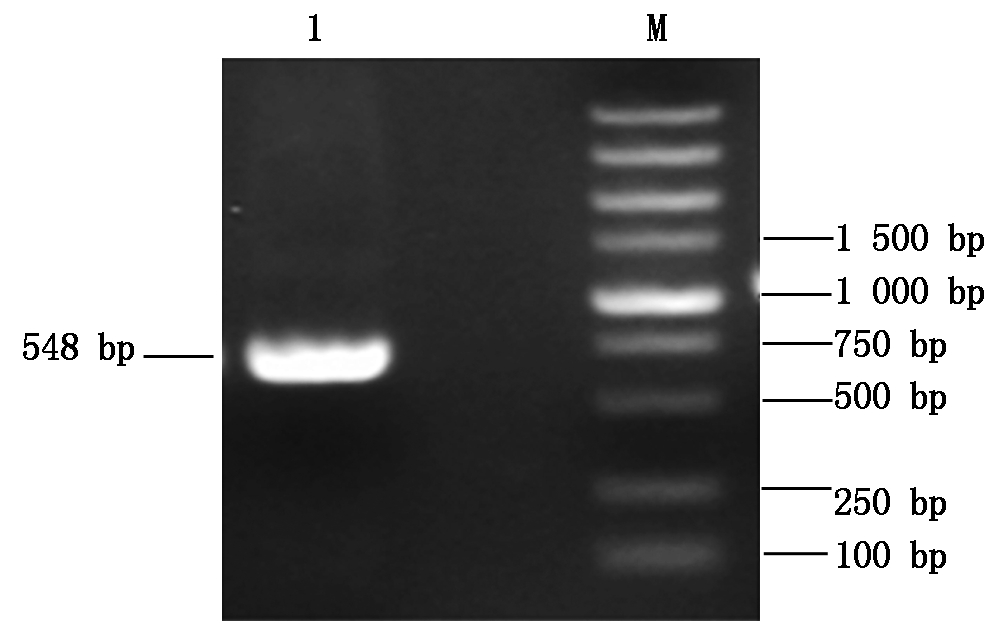
M.Marker 5000; 1.Partial sViperin gene 541~1 089 bp PCR product. M.Marker 5000;1.sViperin 541-1 089 bp基因PCR产物。
图4 猪Viperin基因541-1 089 bp核酸片段的扩增
Fig.4 Amplification of swine partial Viperin gene 541-1 089 bp
2.3.2 原核表达载体pET-sVIP酶切鉴定将重组原核表达载体 pET-sVIP用HindⅢ、XhoⅠ双酶切后,进行1%琼脂糖凝胶电泳,在紫外灯下观察,目的片段与预期大小相符(图5)。
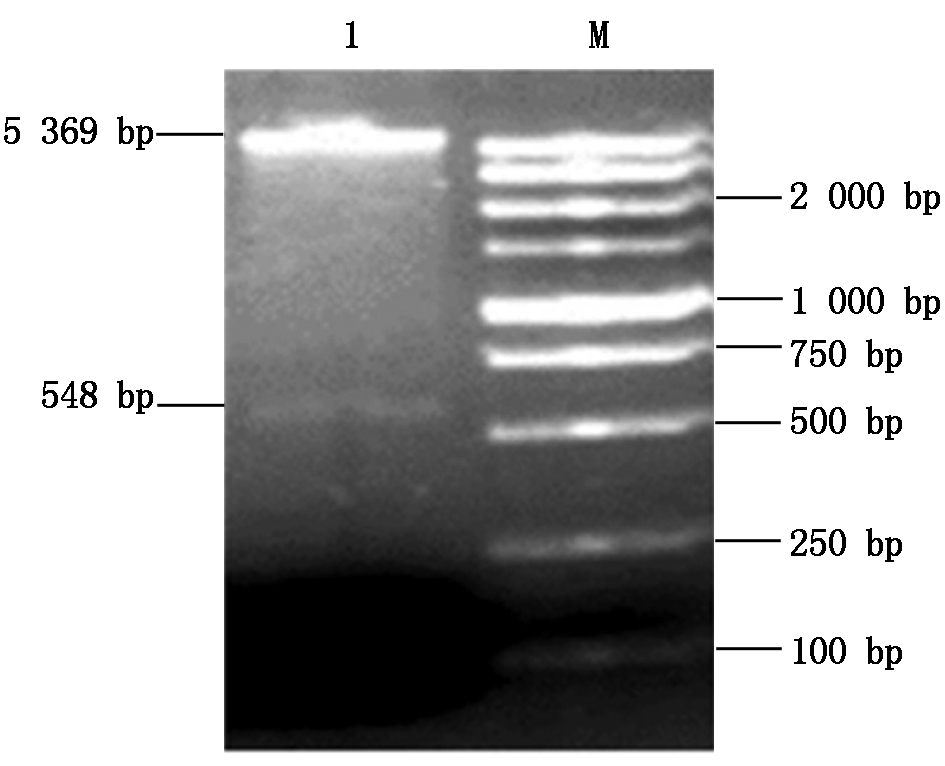
M.Marker 5000; 1.pET-sVIP were degested. M.Marker 5000;1.pET-sVIP质粒酶切产物。
图5 猪Viperin基因541-1 089 bp 位大肠杆菌表达质粒pET-sVIP的酶切鉴定
Fig.5 Identification of prokaryotic expression vector pET-sVIP of swine Viperin genes 541-1 089 bp by enzyme digestion
2.4 猪Viperin基因主要抗原区段在大肠杆菌中的表达
2.4.1 Viperin主要抗原区的表达 将重组原核表达质粒pET-sVIP,转化BL21,于37 ℃用IPTG诱导表达后,进行10%SDS-PAGE电泳,在24.0 ku处可见目的条带,且蛋白以包涵体的形式存在,与预期大小一致,而未诱导蛋白在相应位置无目的蛋白表达(图6)。
2.4.2 蛋白纯化 将蛋白大量表达后,用包涵体纯化的方法进行纯化,纯化后蛋白纯度可达到90%以上(图7)。
2.5 猪Viperin蛋白抗体的制备与鉴定
2.5.1 间接免疫荧光试验(IFA) 9日龄的BALB/c小鼠用纯化后大肠杆菌表达的猪sViperin蛋白免疫2次,每只小鼠50 μg,二次免疫后14 d摘除眼球采血,将血清析出,用南京农业大学动物医学院传染病实验室保存的表达猪Viperin蛋白的真核表达载体pCI-sVIP转染Marc-145细胞后,用制备的小鼠多克隆抗体血清进行IFA试验,检测该血清的特异性。试验证明,转染pCI-sVIP质粒的细胞在荧光显微镜下可见特异性绿色荧光,而转染pCI-neo空载体的细胞却没有可见荧光,证明本试验制备抗体特异性较好(图8)。
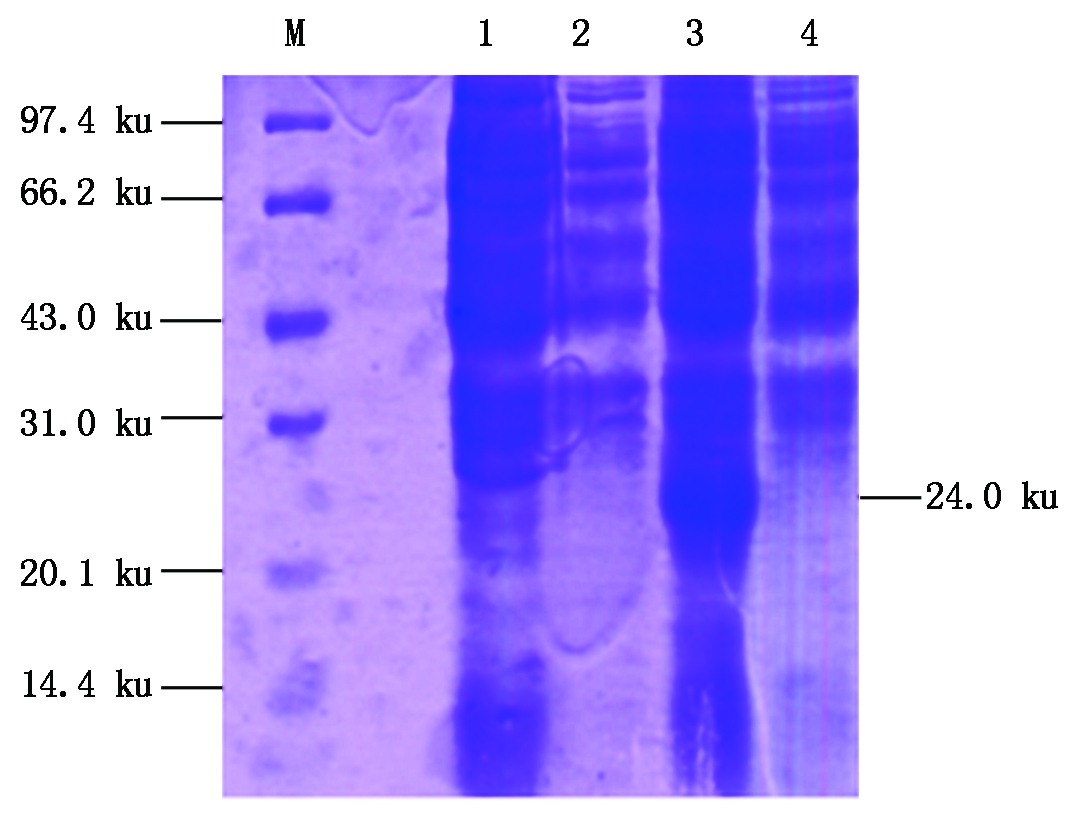
M.蛋白Marker;1. 沉淀中未诱导的pET-sVIP;2.上清中未诱导的pET-sVIP;3.沉淀中IPTG诱导的pET-sVIP;4.上清中IPTG诱导的pET-sVIP。
M.Protein Marker; 1.pET-sVIP in the pellet before inducement; 2.pET-sVIP in the supernatant before inducement; 3.Induced pET-sVIP in the pellet with IPTG; 4.Induced pET-sVIP in the supernatant with IPTG.
图6 重组猪Viperin蛋白BL21表达产物
Fig.6 Expression of recombinant swine Viperin in BL21
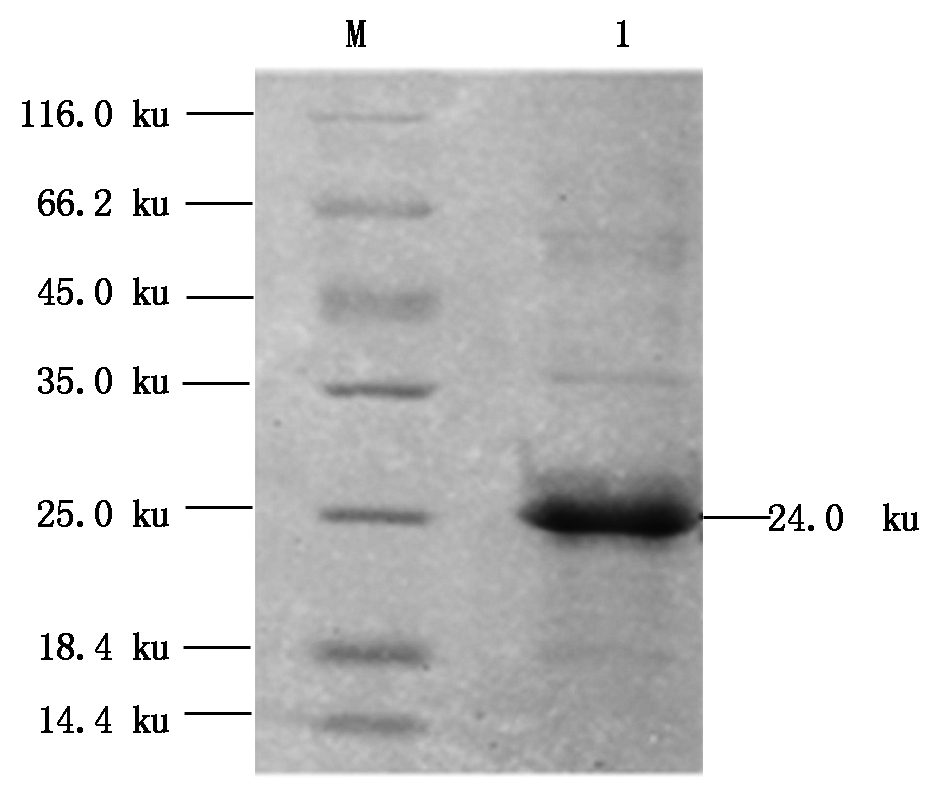
M.蛋白Marker;1.纯化后的重组猪Viperin 蛋白。 M.Protein Marker; 1.Purified recombinant swine Viperin protein.
图7 重组猪Viperin蛋白的纯化
Fig.7 Recombinant swine Viperin protein were purified
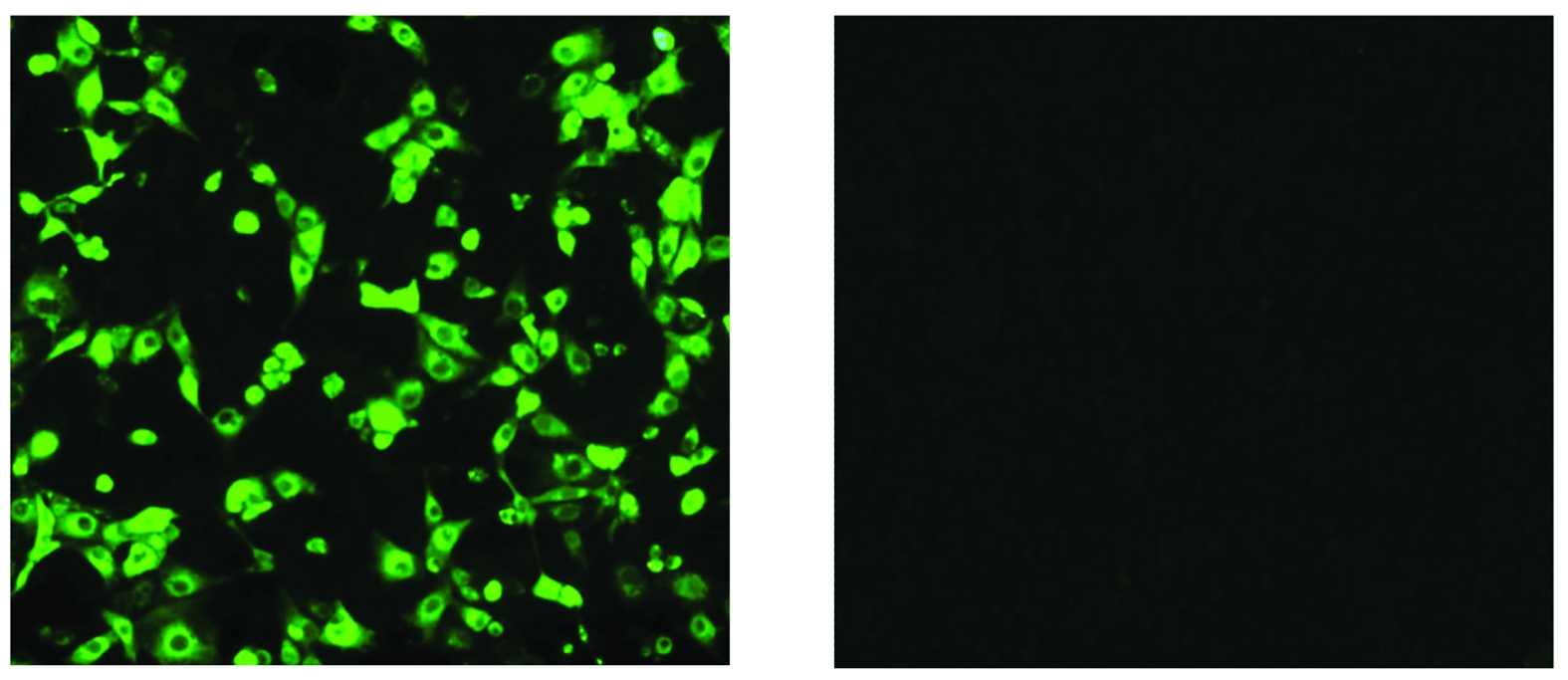
图8 IFA分析鉴定重组猪Viperin蛋白多克隆抗体
Fig.8 Identification of polyclonal antibody of recombinant swine Viperin protein by IFA assay
2.5.2 Western Blot试验 用南京农业大学动物医学院传染病实验室保存表达猪Viperin蛋白的真核表达载体pCI-sVIP转染MARC-145细胞,24 h后收集细胞,用制备的小鼠多克隆抗体血清进行Western Blot试验,检测该血清的特异性,在预期位置出现目的条带,且条带单一,而转染pCI-neo空载体的细胞却未见目的蛋白条带,说明本试验制备血清具有良好的特异性(图9)。用表达猴Viperin蛋白的pVAX-mVIP转染细胞后,用本试验制备的多克隆抗体进行Western Blot试验,结果证明,无特异性条带出现。

图9 Western Blot分析鉴定重组猪 Viperin蛋白多克隆抗体
Fig.9 Identification of polyclonal antibody of recombinant swine Viperin protein by Western Blot assay
3 结论与讨论
Viperin由361个氨基酸组成,在各个物种中显示出高度保守性,其分子质量大约42 ku。该蛋白通过其N端α双亲性螺旋定位于细胞内质网或脂滴等细胞器膜表面。Viperin通过影响细胞脂质代谢、脂筏形成和细胞免疫反应影响病毒在细胞内复制,但对各种病毒的抗病毒作用没有统一的模式,对不同病毒复制的调控机制也有所不同。笔者前期研究了猴源Viperin蛋白在MARC-145细胞中对PRRSV的抗病毒作用[18],但是目前该蛋白在猪体内的抗病毒活性仍不明确。为进一步研究猪源Viperin蛋白在猪体内的抗病毒作用,本试验成功克隆了猪源Viperin蛋白,核酸全长1 089 bp,共362个氨基酸。采用bioediet软件分析,其中人和猴源Viperin的氨基酸同源性达到98.0%,而猴和猪源Vipeirn的氨基酸序列同源性仅为81.2%。但其主要的功能位点(N端α-helix、中间CxxxCxxC模体、和C端区域)却相对较保守,故进而验证不同物种来源的Viperin蛋白的抗病毒活性具有重要意义。
此外,本研究将sViperin蛋白序列用DNAStar进行比较和免疫原性分析,选取其亲水性较好、免疫原性较强的191-362位氨基酸区域克隆进入大肠杆菌pET-28a+表达载体,转化BL21(DE3)大肠杆菌溶源菌,用IPTG诱导后获得表达。大肠杆菌表达系统具有成本低,蛋白表达量高,操作简便,耗时短,易于纯化等优点[19]。表达目的蛋白以包涵体的形式存在,大约24.0 ku。采用包涵体方式纯化后,免疫小鼠,二次免疫后收集血清。将南京农业大学动物医学院传染病实验室构建的表达猪源Viperin蛋白的PCI-sVIP阳性质粒转染MARC-145细胞,并将制备血清1∶1 000稀释后进行Western Blot试验,血清能较好地与重组sViperin蛋白反应。结果证明,该多克隆抗体具有较好的反应原性,且特异性较好,说明选取的蛋白区段免疫原性良好[20]。在MARC-145细胞转染PCI-sVIP阳性质粒后,将制备的多克隆抗体1∶200稀释后进行IFA试验,在显微镜下观察可见特异性绿色荧光。证明该抗体不但反应原性较好,且其血清效价较高。本试验进一步利用Western Bolt的方法验证了制备的鼠anti-sViperin抗体与MARC-145内源性mViperin的反应原性,结果显示,鼠抗猪源Viperin蛋白的抗体不能与猴源的Viperin进行反应,说明了尽管猪源和猴源的Viperin 191-362同源性较高,但不同来源的蛋白抗原表位却不完全相同,故抗体不能进行种间交叉反应。鼠猪源Viperin抗体的成功制备为下面研究猪Viperin蛋白的抗病毒活性和免疫学功能打下基础。
[1] Chan Y K, Gack M U .Viral evasion of intracellular DNA and RNA sensing[J]. Nature Reviews Immunology, 2016, 14(6): 360-373.
[2] Helbig K J,Beard M R. The role of viperin in the innate antiviral response[J]. Journal of Molecular Biology,2014,426(6,SI):1210-1219.
[3] Zhang B C, Zhang J, Xiao Z Z, et al. Rock bream (Oplegnathus fasciatus) viperin is a virus-responsive protein that modulates innate immunity and promotes resistance against megalocytivirus infection[J]. Developmental and Comparative Immunology 2014, 45(1):35-42.
[4] Shen G, Wang K, Wang S, et al. Herpes simplex virus 1 counteracts viperin via its virion host shutoff protein UL41[J]. Journal of Virolog, 2014, 889(20): 12163-12166.
[5] Upadhyay A S, Vonderstein K, Pichlmair A, et al. Viperin is an iron-sulfur protein that inhibits genome synthesis of Tick-borne encephalitis virus via radical SAM domain activity[J]. Cellular Microbiology 2014, 16(6): 834-848.
[6] Lim E S, Wu L I, Malik H S, et al. The function and evolution of the restriction factor viperin in primates was not driven by lentiviruses[J]. Retrovirology, 2012, 9: 55.
[7] Tang H B, Lu Z L, Wei X K, et al. Viperin inhibits rabies virus replication via reduced cholesterol and sphingomyelin and is regulated upstream by TLR4[J]. Scientific Reports, 2016, 6: 30529.
[8] Helbig K J,Eyre N S,Yip E,et al. The antiviral protein viperin inhibits hepatitisC virus replication via interaction with nonstructural protein 5A[J]. Hepatology,2011,5(54):1506-1517.
[9] Szretter K J,Brien J D,Thackray L B,et al. The interferon-induciblegene viperin restricts West Nile virus pathogenesis[J]. Journal of Virology,2011,85(22):11557-11566.
[10] Green T J, Speck P, Geng L, et al. Oyster viperin retains direct antiviral activity and its transcription occurs via a signaling pathway involving a heat-stable hemolymph protein[J]. Journal of General Virology, 2015,96(12): 3587-3597.
[11] Helbig K J,Carr J M,Calvert J K,et al. Viperin is induced following denguevirus type-2(DENV-2)infection and has anti-viral actions requiring the C-terminal end of viperin[J]. PLoS Neglected Tropical Diseases,2013,7(4):e2178.
[12] Teng T S,Foo S S,Simamarta D,et al. Viperin restricts chikungunya virusreplication and pathology[J]. Journal of Clinical Investigation,2012,122(12):4447-4460.
[13] Tan K S,Olfat F,Phoon M C,et al. In vivo and in vitro studies on the antiviralactivities of viperin against influenza H1N1 virus infection[J]. Journal of General Virology,2012,93(Pt6):1269-1277.
[14] Seo J Y,Cresswell P. Viperin regulates cellular lipid metabolism during human cytomegalovirus infection[J]. PLoS Pathogens,2013,9(8):e1003497.
[15] Jy S,Yaneva R,Hinson E,et al. Human cytomegalovirus directly induces theantiviral protein viperin to enhance infectivity[J]. Science,2011,332(6033):1093-1097.
[16] Jumat M R, Huong T N, Ravi L I, et al. Viperin protein expression inhibits the late stage of respiratory syncytial virus morphogenesis[J]. Antiviral Research, 2015, 114: 11-20.
[17] Tang Y D,Na L,Zhu C H,et al. Equine viperin restricts equine infectious anemiavirus replication by inhibiting the production and/or release of viral Gag,Env,and receptor via distortion of the endoplasmic reticulum[J]. Journal of Virology,2014,88(21):12296-12310.
[18] Fang J,Wang H,Bai J,et al. Monkey viperin restricts porcine reproductive and respiratory syndrome virus replication[J]. PLoS One,2016,11(5):e0156513.
[19] Park M K, Lee S H, Yang K S, et al. Enhancing recombinant protein production with an Escherichia coli host strain lacking insertion sequences[J]. Applied Microbiology and Biotechnology, 2014, 98(15): 6701-6713.
[20] Li C,Ge L L,Li P P,et al. The DEAD-box RNA helicase DDX5 acts as a positiveregulator of Japanese encephalitis virus replication by binding to viral 3′UTR[J]. Antiviral Research,2013,100(2):487-499.