梨(Pyrus spp.)是我国分布较广泛的多年生落叶果树,在天津市种植面积约4 000 hm2,占全市果树面积的10%,属于天津市四大经济水果之一(枣、葡萄、苹果和梨),主要分布在静海、西青等区域,与蓟州区的特色果品干果、津西北的桃、汉沽东丽宁河的葡萄构成了天津林果的四大产业区域[1]。新果园的建立和新品种的引进提高了梨果的质量和丰富度,但是也为梨树病害提供了传播途径。梨病毒及类病毒在多数栽培品种中长期潜伏,症状不明显,故病毒病易在梨长期营养繁殖的过程中不断传播蔓延[2],但在感病植株中不仅造成树势减弱,影响果实的产量和品质,严重时还会导致果树绝收,提早枯死,严重威胁着梨的生产[3]。目前,已报道的梨病毒病有20多种,病毒种类包含单链RNA病毒、双链RNA病毒、DNA病毒、类病毒等[4-6]。发生在我国主要栽培梨上面潜伏性病毒和类病毒种类在梨树上发生最为普遍,主要有苹果茎沟病毒 (Apple stem grooving virus,ASGV)、梨环纹花叶病毒(Pear ring pattern mosaic virus)即苹果褪绿叶斑病毒 (Apple cholortotic leaf spot virus,ACLSV)、梨脉黄病毒(Pear vein yellow virus)即苹果茎痘病毒 (Apple stem pitting virus,ASPV)、苹果锈果类病毒(Apple scar skin viroid,ASSVd)和苹果凹果类病毒(Apple dimple fruit viroid,ADFVd)等,主要特点是潜伏侵染无明显症状,常常复合侵染,具有极大的隐秘性和危险性[4,7-10]。该类潜隐性病毒在田间很难通过肉眼观察进行诊断,而病毒含量较低传统血清学的方法很难准确地对其进行检测。聚合内链式反应(PCR法),反转录-PCR法以及优化的一步多重PCR法,定量PCR法等分子生物学的方法被广泛运用于潜隐性病毒的检测中[5]。近几年随着新一代深度测序技术的飞跃发展,深度测序技术也被广泛应用于苹果和梨等核果类果树病毒病的检测中[11-12]。
本研究采集天津西青、蓟州和大港等地区采摘的雪花梨、苹果梨、水晶梨和圆黄梨等品种的新鲜叶片,通过改良梨叶片总RNA提取技术,建立适用于梨树病毒病检测鉴定的单重 RT-PCR 体系,旨在明确天津地区主要梨栽培品种带毒情况及病毒种类,为天津地区苗木检疫、风险性分析以及防治措施的制定提供技术依据。
1 材料和方法
1.1 试验材料
在天津西青、蓟州和大港3个地区随机采摘雪花梨、苹果梨、水晶梨、圆黄梨、早酥红梨和金香玉梨等7个品种的新鲜枝叶,总计70株(表1)。
表1 样品采集信息
Tab.1 The information of collected samples
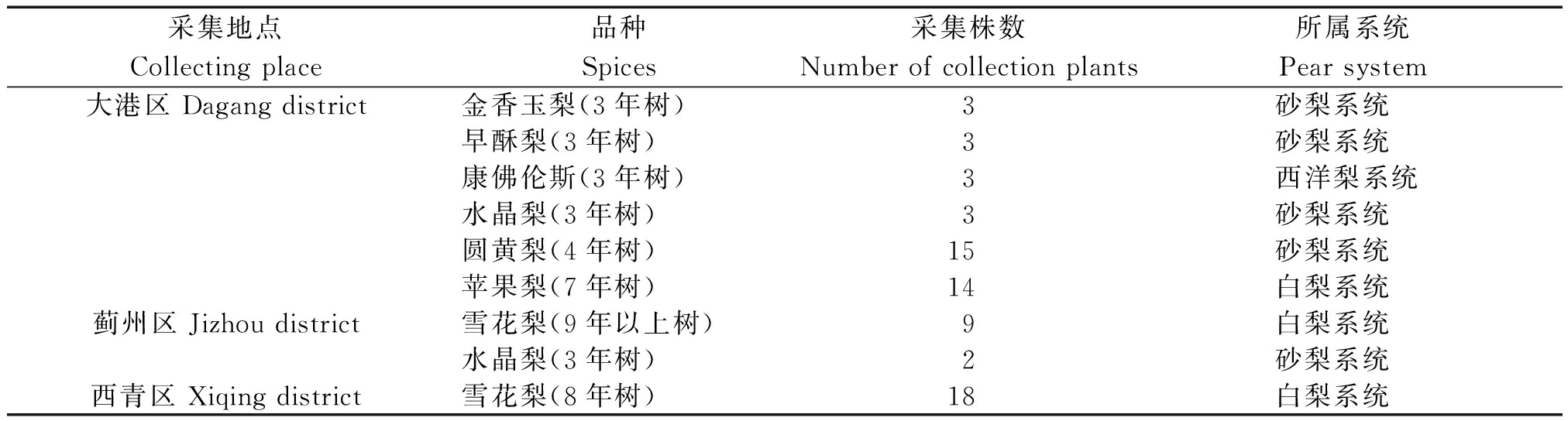
采集地点Collecting place品种Spices采集株数Number of collection plants所属系统Pear system大港区 Dagang district金香玉梨(3年树)3砂梨系统早酥梨(3年树)3砂梨系统康佛伦斯(3年树)3西洋梨系统水晶梨(3年树)3砂梨系统圆黄梨(4年树)15砂梨系统苹果梨(7年树)14白梨系统蓟州区 Jizhou district雪花梨(9年以上树)9白梨系统水晶梨(3年树)2砂梨系统西青区 Xiqing district雪花梨(8年树)18白梨系统
1.2 优化梨叶片总RNA提取方法
1.2.1 TRIzol试剂法 使用基于CTAB法的TransZol Up Plus RNA Kit进行雪花梨叶片总RNA提取,其具体步骤参照北京全式金生物技术有限公司(TransZol Up Plus RNA Kit,ER501-01)的说明书进行。
1.2.2 改良CTAB法
1.2.2.1 基础方法 按照TransZol Plant(北京全式金生物技术有限公司,ET121-01)试剂盒操作步骤。将新鲜的或液氮冻存的植物样品称量后,加入液氮迅速研成粉末状。每80~100 mg组织加入1 mL TPI溶液。涡旋或用枪头吹吸数次,12 000 r/min 4 ℃离心5 min。小心吸取上清,将上清平分至2个新的1.5 mL RNase-free 离心管中。向上清中加入等体积的TPⅡ 溶液(粉红色),颠倒混匀数次,加入1/4上清体积的氯仿,再次颠倒混匀数次,室温孵育5 min。12 000 r/min 4 ℃离心5 min。小心吸取上清于新的RNase-free离心管中。向上清中加入等体积异丙醇,颠倒混匀,室温孵育10 min。12 000 r/min 4 ℃离心10 min。弃上清,此时在管侧和管底形成胶状沉淀。加入1 mL 75%乙醇(RNase-free 的水配制),剧烈涡旋。10 000 r/min 4 ℃离心5 min,弃上清,室温晾干沉淀。 加30~40 μL RNA溶解液溶解沉淀,保存样品于-70 ℃以备长期使用。
1.2.2.2 改良方法1-巯基乙醇 在TPI溶液中分别加入10 μL β-巯基乙醇。
1.2.2.3 改良方法2-巯基乙醇+ DTT 在TPI溶液中分别加入5 μL β-巯基乙醇+5 μL DTT。
1.2.2.4 改良方法3-巯基乙醇+ 抗坏血酸 在TPI溶液中分别加入5 μL β-巯基乙醇+5 μL抗坏血酸。
1.3 RNA质量检测
首先,使用1%琼脂糖凝胶电泳鉴定,并分析RNA的完整性,上样量为5 μL,加入1 μL Lording Buffer 在110 V电压下电泳约15 min,在紫外灯下观察并照相保存。
其次,取1 μL总RNA溶液稀释到一定浓度下,利用紫外分光光度计,计算出A260、A280、OD260/280、0D260/230以及RNA的浓度,纯RNA OD260/280值应为1.8~2.2,OD260/230值应为2.0~2.4。RNA 回收率计算:RNA回收率(μg/g)=(OD260×40×原液体积) /提取样品质量(g),每种方法重复3次,取平均值。
1.4 引物设计
检测引物参考郝璐等[13]发表的引物序列,由华大基因科技股份有限公司合成。引物序列如表2所示。
表2 RT-PCR的引物序列以及目标片段大小
Tab.2 Primers for RT-PCR and the size of the targeted fragments

病毒种类Virus species引物序列Primer sequences目的片段长度/bpSize of targeted fragments 苹果褪绿叶斑病毒(ACLSV)Apple cholortotic leaf spot virusA52: 5'-CAGACCCTTATTGAAGTCGAA-3'A53: 5'-GGCAACCCTGGAACAGA-3'358苹果茎沟病毒(ASGV)Apple stem grooving virusF: 5'-AAGAGAGGATTTAGGTCCCTC-3'R:5'-ATAAAGGGAGGCATGTCAACC-3'825苹果茎痘病毒(ASPV)Apple stem pitting virusC8849:5' -TGCCTCAAAGTACACCCCTCAGT-3'H8534: 5'-CGCCAAGAAATGCACAGC-3'316苹果锈果类病毒(ASSVd)Apple scar skin virioidF: 5'-CCGGTGAGAAAGGAGCTGCCAGCA-3'R: 5'-CCTTCGCCTTCGTCGACGACAGGT-GAGT-3'278苹果凹果类病毒(ADFVd)Apple dimple fruit viroidF: 5'-GAGGAAAACTCCGTGTGGTTC-3'R: 5'-AAGTCCACTCCCTGCCAGACC-3'271
1.5 反转录-PCR检测(RT-PCR)
以Oligo(dT)为反向引物进行反转录,反转录的反应体系如下:Buffer Mix 10 μL;总RNA 8 μL;反向引物Oligo(dT) 1 μL;Enzyme(E-MiX) 1 μL。反应条件:将水浴锅调整到42 ℃,水浴时间为30 min即可。反转录完成后会形成cDNA,以cDNA 为模板进行扩增。
每一个反应体系的总体积都为20 μL,其基本反应体系如下:反转录产物cDNA 3 μL;正向引物0.5 μL;反向引物0.5 μL;dNTP 0.5 μL;Buffer 2 μL;Taq Enzyme 0.5 μL;RNase-free Water 13 μL;总体系为20 μL。
PCR以cDNA为模板进行扩增,反应循环为:94 ℃预处理4 min;94 ℃,30 s,苹果褪绿叶斑病毒(ACLSV)40 ℃,30 s,苹果茎沟病毒(ASGV)50 ℃,30 s,苹果茎痘病毒(ASPV)51 ℃,30 s,苹果凹果类病毒(ADFVd)53 ℃,30 s,苹果锈果类病毒(ASSVd)60 ℃,30 s,72 ℃,20 s,共30个循环;最后72 ℃延伸5 min。
1.6 PCR产物的检测和回收
反应结束后,提取5 μL的PCR扩增产物进行1%的琼脂糖凝胶电泳检测,通过EB染色后,使用BioRad凝胶成像系统观测电泳结果,并拍照保存,以此来证明检测的结果,进行回收扩增片段。
回收扩增片段的程序:将PCR扩增产物进行回收。PCR产物的回收参照PCR产物纯化回收试剂盒(北京艾德莱生物科技有限公司)的说明书进行。PCR产物纯化回收后送至华大基因公司进行测序。
采用Blast,DNAMAN 6.0.3.99 软件对RT-PCR产物所测得的序列进行同源性分析。
2 结果与分析
2.1 四种不同方法获得的梨叶片总RNA质量的比较
采用不同方法提取的雪花梨叶片总RNA电泳结果见图1。条带的完整程度和明暗程度代表RNA的质量,结果显示,4种方法均可以提取出一定量的RNA。如图1所示,改良方法1-巯基乙醇法得到的RNA条带相对来说最为清晰和完整,所提取RNA 的 28S RNA、18S RRNA 亮度比约为2∶1,完整性较好,表示这种方法提出来的总RNA的质量较好,比较适合梨叶片总RNA的提取;基础方法、改良方法2和改良方法3的条带均不清晰,有降解的情况,并且杂质较多。结合表3总RNA产量的比较结果可知,基础方法获得的总RNA OD260/280的值平均为1.573,RNA获得率仅为(56.784±11.172)μg/g,说明梨中可能含有的酚类物质和大分子糖类物质影响梨总RNA的提取质量和产量,改良方法2-巯基乙醇+DTT获得的RNA得率最高,但OD260/280的值平均为1.546,OD260/230的值平均为1.616,均未达到标准比值,说明提取物中有盐等小分子物质和酚类、蛋白等大分子杂质污染。综合梨叶片的总RNA质量与获得率,改良方法1可以在短时间内完成梨叶片总RNA的提取,并且无降解,提取量高,平均浓度可达73.880 μg/g,符合下一步试验要求。是提取雪花梨叶片总RNA较为理想的方法。
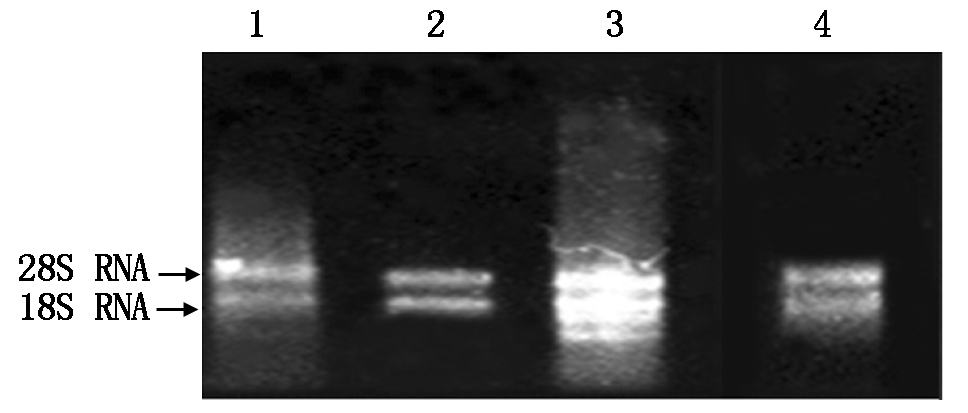
1.基础方法;2.改良方法1-巯基乙醇;3.改良方法2-巯基乙醇+DTT;4.改良方法3-巯基乙醇+抗坏血酸。
1.Basic method; 2.Improved method 1-Mercapto alcohol; 3.Improved method 2-Mercapto alcohol + DTT; 4.Improved method 3-Mercapto alcohol+Ascorbic acid.
图1 不同提取方法对雪花梨叶片总RNA完整性的影响
Fig.1 The effect of different extraction methods on the integrity of the snow pear total RNA
表3 四种方法雪花梨叶片的总RNA质量与获得率
Tab.3 The quality and yield of the total RNA of the snow pears obtained by four different methods

提取方法 Extraction methods OD260/280OD260/230浓度/(μg/g)Concentration 基础方法Basic method1.573±0.0061.913±0.26656.784±11.172改良方法1-巯基乙醇Improved method 1-Mercapto alcohol1.976±0.0492.068±0.23273.880±8.148改良方法2-巯基乙醇+DTT Improved method 2-Mercapto alcohol + DTT1.546±0.0611.616±0.15880.388±8.352改良方法3-巯基乙醇+抗坏血酸Improved method 3-Mercapto alcohol + ascorbic acid1.803±0.0052.077±0.07453.828±8.408
2.2 梨病毒检测结果
以提取的各样品梨的总RNA作为模板,反转录后用表2中的病毒和类病毒的特异性引物进行PCR检测,结果表明,PCR扩增获得了预期大小的目标条带,将PCR产物回收后进行序列测定,将所得的序列与GenBank中已报道的序列进行比对分析,结果证明扩增得到的片段为目标片段。
2.3 样品中病毒种类和带毒率分析
通过RT-PCR鉴定出天津地区梨树所携带的潜隐性病毒种类有5种,但是带毒率各有不同。由表4可知,本次研究的70株梨树总带毒率平均为48.6%,其中,大港区7年生的苹果梨样品(92.8%)最高,其次是西青区种植8年生的雪花梨样品(72.2%),再次为蓟州区种植9年以上的雪花梨样品(66.7%),三者均属于白梨系统;大港地区采集的其他梨样品树龄均较小,带毒率由高到低依次为金香玉梨(33.3%)、水晶梨(33.3%)、圆黄梨(13.3%)、早酥红梨(0)和康佛伦斯(0),前4种梨品种均属于砂梨系统,后一种梨属于西洋梨系统;此外,蓟州采集的3年水晶梨样品(砂梨系统)也未检测到已知的病毒种类。从以上结果可以看出,种植年份越高的植株,带毒率越高,不同品种对病毒的敏感性也不相同。
表4 西青区、蓟州区和大港区的不同栽培品种中病毒和类病毒种类及带毒率检测结果
Tab.4 Detection results of virus and viroid species and virus carrying rate in different cultivars from Xiqing district,Jizhou district and Dagang district
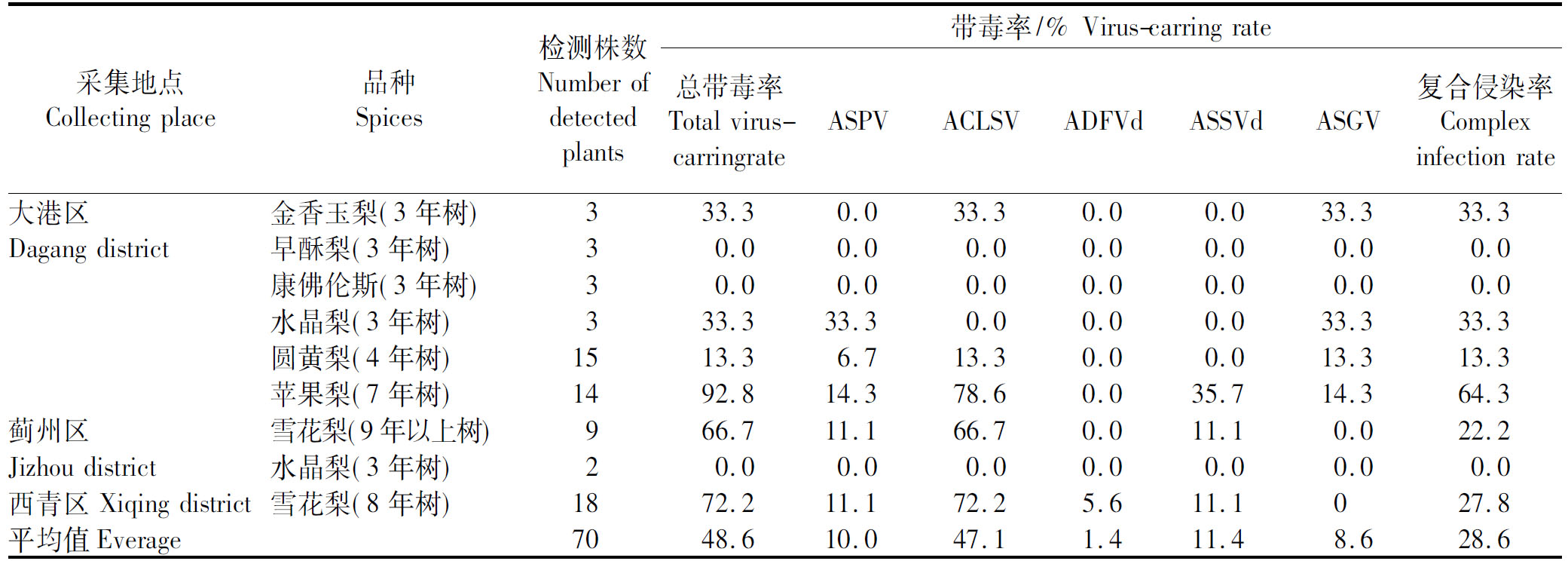
采集地点Collecting place品种Spices检测株数Number of detectedplants带毒率/% Virus-carring rate总带毒率Total virus-carringrate ASPVACLSVADFVdASSVdASGV复合侵染率Complexinfection rate大港区金香玉梨(3年树)333.30.033.30.00.033.333.3Dagang district早酥梨(3年树)30.00.00.00.00.00.00.0康佛伦斯(3年树)30.00.00.00.00.00.00.0水晶梨(3年树)333.333.30.00.00.033.333.3圆黄梨(4年树)1513.36.713.30.00.013.313.3苹果梨(7年树)1492.814.378.60.035.714.364.3蓟州区 雪花梨(9年以上树)966.711.166.70.011.10.022.2Jizhou district水晶梨(3年树)20.00.00.00.00.00.00.0西青区 Xiqing dis-trict雪花梨(8年树)1872.211.172.25.611.1027.8平均值Everage7048.610.047.11.411.48.628.6
从病毒种类方面分析,苹果褪绿叶斑病毒(ACLSV)的带毒率最高,平均为47.1%,其次是苹果锈果类病毒(ASSVd),平均为11.4%,苹果茎痘病毒(ASPV)、苹果茎沟病毒(ASGV)、苹果凹果类病毒(ADFVd)的平均带毒率分别为10.0%,8.6%,1.4%。从病毒复合侵染角度分析,大港地区采集的7年生树龄苹果梨复合侵染率最高,达64.3%,而且感染病毒种类最多。
3 讨论
RNA的质量直接影响其后续分子生物学试验,梨中的多糖、多酚、盐分子以及其他次生代谢产物等物质在RNA提取过程中易与RNA结合,严重影响RNA的提取效率和质量[14-15]。而不同植物种类或同种植物不同组织的RNA提取,往往需要采取不同的提取方法。普通的CTAB法不能有效去除梨叶片中的多糖、多酚类物质,RNA提取效率较差,改良方法中加入可以去除多酚和抗氧化的β-巯基乙醇、DTT和抗坏血酸,能有效地提高RNA的得率,但是DTT和抗坏血酸处理对RNA质量没有优化作用。因此,本研究确定适合梨叶片RNA提取的方法为改良方法1-巯基乙醇。
梨病毒病为系统性病害,具有分布广、种类多、寄主范围广、隐蔽性强、危害严重等特点,由于我国梨树种苗生产缺乏病毒病检测和监管,带毒无性繁殖材料随意嫁接,苗木市场混乱,新品种推广缺乏有效监控等原因,增加了梨病毒病的传播和复合侵染的风险[3,10]。通过对天津市3个主要梨栽培产区随机采样检测发现,本市梨树潜隐性病毒带毒率较高,种类较多,所采集的样品数量虽然较少,但是种类丰富,而且树龄多样,基本可以反映出天津市梨树种植受病毒病影响的情况。本研究中一些天津地区局部新引进的品种金香玉梨、水晶梨和圆黄梨,虽然种植年份较短,但均检测出了2种或3种已知病毒,具有复合侵染现象,而同地块种植的另外2个品种早酥红梨和康佛伦斯梨未检测到已知病毒,说明样品中的病毒很有可能是引种时由种苗携带的。此外,病毒种类和带毒率随着树龄的增加而呈上升趋势,说明随着种植年份的增长,在梨树生长过程中受到病毒病感染的概率增加,梨潜隐性病毒一般可以通过嫁接、修剪工具、根接等方式传播[9,16],老旧果园由于树龄老化、栽培管理不当等原因导致病毒病感染率和病毒种类日益提高,极大影响了梨树的产量和品质。在所采集的品种中包含了西洋梨系统的康佛伦斯梨,白梨系统的苹果梨和雪花梨,以及砂梨系统的水晶梨、圆黄梨、金香玉梨和早酥红梨,不同系统梨带毒率不同,带毒率最高的是白梨系统的品种,其次是砂梨系统的部分品种。王国平等[10]也对我国国家梨种植资源圃中5个系统23个主要品种的树进行带毒率的检测和比较,不同系统带毒率有异,带毒率由高到低依次为西洋梨、白梨和沙梨、新疆梨和秋子梨。说明梨品种及其系统发育地位与对病毒敏感性有一定相关性。
鉴于研究结果显示同一病毒在不同地区、不同品种中发生差异较大,同一地区、同一品种病毒种类和带毒率差异也较大,在生产过程中应加强果园栽培管理,加强水肥管理,注意林间卫生,除去杂草,防治有害昆虫,林间操作时及时消毒工具,防治人为机械传播。种苗方面应规范种苗繁育品种推广的检测监控,加强检疫,培育栽培无毒苗,规范无毒化栽培管理以及推广高效快速的超低温冷冻疗法在果树上的应用[17-20],从源头上控制果树病毒病和类病毒病的传播扩散,为梨产业的健康高效发展打下基础。
[1] 胡忠惠,张文庆,杨丽芳,等. 天津地区苹果生产浅析[J]. 中国园艺文摘,2014(2):47-49.
[2] Li Y Q,Deng C L,Bian Y,et al. Characterization of Apple stem grooving virus and Apple chlorotic leaf spot virus identified in a crab apple tree[J]. Archives of Virology,2017,162(4):1093-1097.
[3] 邓晓云,王国平. 梨病毒病研究新进展[J]. 果树学报,2002,19(5):321-325.
[4] Yao B Y,Wang G P,Ma X F,et al. Simultaneous detection and
Differentiation of three viruses in pear plants by a multiplex RT-PCR[J]. Journal of Virological Methods,2014,196:113-119.
[5] Malandraki I,Beris D,Isaioglou I,et al. Simultaneous detection of three pome fruit tree viruses by one-step multiplex quantitative RT-PCR[J]. PLoS One,2017,12(7):e0180877.
[6] Hu G J,Wang G P,Wang L P,et al. The incidence and molecular characteristics of Apple stem grooving virus from pear in China[J]. Australasian Plant Pathology,2017,46(4):305-311.
[7] 卢永灿. 三种梨病毒实时荧光定量RT-PCR和RT-LAMP检测技术的研究[D]. 武汉:华中农业大学,2016.
[8] Liu J,Zhang X E,Zhang F P,et al. Identification and characterization of microRNAs from in vitro-grown pear shoots infected with Apple stem grooving virus in response to high temperature using small RNA sequencing[J]. BMC Genomics,2015,16(1):945.
[9] 谢联辉,林奇英,吴祖建. 植物病毒名称及其归属[M]. 北京:中国农业出版社,1999.
[10] 王国平,洪 霓,张尊平,等. 我国北方梨产区土栽品种病毒种类的鉴定研究[J]. 中国果树,1994(2):1-4.
[11] Jo Y, Choi H, Kim S, et al. Integrated analyses using RNA-Seq data reveal viral genomes, single nucleotide variations, the phylogenetic relationship, and recombination for apple stem grooving virus[J]. BMC Genomics, 2016, 17: 579.
[12] Jones S, Baizan-Edge A, MacFarlane S, et al. Viral diagnostics in plants using next generation sequencing: computational analysis in practice[J]. Frontiers in Plant Science, 2017, 8:1770.
[13] 郝 璐,叶 婷,陈善义,等. 我国北方部分苹果主产区病毒病的发生与检测[J]. 植物保护,2015,41(2):158-161.
[14] 孙 雯,石海燕,张玉星.黄金梨果实高质量总RNA提取方法的研究[J]. 华北农学报,2013,28(2):70-72.
[15] 许 平,车代弟,王金刚,等. 观赏山梨叶片总RNA的提取及质量分析[J]. 东北农业大学学报,2008,39(3):34-38.
[16] 梁成林,赵玲玲,宋来庆,等. 几种苹果实生砧木种子传毒潜力检测[J]. 果树学报,2014,31(6):1164-1169.
[17] 马文会,王献革,王利民,等. 黄金梨的组织培养和快速繁殖技术初报[J]. 华北农学报,2003,8(3):117.
[18] Wang M-R, Yang W, Zhao L, et al. Cryopreservation of virus: a novel biotechnology for long-term preservation of virus in shoot tips[J]. Plant Methods, 2018,14(1):47.
[19] Yamagishi N, Li C, Yoshikawa N. Promotion of flowering by Apple latent spherical virus vector and virus elimination at high temperature allow accelerated breeding of apple and pear[J]. Frontiers in Plant Science, 2016,7:171.
[20] Lizárraga A, Ascasíbar J, González M, et al. Fast and effective thermotherapy treatment for in vitro virus eradication in apple and pear trees[J]. American Journal of Plant Sciences, 2017, 8(10): 2474.