血清4型禽腺病毒(Fowl adenovirus serotype 4,FAdV-4)属于腺病毒科禽腺病毒属禽腺病毒C种[1]。FAdV-C血清4型强毒株对雏鸡的致病能力较强,可以垂直传播和水平传播。FAdV-4可致鸡发生心包积水综合征(Hydro pericardium syndrome,HPS),该病在全世界分布广泛,以心包囊中积聚透明或淡黄的液体为主要特征,发病鸡常表现为食欲不振、贫血、羽毛粗乱、鸡冠颜色变浅、嗜睡等,死亡率高达30%~90%。心包积液综合征最早发生在巴基斯坦的安卡拉地区,因此,也叫“安卡拉”病,随后墨西哥、加拿大、日本、澳大利亚等国家相继暴发了该病。1976年,我国台湾报道了该病,随后在辽宁、吉林、湖南、江苏和河南等省也相继发生该病[1-5]。目前,该病已经成为一种严重危害我国养禽业发展的传染病。
FAdV是无囊膜的双股DNA病毒,呈二十面体对称,由蛋白衣壳、核心蛋白和DNA组成。蛋白衣壳由五邻体(Peton)、六邻体(Hexon)和纤突(Fiber)3种主要的蛋白构成。六邻体含量最高,是病毒粒子中最大的蛋白,在各种腺病毒具有很高的同源性。六邻体具有群、亚群、型特异抗原决定簇,是中和抗体的靶标。因此,研究六邻体蛋白的特性和功能,将为腺病毒引起疾病的诊断与防治提供重要的理论依据[3-8]。
本研究克隆并表达了FAdV-4的六邻体蛋白,利用大肠杆菌表达系统获得了重组蛋白的大量表达,通过Western Blot对其反应原性进行鉴定,旨在为进一步研究血清4型禽腺病毒和心包积水综合征的防治奠定基础。
1 材料和方法
1.1 试验材料
大肠杆菌BL21、质粒pET-32a、FAdV-4肝毒,为江苏省农业科学院禽病与生物制药研究室保存;PMD18-T、Ex-Taq聚合酶、SolutionⅠ快速连接酶、大肠杆菌DH5α、DNA限制性核酸内切酶、DNA Marker购自TaKaRa公司;引物片段由南京金斯瑞生物科技公司合成;DNA提取试剂盒、琼脂糖凝胶回收试剂盒、小量质粒提取试剂盒,购自美国Axygen公司;HIS标签抗体、碱性磷酸酯酶标记山羊抗小鼠IgG、BCIP/NBT碱性磷酸酯酶显色试剂盒,购自碧云天生物技术研究所;其他试剂均为进口分装或国产分析纯。
1.2 引物设计与合成
根据GenBank上序列号为NC-015323的腺病毒hexon基因序列,应用引物设计软件Primer 5.0 设计2段引物,引入酶切位点,上游引物(5′-TCGCGAATTCATGGCGGCCCTCACG-3′,引入EcoR Ⅰ酶切位点及保护性碱基)、下游引物(5′-CTCTAAGCTTTTACACGGCGTTGCCTG-3′,引入Hind Ⅲ 酶切位点及保护性碱基),由金斯瑞生物科技公司合成。
1.3 hexon基因的扩增与克隆
以FAdV-4肝毒提取的cDNA为模板,用Taq酶进行PCR扩增。扩增条件:94 ℃预变性5 min;94 ℃变性30 s,59 ℃ 退火30 s,72 ℃ 延伸2 min 30 s, 30个循环;72 ℃ 延伸7 min。扩增产物用1% 琼脂糖凝胶电泳鉴定,用凝胶回收试剂盒纯化PCR产物。PCR回收产物克隆至pMD-18T,转化至E.coli DH5α感受态,经PCR鉴定和测序分析获得pMD-18T-hexon重组质粒。
1.4 表达载体的构建与鉴定
将构建的pMD-18T-hexon质粒和pET-32a载体同时用EcoRⅠ和Hind Ⅲ 双酶切。双酶切后的hexon基因片段和pET-32a载体分别纯化回收,经SolutionⅠ快速连接,转化至E.coli DH5α感受态,经氨苄抗性培养基筛选,挑取阳性克隆振荡培养,提取质粒,进行双酶切鉴定,测序分析获得pET-32a-hexon重组质粒。
1.5 pET-32a-hexon融合蛋白的诱导表达鉴定
将重组质粒pET-32a-hexon转化至E.coli BL21,挑取单个菌落进行扩增,当细胞培养至OD600nm约为0.7 h,加入IPTG使其终浓度为1 mmol/L,采用不同诱导时间进行诱导表达,比较不同诱导条件的表达量,确定最佳诱导条件,同时设立pET-32a空载体的表达菌作为空白对照。最后将各时间段菌液收集离心,用PBS重悬沉淀,加入上样缓冲液,煮沸5 min,离心上样,进行SDS-PAGE电泳分析。
1.6 pET-32a-hexon融合蛋白的可溶性分析
取菌液以1∶100的体积比扩大培养,采用优化的表达条件(37 ℃,3 h)进行大量表达,表达完毕后收集菌体,用PBS重悬菌体沉淀并超声破碎,破碎完毕后,4 ℃ 12 000 r/min,离心10 min,分别收集上清和沉淀,加入上样缓冲明液,煮沸5 min,离心进行SDS-PAGE电泳鉴定。
1.7 pET-32a-hexon融合蛋白的Western Blot鉴定
融合蛋白经SDS-PAGE分离后,采用湿法将蛋白转印至硝酸纤维膜(NC膜)上,然后70 V电压作用40 min; 5%BSA,4 ℃封闭过夜,经PBST(0.05%Tween-20)洗涤后分别加入HIS标签抗体和hexon阳性血清,37 ℃孵育1 h;再以PBST(0.05%Tween-20)洗涤,加入碱性磷酸酯酶标记的山羊抗小鼠IgG,37 ℃孵育1 h,PBST(0.05% Tween-20)洗涤,按照BCIP/NBT碱性磷酸酶显色试剂盒说明进行显色处理。
2 结果与分析
2.1 重组表达质粒pET-32a-hexon双酶切鉴定及测序结果
提取重组质粒pET-32a-hexon,以EcoRⅠ和Hind Ⅲ进行双酶切,经琼脂糖凝胶电泳检测,得到与预期大小相符的2个片段(图1),其中小片段为2 800 bp左右;南京金斯瑞生物公司测序结果显示,插入片段hexon基因大小为2 814 bp,且序列正确,表明目的片段已连接到载体pET-32a上,并成功筛选出阳性菌落。
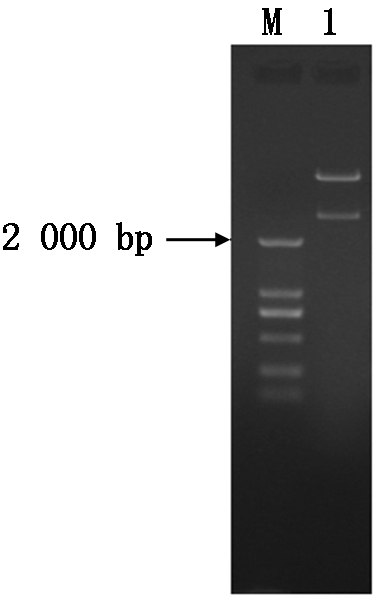
M.DL2000 DNA Marker;1.EcoRⅠ+Hind Ⅲ双酶切。 M.DL2000 DNA Marker;1. EcoR Ⅰ+Hind Ⅲ double enzyme digestion.
图1 重组表达质粒pET-32a-hexon双酶切鉴定结果
Fig.1 Double enzyme digestion of recombinant plasmid pET-32a-hexon
2.2 重组蛋白诱导表达与SDS-PAGE分析结果
从SDS-PAGE分析结果可看出,重组菌BL21(pET-32a-hexon)在1 mmol/L IPTG的诱导下,随着诱导时间的增加,重组蛋白表达量先增加后减少,诱导时间为3 h时,蛋白表达量最高(图2)。重组菌得到了表达,分子量大小在118 ku左右,与预期结果相符。
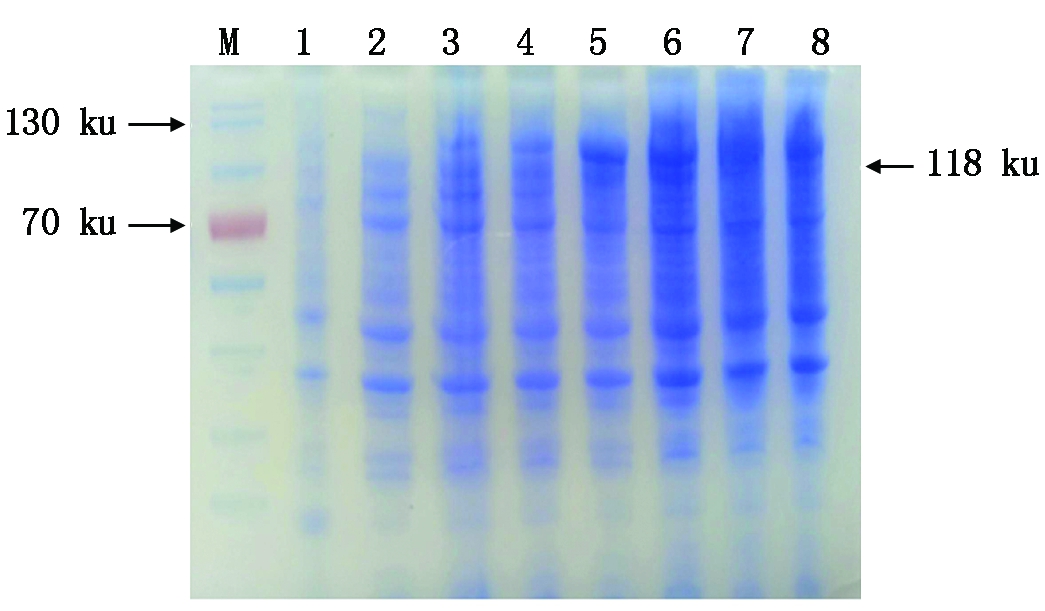
M.蛋白分子量Marker;1.pET-32a空载体;2-8.分别为诱导 后0,1,2,3,4,5,6 h表达的蛋白。 M.Protein Marker;1.Control of vector pET-32a;2-8.Induced pET-32a-hexon for 0,1,2,3,4,5,6 h.
图2 pET-32a-hexon 重组蛋白的SDS-PAGE检测
Fig.2 Analysis of pET-32a-hexon fusion protein by SDS-PAGE
2.3 重组蛋白在菌体中的表达形式
重组菌经1 mmol/L IPTG诱导,37 ℃诱导3 h后,收集菌体,以PBS重悬,超声裂解,进行SDS-PAGE电泳分析,结果表明,沉淀包涵体在118 ku处条带单一且明显,说明表达产物主要是以包涵体形式存在于沉淀中(图3)。
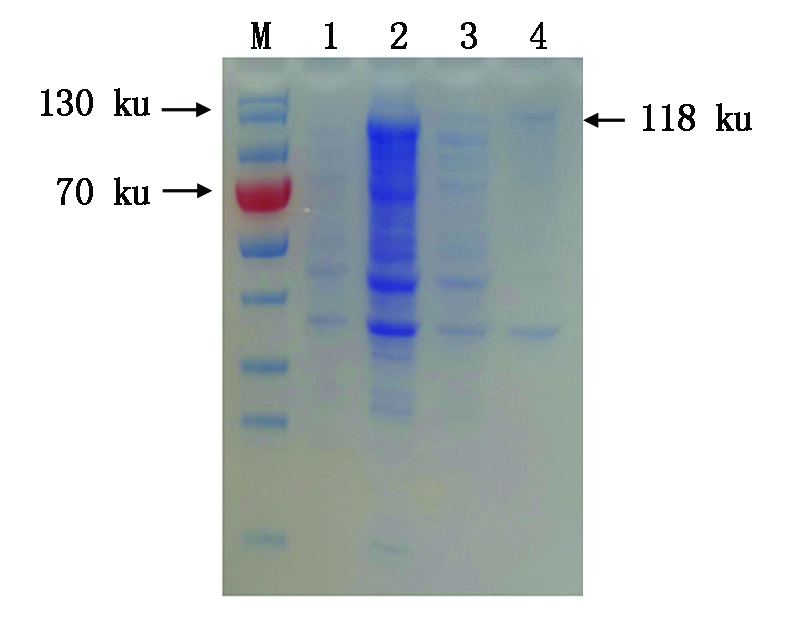
M.蛋白分子量Marker;1.pET-32a空载体;2.诱导后3 h表达的全菌蛋白;3.重组质粒诱导后的上清产物;4.重组质粒诱导后的包涵体产物。
M. Protein Marker;1.Control of vector pET-32a;2.Induced pET-32a-hexon for 3 h;3.The inclusion bodiesinduced by recombinant plasmid;4.The supernatant product induced by recombinant plasmid.
图3 pET-32a-hexon 重组蛋白的 可溶性分析SDS-PAGE检测
Fig.3 Soluble analysis of pET-32a-hexon fusion protein by SDS-PAGE
2.4 重组蛋白的Western Blot鉴定
诱导表达的重组pET-32a-hexon蛋白经SDS-PAGE电泳后,湿转至NC膜上,用HIS标签抗体蛋白、抗FAdV阳性血清和抗FAdV阴性血清分别反应,HIS标签抗体蛋白和抗FAdV阳性血清在100~130 ku处出现特异性印迹条带,抗FAdV阴性血清对照组无特异性条带(图4)。结果表明,重组蛋白pET-32a-hexon得到表达,且能够被HIS标签抗体和抗FAdV阳性血清特异性识别,具有良好的反应原性。

M.蛋白分子量Marker;1.HIS标签抗体; 2.抗FAdV阳性血清;3.抗FAdV阴性血清。 M. Protein Marker;1.HIS tag antibody; 2.Anti-FAdV positive serum; 3.Anti-FAdV negative serum.
图4 pET-32a-hexon 融合蛋白的Western Blot鉴定
Fig.4 Western Blot identification of fusion proteins pET-32a-hexon
3 讨论与结论
由FAdV-4引起的肉鸡心包积水综合征是一种高度的传染性疾病,主要发生于3~5周龄的肉鸡,病死率高达80%,感染初期,临床症状不明显,很难进行诊断,发病7 d后,死亡率突然上升,7~14 d后死亡率逐渐下降[9-14],容易与禽类其他疾病比如传染性法氏囊病、新城疫、马立克等病发生混合性感染[15-19],已经严重危害了养禽业发展,给包括我国在内的世界养禽业造成了严重的经济损失。
六邻体(Hexon)蛋白是FAdV-4的主要抗原蛋白,含有大量的抗原决定簇,包括型特异性、型间特异性及中和表位等,与FAdV-4的致病性密切相关[1-3]。六邻体蛋白是禽腺病毒被研究最广泛的结构蛋白之一,FAdV共有252个壳粒,其中六邻体就有240个,占90% 以上。hexon基因编码942个氨基酸,大小为109 ku,是主要的保护性抗原基因[20],可以刺激机体产生抗体,进而中和病毒体[21-23]。
本试验采用大肠杆菌原核表达系统对FAdV-4主要结构蛋白六邻体进行表达,首先用PCR方法扩增得到hexon基因的全序列,将其克隆至表达载体pET-32a上,在原核表达系统中在1 mmol/L IPTG,37 ℃条件下诱导3 h,表达量最高,表达出大小约118 ku的六邻体重组蛋白。试验中所用的pET-32a为含氨苄抗性基因的原核高效表达载体,表达产物带有HIS标签,方便其使用商品化镍柱进行纯化。试验中选择的表达菌株为BL21(DE3),是一个广泛用于表达外源蛋白的宿主菌,尤其适合重组融合蛋白的表达。该细菌缺少细胞膜外的蛋白酶ompT基因和其他多种蛋白酶,降低了重组产物表达后被细胞降解或剪切的概率[15,24-26]。本试验所表达的六邻体重组蛋白,由SDS-PAGE结果分析可得,主要以包涵体形式存在于沉淀中,通过简单的变复性处理之后可得到高表达量、单一的目的蛋白。且通过Western Blot分析可得出,该重组融合蛋白可与HIS标签抗体蛋白和抗FAdV阳性血清发生特异性结合,在100 ku附近出现特异性印迹条带,说明表达的融合蛋白具有良好的反应原性。
本研究成功获得了FAdV-4的主要结构蛋白六邻体(hexon)蛋白,为进一步研究血清4型禽腺病毒提供了参考资料,也为今后制备抗六邻体蛋白单克隆抗体、建立FAdV-4检测方法、以及其引起的心包积水综合征(HPS)的防治奠定了良好的基础。
[1] 罗思思,谢芝勋,邓显文,等. Ⅰ群禽腺病毒分离鉴定及hexon基因的序列分析[J]. 畜牧与兽医,2012,44(1):52-56.
[2] 邱丽叶. 禽腺病毒荧光定量PCR检测方法的建立与初步应用[D]. 哈尔滨:东北农业大学,2016.
[3] 张鸿意,曲章义,王 鹏,等. 腺病毒六邻体蛋白结构,功能及疫苗研究[J]. 国际免疫学杂,2006,29(2):126-128.
[4] 金玉霞. 腺病毒六邻体蛋白的免疫学研究进展[J]. 国际免疫学杂志,2002,25(4):172-174.
[5] 罗思思,谢芝勋,邓显文,等. Ⅰ群禽腺病毒五邻体基因的克隆及原核表达[J]. 广东农业科学,2011,38(7):154-157.
[6] Kim J N,Byun S H,Min J K,et al. Outbreaks of hydropericardium syndrome and molecular characterization of korean fowl adenoviral isolates[J]. Avian Diseases,2008,52(3):526.
[7] Domanska-Blicharz K,Tomczyk G,Smietanka K,et al. Molecular characterization of fowl adenoviruses isolated from chickens with gizzard erosions[J]. Poultry Science,2011,90(5):983-989.
[8] Niczyporuk J S,Samorek-Salamonowicz E A. Analysis of adenovirus strains isolated from poultry in Poland[J]. Bulletin of the Veterinary Institute in Pulawy,2013,57(3):305-310.
[9] Mase M,Nakamura K,Minami F. Fowl adenoviruses isolated from chickens with inclusion body hepatitis in Japan,2009-2010[J]. Journal of Veterinary Medical Science,2012,74(8):1087.
[10] Fauquet C M, Mayo M A, Maniloff J, et al. Proceedings of VIIIth report of the international committee,Virus Taxonomy, 1995[C]. Vienna: Springer, c1995.
[11] Fields B N,Knipe D M,Howley R M,et al. Proceedings of the viruses and the irreplication,Thomas Shenk Adenovirde,1996[C]. Plhiadelphia: Lippincott-Rave Publishers, c1996.
[12] 周 斌,刘华雷,曹瑞兵,等. 污染疫苗的禽腺病毒分离和鉴定[J]. 南京农业大学学报,2004,27(3):78-80.
[13] 李昕键,吴 彻,雷小亚,等. 鸡心包积液综合征病原的分离鉴定与进化分析[J]. 动物医学进展,2017,38(2):27-31.
[14] 李京帅,李银聚,张春杰,等. 禽腺病毒血清4型河南株的分离鉴定及对鸡胚致病性的研究[J]. 中国兽医科学,2018(4):1-8.
[15] 楚电峰,刘相娥,薄智勇,等.Ⅰ群禽腺病毒的流行病学和防控研究现状[J].中国动物检疫,2017,34(5):86-89.
[16] 王亚楠,韩 涛,李纯玲,等. 禽腺病毒Ⅰ群的研究现状[J]. 中国动物保健,2017,19(1):61-64.
[17] Zhao J,Zhong Q,Zhao Y,et al. Pathogenicity and complete genome characterization of fowl adenoviruses isolated from chickens associated with inclusion body hepatitisand hydropericardium syndromein China[J]. PLoS One,2015,10(7):e0133073.
[18] Schachner A,Marek A,Jaskulska B,et al. Recombinant FAdV-4 fiber-2 protein protects chickens against hepatitis-hydropericardium syndrome(HHS)[J]. Vaccine,2014,32(9):1086.
[19] Wang X L,Tang Q X,Chu Z L,et al. Immune protection efficacy of FAdV-4 surface proteins fiber-1,fiber-2,hexon and penton base[J]. Virus Research,2018,245:1-6.
[20] Pei Y L,Corredor J C,Griffin B D,et al. Fowl adenovirus 4 (FAdV-4)-Based infectious clone for vaccine vector development and viral gene function studies[J]. Viruses,2018,10(2):97.
[21] Pei Y,Corredor J C,Griffin B D,et al. Fowl adenovirus 4(FAdV-4)-Based infectious clone for vaccine vector development and viral gene function studies[J]. Viruses,2018,10(3):97.
[22] Ye J,Liang G,Zhang J,et al. Outbreaks of serotype 4 fowl adenovirus with novel genotype,China[J]. Emerging Microbes & Infections,2016,5(5):e50.
[23] Nakamura K,Mase M,Yamaguchi S,et al. Pathologic study of specific-pathogen-free chicks and hens inoculated with adenovirus isolated from hydropericardium syndrome[J]. Avian Diseases,1999,43(3):414.
[24] 赵冬敏,黄欣梅,刘宇卓,等. 鹅坦布苏病毒非结构蛋白NS1的原核表达及纯化[J]. 华北农学报,2012,27(6):11-14.
[25] 吴 萌,王安平,吴海涛. 番鸭细小病毒VP3基因的原核表达及鉴定[J]. 安徽农业科学,2017,45(35):124-127.
[26] 文艳玲. 禽腺病毒Ⅰ型hexon蛋白部分基因的原核表达及纯化[J]. 中国畜牧兽医文摘,2014,30(1):35-36.