灰葡萄孢是目前研究较为深入植物病原真菌之一,它能够引起500多种植物的灰霉病,常常对农业生产造成严重影响,由灰霉病造成的世界经济损失每年高达千亿美元[1-3]。随着灰葡萄孢基因组序列的发布,灰葡萄孢已经成为植物-病原物互作研究的模式真菌[4-5]。灰葡萄孢致病相关基因的挖掘及其致病机制的研究,可为阐明灰葡萄孢致病机制及灰霉病的防治提供理论依据。
灰葡萄孢MAPK信号途径在病菌的生长、发育和致病过程中发挥重要调控作用[6-7]。灰葡萄孢MAPK信号途径包括3种类型的MAP激酶编码基因bmp1[8]、bmp3[9-10]和BcSak1[11]。bmp1基因的缺失突变体Δbmp1生长速率减慢,分生孢子的产量降低,分生孢子能够在寄主植物表面萌发,但不能穿透寄主组织,在西红柿叶片上和康乃馨的花朵上均不能产生致病斑[7-8]。bmp3基因的缺失突变体Δbmp3在低渗透压的培养基上生长速率减慢,完全丧失了产孢能力和产菌核能力[9-10]。BcSak1基因的缺失突变体ΔBcSak1的生长速度下降,不能产生分生孢子,菌核产生量增加,不能穿透寄主组织,致病力明显降低[11]。bmp3和BcSak1下游的BcReg1基因与致病力也密切相关,突变体Δbcreg1不产生分生孢子,能够穿透植物组织但不能形成致病斑[12]。TCHK-MAPK信号途径中BOS4、BOS5、BOS2与致病力密切相关,其敲除突变体致病力均完全丧失,BOS5敲除突变体菌丝的生长速率远远低于野生型菌株,虽能够穿透寄主细胞,但是菌丝的形态发生严重畸形[13]。此外,bmp1下游的Ste12转录因子也与病菌的侵染密切相关[14-15]。
河北农业大学真菌毒素与植物分子病理学实验室前期获得了灰葡萄孢致病基因BcKMO,该基因编码犬尿氨酸单氧酶(Kynurenine 3-monooxygenase,KMO)[16];利用基因互补技术,明确了BcKMO基因正调控病菌的生长、发育,负调控病菌的致病力[17],确定了BcKMO基因通过调控病菌的胞壁降解酶活性、毒素活性、产酸能力、致病相关基因及信号途径基因的表达而影响病菌的致病力[18]。但是该基因与病菌MAPK信号途径之间的关系尚未明确。
本研究通过检测BcKMO基因突变体对MAPK信号途径抑制剂的敏感性、BcKMO基因与MAPK信号途径关键基因的表达规律、BcKMO基因突变对MAPK信号途径关键基因表达的影响,以及MAPK信号途径关键基因突变对BcKMO基因表达的影响,确定BcKMO基因与MAPK信号途径之间的关系,旨在为阐明灰葡萄孢BcKMO基因调控病菌生长、发育和致病力的分子机制奠定基础。
1 材料和方法
1.1 试验材料
灰葡萄孢野生型菌株BC22、BcKMO基因的T-DNA插入突变体BCG183、回复突变体BCG183/BcKMO、MAPK信号途径关键基因bmp1和bmp3的RNAi突变体菌株,均由河北农业大学真菌毒素与植物分子病理学实验室保存并提供。
1.2 BcKMO基因突变体对MAPK信号途径抑制剂的敏感性检测
将野生型BC22、突变体BCG183和BCG183/BcKMO分别接种到含有MAPK信号途径特异性抑制剂U0126的PDA培养基上,U0126终浓度为10 μmol/L,20 ℃条件下培养,观测病菌菌落的生长速率。同时设空白对照。每个处理至少重复3次。
1.3 BcKMO、bmp1和bmp3的表达规律分析
1.3.1 病菌不同发育阶段、不同部位的基因表达规律分析 分别提取灰葡萄孢野生型BC22的菌丝生长时期、分生孢子时期和菌核时期的菌丝、分生孢子和菌核的RNA,反转录成cDNA。以Tubulin基因作为内参,利用Real-time PCR技术,分析BcKMO和MAPK途径关键基因bmp1、bmp3的表达情况。反应体系(10 μL):模板cDNA 1.0 μL、Mix(5 U/μL) 5 μL、引物(10 μmol/L) 0.2 μL。反应程序:95 ℃ 10 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35个循环,每个样品重复3次。
1.3.2 不同培养条件对BcKMO、bmp1和bmp3表达的影响 将灰葡萄孢野生型BC22分别接种在含蔗糖、甘油、果糖、葡萄糖的YEB培养基中,在20 ℃黑暗条件下培养7 d,提取其RNA,反转录成cDNA。以Tubulin基因作为内参,利用Real-time PCR技术来分析BcKMO、bmp1和bmp3的表达情况。反应体系和程序同上。
1.4 BcKMO基因突变体中bmp1和bmp3的表达分析
利用Real-time PCR技术,检测野生型菌株BC22、突变体BCG183和BCG183/BcKMO中bmp1、bmp3基因的表达水平。分别以BC22、BCG183、BCG183/BcKMO的cDNA为模板,以Tubulin基因为内参,用bmp1和bmp3基因的特异性引物(表1)进行Real-time PCR检测。
1.5 bmp1和bmp3基因的RNAi突变中BcKMO的表达分析
利用Real-time PCR技术,检测bmp1和bmp3基因RNAi突变体中BcKMO的表达水平。以bmp1和bmp3基因RNAi突变体的cDNA为模板,Tubulin基因为内参,用BcKMO基因特异性引物(表1)进行荧光定量PCR检测。
表1 Real-time PCR引物设计
Tab. 1 Real-time PCR primers design
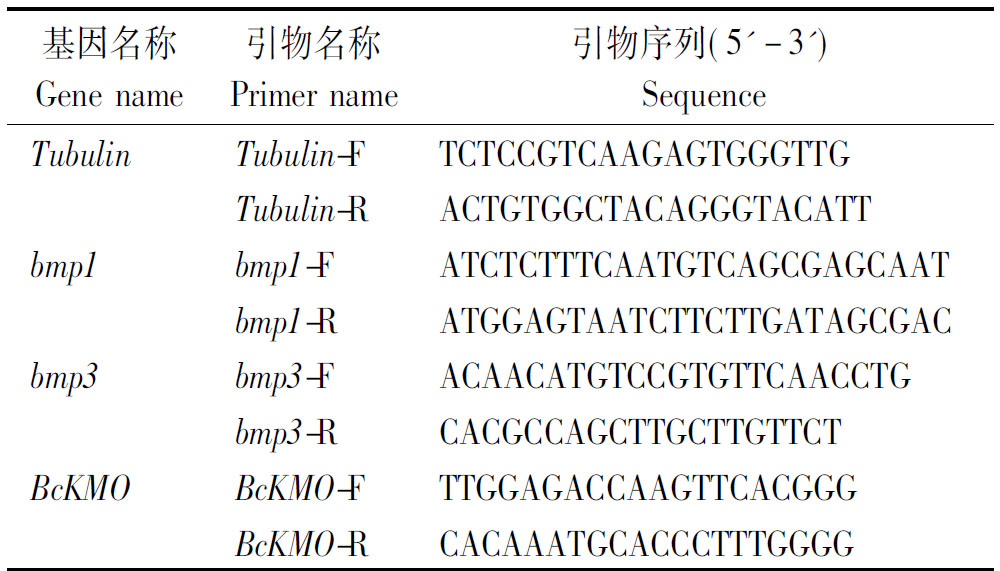
基因名称Gene name引物名称Primer name引物序列(5'-3')SequenceTubulinTubulin-FTCTCCGTCAAGAGTGGGTTGTubulin-RACTGTGGCTACAGGGTACATTbmp1bmp1-FATCTCTTTCAATGTCAGCGAG-CAATbmp1-RATGGAGTAATCTTCTTGAT-AGCGACbmp3bmp3-FACAACATGTCCGTGTTCAACCTGbmp3-RCACGCCAGCTTGCTTGTTCTBcKMOBcKMO-FTTGGAGACCAAGTTCACGGGBcKMO-RCACAAATGCACCCTTTGGGG
2 结果与分析
2.1 BcKMO基因突变体对MAPK信号途径抑制剂的敏感性检测
检测野生型BC22、突变体BCG183和BCG183/BcKMO对MAPK信号途径特异性抑制剂U0126的敏感性,发现突变体BCG183对抑制剂U0126的敏感性显著低于野生型和回复突变体,抑制率测定结果也确定突变体BCG183受抑制的程度显著降低(图1)。

不同字母表示在P<0.05水平上差异显著。图2-5同。 Different letters mean significant difference at P < 0.05 level. The same as Fig.2-5.
图1 突变体对MAPK信号途径抑制剂的敏感性检测
Fig.1 Sensitivity detection of BcKMO gene mutants to specific inhibitor of MAPK signaling pathway
2.2 BcKMO、bmp1和bmp3的表达规律分析
2.2.1 病菌不同发育阶段、不同组织部位的基因表达分析 利用Real-time PCR技术,检测BcKMO和bmp1、bmp3在病菌不同发育阶段、不同部位的表达情况。结果发现,BcKMO和bmp1、bmp3在菌丝、分生孢子和菌核中均有所表达,BcKMO在6~8 d的菌丝和菌核中表达水平高;bmp1在6,7 d的菌丝中表达水平较高,但在菌核和分生孢子中的表达水平相对较低;bmp3的表达规律与BcKMO基因基本一致,在7 d的菌丝和菌核中表达水平高(图2)。
2.2.2 不同培养条件对BcKMO、bmp1和bmp3表达的影响 利用Real-time PCR技术,检测不同培养条件下生长的野生型菌株BC22中BcKMO和MAPK途径关键基因bmp1、bmp3的表达水平,结果发现,BcKMO和bmp1、bmp3均在含蔗糖和果糖的培养条件下表达水平较高,BcKMO和bmp1的表达情况基本一致,均是在含果糖的培养条件下表达水平最高(图3)。
2.3 BcKMO基因突变体中bmp1和bmp3的表达分析
利用Real-time PCR技术,检测野生型BC22、突变体BCG183和BCG183/BcKMO中bmp1和bmp3的表达情况。结果发现,突变体BCG183中bmp1、bmp3的表达均发生了显著的变化,bmp1的表达水平显著高于野生型和回复突变体,而bmp3的表达水平显著低于野生型和回复突变体(图4)。
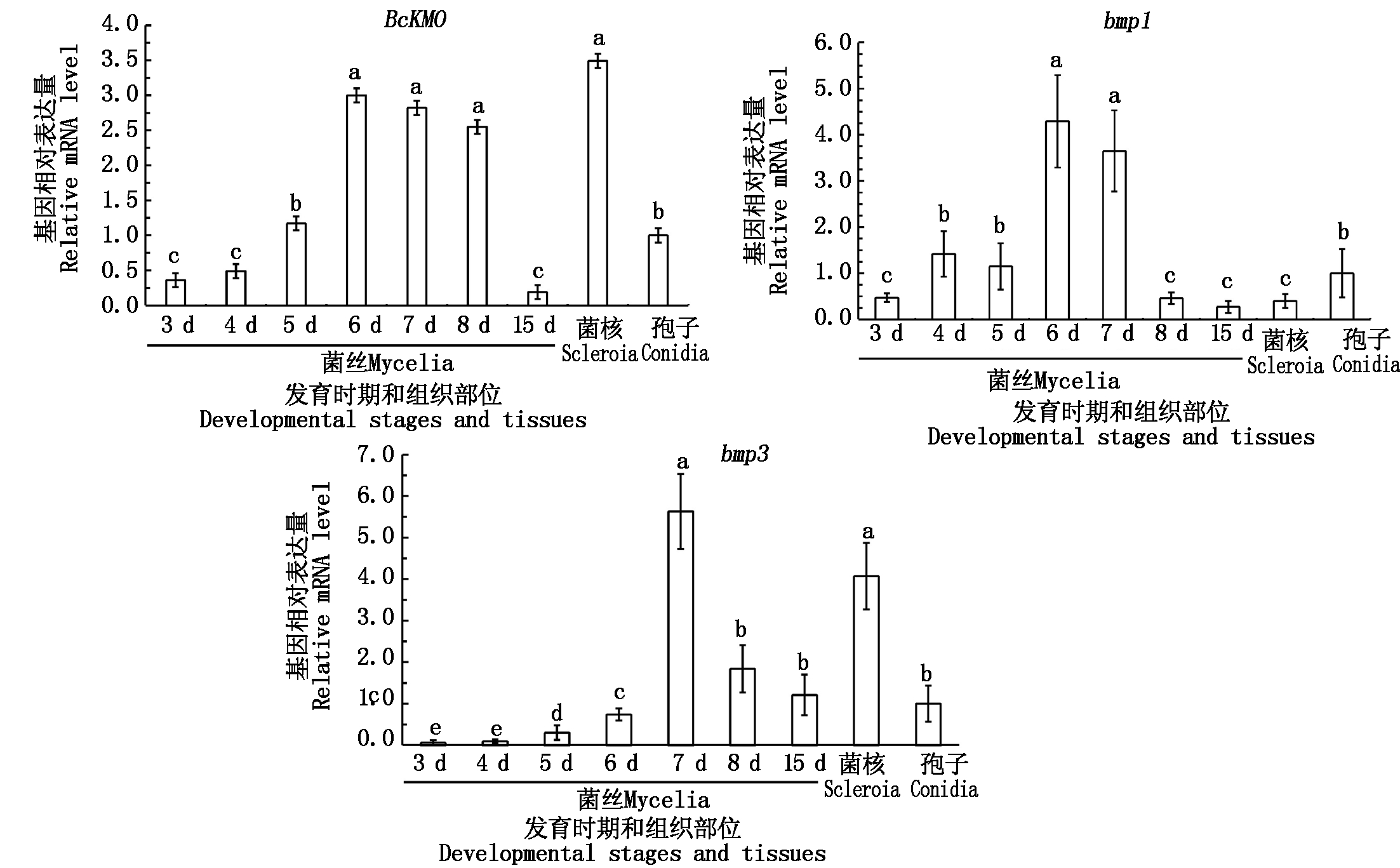
图2 BcKMO、bmp1和bmp3的表达规律分析
Fig. 2 Expression levels of BcKMO,bmp1,and bmp3
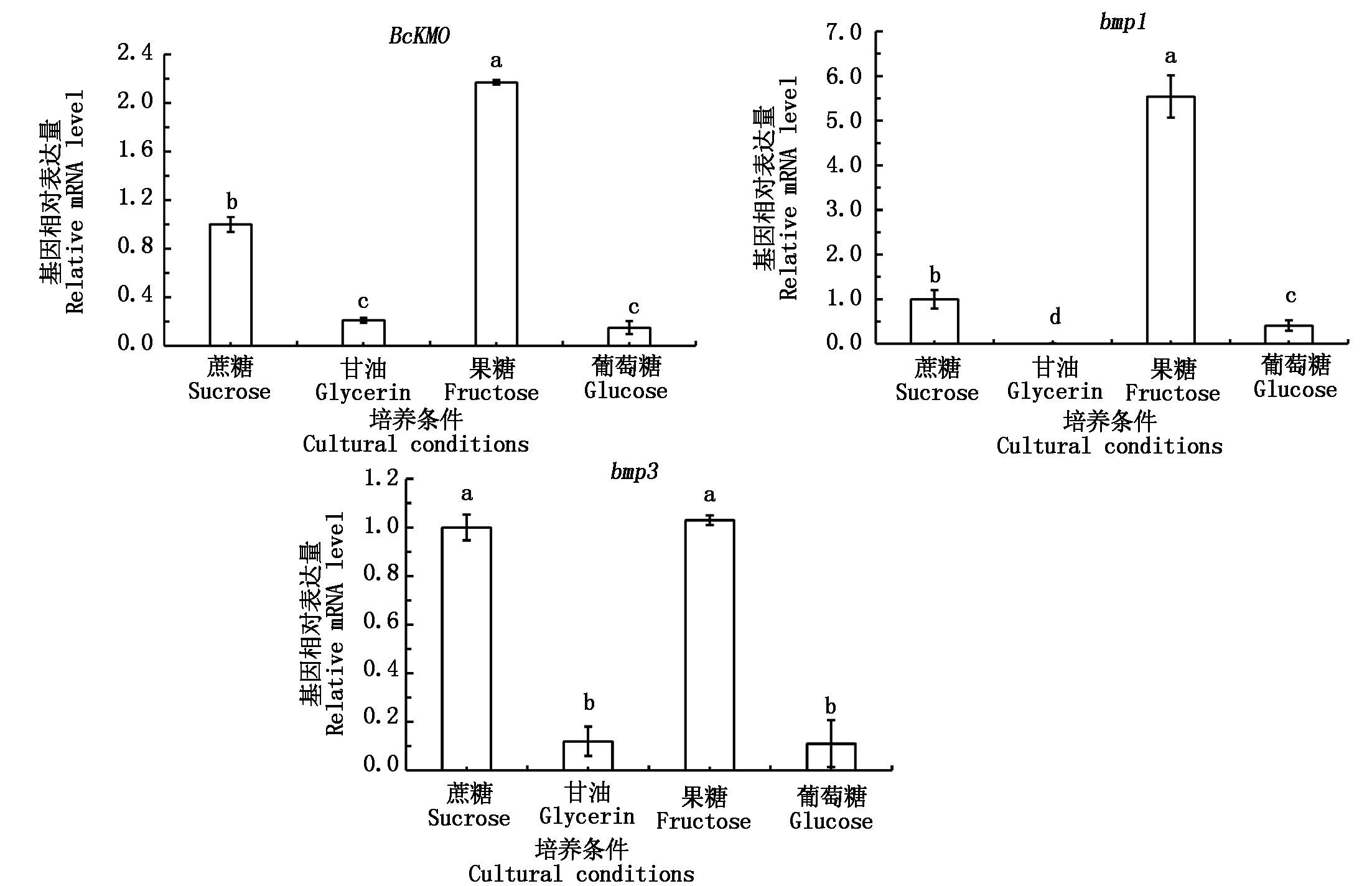
图3 不同培养条件对BcKMO、bmp1和bmp3表达的影响
Fig. 3 Expression levels of BcKMO,bmp1,and bmp3 in different cultural conditions
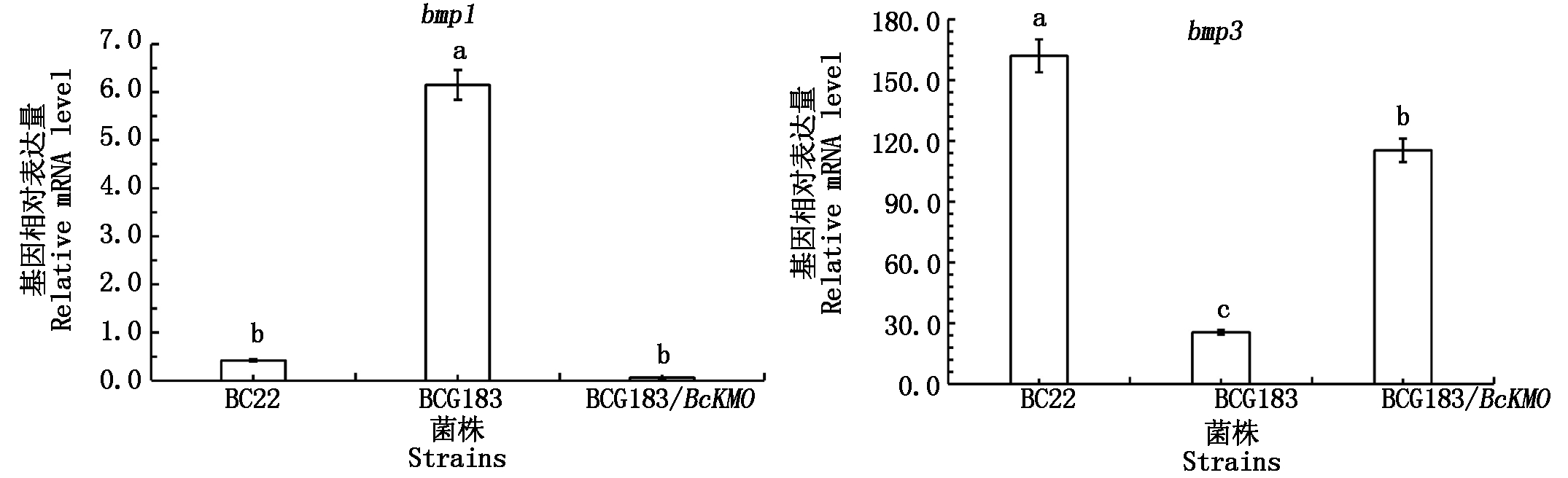
图4 突变体BCG183和BCG183/BcKMO中bmp1和bmp3的表达水平分析
Fig. 4 Expression levels of bmp1 and bmp3 in mutants BCG183 and BCG183/BcKMO
2.4 bmp1和bmp3基因的RNAi突变中BcKMO的表达分析
利用Real-time PCR技术,检测bmp1和bmp3基因RNAi突变体中BcKMO的表达水平。结果发现,bmp1基因的RNAi突变体中BcKMO的表达水平显著高于野生型,而bmp3基因的RNAi突变体中BcKMO的表达水平显著低于野生型(图5)。
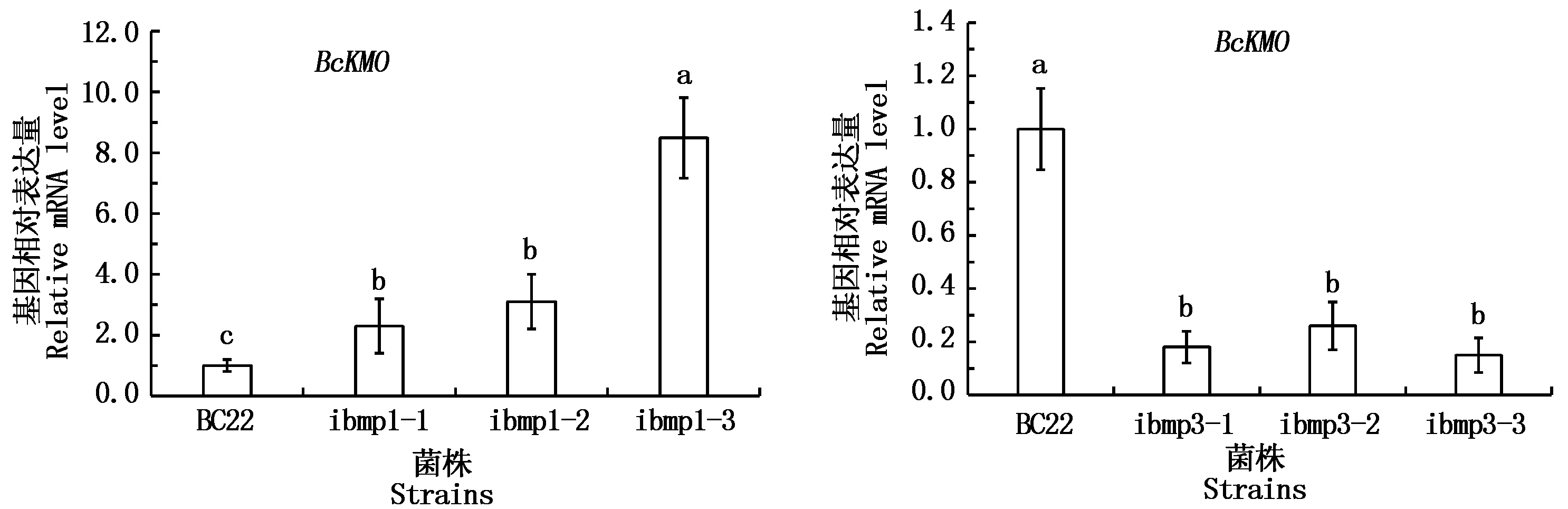
图5 bmp1和bmp3基因RNAi突变体中BcKMO基因表达分析
Fig.5 Expression levels of BcKMO in RNAi mutants of bmp1 and bmp3
3 讨论与结论
有文献报道,灰葡萄孢MAPK信号途径在病菌生长、发育和致病过程中发挥重要的调控作用[19-20]。如bmp1基因影响附着胞的形成和穿透寄主组织的能力[8],bmp3基因影响病菌的菌丝生长、产孢能力和产菌核能力[9-10],BcSak1基因影响病菌的菌丝的生长、产孢能力和致病力[11],编码MAPK激酶(MAPKK)Ste7、MAPKK激酶(MAPKKK)Ste11和假定MAPK衔接蛋白Ste50的基因影响病菌的致病力、分生孢子的萌发、营养生长和菌核的形成等方面[14]。
实验室前期明确了灰葡萄孢致病基因BcKMO正调控病菌的生长、发育,负调控病菌的致病力[9-10],但是该基因是否通过病菌的MAPK信号途径起作用以及BcKMO与病菌MAPK信号途径关键基因之间的关系尚未明确。本研究对灰葡萄孢致病基因BcKMO与病菌MAPK信号途径之间的关系进行深入研究,发现突变体BCG183对MAPK信号途径特异性抑制剂U0126不敏感性,且BcKMO与MAPK信号途径关键基因bmp1、bmp3在表达规律上存在一定的相似性,由此确定BcKMO基因可能通过病菌MAPK信号途径起作用。检测突变体BCG183中MAPK信号途径关键基因bmp1、bmp3的表达水平,发现突变体BCG183中bmp1的表达被显著上调、bmp3的表达被显著下调,表明BcKMO基因负调控bmp1的表达、正调控bmp3的表达。利用Real-time PCR技术,检测bmp1、bmp3基因的RNAi突变体中BcKMO的表达水平,发现BcKMO在bmp1基因的RNAi突变体中被显著上调,在bmp3基因的RNAi突变体中被显著下调,表明bmp1负调控BcKMO的表达,bmp3正调控BcKMO的表达。研究结果为阐明BcKMO基因调控病菌生长、发育和致病力的分子机制奠定了基础。
[1] Nakajima M,Akutsu K. Virulence factors of Botrytis cinerea[J]. Journal of General Plant Pathology,2014,80(1):15-23.
[2] Elad Y,Pertot I,Cotes Prado A M,et al. Plant hosts of Botrytis spp. Botrytis-the fungus,the pathogen and its management in agricultural systems [M]. Switzerland:Springer International Publishing,2016.
[3] Weiberg A,Wang M,Lin F M,et al. Fungal small RNAs suppress plant immunity by hijacking host RNA interference pathways[J]. Science,2013,342(6154):118-123.
[4] Amselem J,Cuomo C A,Van Kan J A,et al. Genomic analysis of the necrotrophic fungal pathogens Sclerotinia sclerotiorum and Botrytis cinerea[J]. PLoS Genetics,2011,7(8):e1002230.
[5] Van Kan J A. Shaw M W,Grant-Downton R T. Botrytis species:relentless necrotrophic thugs orendophytes gone rogue? [J]. Molecular Plant Pathology,2014,15(9):957-961.
[6] Schumacher J. Signal transduction cascades regulating
Differentiation and virulence in Botrytis cinerea. Botrytis the fungus,the pathogen and its management in agricultural systems [M]. Switzerland:Springer International Publishing,2016.
[7] Marschall R,Tudzynski P. BcIqg1,a fungal IQGAP homolog,interacts with NADPH oxidase,MAP kinase and calcium signaling proteins and regulates virulence and development in Botrytis cinerea[J]. Molecular Microbiology,2016,101(2):281-298.
[8] Leroch M,Mueller N,Hinsenkamp I,et al. The signalling mucin Msb2 regulates surface sensing and host penetration via BMP1 MAP kinase signalling in Botrytis cinerea[J]. Molecular Plant Pathology,2015,16(8):787-798.
[9] Schumacher J,Tudzynski P. Morphogenesis and Infection in Botrytis cinerea morphogenesis and pathogenicity in Fungi [M]. Berlin Heidelberg:Springer Berlin Heidelberg,2012.
[10] Liu W,Souli M C,Perrino C,et al. The osmosensing signal transduction pathway from Botrytis cinerea regulates cell wall integrity and MAP kinase pathways control melanin biosynthesis with influence of light[J]. Fungal Genetics and Biology,2011,48(4):377-387.
[11] Heller J,Ruhnke N,Espino J J,et al. The mitogen-activated protein kinase BcSak1 of Botrytis cinerea is required for pathogenic development and has broad regulatory functions beyond stress response[J]. Molecular Plant-microbe Interactions,2012,25(6):802-816.
[12] Michielse C B,Becker M,Heller J,et al. The Botrytis cinerea Reg1 protein,a putative transcriptional regulator,is required for pathogenicity,conidiogenesis,and the production of secondary metabolites[J]. Molecular Plant-microbe Interactions,2011,24(9):1074-1085.
[13] Li X,Fernández-Ortu o D,Grabke A,et al. Resistance to fludioxonil in Botrytis cinerea isolates from blackberry and strawberry[J]. Phytopathology,2014,104(7):724-732.
o D,Grabke A,et al. Resistance to fludioxonil in Botrytis cinerea isolates from blackberry and strawberry[J]. Phytopathology,2014,104(7):724-732.
[14] Schamber A,Leroch M,Diwo J,et al. The role of mitogen-activated protein (MAP) kinase signalling components and the Ste12 transcription factor in germination and pathogenicity of Botrytis cinerea[J]. Molecular Plant Pathology,2010,11(1):105-119.
[15] Rui O,Hahn M. The Slt2-type MAP kinase Bmp3 of Botrytis cinerea is required for normal saprotrophic growth,conidiation,plant surface sensing and host tissue colonization[J]. Molecular Plant Pathology,2007,8(2):173-184.
[16] 张玉净,郝志敏,郑 蒙,等. 灰葡萄孢产孢缺陷菌株的遗传分析[J]. 华北农学报,2011,26(3):86-89.
[17] 李培芬,赵福鑫,董丽萍,等. 灰葡萄孢BcKMO在病菌生长、发育和致病过程中的功能[J]. 中国农业科学,2014,47(15):2971-2979.
[18] 李培芬,赵福鑫,董丽萍,等. 灰葡萄孢犬尿氨酸单氧酶基因BcKMO调控病菌致病力的机制分析[J]. 中国农业科学,2014,47(16):3169-3175.
[19] Doehlemann G,Berndt P,Hahn M. Different signalling pathways involving a Galpha protein,cAMP and a MAP kinase control germination of Botrytis cinerea conidia[J]. Molecular Microbiology,2006,59(3):821-835.
[20] Yang Q,Yan L,Gu Q,et al. The mitogen-activated protein kinase kinase kinase BcOs4 is required for vegetative
Differentiation and pathogenicity in Botrytis cinerea[J]. Applied Microbiology and Biotechnology,2012,96(2):481-492.