转录因子是一类反式作用因子[1],能够激活或抑制目的基因在特定的时间与空间表达的蛋白质分子[2]。植物中较大转录因子基因家族碱性亮氨酸拉链蛋白(The basic leucine zipper,bZIP)在植物生长发育、衰老和抗逆等生理反应中起关键作用[2-6]。拟南芥与水稻中分别发现bZIP家族成员127个和94个[7]。根据bZIP结构特点,Jakoby等[3]将拟南芥的bZIP转录因子分为A、B、C、D、E、F、G、H、I和S共10个亚族,而TGA家族基因属于碱性亮氨酸拉链蛋白家族中的D亚族,它能够与DNA核心序列(TGACGT)相结合,激活或抑制下游靶标基因的转录,在植物抵抗胁迫及花器官发育过程中发挥重要作用[8], 如D亚族的D3和D5组通过响应PR启动子上的乙烯应答元件参与植物抗病反应,除此之外,TGA转录因子还能够参与水杨酸(Salicylic,SA)、茉莉酸(Jasmonic acid,JA) 和生长激素等的信号转导,来完成抗逆响应[9-11]。
研究表明,AtTGA5基因过量表达的转基因拟南芥能提高对霜霉病(Peronospora parasitica)的抗性[12];Pontier等[13]将AtTGA2基因导入烟草后,转基因烟草对丁香假单胞菌的抗性提高,且病程相关基因(PR1、PR2和PR3)表达量升高,表明TGA2转录因子可以调控病程相关基因表达,在植物的抗病防御反应中起重要作用;Zhang等[14]研究发现,AtTGA2、AtTGA5和AtTGA6三者在激活拟南芥系统获得性抗病中存在功能冗余,当敲除三者中任何一个,SA类似物2,6-二氯异烟酸(2,6-dichloroisonicotinic acid,INA)仍能诱导敲除突变体中PR1基因表达,增强抗病性,反之,将3个基因同时敲除, INA既不能诱导敲除突变体中PR1基因表达,也不能提高三元突变体的抗病性;田义[15]研究表明,苹果MdTGA2.1能够与MdNPR及AtNPR1 相互作用,并且过量表达该基因可以互补拟南芥 TGA2/5/6 三突变体对SA的敏感表型。将TGA2.2基因在烟草中过表达后,PR1-a和ParA基因表达量提高,而使TGA2.2基因缺失后,突变体经SA处理后,PR1-a和ParA基因不表达,表明TGA2.2基因在植物中对病原菌的防御起到正调控作用[16]。西红柿中,利用VIGS技术瞬时沉默TGA1a和TGA2.2,用病原菌处理沉默植株后,发现Pto激酶介导的抗性反应减弱,表明TGA1a和TGA2.2可能参与西红柿对假单胞菌的抗性[17]。
目前,关于TGA类转录因子的研究在模式植物中居多,均表明该类基因家族在植物抗病性反应过程中起关键作用,本研究在前期通过 Solexa 高通量测序技术研究枯萎病菌诱导后抗病和感病棉花品种转录因子的表达变化,结果表明,枯萎病菌诱导后,在抗、感病品种中,bZIP 转录因子家族基因表达活性变化数量较多,推测 bZIP 转录因子家族可能在棉花抗枯萎病中发挥重要作用。本试验在此基础上,以高抗枯萎病的陆地棉为试验材料,利用电子克隆结合RT-PCR技术分离与抗枯萎病相关的bZIP转录因子亚家族TGA转录因子基因,利用qPCR技术分析基因表达特征,为棉花抗枯萎病育种提供基因资源。
1 材料和方法
1.1 材料种植与处理
试验所需材料为陆地棉抗枯萎病品种中棉所 12 号[18]。种子消毒后浸泡于无菌水至露白,再将其种植于蛭石中,待真叶长出,移至霍格兰营养液,定期更换培养液。将接种于查氏固体培养基的枯萎病菌置于查氏液体培养基中,于26 ℃避光振荡培养7 d,调至菌液孢子数为1×107个/mL待用。
1.2 枯萎病菌及激素处理
中棉所 12 号分别在1×107个/mL 的枯萎病菌液、乙烯(1 mmol/L) [19]、水杨酸(50 μmol/L)[19]、茉莉酸(1 mmol/L) [19]溶液中浸泡45 min后,在浸泡后不同的时段0,1,3,6,12,24,48 h取其根部组织,同等条件下将棉苗浸泡于水中,取相同时间段根部组织为Mock,取样后于低温保存。
1.3 TGA1与TGA9.2基因克隆
采用 CTAB 法进行棉花根部总 RNA提取[20], 采用全式金公司All-in-One First-Strand cDNA Synthesis SuperMix for PCR试剂盒进行cDNA反转录,其操作步骤按说明书进行。
利用西域绿洲重点实验室棉花课题组前期获得的枯萎病菌诱导棉花后的基因表达谱数据,从中选取差异表达 bZIP 序列为基因探针,在棉花EST 数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中,运用tBlastN和BlastN获取同源性较高序列,利用 CAP3 软件进行序列拼接;利用ORF Finder 和SMART(http://smart.embl-heidelberg.de)软件进行备选基因开放阅读框ORF分析 和bZIP结构域分析,对符合的目标基因进行引物设计(表1),以cDNA为模板,通过PCR扩增并通过系列试验验证,将获得的阳性菌株送上海生工进行基因测序。
1.4 TGA1与TGA9.2基因序列分析
利用NCBI中ORF Finder进行基因ORF分析;利用SMART进行蛋白保守域分析;利用Mega 5.0进行系统进化分析。利用GOR4进行蛋白二级结构分析;利用ExPaSy ProtScale进行蛋白亲/疏水性分析;利用SWISS-MODEL进行蛋白结构域三级结构的同源建模分析;利用ExPaSy ProtParam进行蛋白理化性质分析。
1.5 实时荧光定量PCR分析
以棉花GhUBQ7(DQ116441)为内参基因,qRT-PCR 引物见表1。qPCR 反应体系及程序参见 TaKaRa 公司qTaq for Real-Time qPCR说明书。试验设 3 个重复,采用 2-ΔΔCt 法计算基因相对表达量[19]。
表1 引物序列
Tab.1 Primer sequence
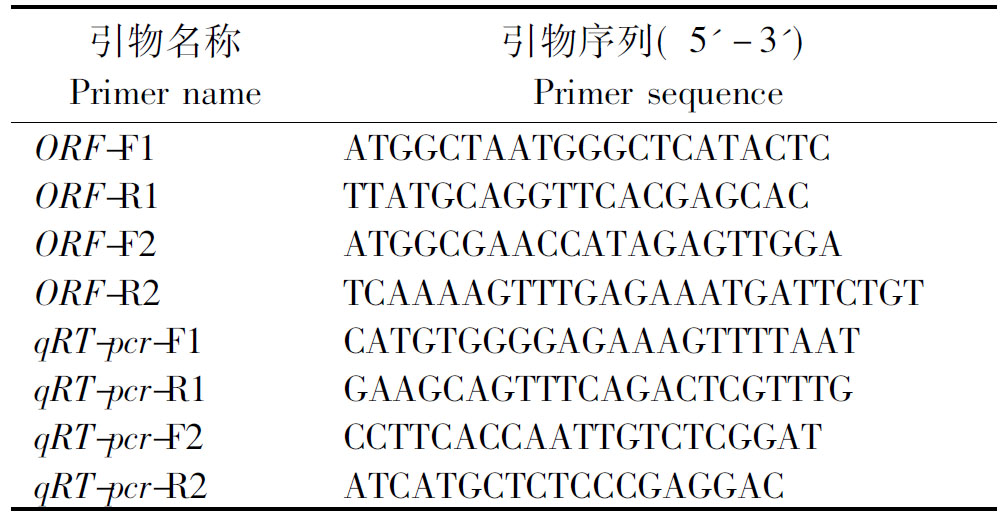
引物名称Primer name引物序列( 5'-3')Primer sequenceORF-F1ATGGCTAATGGGCTCATACTCORF-R1TTATGCAGGTTCACGAGCACORF-F2ATGGCGAACCATAGAGTTGGAORF-R2TCAAAAGTTTGAGAAATGATTCT-GTqRT-pcr-F1CATGTGGGGAGAAAGTTTTAATqRT-pcr-R1GAAGCAGTTTCAGACTCGTTTGqRT-pcr-F2CCTTCACCAATTGTCTCGGATqRT-pcr-R2ATCATGCTCTCCCGAGGAC
2 结果与分析
2.1 GhTGA1与GhTGA9.2基因ORF克隆及分析
利用ORFFinder及 SMART软件分析,获得ORF完整且含bZIP结构域及DOG1结构域序列(图1-A、图2-A)。以中棉所 12 号的根部cDNA为模板,分别扩增出长度为1 281,1 461 bp目的条带(图1-B、图2-B),测序结果表明,其核苷酸序列与电子克隆序列一致,分别命名为GhTGA1与GhTGA9.2,二者分别编码405,486个氨基酸(图1-A、图2-A),GhTGA1蛋白预测分子量为45.5 ku,等电点为6.29;GhTGA9.2蛋白预测分子量为54.2 ku,等电点为6.64。GhTGA1与GhTGA9.2蛋白的BRLZ(Basic Region Leucin Zippper BRLZ或bZIP)保守结构域分别位于121-170与183-235氨基酸,除bZIP结构域外,分析表明,2个基因均含有DOG1结构域(图1-C、图2-C)。因此,这2个基因属于bZIP转录因子蛋白亚家族TGA家族基因。利用GOR4程序预测蛋白质的二级结构分析表明,GhTGA1与GhTGA9.2蛋白中α螺旋分别为57.78%和47.74%,延伸带分别为13.83%和13.99%,无规则卷曲占28.40%和38.27%(图1-D、图2-D);利用SWISS-MODEL(https://swissmodel.expasy.org/interactive)数据库进行GhTGA1与GhTGA9.2蛋白三级结构分析(图1-E、图2-E),其三级结构主要为螺旋-转角-螺旋。

A.GhTGA1基因推导的氨基酸序列;下划线.bZIP结构域;方框.DOG1结构域;B.GhTGA1基因PCR扩增;M.DL2000;1.阴性对照;2.cDNA为模板的PCR扩增;C.GhTGA1基因蛋白结构分析;D.GhTGA1基因编码的氨基酸序列二级结构分析;最长竖线.α螺旋;中长竖线.延伸带;最短竖线.无规则卷曲;E.GhTGA1基因编码的蛋白三级结构分析。
A.The amino acid sequence deduced from GhTGA1 gene;Underline.bZIP domain;Box.DOG1 domain;B.PCR of GhTGA1 from genome cDNA;M. DL2000;1.Negative control;2.PCR amplification of cDNA as a template;C. Protein structure of GhTGA1 gene analysis;D.Analysis of two grade structure of amino acid sequence encoded by GhTGA1 gene;Alpha helix.Extended strand and random coil are represented by the longest,the second longest and the shortest vertical bars,respectively;E.Protein tertiary structure of GhTGA1 gene analysis.
图1 GhTGA1基因扩增及氨基酸序列分析
Fig.1 PCR amplification results of GhTGA1 gene and amino acid sequence analysis

A.GhTGA9.2基因推导的氨基酸序列;下划线.bZIP结构域;方框.DOG1结构域;B.GhTGA9.2基因PCR扩增;M.DL2000;1.阴性对照;2.cDNA为模板的PCR扩增。C.GhTGA9.2基因基因蛋白结构分析; D.GhTGA9.2基因编码的氨基酸序列二级结构分析;最长竖线.α螺旋;中长竖线.延伸带;最短竖线.无规则卷曲。E.GhTGA9.2基因编码的蛋白三级结构分析。
A.The amino acid sequence deduced from GhTGA9.2 gene;Underline.bZIP domain;Box.DOG1 domain;B.PCR of GhTGA9.2 from genome cDNA;M. DL2000;1.Negative control;2.PCR amplification of cDNA as a template.C.Protein structure of GhTGA9.2 gene analysis;D.Analysis of two grade structure of amino acid sequence encoded by GhTGA9.2 gene;Alpha helix,extended strand and random coil are represented by the longest,the second longest and the shortest vertical bars,respectively.E.Protein tertiary structure of GhTGA9.2 gene analysis.
图2 GhTGA9.2基因扩增及蛋白序列分析
Fig.2 PCR amplification results of GhTGA9.2 gene and amino acid sequence analysis
2.2 GhTGA1与GhTGA9.2基因同源进化分析
利用Blast程序分别对GhTGA1与GhTGA9.2基因进行同源比对分析,选取E-value较高的序列,其登录号为:NM_125919.3(AtTGA1)、EF470806(AtTGA2)、NM_102057(AtTGA3)、NM_001343084(AtTGA4)、NM_001342914 (AtTGA5)、NM_202564(AtTGA6)、NM_106441(AtTGA7)、NM_105536(AtTGA8)、 NM_001331769.1(AtTGA9)、 NM_001203315(AtTGA10)、U90214.1(NtTGA2.1)、AF031487.1 (NtTGA2.2)、 XM_016591187(NtTGA1A),利用系统进化分析软件Mega 5.0对目的基因和上述基因进行进化关系比较,分析表明,GhTGA1基因与NM_125919.3(AtTGA1)亲缘关系较近,命名该基因为GhTGA1,GhTGA9.2基因与NM_001331769.1(AtTGA9)亲缘关系较近,但棉花中已有GhTGA9 和GhTGA9.1,命名该基因为GhTGA9.2(图3)。
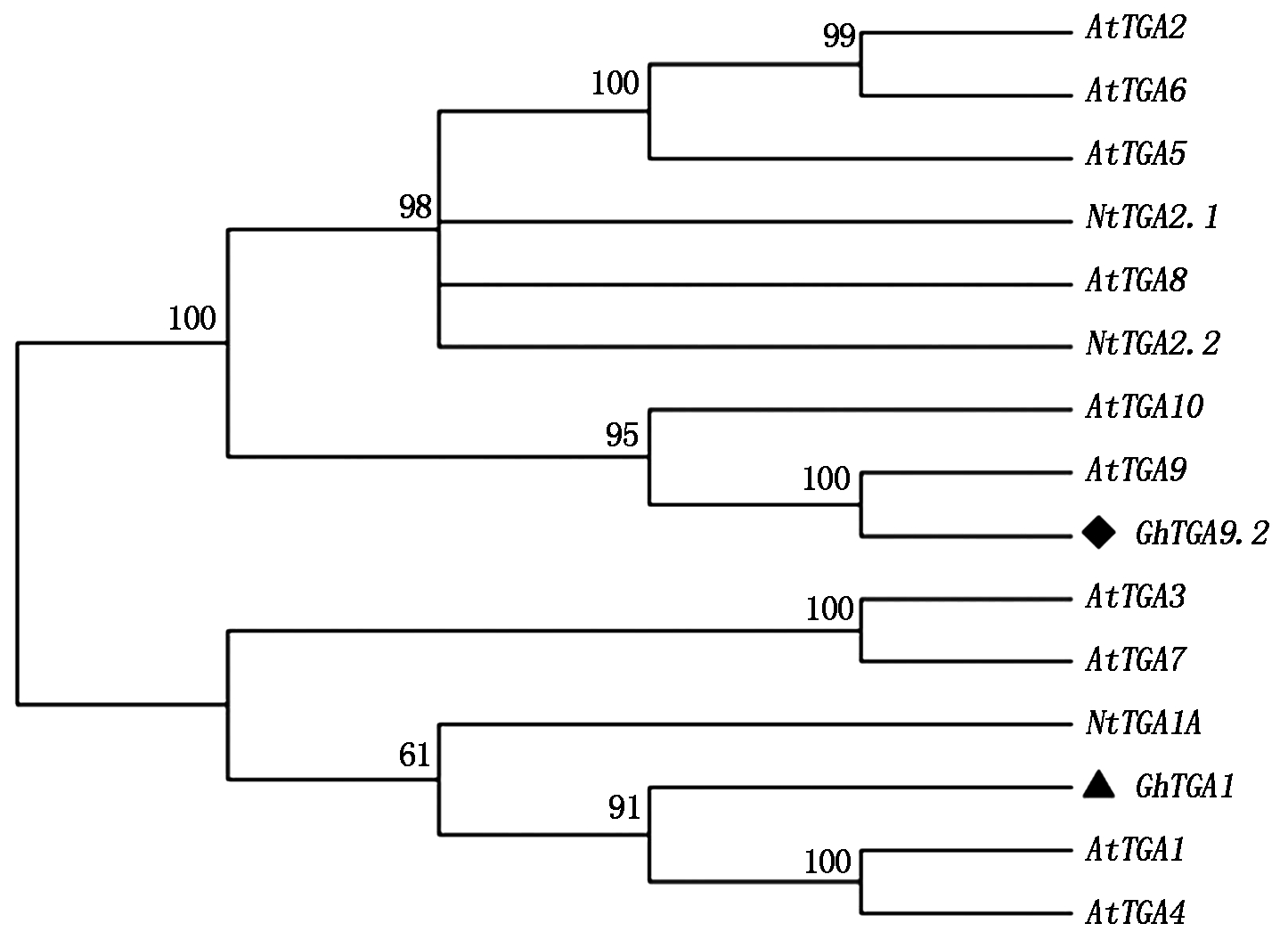
黑菱形.GhTGA9.2;黑三角形.GhTGA1;图中分支上的数字表示Bootstrap验证中基于1 000次重复该节点可信度的百分比。 Black diamond.GhTGA9.2;Black triangle.GhTGA1;The numbers on the branches represent the reliability percent of Bootstrap values based on 1 000 replications.
图3 GhTGA1与GhTGA9.2基因与其他TGA家族基因的系统进化分析
Fig.3 Phylogenetic tree of GhTGA1 and GhTGA9.2 with other TGA family gene in plant
2.3 GhTGA1和TGA9.2表达特征分析
利用实时荧光定量技术进行枯萎病菌接菌后GhTGA1和TGA9.2转录因子基因表达水平分析,结果显示,在抗病品种中棉所 12 号中,二者均能被枯萎病菌诱导表达,但表达量变化趋势不同,GhTGA1基因表达量在处理时间内均高于 Mock,随处理时间延长,呈先升高后下降趋势,处理6 h时表达量最高(图4-A),GhTGA9.2表达量在各个处理时间点均低于Mock,且各处理时间点之间表达量变化不明显,呈下调表达趋势(图4-B)。
植物激素是植物体抗病信号通路的重要信号分子,本试验分别在棉花苗期用乙烯(ET)、茉莉酸(JA)以及水杨酸(SA)对中棉所 12 号进行处理,结果表明, GhTGA1和GhTGA9.2基因均能在不程度响应激素胁迫应答,ET处理后,GhTGA1和GhTGA9.2基因表达量变化趋势相似,均表现为先增加后降低趋势,但GhTGA1基因表达量在处理24 h表达量达到最大值,约为此处理点Mock的12倍(图4-C),预示着GhTGA1可能在响应ET诱导后期发挥重要作用;GhTGA9.2基因整体表达量均高于Mock,在处理3 h表达量最高为1.1,较Mock而言,响应并不明显(图4-D);JA处理后,在处理2 h,GhTGA1基因表达量迅速升高,且表达量最高,随处理时间推移,逐渐下降(图4-E),而GhTGA9.2基因随处理时间变化,与Mock相比,表达量维持在较高水平(图4-F),表明GhTGA1和GhTGA9.2对JA胁迫应答响应明显,推测在棉花中GhTGA1和GhTGA9.2参与JA信号途径。SA处理后,GhTGA1和GhTGA9.2表达情况截然相反,GhTGA1对SA胁迫表现为负调控,每个处理时间点,其表达量均低于Mock(图4-G),而GhTGA9.2表达受SA诱导后,其表达量的变化趋势为先上升再下降,处理3 h表达量最高,各处理时间点表达量均高于Mock(图4-H),表明该基因能够响应SA胁迫应答,且呈正调控。

图4 GhTGA1与GhTGA9.2基因在不同胁迫处理下表达特征分析
Fig.4 Expression analysis of GhTGA1 and GhTGA9.2 gene under different treatments in cotton
3 结论与讨论
棉花是重要的纺织品、饲料、生物能源等原料,而海岛棉(Gossypium barbadense Linn)纤维洁白细长,强度高,受纺织行业青睐[19],新疆作为我国海岛棉唯一产区,近年来因枯萎病发病严重,制约了海岛棉的生产。因此,培育或创制抗枯萎病海岛棉种质资源是当前的主要目标。众多研究表明,转录因子家族基因参与了植物的发育、抗逆、衰老等过程,且在这些生理过程中起关键作用,而利用植物基因工程技术创制棉花抗病耐逆新材料成为研究热点[19-20]。本研究在利用前期高通量测序技术获得表达普数据基础上,利用生物信息学方法,以筛选出的差异表达 bZIP 序列为探针,获得2个 ORF 完整的bZIP 转录因子基因,通过系统进化树分析表明,GhTGA1与拟南芥AtTGA1亲缘关系较近,GhTGA9.2与拟南芥AtTGA9亲缘关系较近,推测GhTGA1与GhTGA9.2基因属于棉花 bZIP 家族的亚家族TGA 转录因子。
研究表明,不同的棉花TGA转录因子参与不同的发育过程和代谢途径[21-22],研究棉花TGA转录因子基因的表达特征有助于揭示它们的功能,经研究发现,拟南芥基因组中共有 10 个 TGA 转录因子,依据其序列相似性可将其分为 5 组(Ⅰ组包含 TGA1 与 TGA4;TGA2、TGA5 与 TGA6 组成第Ⅱ组;TGA3 与 TGA7 组成第Ⅲ组;TGA9 和 TGA10 构成第Ⅳ组;PAN 为第Ⅴ组)。其中Ⅰ、Ⅱ与Ⅲ组成员广泛参与植株的抗病反应,Ⅳ与Ⅴ组对植物花器官发育具有重要的调控功能[23],利用实时荧光定量技术分析病原菌诱导后GhTGA1与GhTGA9.2基因表达特征,结果表明,GhTGA1在抗病品种中呈现上调表达,推测GhTGA1基因可能在棉花对枯萎病菌的抗性是正调控作用,而此结果与小麦中条锈病处理后TaTGA2.2 基因的上调表达一致,而GhTGA9.2在抗病品种中呈下调表达,推测该基因可能负调控棉花对枯萎病的抗性。目前,关于植物对病原体的防御以及防御基因的表达过程中,植物激素分子水杨酸(SA)、茉莉酸(JA)和乙烯(ET)等作为植物抗病信号的重要分子发挥重要作用,而该过程中可能需要2种或2种以上信号通路协同作用,实现植物的抗病性[24-25]。本试验通过外源激素分子处理棉花,利用qRT-PCR分析GhTGA1与GhTGA9.2在激素诱导后的表达模式,在乙烯和茉莉酸处理后,GhTGA1与GhTGA9.2基因表现为上调表达,表明二者在棉花中可以被JA和ET诱导上调表达,此结果与湖北海棠MhTGA2基因可以被MeJA和ACC诱导表达结果一致[26],推测它们可能同时参与JA和ET信号路径;水杨酸处理后,GhTGA1基因为下调表达,而GhTGA9.2受SA诱导呈上调表达,Zhang等[27]用外源的SA、 MeJA和ET诱导小麦,结果表明, MeJA和ET这2个激素可以诱导TabZIP1的表达,SA却不能诱导该基因的表达,而冯传欣[24]对小麦进行水杨酸(SA)和脱落酸(ABA)诱导,结果表明,二者均能使TaTGA2.2 基因上调表达,进一步说明不同的基因通过不同的信号途径参与植物响应不同的胁迫应答。
综上所述,TGA转录因子基因在植物的生长及胁迫应答等生理过程中发挥重要作用,关于棉花中TGA转录因子研究与报道甚少。本研究以石河子大学长绒棉育种课题组利用Solexa高通量测序技术建立了枯萎病菌诱导棉花幼苗根部不同时间的基因表达谱为基础,从抗枯萎病菌的中棉所 12 号中克隆到了GhTGA1与GhTGA9.2基因,并通过qRT-PCR技术分析了GhTGA1与GhTGA9.2基因的表达特征,为后续棉花遗传转化验证基因功能奠定了基础。
[1] 赵曾强,韩泽刚,李会会,等. 棉花GhWRKY44基因的克隆与表达分析[J]. 西北植物学报,2015,35(1):10-15.
[2] Zhang J Z. Overexpression analysis of plant transcription factors[J]. Current Opinion in Plant Biology,2003,6(5):430.
[3] Jakoby M,Weisshaar B,Dröge-Laser W,et al. bZIP transcription factors in Arabidopsis[J]. Trends in Plant Science,2002,7(3):106-111.
[4] Nijhawan A,Jain M,Tyagi A K,et al. Genomic survey and gene expression analysis of the basic leucine zipper transcription factor family in rice[J]. Plant Physiology,2008,146(2):333-350.
[5] Liu X,Chu Z Q. Genome-wide evolutionary characterization and analysis of bZIP transcription factors and their expression profiles in response to multiple abiotic stresses in Brachypodium distachyon[J]. BMC Genomics,2015,16(1):227.
[6] 朱 倩. 4个bZIP转录因子在稻瘟病菌生长发育及致病过程中的功能研究[D]. 南京: 南京农业大学,2014.
[7] Li X,Gao S,Tang Y,et al. Genome-wide identification and evolutionary analyses of bZIP transcription factors in wheat and its relatives and expression profiles of anther development related TabZIP genes[J]. BMC Genomics,2015,16(1):976.
[8] Glazebrook J. Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens[J]. Annual Review of Phytopathology,2005,43(1):205-227.
[9] Izawa T,Foster R,Chua N H. Plant bZIP protein DNA binding specificity[J]. Journal of Molecular Biology,1993,230(4):1131-1144.
[10] Jones J D,Dangl J L. The plant immune system[J]. Nature,2006,444:323-329.
[11] Gao X,Wheeler T,Li Z,et al. Silencing GhNDR1 and GhMKK2 compromises cotton resistance to Verticillium wilt[J]. The Plant Journal:for Cell and Molecular Biology,2011,66(2):293-305.
[12] Kim H S,Delaney T P. Over-expression of TGA5,which encodes a bZIP transcription factor that interacts with NIM1/NPR1,confers SAR-independent resistance in Arabidopsis thaliana to Peronospora parasitica[J]. Plant Journal,2002,32(2):151-163.
[13] Pontier D,Miao Z H,Lam E. Trans-dominant suppression of plant TGA factors reveals their negative and positive roles in plant defense responses[J]. Plant Journal for Cell&Molecular Biology,2001,27(6):529-538.
[14] Zhang Y,Tessaro M J,Lassner M,et al. Knockout analysis of Arabidopsis transcription factors TGA2,TGA5,and TGA6 reveals their redundant and essential roles in systemic acquired resistance[J]. Plant Cell,2003,15(11):2647.
[15] 田 义. 苹果抗病相关基因MdTGA2.1、MdAP2D4与MdAP2D19的克隆与分析[D]. 泰安: 山东农业大学,2013.
[16] Niggeweg R,Weigel R U,Gatz C,et al. Tobacco TGA factors differ with respect to interaction with NPR1,activation potential and DNA-binding properties[J]. Plant Molecular Biology,2000,42(5):775-788.
[17] Ekengren S K,Liu Y,Schiff M,et al. Two MAPK cascades,NPR1,and TGA transcription factors play a role in Pto-mediated disease resistance in tomato[J]. Plant Journal,2003,36(6):905.
[18] 韩泽刚,赵曾强,何兰兰,等. 棉花抗枯萎病相关转录因子基因GhERFB101的克隆与表达分析[J]. 华北农学报,2015,30(1):66-72.
[19] 赵曾强,孙国清,张国丽,等. 海岛棉GbRLCK10基因克隆及表达分析[J]. 西北植物学报,2017,37(11):2130-2138.
[20] 何兰兰. 棉花ERF亚族转录因子基因的克隆与特征分析[D]. 石河子: 石河子大学,2014.
[21] Alves M S,Dadalto S P,Goncalves A B,et al. Plant bZIP transcription factors responsive to pathogens:a review[J]. International Journal of Molecular Sciences,2013,14(4):7815-7828.
[22] 李潇玲,张 析,郭文婷,等. 棉花抗枯萎病相关转录因子基因的克隆与表达[J]. 西北植物学报,2017,37(1):67-73.
[23] 田 义,张彩霞,康国栋,等. 植物TGA转录因子研究进展[J]. 中国农业科学,2016,49(4):632-642.
[24] 冯转欣. 小麦 TaTGA2.2 转录因子的特征分析及其在小麦-条锈菌互作中的功能初步研究[D]. 杨凌: 西北农林科技大学,2015.
[25] Li J,Brader G,Palva E T. The WRKY70 transcription factor:A node of convergence for jasmonate-mediated and salicylate-mediated signals in plant defense[J]. The Plant Cell,2004,16(2):319-331.
[26] 张计育. 湖北海棠抗病相关基因的克隆及其功能分析[D]. 南京: 南京农业大学,2011.
[27] Zhang Y,Zhang G,Xia N,et al. Cloning and characterization of a bZIP transcription factor gene in wheat and its expression in response to stripe rust pathogen infection and abiotic stresses[J]. Physiological and Molecular Plant Pathology,2008,73(4/5):88-94.