水稻是我国主要的粮食作物之一,黑龙江是我国主要水稻种植生产基地之一,全省种植面积超过400万hm2。水分是水稻高产稳产的重要条件之一,水分亏缺会影响水稻的正常生长和发育[1]。我国是一个农业生产大国并且干旱频发、范围广,干旱是自然灾害之一,不仅造成极大的经济损失同时也给农业生产带来不利影响,威胁着国家的粮食安全和生活水平[2-4]。我国还是一个贫水国家,人均水资源占有量是世界的1/4,同时,我国水资源分布不均衡,主要分布在长江流域及其以南地区。近些年来,干旱频繁发生严重影响了作物产量和农民收入,因此,确保干旱条件下粮食的高产稳产是非常重要的,也是急需解决的问题 [5-6]。大量研究表明,干旱胁迫会影响水稻籽粒的生长进而导致减产,干旱胁迫程度越大,减产越严重[7-10]。此外,孕穗期是水稻对水分的敏感时期,孕穗期干旱胁迫会降低水稻的穗粒数、结实率和千粒质量,从而导致水稻的产量下降[11]。
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种在生物中广泛存在的自由态四碳非蛋白氨基酸,在植物中也是信号物质。植物受到逆境胁迫时体内 GABA 含量会升高,对提高植物的抗逆性具有重要作用[12]。在干旱胁迫条件下,GABA能作为渗透调节物质,通过降低细胞质水势,提高细胞保水能力,缓解干旱对细胞带来的伤害[13]。相关研究表明,拟南芥在受到低氮胁迫下,外源GABA 能够作为氮源供给拟南芥,使其正常生长发育[14]。王宣东等[15]研究发现,外源GABA能够降低盐胁迫给小麦带来的伤害,具有保护作用。外源GABA 还能够提高黄瓜、甜瓜的抗逆性[16-17]。
氮素作为植物体内的必需元素,植物通过氮代谢过程利用氮素促进自身生长发育,植物的氮代谢是一个重要的生理过程,作物的产量和品质都与其有着一定的密切关系[18]。在这个过程中,GOT、GPT和GS是氮代谢过程中的关键酶[19-20],当植物受到逆境胁迫时,这些酶对调节植物体内的代谢平衡具有重要作用[21-24]。此外,提升籽粒氮代谢的关键酶活性有利于籽粒内蛋白质的含量提升,使其产量增加并可以改善品质[25-26]。目前,关于孕穗期干旱胁迫下施用外源GABA对水稻籽粒氮素形成及产量的影响未见相关报道。 本试验以东农425和松粳6为材料,研究孕穗期干旱胁迫下施用不同浓度的GABA对寒地粳稻籽粒干物质积累、氮素含量和氮代谢关键酶活性及产量的影响,旨在明确孕穗期干旱胁迫下外源GABA的最适施用量,为干旱胁迫下寒地粳稻化控栽培技术提供理论依据和技术支持。
1 材料和方法
1.1 试验地点与条件
试验于2016年在黑龙江省东北农业大学盆栽场进行,每个盆的规格均为盆高34.0 cm,直径34.0 cm,供试土壤为黑土,土壤自然风干后进行筛土,供试土壤为黑土,毎盆加土12.5 kg,2016年4月14日播种,2016年5月28日移栽,选取长势一致的稻苗每盆移栽4穴,每穴3株稻苗。土壤基本肥力:有机质含量22.24 g/kg、全氮1.20 g/kg、全磷0.39 g/kg、缓效钾705.41 mg/kg、碱解氮128.82 mg/kg、速效磷18.51 mg/kg、速效钾99.02 mg/kg,土壤pH值6.8。每盆施肥方法为:基肥(每盆尿素1.67 g、二胺1.11 g、硫酸钾0.83 g)和分蘖肥(每盆尿素1.67 g)。
1.2 试验材料与设计
试验以生育期相近,抗旱品种东农425和非抗旱品种松粳6为供试材料,采取随机区组设计,孕穗期(幼穗生长1 cm左右)进行干旱处理,孕穗期结束后开始复水,干旱处理期间土壤水势维持在-25 kPa;同时叶面喷施不同浓度的GABA,浓度分别为:0(A0),0.25(A1),0.50(A2),1.00(A3),2.00(A4),4.00 mmol/L(A5),以正常灌溉为对照(CK),共14个处理,每个处理重复3次,喷施外源GABA时加入适当的叶面展开剂tween-20,tween-20可以增加叶片的表面活性,使叶片能够吸附喷施的外源GABA,每个处理喷施500 mL的GABA,并使其均匀布满叶片,在干旱处理前2 d的下午(15:00-17:00)进行连续喷施。每个处理35盆,干旱处理在防雨大棚内完成,利用土壤水势测定仪(中科院南京土壤研究所生产)测定土壤水势,每天于8:00,12:00,18:00进行测定,对未达到处理要求的进行及时补水使其达到处理要求,其他同大田管理。
1.3 试验方法
1.3.1 籽粒取样方法 选取各处理生长一致的植株,挂牌标记。分别于齐穗后7,14,21,28,35 d的9:30-10:30进行取样,取挂牌植株的籽粒,每个处理随机取3穴,3次重复,并选取穗中上部的籽粒测定氮代谢相关指标。
1.3.2 籽粒氮代谢相关指标的测定 用天平称量1 g去壳的籽粒,然后放入研钵中,在研钵中加入液氮进行速冻,再加4 mL缓冲液(pH值7.6,内含1.0 mmol/L MgCl2·6H2O,1.0 mmol/L EDTA,10 mmol/L 的β-巯基乙醇)研磨成匀浆,得到的匀浆转移至离心管中,4 ℃下,利用离心机(12 000 r/min)离心20 min,上清液即为粗酶提取液,利用粗酶提取液测定酶活性。参考Zhang等[27]的方法对谷氨酰胺合成酶(GS)活性进行测定,在37 ℃下,以每分钟催化生成1 μmol γ-谷氨酰异羟肟酸所需要的酶量表示GS酶活性。
用天平称量0.5 g去壳的籽粒,然后放入研钵中,在研钵中加入液氮进行速冻,再加2 mL的0.05 mol/L Tris-HCl缓冲液(pH值7.2),研磨成匀浆,得到的匀浆转移至离心管中,4 ℃下,利用离心机(20 000 r/min)离心20 min,上清液即为粗酶提取液,利用粗酶提取液测定酶活性。参考吴良欢等[28]的活度比色法对谷草转氨酶(GOT)和谷丙转氨酶(GPT)活性进行测定,以每克样品在30 min内催化形成丙酮酸的微摩尔(μmol)数表示GOT和GPT酶活性。
水稻籽粒中的全氮含量利用FOSS公司KJELTEC2300型全自动凯氏定氮仪进行测定。
1.3.3 籽粒干物质量的测定 选取各处理生长一致的植株,挂牌标记。分别于齐穗后7,14,21,28,35 d的9:30-10:30进行取样,取挂牌植株的籽粒,每个处理随机取3穴,3次重复,然后放入烘箱,105 ℃对籽粒进行杀青处理0.5 h,80 ℃烘干至恒重并称取籽粒的质量。
1.3.4 产量和产量构成因素的测定 在成熟期,每个处理取6盆,自然风干后,分别脱粒称质量;并进行室内考种测定有效穗数、穗总粒数、千粒质量和结实率。
1.3.5 籽粒内源GABA含量的测定 参照Saito等[29]的方法对GABA含量进行测定。
1.4 数据处理与分析
试验获得的数据利用Microsoft Office Excel 2007和SPSS v19.0数据处理软件进行数据处理与分析。
2 结果与分析
2.1 孕穗期干旱胁迫下外源GABA对寒地粳稻籽粒干物质积累的影响
由图1可知,2个粳稻品种籽粒干物质积累总体变化趋势相似,均随着生育期进程的推移呈逐渐增加趋势,积累速度表现为先快后慢。与对照相比,孕穗期干旱处理显著降低了籽粒干物质积累(除齐穗后7 d);与A0处理相比,外源喷施GABA提高籽粒干物质积累量,在一定浓度范围内,随着喷施外源GABA浓度的增加,2个粳稻品种籽粒干质量增加,达到一定浓度后下降。在齐穗后35 d,东农425在A2处理下和松粳6在A3处理下籽粒干物质积累增幅最大,其增幅分别为27.68%,34.80%。
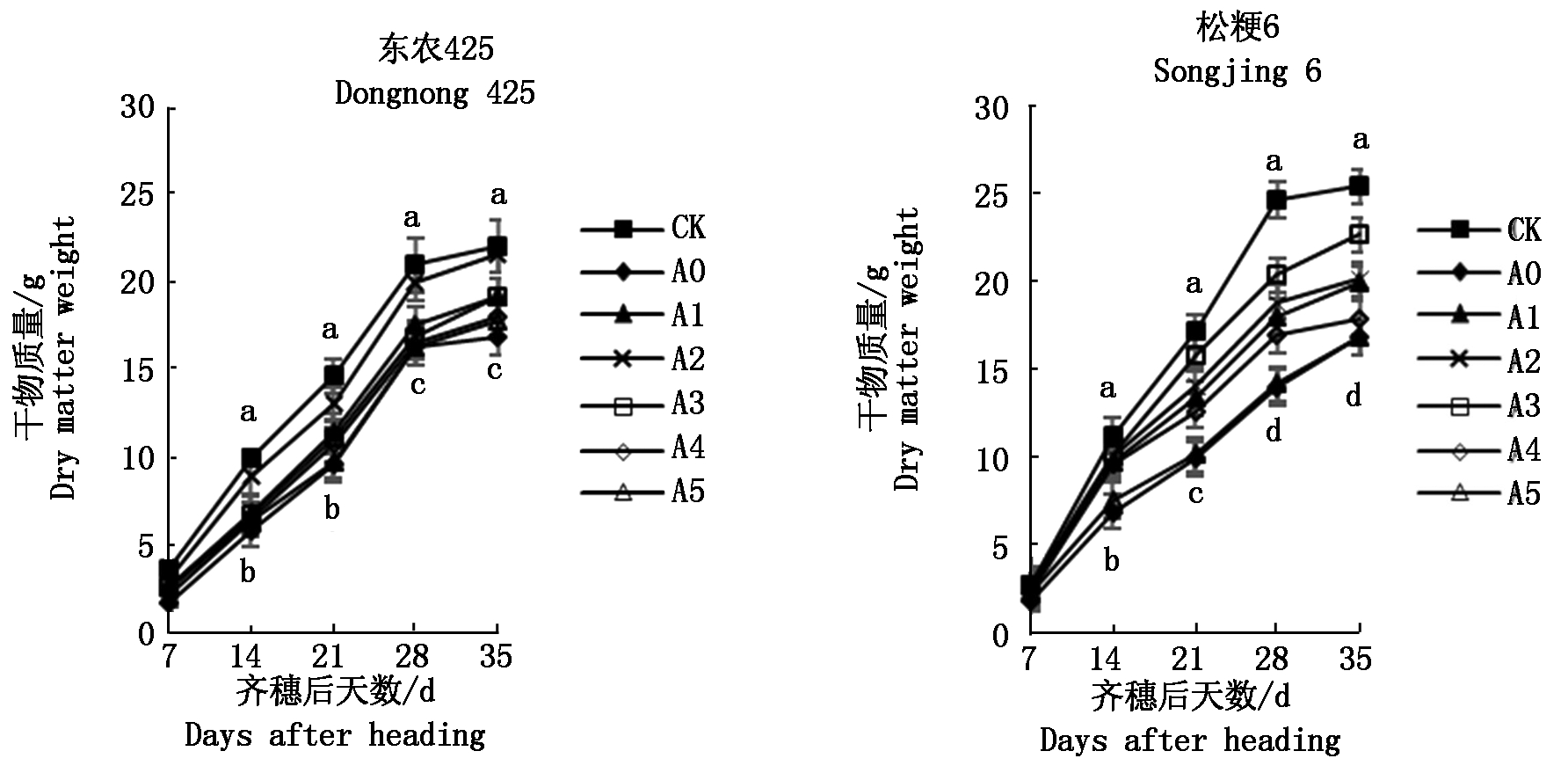
图1 孕穗期干旱胁迫下外源GABA对寒地粳稻籽粒干物质积累的影响
Fig.1 Effect of exogenous GABA at booting stage on dry matter accumulation of Japonica rice in cold region under drought stress
2.2 孕穗期干旱胁迫外源GABA对寒地粳稻籽粒氮代谢相关酶活性的影响
由图2可知,2个粳稻品种籽粒GS酶活性总体变化趋势相似,均随着生育期进程的推移呈逐渐降低趋势,与对照相比,孕穗期干旱胁迫能够提高两粳稻品种籽粒GS酶活性,与A0处理相比,外源喷施GABA能够不同程度地提高籽粒GS酶活性;齐穗后7 d,在A2处理下东农425和在A3处理下松粳6籽粒GS酶活性增幅最大,其增幅分别为39.49%和34.88%。在籽粒形成前期,东农425和松粳6籽粒GS酶活性表现分别为A2>A1>A3>A4>A5>A0和A3>A2>A1>A4>A5>A0,在籽粒形成后期,两品种各处理GS酶活性均降到对照以下(除A2、A3处理)。
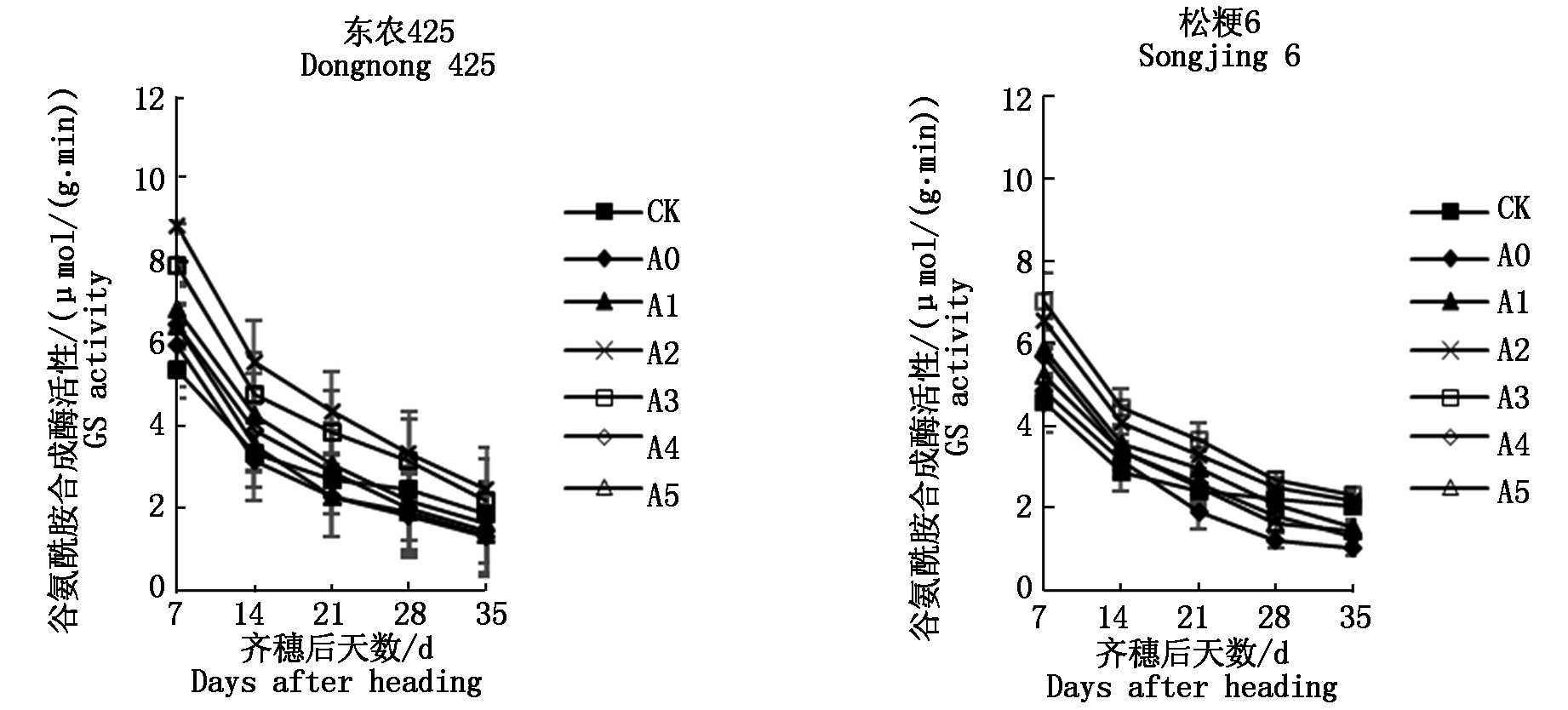
图2 孕穗期干旱胁迫下外源GABA对寒地粳稻籽粒谷氨酰胺合成酶(GS)酶活性的影响
Fig.2 Effect of exogenous GABA at booting stage on the activity of glutamine synthetase(GS)in grain of Japonica rice under drought stress
由图3可知,2个粳稻品种籽粒谷草转氨酶(GOT)和谷丙转氨酶(GPT)活性总体变化趋势相似,均随着生育期进程的推移呈先升高后降低趋势,齐穗后14 d,两粳稻品种籽粒GOT和GPT酶活性达到最大值,与对照相比,孕穗期干旱胁迫能够降低两粳稻品种籽粒GOT和GPT酶活性,与A0处理相比,外源喷施GABA能够不同程度地提高籽粒GOT和GPT酶活性;A2和A3处理下东农425和松粳6籽粒GOT和GPT酶活性增幅最大,GOT酶活性增幅分别为4.50%和3.90%,GPT酶活性增幅分别为6.25%和4.45%。除A2和A3处理下籽粒GOT和GPT酶活性与对照差异不显著外,其余各处理下籽粒GOT和GPT酶活性均显著低于对照水平。
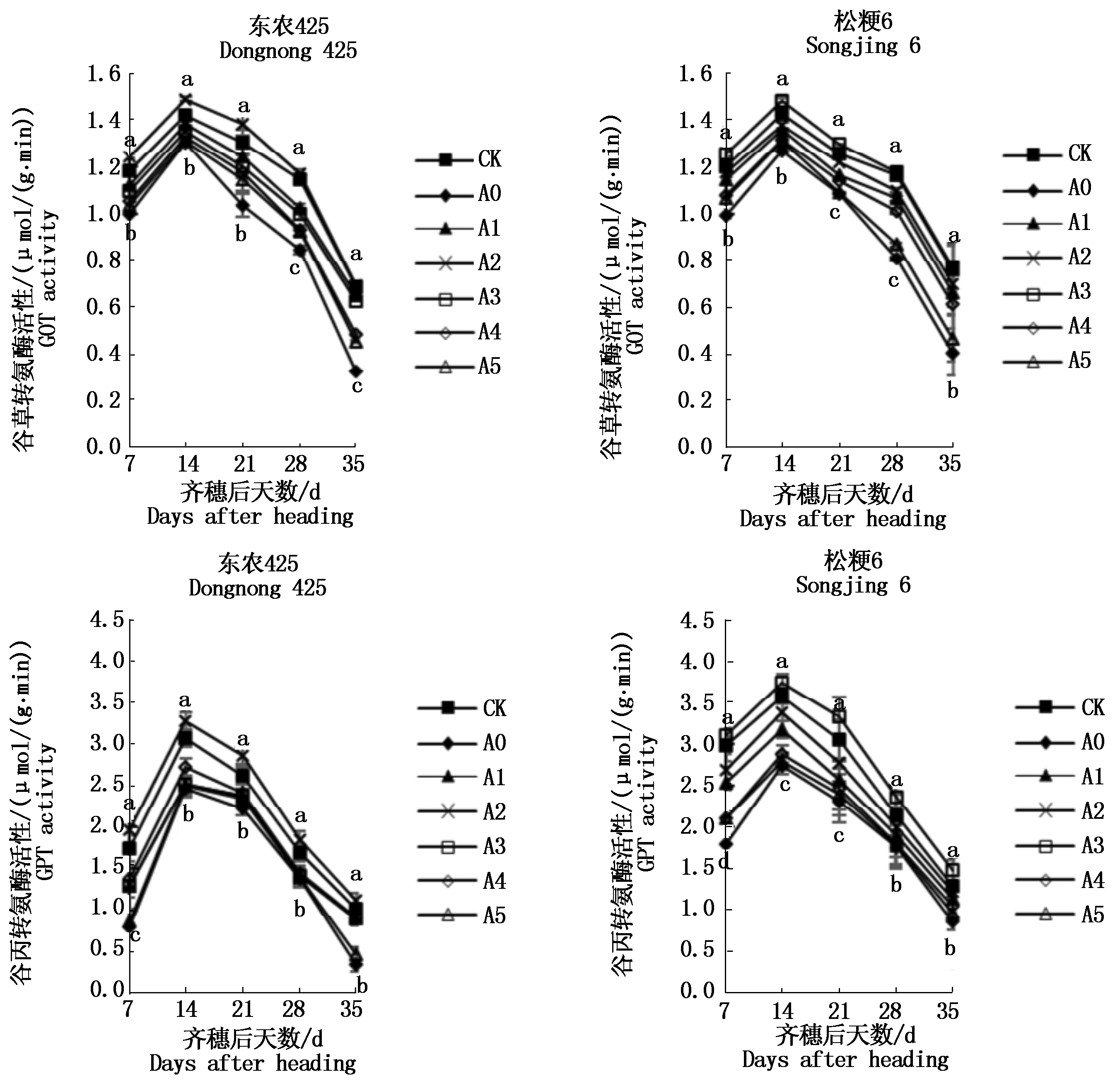
图3 孕穗期干旱胁迫下外源GABA对寒地粳稻籽粒谷草转氨酶(GOT)和谷丙转氨酶(GPT)活性的影响
Fig.3 Effects of exogenous GABA at booting stage on the activity of aspartate aminotransferase(GOT) and alanine aminotransferase(GPT)in Japonica rice in cold region under drought stress
由图4可知,2个粳稻品种籽粒全氮含量总体变化趋势相似,均随着生育期进程的推移呈逐渐降低趋势,前期下降幅度较快,后期下降幅度较平缓,与对照相比,孕穗期干旱胁迫下两品种籽粒全氮含量提高,东农425达到显著水平;与A0处理相比,外源喷施GABA提高籽粒全氮含量,2个粳稻品种籽粒全氮含量增幅均随着喷施外源GABA浓度的增加,表现为先升高后降低的变化趋势;齐穗后7 d,东农425在A2处理下和松粳6在A3处理下籽粒全氮含量增幅最大,其增幅分别为32.64%,23.50%。
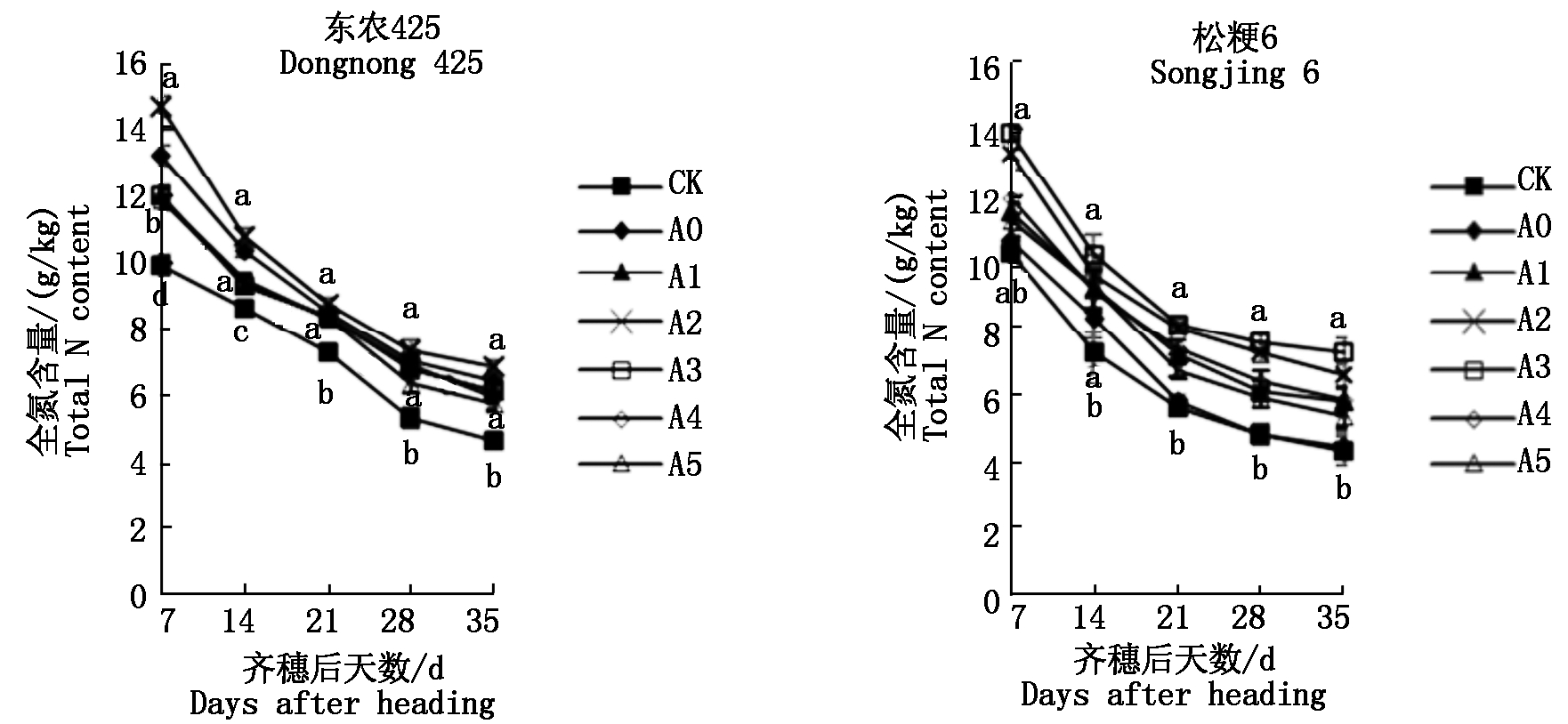
图4 孕穗期干旱胁迫下外源GABA对寒地粳稻籽粒全氮含量的影响
Fig.4 Effect of exogenous GABA at booting stage on the whole nitrogen content of rice in cold region under drought stress
2.3 孕穗期干旱胁迫下外源GABA对寒地粳稻产量及产量构成因素的影响
由表1可知,与对照相比,孕穗期干旱处理显著降低了东农425和松粳6 2个粳稻品种的产量,外源喷施GABA能够不同程度地增加2个粳稻品种产量,随着喷施外源GABA浓度的增加,产量的增幅均表现为先升高后降低的变化趋势,A0处理下东农425和松粳6产量降幅最大,降幅分别为30.41%和33.95%,孕穗期干旱处理松粳6减产幅度大于东农425,孕穗期干旱胁迫下外源GABA可以提高东农425和松粳62个粳稻品种的抗旱性;与A0处理相比,A1、A2、A3、A4、A5处理下东农425产量增幅分别为21.82%,36.71%,29.21%,21.58%,3.20%,松粳6产量增幅分别为26.10%,37.20%,44.16%,27.81%,3.93%。与对照相比,孕穗期干旱胁迫下东农425和松粳6两粳稻品种有效穗数、穗粒数、结实率和千粒质量与产量变化趋势一致,均显著降低。喷施外源GABA提高2个品种的有效穗数、穗粒数、结实率和千粒质量,东农425在A2处理下与松粳6在A3处理下有效穗数、穗粒数、结实率和千粒质量与对照差异不显著,其余各处理下均显著低于对照水平。
表1 孕穗期干旱胁迫下外源GABA对寒地粳稻产量及产量构成因素的影响
Tab.1 Effects of exogenous GABA at booting stage on yield and yield components of Japonica rice in cold region under drought stress
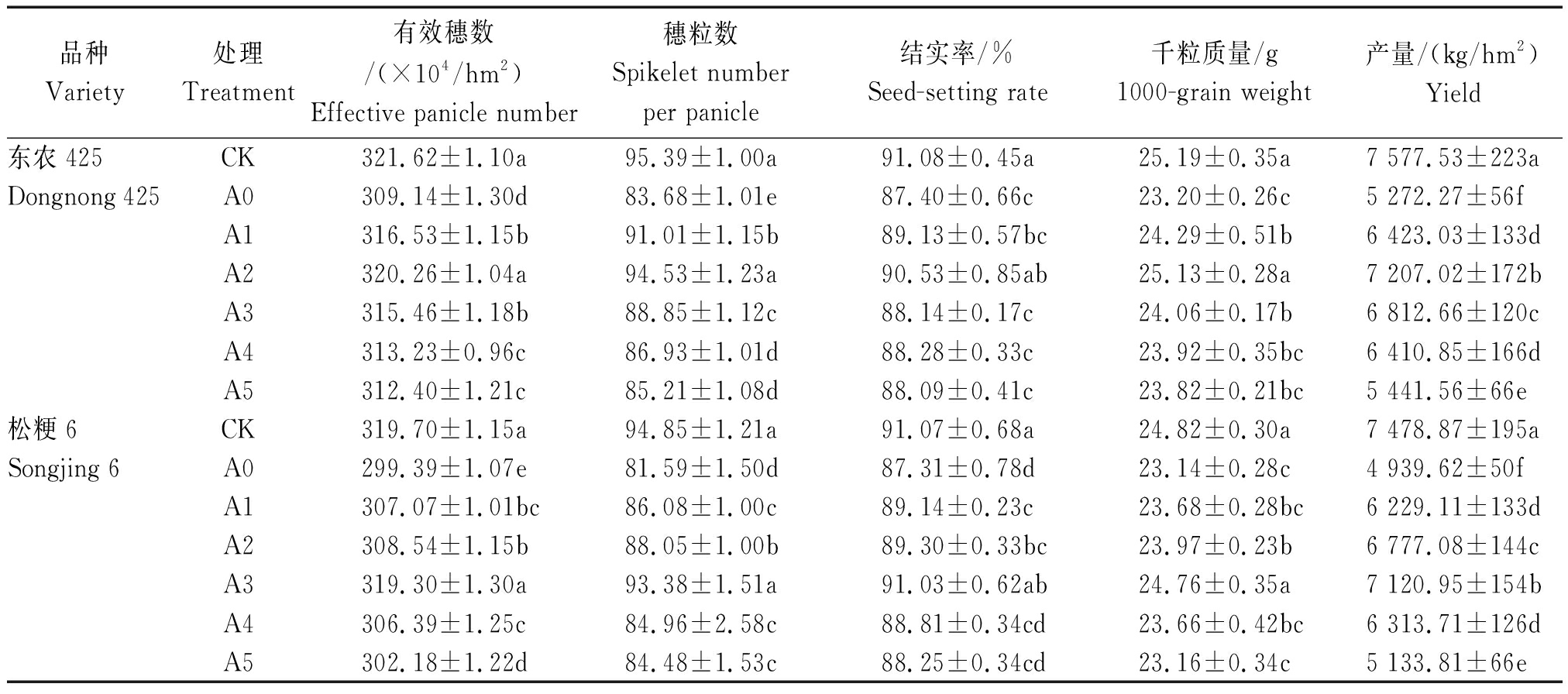
品种Variety处理Treatment有效穗数/(×104/hm2)Effective panicle number穗粒数Spikelet numberper panicle结实率/%Seed-setting rate千粒质量/g1000-grain weight产量/(kg/hm2)Yield东农425CK321.62±1.10a95.39±1.00a91.08±0.45a25.19±0.35a7 577.53±223aDongnong 425A0309.14±1.30d83.68±1.01e87.40±0.66c23.20±0.26c5 272.27±56fA1316.53±1.15b91.01±1.15b89.13±0.57bc24.29±0.51b6 423.03±133dA2320.26±1.04a94.53±1.23a90.53±0.85ab25.13±0.28a7 207.02±172bA3315.46±1.18b88.85±1.12c88.14±0.17c24.06±0.17b6 812.66±120cA4313.23±0.96c86.93±1.01d88.28±0.33c23.92±0.35bc6 410.85±166dA5312.40±1.21c85.21±1.08d88.09±0.41c23.82±0.21bc5 441.56±66e松粳6CK319.70±1.15a94.85±1.21a91.07±0.68a24.82±0.30a7 478.87±195aSongjing 6A0299.39±1.07e81.59±1.50d87.31±0.78d23.14±0.28c4 939.62±50fA1307.07±1.01bc86.08±1.00c89.14±0.23c23.68±0.28bc6 229.11±133dA2308.54±1.15b88.05±1.00b89.30±0.33bc23.97±0.23b6 777.08±144cA3319.30±1.30a93.38±1.51a91.03±0.62ab24.76±0.35a7 120.95±154bA4306.39±1.25c84.96±2.58c88.81±0.34cd23.66±0.42bc6 313.71±126dA5302.18±1.22d84.48±1.53c88.25±0.34cd23.16±0.34c5 133.81±66e
注:同一列中,数据后不同小写字母表示在0.05水平差异显著。
Note:Within a column,values followed by Different letters are significantly Different at P<0.05.
2.4 孕穗期干旱胁迫下籽粒内源GABA含量
由图5可知,2个粳稻品种籽粒内源GABA(以鲜质量计)总体变化趋势相似,均随着生育期进程的推移呈逐渐下降趋势,下降速度表现为先快后慢,孕穗期干旱胁迫会增加籽粒内源GABA含量,与对照相比,A0处理下东农425和松粳6籽粒GABA含量分别提高2.39,1.70倍;外源GABA能够增加孕穗期干旱胁迫下籽粒内源GABA含量,随着外源GABA浓度的增加,表现为先升高后下降的变化趋势,齐穗后7,14 d各处理达到显著水平,齐穗后21~35 d各处理均无显著差异,与A0处理相比,在齐穗后7,14 d,A2和A3处理下东农425籽粒GABA含量显著升高,A2、A3和A4处理下松粳6籽粒GABA含量显著升高。
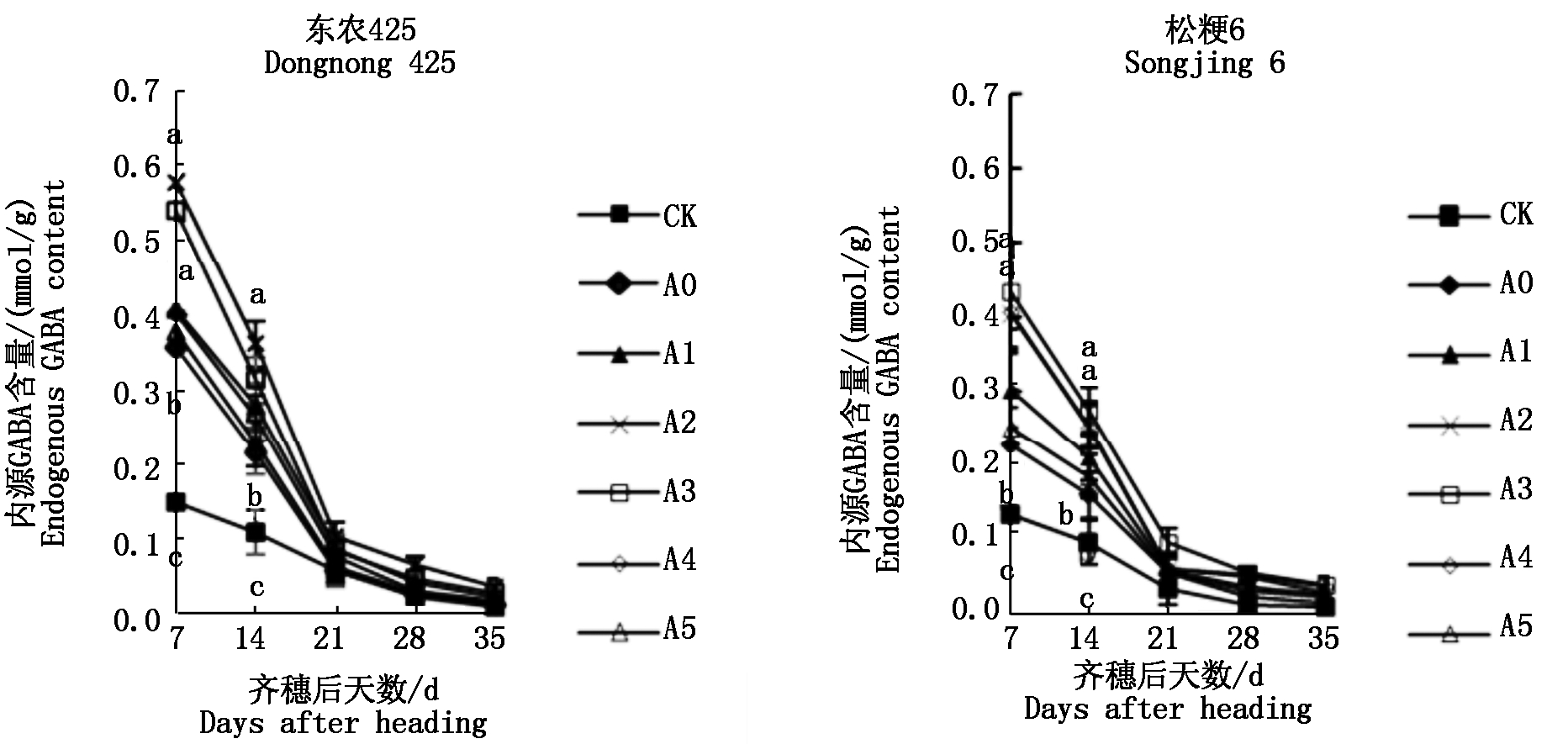
图5 孕穗期干旱胁迫下籽粒内源GABA含量
Fig.5 The content of endogenous GABA in grain under drought stress at booting stage
2.5 孕穗期干旱胁迫下各项指标间的相关性
由表2可知,籽粒全氮和内源GABA含量与GOT、GPT和GS氮代谢关键酶活性呈显著或极显著正相关,与籽粒干质量呈极显著负相关,籽粒干质量与GOT、GPT和GS氮代谢关键酶呈极显著负相关。成熟期籽粒干质量和产量与有效穗数、穗粒数、千粒质量和结实率呈极显著正相关。
表2 孕穗期干旱胁迫下各项指标间的相关性
Tab.2 Correlation between the indexes of drought stress at booting stage
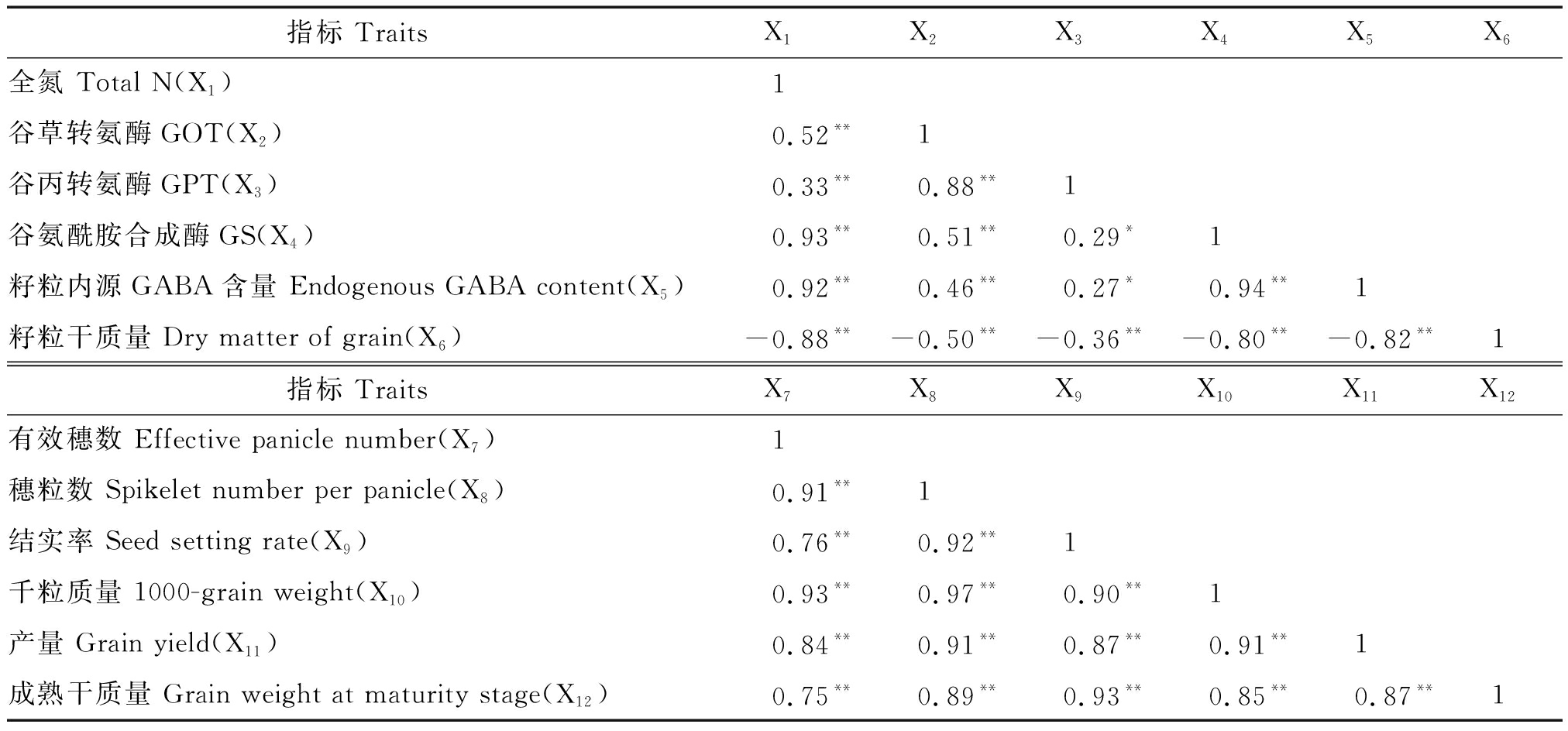
指标 TraitsX1X2X3X4X5X6全氮 Total N(X1)1谷草转氨酶GOT(X2)0.52**1谷丙转氨酶GPT(X3)0.33**0.88**1谷氨酰胺合成酶GS(X4)0.93**0.51**0.29*1籽粒内源GABA含量 Endogenous GABA content(X5)0.92**0.46**0.27*0.94**1籽粒干质量 Dry matter of grain(X6)-0.88**-0.50**-0.36**-0.80**-0.82**1指标 TraitsX7X8X9X10X11X12有效穗数 Effective panicle number(X7)1穗粒数 Spikelet number per panicle(X8)0.91**1结实率 Seed setting rate(X9)0.76**0.92**1千粒质量 1000-grain weight(X10)0.93**0.97**0.90**1产量 Grain yield(X11)0.84**0.91**0.87**0.91**1成熟干质量 Grain weight at maturity stage(X12)0.75**0.89**0.93**0.85**0.87**1
注:*.0.05显著水平;**.0.01极显著水平。
Note:*.Represents significant difference at P<0.05;**.Represents significant difference at P<0.01.
2.6 孕穗期干旱胁迫喷施外源GABA浓度与产量之间的回归模拟分析
由图6可知,孕穗期干旱胁迫下寒地粳稻产量和施用外源GABA浓度之间存在极显著的二次关系(R2分别为0.812 5和0.840 8),根据拟合方程可以计算出当东农425和松粳6的喷施外源GABA分别为0.54,1.22 mmol/L时,产量达到最高,分别为6 789.51,6 735.63 kg/hm2。
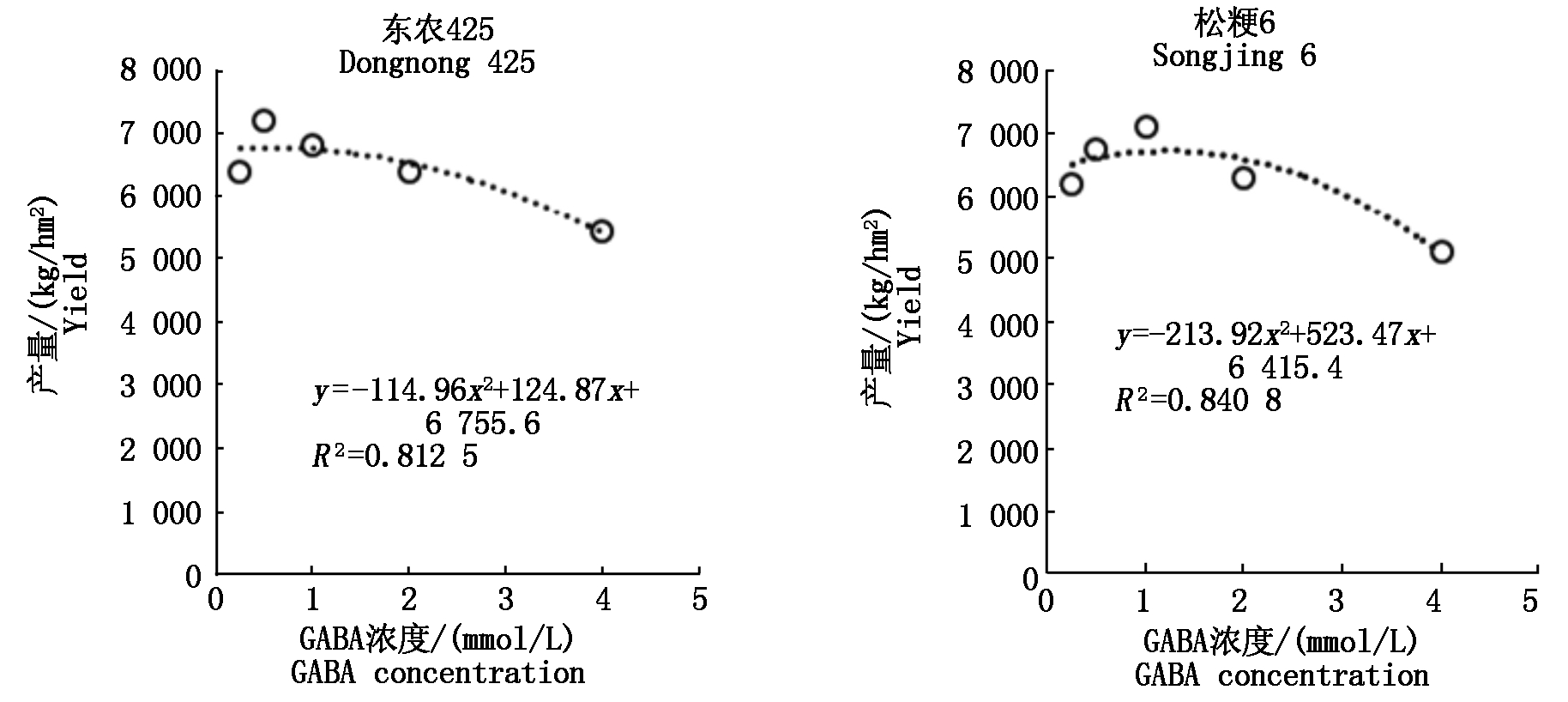
图6 孕穗期干旱胁迫下喷施外源GABA浓度与产量之间的回归曲线
Fig.6 The regression curve between the concentration of exogenous GABA and the yield under the drought stress at booting stage
3 讨论
干物质的生产、转运和分配其实质就是水稻产量形成的过程,水稻籽粒干物质的积累是后期水稻产量形成的基础,水稻在孕穗期遇到干旱胁迫时,其籽粒干物质量积累及产量均显著下降[30-31]。目前,关于外源GABA对干旱胁迫下作物干物质积累影响未见报道。本研究表明,孕穗期干旱胁迫下寒地粳稻成熟期籽粒干物质量积累显著降低(除齐穗后7 d),松粳6的降幅高于东农425;喷施外源GABA能够显著提高干旱胁迫下两粳稻品种籽粒的干物质量积累,随着GABA浓度的增加,籽粒干物质量积累增幅表现为先升高后降低的变化趋势。
大量研究表明,孕穗期干旱胁迫下水稻的有效穗数、穗粒数、千粒质量、结实率会降低,最终导致减产[8,32-33]。本研究表明,孕穗期干旱胁迫下寒地粳稻的产量及产量构成因素均显著下降,东农425减产幅度小于松粳6,与前人研究结果一致。作物在遇到逆境胁迫时,外源GABA能够提高逆境胁迫下小麦的有效穗数进而提高小麦产量[34],同时也能够提高水稻的产量[35]。GABA能够减轻逆境对作物造成的伤害,维持作物的正常生长发育,保证作物的生物量[36]。本研究发现,孕穗期干旱胁迫下外源GABA处理能够显著提高2个粳稻品种产量及产量构成因素,随着GABA浓度的增加产量及产量构成因素的增幅表现为先增加后减小的变化趋势,在最适浓度的GABA处理下2个粳稻品种的产量及产量构成因素与对照无显著差异。
已有研究证明,干旱胁迫会引起水稻籽粒中氮素含量增加,并维持较高的氮素水平[37]。本研究结果发现,孕穗期干旱胁迫下寒地粳稻籽粒全氮含量增加,与前人研究结果一致。逆境胁迫下作物体内GABA可以作为氮的临时储存库,减轻逆境对作物造成的伤害[20,38-40]。本研究结果表明,干旱胁迫下外源GABA能够提高2个粳稻品种籽粒全氮含量,全氮含量的增幅随着GABA浓度的增加表现为先升高后下降的变化趋势。
水稻籽粒中GS酶参与无机氮转化有机氮的过程,产生的谷氨酸经过GOT和GPT的催化合成其他的氨基酸,然后供籽粒合成蛋白质,这3种酶都起到了重要作用[41-42]。GS不仅是氮代谢关键酶,还与植物的逆境防御生理代谢有着密切的关系[43-44],植物遇到逆境时体内的GABA含量会增加[45]。本研究发现,孕穗期干旱胁迫能够提高2个粳稻品种籽粒GS酶活性(齐穗后7,14 d)和内源GABA含量(齐穗后7,14 d),降低GOT和GPT酶活性。
处于逆境下作物体内的GABA能作为调节物质来维持作物氮代谢正常进行,从而抵御逆境对作物造成的伤害,甄爱等[46]研究表明,外源施用GABA能够维持Ca(NO3)2胁迫下甜瓜幼苗氮代谢平衡,外源GABA处理能够提高2个粳稻品种干旱处理时籽粒的GS、GOT、GPT氮代谢关键酶活性与内源GABA含量,氮代谢关键酶活性和内源GABA含量的增幅均随着GABA浓度的增加表现为先升高后降低的变化趋势,降低了干旱胁迫下水稻氮代谢变化带来的危害,保证了籽粒的正常生长。
综上所述,孕穗期干旱胁迫处理对寒地粳稻籽粒干物质积累、产量形成和生理代谢过程具有显著影响,对松粳6的影响程度大于东农425。喷施外源GABA可以有效地提高寒地粳稻籽粒的干质量、氮代谢关键酶活性、内源GABA含量、产量及产量构成因素,保证了籽粒的正常生长,最终缓解干旱胁迫对产量造成的影响;与A0相比,东农425和松粳6分别在A2和A3处理下氮代谢相关酶活性与对照差异不显著,籽粒干物质量积累和产量增加效果最为明显。本研究说明,低浓度的GABA对干旱胁迫下水稻籽粒的生长具有促进作用,而高浓度的GABA则会产生抑制作用,且不同水稻品种对GABA的敏感性存在差异。
[1] 全瑞兰,王青林,马汉云,等. 干旱对水稻生长发育的影响及其抗旱研究进展[J]. 中国种业,2015(9):12-14.
[2] 刘小龙. 我国干旱地区水文地质研究现状[J]. 工程建设与设计,2017(11):123-124.
[3] 邓 忠,翟国亮,吕谋超,等. 我国农业应对干旱灾害的技术研究现状及展望[J]. 节水灌溉,2016(8):162-165.
[4] 康 蕾,张红旗. 我国五大粮食主产区农业干旱态势综合研究[J]. 中国生态农业学报,2014,22(8):928-937.
[5] 孙 莹. 水资源现状及保护应对措施分析[J]. 科技资讯,2017(33):101-102.
[6] 黄 阳. 浅谈我国农田水利的现状与对策[J]. 南方农业,2017,11(14):113-113.
[7] 蔡一霞,李 洋,朱海涛,等. 灌浆期亏缺灌溉对水稻产量形成的影响[J]. 中国农业科学,2015,48(8):1492-1505.
[8] 朱海平,李贵勇,夏琼梅,等. 不同时期干旱胁迫对水稻产量和生长特性的影响[J]. 中国稻米,2017,23(4):135-138.
[9] 陈 亮,汪本福,江元元,等. 孕穗期干旱及复水对水稻叶片生理生化和产量的影响[J]. 中国稻米,2016,22(1):59-64.
[10] 段素梅,杨安中,黄义德,等. 干旱胁迫对水稻生长、生理特性和产量的影响[J]. 核农学报,2014,28(6):1124-1132.
[11] 郭贵华,刘海艳,李刚华,等. ABA缓解水稻孕穗期干旱胁迫生理特性的分析[J]. 中国农业科学,2014,47(22):4380-4391.
[12] Xiang L,Hu L,Xu W,et al. Exogenous γ-Aminobutyric acid improves the structure and function of photosystem Ⅱ in muskmelon seedlings exposed to Salinity-Alkalinity stress[J]. PLoS One,2016,11(10):e0164847.
[13] 杨泽伟,王龙海,朱 莉,等.γ-氨基丁酸代谢旁路在植物响应逆境胁迫中的作用机制研究[J]. 生物技术进展,2014,4(2):77-84.
[14] Wendy L Allan, Barry J Shelp. Fluctuations of γ-aminobutyrate, γ-hydroxybutyrate, and related amino acids in leaves as a function of the light-dark cycle, leaf age, and N stress[J].Canadian Journal of Botany, 2006, 84(8):1339-1346.
[15] 王宣东,郭尚敬,李妹芳,等.γ-氨基丁酸对小麦耐盐性的影响(英文)[J]. 南方农业学报,2017,48(10):1761-1768.
[16] 王春燕,郭玉佳,张晓倩,等. 不同浓度NaCl胁迫下γ-氨基丁酸对黄瓜幼苗生长及矿质元素吸收的影响[J]. 北方园艺,2014(3):5-8.
[17] 王春燕,李敬蕊,夏庆平,等. 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系GABA代谢及氨基酸含量的影响[J]. 应用生态学报,2014,25(7):2011-2018.
[18] Lawlor D W. Carbon and nitrogen assimilation in relation to yield:mechanisms are the key to understanding production systems[J]. Journal of Experimental Botany,2002,53(370):773-787.
[19] Lam H M,Coschigano K T,Oliveira I C,et al. The molecular-genetics of nitrogen assimilation into amino acids in higher plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1996,47(4):569-593.
[20] Rocha M,Licausi F,Araújo W L,et al. Glycolysis and the tricarboxylic acid cycle are linked by alanine aminotransferase during hypoxia induced by waterlogging of Lotus japonicus[J]. Plant Physiology,2010,152(3):1501-1513.
[21] Berger S,Sinha A K,Roitsch T. Plant physiology meets phytopathology:plant primary metabolism and plant-pathogen interactions[J]. Journal of Experimental Botany,2007,58(15/16):4019-4026.
[22] Heil M,Bostock R M. Induced systemic resistance(ISR)against pathogens in the context of induced plant defences[J]. Annals of Botany,2002,89(5):503-512.
[23] Bolton M D. Primary metabolism and plant defense-fuel for the fire[J]. Molecular Plant-microbe Interactions,2009,22(5):487-497.
[24] Kinnersley A M,Turano F J. Gamma aminobutyric acid(GABA)and plant responses to stress[J]. Critical Reviews in Plant Sciences,2000,19(6):479-509.
[25] 王小纯,熊淑萍,马新明,等. 不同形态氮素对专用型小麦花后氮代谢关键酶活性及籽粒蛋白质含量的影响[J]. 生态学报,2005,25(4):802-807.
[26] 马冬云,郭天财,查菲娜,等. 种植密度对两种穗型冬小麦旗叶氮代谢酶活性及籽粒蛋白质含量的影响[J]. 作物学报,2007,33(3):514-517.
[27] Zhang C, Peng S, Peng X, et al. Response of glutamine synthetase isoforms to nitrogen sources in rice (Oryza sativa L.) roots[J]. Plant Science, 1997, 125(2):163-170.
[28] 吴良欢,蒋式洪,陶勤南. 植物转氨酶(GOT和GPT)活度比色测定方法及其应用[J]. 土壤通报,1998,29(3):136-138.
[29] Saito T,Matsukura C,Sugiyama M,et al. Screening for gamma-aminobutyric acid(GABA)-rich tomato varieties[J]. Journal of the Japanese Society for Horticultural Science,2008,77(3):242-250.
[30] 雷 舜,王抄抄,黄 炎,等. 分蘖期控制灌溉对土温及水稻干物质积累等的影响[J]. 华北农学报,2016,31(2):153-158.
[31] 赵宏伟,田雪飞,于美芳,等. 孕穗期干旱胁迫对寒地粳稻干物质积累、转运及产量形成影响[J]. 东北农业大学学报,2016,47(11):1-8.
[32] 高 阳,杨婷婷,鲍广稳,等. 孕穗期干旱胁迫对水稻部分性状及产量的影响[J]. 安徽科技学院学报,2015(1):19-22.
[33] 杨安中,段素梅,吴文革,等. 孕穗期干旱胁迫对超级稻剑叶部分生理指标及产量的影响[J]. 分子植物育种,2017,15(2):685-691.
[34] 郑舒文,徐其隆,邹华文.γ-氨基丁酸对渍水胁迫下小麦产量的影响[J]. 湖北农业科学,2016,55(1):31-33.
[35] 沙汉景,胡文成,贾 琰,等. 外源水杨酸,脯氨酸和γ-氨基丁酸对盐胁迫下水稻产量的影响[J]. 作物学报,2017,43(11):1677-1688.
[36] 贾 琰,赵宏伟,王敬国,等. 逆境胁迫下作物中γ-氨基丁酸代谢及作用的研究进展[J]. 作物杂志,2014(5):9-15.
[37] 石 英,沈其荣,茆泽圣,等. 旱作条件下水稻的生物效应及表层覆盖的影响[J]. 植物营养与肥料学报,2001,7(3):271-277.
[38] Liu C,Li Z,Yu G. The dominant glutamic acid metabolic flux to produce γ-Amino butyric acid over proline in Nicotiana tabacum leaves under water stress relates to its significant role in antioxidant activity[J]. Journal of Integrative Plant Biology,2011,53(8):608-618.
[39] Fait A,Fromm H,Walter D,et al. Highway or byway:the metabolic role of the GABA shunt in plants[J]. Trends in Plant Science,2008,13(1):14.
[40] Miyashita Y,Good A G. Contribution of the GABA shunt to hypoxia-induced alanine accumulation in roots of Arabidopsis thaliana[J]. Plant & Cell Physiology,2008,49(1):92-102.
[41] 冯万军,邢国芳,牛旭龙,等. 植物谷氨酰胺合成酶研究进展及其应用前景[J]. 生物工程学报,2015,31(9):1301-1312.
[42] 曹珍珍,张其芳,韦克苏,等. 水稻籽粒氮代谢几个关键酶对花后高温胁迫的响应及其与贮藏蛋白积累关系[J]. 作物学报,2012,38(1):99-106.
[43] Miflin B J,Habash D Z. The role of glutamine synthetase and glutamate dehydrogenase in nitrogen assimilation and possibilities for improvement in the nitrogen utilization of crops[J]. Journal of Experimental Botany,2002,53:979-987.
[44] Masclaux-Daubresse C,Carrayol E,Valadier M H. The two nitrogen mobilisation-and senescence-associated GS1 and GDH genes are controlled by C and N metabolites[J]. Planta,2005,221(4):580-588.
[45] Perez M,Invers O,Manuel Ruiz J,et al. Physiological responses of the seagrass Posidonia oceanica to elevated organic matter content in sediments:An experimental assessment[J]. Journal of Experimental Marine Biology and Ecology,2007,344(2):149-160.
[46] 甄 爱,胡晓辉,任文奇,等. 外源γ-氨基丁酸对Ca(NO3)2胁迫下甜瓜幼苗NO3-N同化的影响[J]. 应用生态学报,2016,27(12):3987-3995.