摘要:为了了解Mo的分子功能,对26 000粒拟南芥EMS诱变突变体种子进行了筛选,鉴定出一个对正常Mo敏感的突变体4-10。在正常170 nmol/L Mo条件下,4-10突变体的根部伸长发育受到抑制,而340 μmol/L Mo处理能部分恢复突变体根长。在170 nmol/L Mo条件下4-10和Col-0幼苗的根长分别为(1.56±0.13)cm和(11.89±0.71)cm;而在340 μmol/L Mo条件下,4-10和Col-0的根长分别为(3.3±0.17)cm和(6.8±0.73)cm。此外,340 μmol/L Mo处理能够恢复4-10异常的根形态。Mo含量测定结果表明,4-10突变体植株根部Mo含量显著低于野生型植株;除了对正常Mo敏感外,4-10突变体叶色对![]() 也敏感,其花青素含量显著高于Col-0。为了鉴定4-10突变体候选基因,利用图位克隆技术将候选基因定位到1号染色体一个23 kb区域(26.809~26.832 Mb),进一步基因组重测序结果表明,在该区域存在1个非同义突变SNP,包含该SNP的基因At1g71100编码核糖-5-磷酸异构酶(RPI),初步证明,RPI基因为4-10突变体的候选基因。利用AtRPI基因纯合突变植株和4-10突变体进行的等位性检测结果表明,4-10突变体和等位基因突变体rsw10-1杂交的F1仍然对
也敏感,其花青素含量显著高于Col-0。为了鉴定4-10突变体候选基因,利用图位克隆技术将候选基因定位到1号染色体一个23 kb区域(26.809~26.832 Mb),进一步基因组重测序结果表明,在该区域存在1个非同义突变SNP,包含该SNP的基因At1g71100编码核糖-5-磷酸异构酶(RPI),初步证明,RPI基因为4-10突变体的候选基因。利用AtRPI基因纯合突变植株和4-10突变体进行的等位性检测结果表明,4-10突变体和等位基因突变体rsw10-1杂交的F1仍然对![]() 敏感,从而确定RPI基因为4-10突变体基因。通过表型分析注意到除了过量Mo能恢复4-10突变体根长之外,外源尿苷处理同样可以恢复4-10突变体的根长。结果表明,过量的Mo通过尿苷转运作用促进了补救合成途径进程。
敏感,从而确定RPI基因为4-10突变体基因。通过表型分析注意到除了过量Mo能恢复4-10突变体根长之外,外源尿苷处理同样可以恢复4-10突变体的根长。结果表明,过量的Mo通过尿苷转运作用促进了补救合成途径进程。
关键词:![]() 拟南芥;图位克隆;钼;补救合成途径
拟南芥;图位克隆;钼;补救合成途径
钼(Mo)是有机体内重要的微量元素[1-3]。当Mo浓度低于0.2 mg/kg时,植物会缺Mo,而Mo浓度高于6 mg/kg会产生毒性[4-5]。土壤pH值是影响钼酸盐生物利用度的重要因素之一,当pH值低于5.5时,钼酸盐同化作用受到抑制[6]。为弥补钼的缺乏,2种高效的方式是施钼酸盐肥和增加pH值。关于钼酸盐毒性的症状已经有报道,如叶片颜色和色素变化以及生长减弱等[6-7]。目前,关于Mo作为有机嘌呤复合体的组成部分的生物学作用已被阐述[6,8-10]。然而,关于Mo毒性的研究报道却很少。
当环境发生变化时,植物的基因表达也会随之发生改变[11-12]。目前,已经鉴定出维持Mo平衡过程中的许多重要转运蛋白,如MOT1和MOT2。钼酸盐转运蛋白MOT1已经从拟南芥中鉴定出来,它参与Mo缺乏条件下的Mo吸收和转运[13]。转运蛋白MOT2定位于液泡上,并参与将储存的钼酸盐从液泡输出到细胞质中,然后转运到成熟的种子中的过程[14]。与硫酸盐转运蛋白家族不同,另一个衣藻MOT2蛋白是促进因子超家族的主要成员[15],表明钼酸盐在植物中存在不同并且复杂的代谢机制。
为进一步了解Mo稳态的分子机制,尝试在正常Mo条件下鉴定敏感的突变体。本研究鉴定出了一个新的突变体4-10,其根长对正常的Mo具有敏感性。在正常Mo(170 nmol/L,1 Mo)条件下,4-10突变体具有非常短并且异常的根表型,而过量的Mo(340 μmol/L,2000 Mo)可恢复其根的伸长和表型,并且4-10具有比Col-0更低的Mo含量。另外,在1 Mo和2000 Mo条件下,4-10突变体对![]() 敏感,花青素含量显著低于Col-0。4-10的图位克隆结果显示,该基因编码核糖-5-磷酸异构酶(RPI)。此外,4-10对尿苷敏感,在1 Mo条件下施加尿苷可以充分恢复4-10植株的根伸长。综上所述,本研究结果可揭示Mo元素在拟南芥从头合成途径(De novo synthesis)上的新功能。
敏感,花青素含量显著低于Col-0。4-10的图位克隆结果显示,该基因编码核糖-5-磷酸异构酶(RPI)。此外,4-10对尿苷敏感,在1 Mo条件下施加尿苷可以充分恢复4-10植株的根伸长。综上所述,本研究结果可揭示Mo元素在拟南芥从头合成途径(De novo synthesis)上的新功能。
EMS诱变的Columbia(Col-0gl1-1)种子购自Lehle Seeds(目录号M2E-01A-07(201B))。通过TAIR网站(www.arabidopsis.org)的ABRC中订购AtRPI基因CS16363(rsw10-1)中的点突变纯合品系的种子。F1种子来源于4-10和rsw10-1之间的杂交。将种子播种在MGRL生长培养基上[16],然后将植株在22 ℃,16 h光照/8 h黑暗光周期的条件下培养。
在170 nmol/L Mo(1 Mo)MGRL培养基上共生长26 000个EMS诱变的M2种子。将短根的植株转移到340 μmol/L Mo(2000 Mo)MGRL培养基中,并标记根尖的位置。5 d后,将在2000 Mo条件下根伸长恢复的植株再次转移到1 Mo培养基中培养5 d,选择其根伸长停止或缓慢的植物,并获得M3种子。将M3种子播种到1 Mo和2000 Mo培养基上并确认表型。第2次筛选后,获得突变体4-10。
关于候选基因定位,将4-10突变体与野生型Landsbergerecta(Ler)杂交,获得F2种子。提取在1 Mo加0.3 mmol/L的![]() 条件下表现出突变体表型的F2单株基因组DNA,并使用dCAPs和SSLP标记F23N20和F23N20(34)进行基因定位。同时将4-10突变体进行全基因组重测序并与野生型进行SNP位点比较分析。
条件下表现出突变体表型的F2单株基因组DNA,并使用dCAPs和SSLP标记F23N20和F23N20(34)进行基因定位。同时将4-10突变体进行全基因组重测序并与野生型进行SNP位点比较分析。
使用RNeasy Plant Mini试剂盒(Qiagen,Valencia,CA,USA)从叶片中提取总RNA。然后将RNA反转录为cDNA(PrimeScript RT试剂盒),并用于基因克隆。回收PCR产物用于测序。引物序列见表1。
表1 基因克隆所需引物序列
Tab.1 The primers for gene cloning

基因名Gene name上游引物 (5′-3′) Forward primer 下游引物 (5′-3′) Reverse primer AT1G71070ATGGGAGCTGAAAAGAAATGGCTTTTCACTTGCATTGATTCGATTGTGAAAT1G71080ATGTCGAATCACTCCAGAGATGTTATACGGAGTTGACTTCATCTTCAAT1G71090ATGTCAGGTTTCTCCAGTGGAATTATTGCATACCTTGGACAGTAAT1G71100ATGGGTTCTGCATTCGATCCCTTATCCAAACCTATCCTTGACGAT1G71110ATGAGCTTCTTTATCCTCTCCGTCTATACGCATTCTACAGAAAGCTAT1G71120ATGTCTTCTTCTTCTTCAATGGACTTTAAAATGTGATCTTGTTGGTGGCAT1G71130ATGAAGCGTATTATCAGAATCTCATCACGCGCCTCTAGCAACCTCAGAT1G71140ATGGATTCGGCGGAGAAGGGCTTGTTAGCTGATGTATTCATGTTCTAT1G71150ATGGCGAAACCAAACATAGACTAAAGAGTAACATTCTGCATAT1G71160ATGGAATCGAGCTTTCATTTCATCAAGAAAGAAGCTCTGTCTTCAT1G71170ATGGAGACTCAGTATCCGAAACTATCAGGATAAGCCGTTAAGTCTCCT
对1 Mo和2000 Mo条件下生长14 d的Col-0和4-10植株的根和地上部分分别进行取材,并用浓硝酸消化。然后将样品溶解在0.08 mol/L HNO3中,并通过ICP-MS(SPQ9700;SⅡ,Chiba,Japan)进行Mo含量的测定。
植株在1 Mo和2000 Mo条件下,用体式显微镜(SZH10;Olympus)分析其根部形态。通过共聚焦荧光显微镜(FV-1000;Olympus)用PI(10 mg/mL;Molecular Probes)对生长14 d的幼苗根部进行根尖观察,激发和发射波长分别为619,559 nm。每个株系超过10株植株进行分析。
为了检测4-10突变体和Col-0植株对尿苷的敏感性,将种子播种在含有1 Mo和5 mmol/L尿苷的组合培养基上。
使用软件ImageJ(http://rsb.info.nih.gov/ij/)对生长10 d的植株根长进行测定,数据以平均值±SD表示。每种条件下至少测量30株植株。
在1 Mo/200 Mo加0.3 mmol/L ![]() 条件下生长10 d的4-10和Col-0植株用于花青素的测量[17]。
条件下生长10 d的4-10和Col-0植株用于花青素的测量[17]。
为了在正常的Mo条件下鉴定出新的突变体,本研究将EMS诱变的M2种子(共26 000个种子,Col-0 gl1-1)播种到170 nmol/L Mo(1 Mo)培养基上,选择根伸长发育受到抑制的植株并转移到340 μmol/L的Mo(2000 Mo)培养基中培养5 d,将具有根长恢复的植株再次转移到1 Mo培养基中培养5 d,选择根停止伸长或伸长发育缓慢的植株,单株收种得到M3种子。将M3种子播种到1 Mo和2000 Mo培养基上,选择生长有差异的株系。经过筛选后,获得了一个编号为4-10的突变体(图1-A)。根长测量结果表明,在1 Mo条件下,4-10和Col-0幼苗的根长分别为(1.56±0.13)cm和(11.89±0.71)cm;而在2000 Mo条件下,4-10和Col-0的根长分别为(3.3±0.17)cm和(6.8±0.73)cm(图1-B)。
此外,4-10异常的根形态可以通过340 μmol/L的Mo处理后得到恢复(图2)。而在1 Mo和2000 Mo条件下,4-10的地上部分表型与Col-0中观察到的表型没有区别,这与地上部分鲜质量测定结果一致。
除了对Mo的敏感性外,4-10突变体的叶色也对![]() 敏感。在0.3 mmol/L
敏感。在0.3 mmol/L ![]() 条件下,4-10植物的叶片颜色为红色,而Col-0的叶片颜色为绿色(图3-A),340 μmol/L Mo(2000 Mo)可恢复4-10突变体的叶色表型。此外,在外源施加0.3 mmol/L
条件下,4-10植物的叶片颜色为红色,而Col-0的叶片颜色为绿色(图3-A),340 μmol/L Mo(2000 Mo)可恢复4-10突变体的叶色表型。此外,在外源施加0.3 mmol/L ![]() 的1 Mo和2 000 Mo培养基中,4-10突变体的叶片花青素含量显著高于Col-0(图3-B)。在加入0.3 mmol/L
的1 Mo和2 000 Mo培养基中,4-10突变体的叶片花青素含量显著高于Col-0(图3-B)。在加入0.3 mmol/L ![]() 的1 Mo条件下,Col-0和4-10幼苗的花青素相对含量分别为(100.00±10.06)%和(450.74±40.01)%。此外,在加入0.3 mmol/L NH4+的2 000 Mo条件下,Col-0和4-10的花青素相对含量分别为(98.00±12.16)%和(301.28±32.11)%(图3-B)。
的1 Mo条件下,Col-0和4-10幼苗的花青素相对含量分别为(100.00±10.06)%和(450.74±40.01)%。此外,在加入0.3 mmol/L NH4+的2 000 Mo条件下,Col-0和4-10的花青素相对含量分别为(98.00±12.16)%和(301.28±32.11)%(图3-B)。
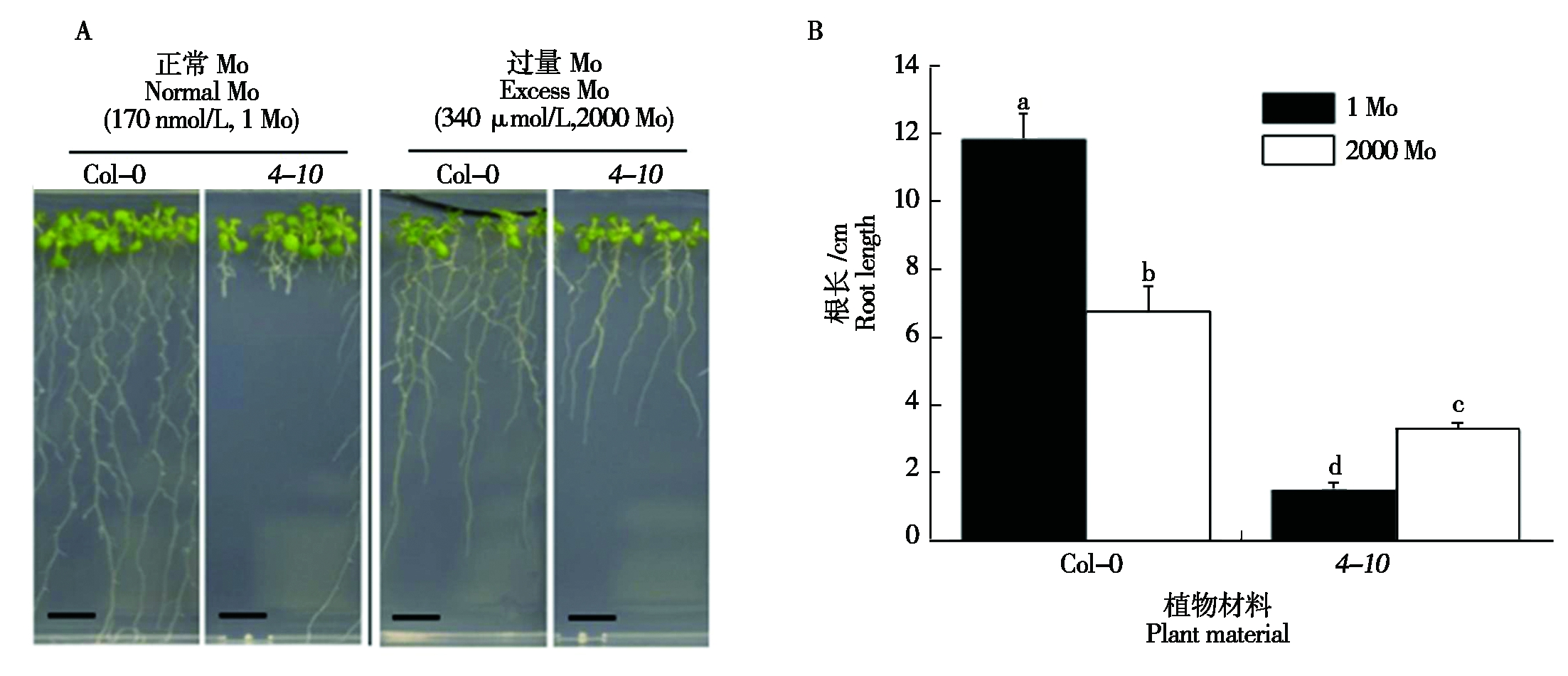
A.在不同Mo条件下生长的Col-0、4-10植株;B. Col-0和4-10植株的根长。不同字母表示基于Tukey测试的0.05水平上的显著差异。图3,5同。
A. Col-0,4-10 seedlings grown in different Mo conditions;B. Root length of Col-0 and 4-10 seedlings. Different letters represent significant differences at the 0.05 level based on Tukey′s test.The same as Fig.3,5.
图1 拟南芥4-10突变体在响应Mo条件下的表型
Fig.1 Phenotype of Arabidopsis 4-10 mutant in response to Mo conditions
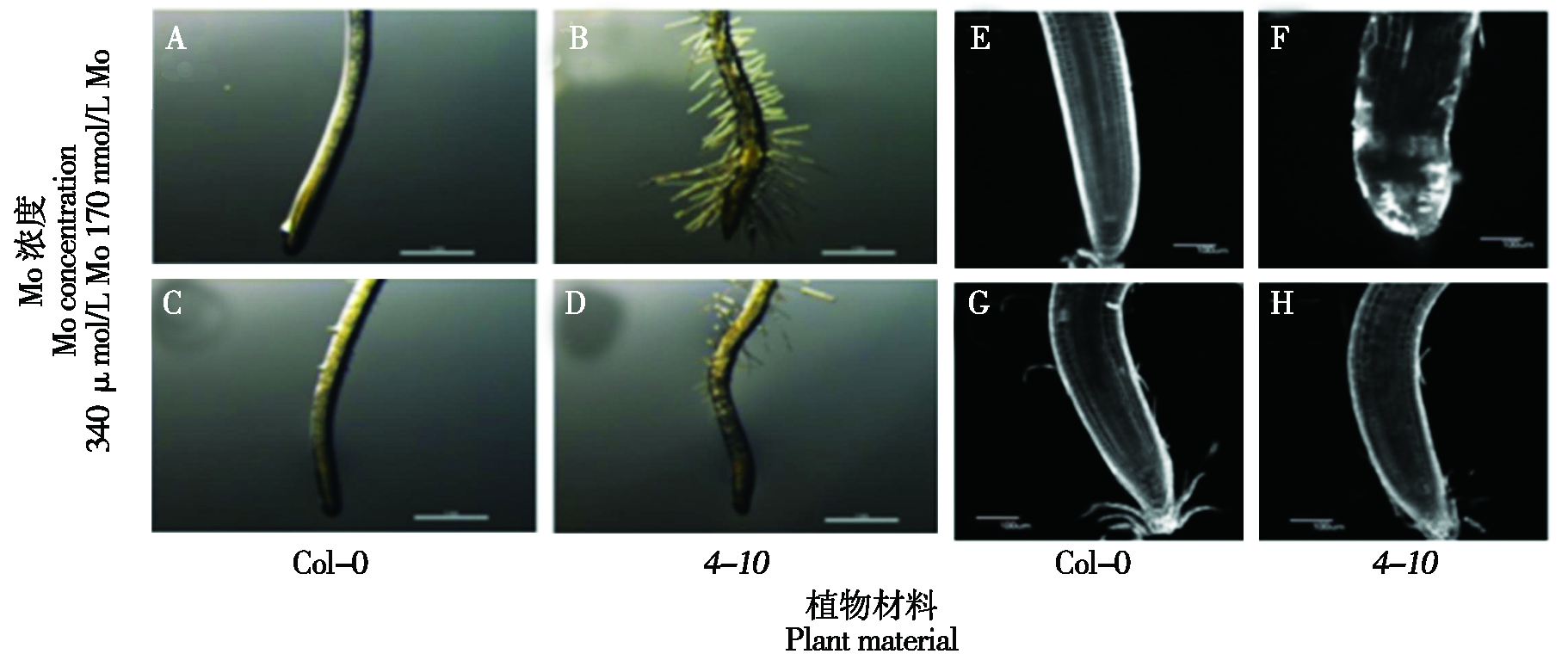
A~D. 过量Mo对Col-0和4-10植株初生根形态的影响;E~H. 过量Mo条件下Col-0和4-10根尖形态。
A-D.Effects of excess Mo on primary root morphology of Col-0 and 4-10 plants;E-H.Effects of excess Mo on root tips of Col-0 and 4-10 seedlings.
图2 过量Mo条件下拟南芥4-10 突变体的根表型
Fig.2 Root phenotype of Arabidopsis 4-10 mutant under excess Mo conditions
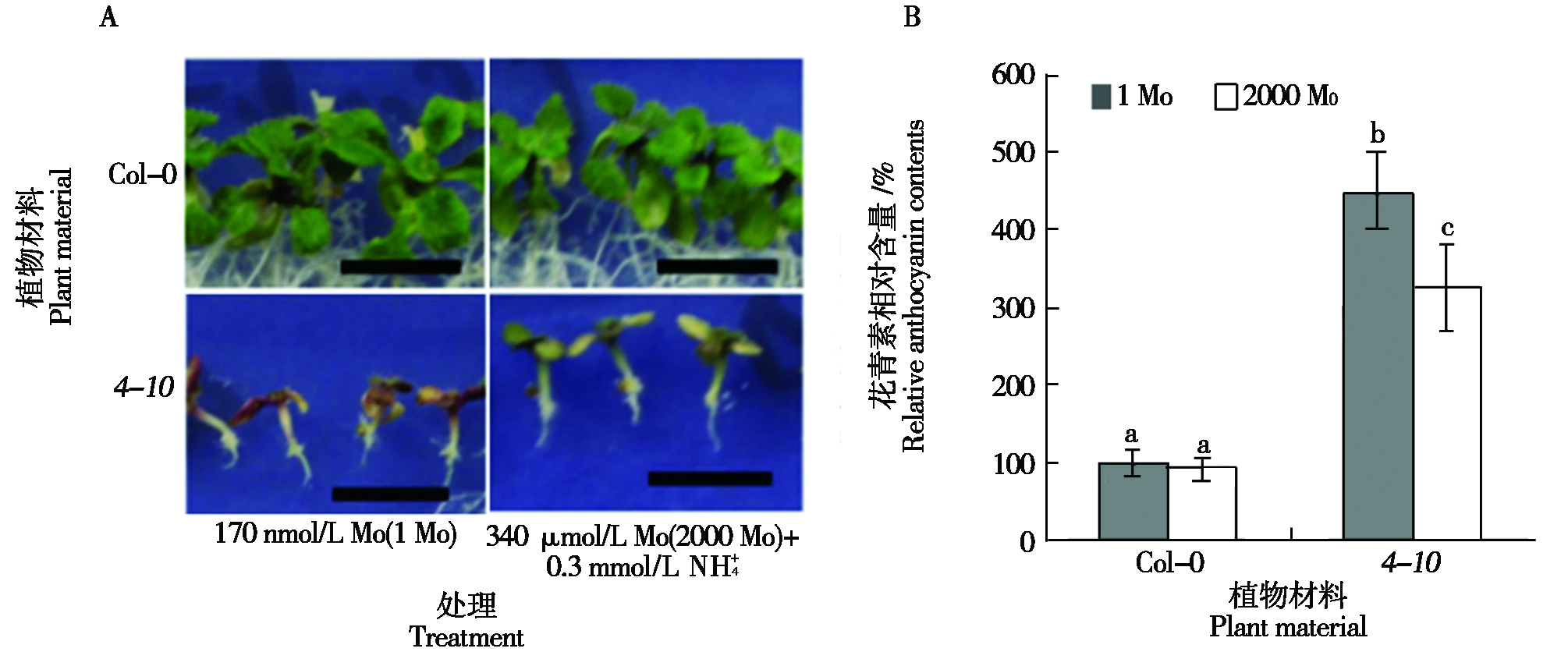
A. Col-0和4-10植株在![]() 条件下表型;B. Col-0和4-10植株在
条件下表型;B. Col-0和4-10植株在![]() 条件下花青素相对含量。
条件下花青素相对含量。
A. Col-0 and 4-10 seedlings grown under ![]() conditions;B. Relative anthocyanin contents of Col-0 and 4-10 plants grown under
conditions;B. Relative anthocyanin contents of Col-0 and 4-10 plants grown under ![]() conditions.
conditions.
图3 拟南芥4-10突变体对![]() 敏感
敏感
Fig.3 Arabidopsis 4-10 mutant was sensitive to NH4+
将具有Col-0背景的4-10突变体与野生型植株Ler杂交,进行初步和精细定位。在加入![]() 的1 Mo条件下,野生型(Ler)植株和4-10杂交的后代F2群体中突变体表型(红色叶)与野生型表型(绿色叶)的分离比符合1∶3(389∶1 161)的遗传规律,表明4-10的突变体表型(红色叶)是单基因隐性遗传。利用F2中具有突变表型单株,使用dCAPs和SSLP标记F23N20和F23N20(34)(图4-A)将候选基因定位到1号染色体一个23 kb区域(26.809~26.832 Mb)。TAIR9中有11个基因(图4-B)在此区域中有注释,结合4-10突变体重测序结果,鉴定出3个SNP作为候选突变位点,其中2个SNP突变导致At1g71080和At1g71090中氨基酸变化,另一个突变导致At1g71100处的氨基酸由R变为终止密码子(图4-B)。At1g71100编码核糖-5-磷酸异构酶(RPI)[18],其突变体rsw10的表型为根毛细胞膨胀,纤维素水平降低,非纤维素多糖中一些单糖水平发生改变[15]。为了证明RPI是4-10突变的目标基因,本研究利用AtRPI基因纯合突变植株(rsw10-1,CS16363)进行了等位性检测(图4-C)。在加入
的1 Mo条件下,野生型(Ler)植株和4-10杂交的后代F2群体中突变体表型(红色叶)与野生型表型(绿色叶)的分离比符合1∶3(389∶1 161)的遗传规律,表明4-10的突变体表型(红色叶)是单基因隐性遗传。利用F2中具有突变表型单株,使用dCAPs和SSLP标记F23N20和F23N20(34)(图4-A)将候选基因定位到1号染色体一个23 kb区域(26.809~26.832 Mb)。TAIR9中有11个基因(图4-B)在此区域中有注释,结合4-10突变体重测序结果,鉴定出3个SNP作为候选突变位点,其中2个SNP突变导致At1g71080和At1g71090中氨基酸变化,另一个突变导致At1g71100处的氨基酸由R变为终止密码子(图4-B)。At1g71100编码核糖-5-磷酸异构酶(RPI)[18],其突变体rsw10的表型为根毛细胞膨胀,纤维素水平降低,非纤维素多糖中一些单糖水平发生改变[15]。为了证明RPI是4-10突变的目标基因,本研究利用AtRPI基因纯合突变植株(rsw10-1,CS16363)进行了等位性检测(图4-C)。在加入![]() 的1 Mo条件下,rsw10-1、4-10与rsw10-1杂交的F1植株均表现出与4-10相似的突变表型(图4-D),并且与rsw10-1一样,外源5 mmol/L尿苷处理能够将4-10的根长完全恢复至野生型表型(图4-E)。结果证明,RPI导致了4-10的突变表型。
的1 Mo条件下,rsw10-1、4-10与rsw10-1杂交的F1植株均表现出与4-10相似的突变表型(图4-D),并且与rsw10-1一样,外源5 mmol/L尿苷处理能够将4-10的根长完全恢复至野生型表型(图4-E)。结果证明,RPI导致了4-10的突变表型。
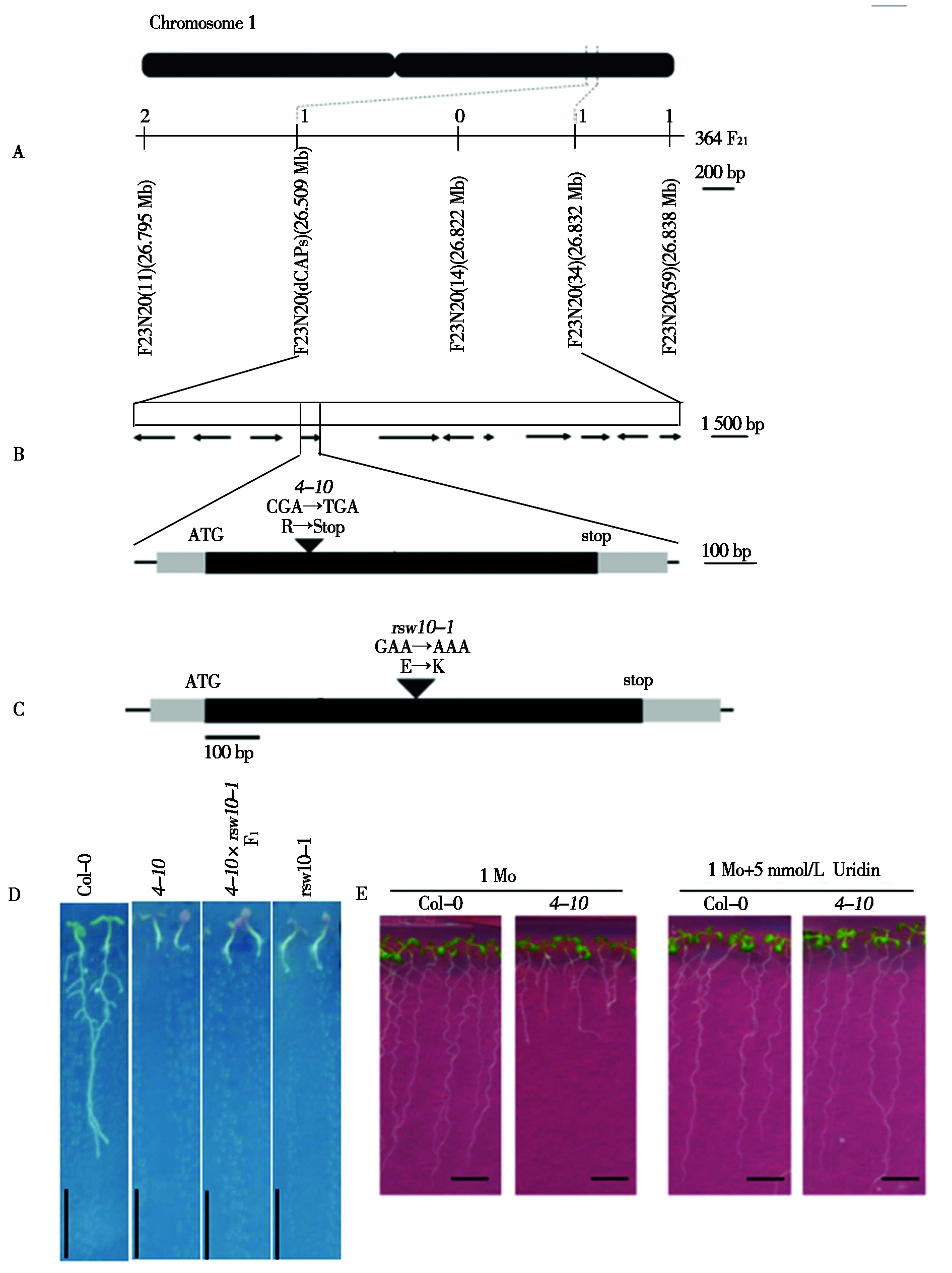
A.4-10突变体候选基因精细定位;B.4-10突变体的测序区域;C.RPI中的点突变位置的示意图;![]() 对植株生长的影响;E. 尿苷对植物生长的影响。
对植株生长的影响;E. 尿苷对植物生长的影响。
A.Fine mapping of candidate genes of 4-10 mutant;B.Sequenced region of the 4-10 mutant;C.Schematic diagram of point mutation position in RPI;D.Effect of ![]() on plant growth;E.Effect of uridine on plant growth.
on plant growth;E.Effect of uridine on plant growth.
图4 RPI是导致突变体4-10对Mo和NH4+敏感的基因
Fig.4 RPI is the causal gene of Mo and NH4+ sensitive mutant,4-10
植物具有感知内部和外部Mo状态的能力,然后通过基因表达的改变来适应Mo条件的变化。为了确定4-10突变体的Mo敏感性是否发生了变化,测定了在1 Mo和2 000 Mo条件下4-10植株细胞中的Mo含量。结果表明,在1 Mo和2 000 Mo条件下,4-10突变体根中Mo含量显著低于Col-0(图5A);在1 Mo条件下,4-10和Col-0植株根系Mo含量(以干质量计)分别为(2.8±0.31)mg/kg和(4.2±0.28)mg/kg(图5);在2 000 Mo条件下,4-10和Col-0的根Mo含量分别为(1 000±112.92)mg/kg和(1 600±110.93)mg/kg(图5)。在1 Mo条件下,Col-0和4-10突变体植株的地上部位中Mo含量没有显著差异(图5-A),在2 000 Mo条件下,4-10突变体地上部Mo含量显著高于Col-0(图5-B)。根中Mo含量的改变表明,RPI的突变参与了Mo的稳态途径而不是感应/信号转导。为了证实这种假设,应该通过测定Mo稳态中涉及的几个基因(如MOT1、MOT2等)的mRNA水平来对4-10突变体植株进一步分析。
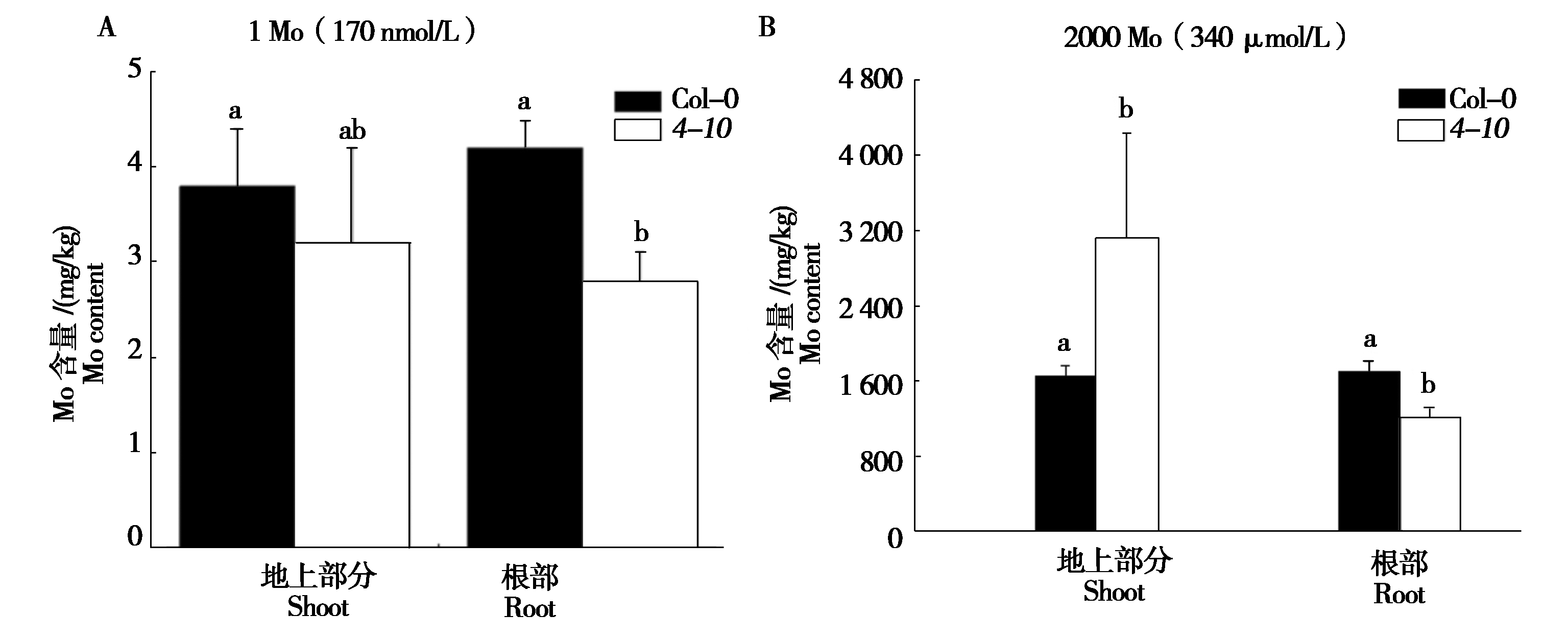
图5 4-10突变体植株根系Mo浓度低于Col-0
Fig.5 Seedlings of 4-10 mutant had a lower root Mo concentration than that of Col-0
前期已有报道,RPI参与多种生物途径。本研究结果表明,RPI的突变可以响应过量的Mo和![]() 此外,过量的Mo可以恢复具有RPI点突变的4-10根突变表型。在拟南芥中,有3个RPI(At1g71100、At2g01290和At3g04790)[19-21]。At1g71100位于细胞质溶液中,在子叶、下胚轴、根、叶、莲座叶、花、幼苗、花序和角果等各组织中表达[19]。Howles等[19]的结果表明,尿苷可以恢复rsw10-1的突变表型,并且通过尿苷的恢复是rsw10的特异性效果。当用外源尿苷处理4-10突变体幼苗时,它的根长也可以完全恢复,这表明嘧啶从头合成可能是产生4-10植株根表型变化的主要途径[19]。由于4-10的根伸长和叶片颜色明显发生改变,而突变表型可以通过过量的Mo和施加
此外,过量的Mo可以恢复具有RPI点突变的4-10根突变表型。在拟南芥中,有3个RPI(At1g71100、At2g01290和At3g04790)[19-21]。At1g71100位于细胞质溶液中,在子叶、下胚轴、根、叶、莲座叶、花、幼苗、花序和角果等各组织中表达[19]。Howles等[19]的结果表明,尿苷可以恢复rsw10-1的突变表型,并且通过尿苷的恢复是rsw10的特异性效果。当用外源尿苷处理4-10突变体幼苗时,它的根长也可以完全恢复,这表明嘧啶从头合成可能是产生4-10植株根表型变化的主要途径[19]。由于4-10的根伸长和叶片颜色明显发生改变,而突变表型可以通过过量的Mo和施加![]() 恢复,所以集中研究在RPI突变情况下和从头合成途径中如何能响应Mo和
恢复,所以集中研究在RPI突变情况下和从头合成途径中如何能响应Mo和![]() 由于Mo在高等植物中已被确定为硝酸还原酶的重要组分[3],在NH4+条件下4-10的突变表型也可能源于Mo的功能,于是笔者更加关注Mo与从头合成途径(De novo synthesis)之间的关系。在本研究中的证据表明,过量的Mo通过补救合成途径(Salvage pathway)促进了从头合成途径。首先,4-10突变体不仅根伸长,而且根的形态可以通过过量的Mo来恢复;其次,4-10的突变表型也通过尿苷完全恢复;第三,在1 Mo和2000 Mo条件下,4-10植株的Mo浓度都低于Col-0。总之,根据本研究的结果和假设,结合之前已知的研究提出了假说,对4-10突变体植株根长发育进行了解释。在从头合成途径中,Ru5p通过RPI转化为R5P,然后转化为5-磷酸核糖-α-焦磷酸(PRPP)、OMP、UMP,从而进入核苷酸生物合成途径[18-19]。据推测,4-10根细胞的生长表现为突变表型,因为嘧啶从头生物合成过程需求量很高,但由于正常Mo条件下的RPI突变而导致产生有限的R5P。然而,在过量的Mo条件下,过量的Mo可能通过平衡核苷转运蛋白(ENT)的作用将更多的尿苷转运到4-10突变体幼苗的细胞中来促进补救合成途径,尿苷可以被磷酸化成UMP,因此,更多的UMP进入4-10突变体幼苗的核苷酸生物合成途径,4-10的突变体表型在过量的Mo条件下得到恢复。然而,为了进一步证明这一假设仍然需要一些其他数据,例如,在1 Mo和2000 Mo条件下,应在4-10和Col-0植株中测量UMP、UDP和UTP的浓度等。
由于Mo在高等植物中已被确定为硝酸还原酶的重要组分[3],在NH4+条件下4-10的突变表型也可能源于Mo的功能,于是笔者更加关注Mo与从头合成途径(De novo synthesis)之间的关系。在本研究中的证据表明,过量的Mo通过补救合成途径(Salvage pathway)促进了从头合成途径。首先,4-10突变体不仅根伸长,而且根的形态可以通过过量的Mo来恢复;其次,4-10的突变表型也通过尿苷完全恢复;第三,在1 Mo和2000 Mo条件下,4-10植株的Mo浓度都低于Col-0。总之,根据本研究的结果和假设,结合之前已知的研究提出了假说,对4-10突变体植株根长发育进行了解释。在从头合成途径中,Ru5p通过RPI转化为R5P,然后转化为5-磷酸核糖-α-焦磷酸(PRPP)、OMP、UMP,从而进入核苷酸生物合成途径[18-19]。据推测,4-10根细胞的生长表现为突变表型,因为嘧啶从头生物合成过程需求量很高,但由于正常Mo条件下的RPI突变而导致产生有限的R5P。然而,在过量的Mo条件下,过量的Mo可能通过平衡核苷转运蛋白(ENT)的作用将更多的尿苷转运到4-10突变体幼苗的细胞中来促进补救合成途径,尿苷可以被磷酸化成UMP,因此,更多的UMP进入4-10突变体幼苗的核苷酸生物合成途径,4-10的突变体表型在过量的Mo条件下得到恢复。然而,为了进一步证明这一假设仍然需要一些其他数据,例如,在1 Mo和2000 Mo条件下,应在4-10和Col-0植株中测量UMP、UDP和UTP的浓度等。
尿苷和过量Mo在根长中的活性以及尿苷和过量Mo促进4-10植株的根伸长的结果,使提出伸长生长中的RPI(或从头合成途径)信号是否可以由Mo体内平衡或Mo感应/信号转导的问题。根据本研究获得的数据,具有RPI突变的4-10植株降低了根中内源Mo的水平,这可能被植物Mo传感系统所感知。为保持Mo的稳态,Mo转运蛋白基因等一些相关基因也可能受到4-10突变体植株中RPI突变的调控。更重要的是,RPI的mRNA表达量也可能受到Mo和![]() 的调节。在获得上述新的数据之前,现在很难做出合理的假设来解释这个结果。但是,这揭示了RPI和Mo平衡之间可能存在一个不确定的机制。
的调节。在获得上述新的数据之前,现在很难做出合理的假设来解释这个结果。但是,这揭示了RPI和Mo平衡之间可能存在一个不确定的机制。
参考文献:
[1] Kovács B,Puskás-Preszner A,Huzsvai L,et al. Effect of molybdenum treatment on molybdenum concentration and nitrate reduction in maize seedlings[J]. Plant Physiology and Biochemistry,2015,96(6):38-44.
[2] Elrys A S,Abdo A E,Desoky E M. Potato tubers contamination with nitrate under the influence of nitrogen fertilizers and spray with molybdenum and salicylic acid[J]. Environmental Science and Pollution Research International,2018,25(7):7076-7089.
[3] 秦世玉,孙学成,胡承孝,等. 钼肥对甘蓝型油菜薹期碳氮代谢的影响[J]. 华北农学报,2016,31(4):227-232.
[4] Tejada-Jiménez M,Chamizo-Ampudia A,Galván A,et al. Molybdenum metabolism in plants[J]. Metallomics :Integrated Biometal Science,2013,5(9):1191-1203.
[5] Duan G,Hakoyama T,Kamiya T,et al. LjMOT1,a high-affinity molybdate transporter from Lotus japonicus,is essential for molybdate uptake,but not for the delivery to nodules[J]. The Plant Journal,2017,90(6):1108-1119.
[6] Kaiser B N,Gridley K L,Ngaire Brady J,et al. The role of molybdenum in agricultural plant production[J]. Annals of Botany,2005,96(5):745-754.
[7] Kumchai J,Huang J Z,Lee C Y,et al. Proline partially overcomes excess molybdenum toxicity in cabbage seedlings grown in vitro[J]. Genetics and Molecular Research,2013,12(4):5589-5601.
[8] Marelja Z,Leimkuhler S,Missirlis F. Iron sulfur and molybdenum cofactor enzymes regulate the drosophila life cycle by controlling cell metabolism[J]. Frontiers in Physiology,2018,9:50.
[9] Kaufholdt D,Baillie C K,Meinen R A,et al. The Molybdenum cofactor biosynthesis network:in vivo Protein-protein interactions of an actin associated Multi-protein complex[J]. Frontiers in Plant Science,2017,8:1946.
[10] Mendel R R. The molybdenum cofactor[J]. Journal of Biological Chemistry,2013,288(19):13165-13172.
[11] 秦世玉,孙学成,胡承孝,等. 硫硒钨对钼酸盐吸收及钼酸盐转运子的影响[J]. 华北农学报,2015,30(5):232-238.
[12] Tejada-Jiménez M,Gil-Díez P,León-Mediavilla J,et al. Medicago truncatula Molybdate Transporter type 1(MtMOT1.3)is a plasma membrane molybdenum transporter required for nitrogenase activity in root nodules under molybdenum deficiency[J]. New Phytologist,2017,216(4):1223-1235.
[13] Tomatsu H,Takano J,Takahashi H,et al. An Arabidopsis thaliana high-affinity molybdate transporter required for efficient uptake of molybdate from soil[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(47):18807-18812.
[14] Gasber A,Klaumann S,Trentmann O,et al. Identification of an Arabidopsis solute carrier critical for intracellular transport and inter-organ allocation of molybdate[J]. Plant Biology,2011,13(5):710-718.
[15] Tejada-Jimenez M,Galvan A,Fernandez E. Algae and humans share a molybdate transporter[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(16):6420-6425.
[16] Wu T,Kamiya T,Yumoto H,et al. An Arabidopsis thaliana copper-sensitive mutant suggests a role of phytosulfokine in ethylene production[J]. Journal of Experimental Botany,2015,66(13):3657-3667.
[17] Neff M M,Chory J. Genetic interactions between phytochromeA,phytochrome B,and cryptochrome 1 during Arabidopsis development[J]. Plant Physiology,1998,118(1):27-35.
[18] Buchanan B B,Gruissem W,Jones R L. Biochemistry and Molecular Biology of plants[C]. Rockville:American Society of Plant Physiologists,2000.
[19] Howles P A,Birch R J,Collings D A,et al. A mutation in an Arabidopsis ribose 5-phosphate isomerase reduces cellulose synthesis and is rescued by exogenous uridine[J]. Plant Journal,2006,48(4):606-618.
[20] Eicks M,Maurino V,Knappe S,et al. The plastidic pentose phosphate translocator represents a Link between the cytosolic and the plastidic pentose phosphate pathways in plants[J]. Plant Physiology,2002,128(2):512-522.
[21] Kruger N J,Von Schaewen A. The oxidative pentose phosphate pathway:structure and organisation[J]. Current Opinion in Plant Biology,2003,6(3):236-246.
Abstract:In order to understand the molecular functions of molybdenum(Mo),a total of 26 000 seeds of Arabidopsis mutant mutagenized with ethylmethylsulfone(EMS)with alterations at normal Mo condition were identified and investigated. A mutant named 4-10,which was sensitive to normal Mo,was isolated. The root elongation of the 4-10 mutant was restored under the normal 170 nmol/L Mo condition and supply of 340 μmol/L Mo partially rescued root elongation. Under the 170 nmol/L Mo condition,the root length of 4-10 and Col-0 seedlings was(1.56±0.13)cm and (11.89±0.71)cm,respectively,while under 340 μmol/L Mo conditions,the root length of 4-10 and Col-0 was(3.3±0.17)cm and (6.8±0.73)cm. In addition,the abnormal root morphology of 4-10 could also be recovered by 340 μmol/L Mo treatment. Mo concentration measurement results showed that the root Mo concentration of 4-10 mutant was significantly lower than that of wild type. Besides the sensitivity to normal Mo,the leaf color of 4-10 mutant was also sensitive to ![]() Moreover,the leaves of 4-10 mutant had a higher anthocyanin contents than that of Col-0. To identify the causal gene of 4-10 mutant,the mutation was mapped to chromosome 1(between 26.809 and 26.832 Mb)using map-based cloning. Genome re-sequencing data showed that one mutation resulted in an amino acid substitution in At1g71100,encoded a ribose 5-phosphate isomerase(RPI),which revealed that RPI might be the causal gene of 4-10 mutant. To show that RPI is the causal gene of 4-10,a mutant line(rsw10-1)homozygous for a point mutation in the AtRPI gene was examined. rsw10-1 and F1 plants from crosses between 4-10 and rsw10-1 displayed similar phenotype to 4-10 under
Moreover,the leaves of 4-10 mutant had a higher anthocyanin contents than that of Col-0. To identify the causal gene of 4-10 mutant,the mutation was mapped to chromosome 1(between 26.809 and 26.832 Mb)using map-based cloning. Genome re-sequencing data showed that one mutation resulted in an amino acid substitution in At1g71100,encoded a ribose 5-phosphate isomerase(RPI),which revealed that RPI might be the causal gene of 4-10 mutant. To show that RPI is the causal gene of 4-10,a mutant line(rsw10-1)homozygous for a point mutation in the AtRPI gene was examined. rsw10-1 and F1 plants from crosses between 4-10 and rsw10-1 displayed similar phenotype to 4-10 under ![]() condition,establishing that the mutation in the RPI gene was responsible for the phenotype. We noticed through phenotypic analysis that the root elongation of the mutant was not only recovered by addition of excess Mo but also by uridine. The results obtained indicated that excess Mo promote salvage pathway through the action of uridine transport.
condition,establishing that the mutation in the RPI gene was responsible for the phenotype. We noticed through phenotypic analysis that the root elongation of the mutant was not only recovered by addition of excess Mo but also by uridine. The results obtained indicated that excess Mo promote salvage pathway through the action of uridine transport.
Key ![]() Arabidopsis;Mapping;Molybdenum;Salvage pathway
Arabidopsis;Mapping;Molybdenum;Salvage pathway
中图分类号:S335;Q78
文献标识码:A
文章编号:1000-7091(2018)03-0024-07
doi:10.7668/hbnxb.2018.03.005
收稿日期:2018-01-21
基金项目:国家自然科学基金项目(31701934);农业部东北地区园艺作物生物学与种质创制重点实验室开放课题基金项目(neauhc201601)