转录因子作为基因表达的调控者,在植物的适应机制中扮演非常重要的角色。植物通过转录因子与靶基因启动子中的顺式元件特异结合,从而激活或抑制基因的表达,参与代谢过程或启动防卫反应。WRKY是植物中最大的转录因子家族之一,参与植物多种生命活动过程,包括萌发、生长发育、衰老、生物或非生物胁迫反应等。其名称源于序列中包含一段由约60个氨基酸残基组成的高度保守的 WRKY结构域,这段区域包括 N 端的WRKYGQK 序列和C端的锌指结构,能够与靶基因启动子区域中的 W 盒 TTGACC/T核苷酸序列特异性结合,进而调控下游目标基因的表达[1-2]。根据 WRKY 保守域的数量和锌指结构的类型,WRKY 蛋白可分为 3 种类型,其中,Ⅰ型蛋白包含 2 个 WRKYGQK 序列和C2H2锌指结构;Ⅱ型蛋白包含 1 个 WRKYGQK和 C2H2型锌指结构,依据其结构特征可进一步分为 5 个亚组(Ⅱa、Ⅱb、Ⅱc、Ⅱd和Ⅱe);Ⅲ型蛋白含有一个 WRKY 保守域,其锌指结构为C2HC[1-2]。
WRKY 蛋白在植物的多种生理过程中发挥重要调控作用,包括高等植物的生长发育、各种胁迫反应和代谢等过程。而且,这些调控作用往往与水杨酸(SA)、茉莉酸(JA)和脱落酸(ABA)等激素介导的信号途径相互联系在一起。研究表明,在不同的生物学功能中,WRKY蛋白起激活子或抑制子的作用[3-5]。除了调控植物抗病反应外,许多WRKY基因的表达受干旱、高温、冷害及高盐等逆境因子诱导表达。因此,普遍认为,WRKY 转录因子参与植物非生物胁迫应答过程,并在逆境信号转导通路中扮演正/负调控因子的关键角色[5-8]。例如,拟南芥AaWRKY39在SA和JA介导的热胁迫响应中发挥正调控作用,而拟南芥AtWRKY25和AtWRKY33参与植株对高温和盐胁迫的耐性[9-11]。研究发现,过表达水稻OsWRKY45基因提高了植株的抗病能力及耐盐抗旱能力[12]。过表达大豆GmWRKY13、GmWRKY21和GmWRKY54增强植物对多种非生物逆境胁迫的耐受性[13]。
对模式植物耐受胁迫机理的研究,揭示了WRKY转录因子在应答过程中的中心调控作用。作为重要的粮食作物,小麦WRKY转录因子调控非生物胁迫的机理研究却相对滞后。主要原因是小麦的基因组庞大而复杂,全基因组测序还没有完成,而且转基因技术体系效率相对较低。尽管如此,小麦WRKY基因克隆及功能研究也取得了一定进展。在拟南芥中过表达小麦TaWRKY51,可以增加拟南芥对ABA、干旱和盐胁迫处理的敏感性,推测TaWRKY51可能在植物响应非生物胁迫信号传导过程中起负调控作用[14]。另一个小麦TaWRKY35基因过表达植株的耐盐性显著提高[15]。Wu等[16]报道,有2个小麦WRKY基因(TaWRKY19a 和TaWRKY71)的表达受热胁迫诱导。将小麦TaWRKY10在烟草中异源表达能够提高植株对多种非生物胁迫的耐性[17]。
WRKY 转录因子是一类庞大的家族,并且功能多样,调控机理复杂。迄今为止,小麦WRKY基因与抗逆关系的研究报道还较少。因此,需要从小麦中克隆更多的WRKY基因并阐明其作用机制。
本研究从小麦中克隆一个TaWRKY71a基因,并对其进行了生物信息学和表达分析,以期为小麦抗逆生理机制的阐明及遗传改良提供依据。
1 材料和方法
1.1 试验材料及处理
供试材料为普通小麦品种扬麦158(Triticum aestivum L. cv. Yangmai 158),由天津农学院天津-布里斯托环境变化对农作物影响研究中心保存。小麦种植及处理方式参照文献[18]的方法。材料用液氮迅速冷冻后保存于-80 ℃冰箱,备用。
1.2 试验方法
1.2.1 总RNA的提取及cDNA的合成 植物总RNA采用TIANGEN公司试剂盒提取,按照Invitrogen公司提供的反转录试剂盒进行cDNA第1链的合成,并于-20 ℃保存备用。
1.2.2 TaWRKY71a基因的克隆 以WRKY保守结构域为基础,到http://www.ncbi.nlm.nih.gov/Blast/网站上对小麦EST库进行BlastN查询,将搜索到的一些高度相似且重叠的ESTs进行序列拼接,组合成序列较长的复合EST,再以此为查询序列重复进行BlastN搜索、聚类、拼接直至无法进行,以达到最有效延伸。利用ORF finder 工具(http://www.ncbi.nlm.nih.gov/gorf)查找该序列的开放阅读框,设计克隆引物F1/R1(表1)并进行PCR扩增。PCR反应体系参照文献[19]。扩增条件为:98 ℃预变性30 s;98 ℃变性10 s,60 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖电泳分离后,回收纯化,与克隆载体pGEM-T连接,转化到感受态细胞DH5α中,挑选经PCR鉴定正确的阳性克隆送北京博迈德生物公司进行测序。
1.2.3 TaWRKY71a基因编码的氨基酸序列分析 利用NCBI的CDD工具对蛋白质的保守结构域进行预测[20];利用ProtParam对蛋白质的理化性质进行分析[21];利用SOPMA对蛋白质二级结构进行预测[22];利用CELLO对蛋白质进行亚细胞定位预测[23];利用DNAMAN软件对蛋白质序列进行比对;利用MEGA 6.0软件构建进化树。核定位信号(NLS)预测利用NLS Mapper (http://nls-mapper.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi)进行[24]。其他相关在线工具和软件的网址参照文献[19]。
1.2.4 TaWRKY71a基因的表达分析 目标基因及小麦Actin基因引物序列见表1。以1.2.1获得的cDNA为模板,以小麦Actin基因为内参进行实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)分析。根据北京康为世纪公司荧光定量PCR试剂盒说明书进行操作。反应体系包括:2×UltraSYBR混合液10 μL,上下游引物各0.4 μL,cDNA 2 μL,加水补足20 μL。扩增反应在ABI 7500 Fast qRT-PCR仪上进行,扩增条件为:95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。
1.3 数据处理
采用2-ΔΔCt法计算相对表达量,以相同的试验方法进行3次生物学重复,用Excel软件对数据进行方差分析。
表1 用于基因克隆及表达分析的引物
Tab.1 Primers for gene cloning and expression analysis
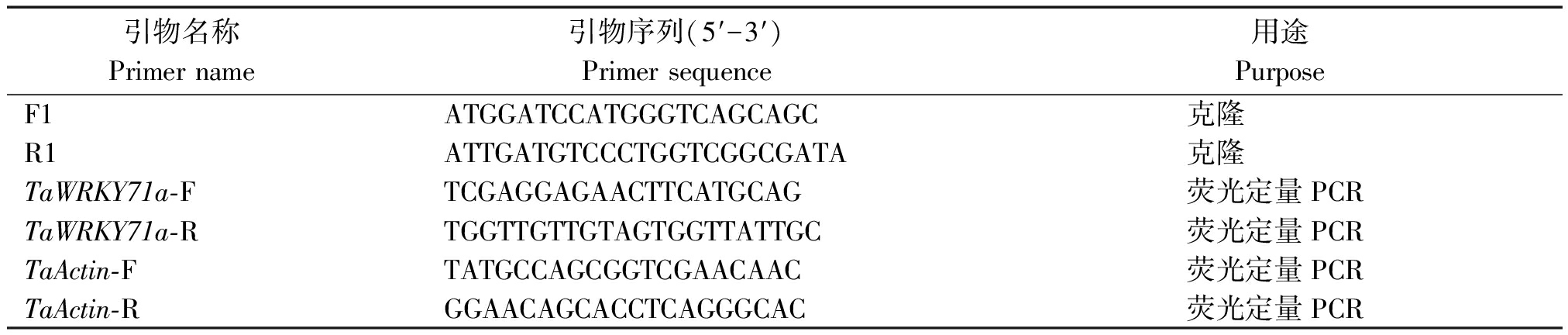
引物名称Primer name引物序列(5′-3′)Primer sequence 用途PurposeF1ATGGATCCATGGGTCAGCAGC克隆R1ATTGATGTCCCTGGTCGGCGATA克隆TaWRKY71a-FTCGAGGAGAACTTCATGCAG荧光定量PCRTaWRKY71a-RTGGTTGTTGTAGTGGTTATTGC荧光定量PCRTaActin-FTATGCCAGCGGTCGAACAAC荧光定量PCRTaActin-RGGAACAGCACCTCAGGGCAC荧光定量PCR
2 结果与分析
2.1 目的基因克隆
利用引物F1/R1对两叶一心期扬麦158叶片总RNA反转录得到的cDNA进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测后,得到约1 100 bp的特异性条带(图1)。将目的条带经回收纯化、克隆和测序后,利用BioEdit软件进行序列比对和拼接。通过ORF finder软件分析表明,该序列含有一个长为1 068 bp的完整开放阅读框,编码355个氨基酸残基。序列中包含保守的WRKY结构域,该区域N端有一个典型的 WRKYGQK序列,C 端有一个 C2H2型锌指结构(图2)。经Blast搜索比对,该基因编码序列与GenBank数据库中小麦TaWRKY71 (GenBank:ABN43177.1)氨基酸序列的相似度为98.3%,说明它们可能是等位基因,因此命名为TaWRKY71a。
2.2 TaWRKY71a基因编码的氨基酸序列分析
2.2.1 TaWRKY71a蛋白理化性质分析 ProtParam分析可知,TaWRKY71a蛋白分子量为38.77 ku,分子式为C1671H2649N507O528S15,含有38个负电荷氨基酸残基,40个正电荷氨基酸残基,理论等电点为8.15;不稳定系数为60.22,属不稳定型蛋白。ProtScale分析可知,TaWRKY71a蛋白亲水性区域(分值为负)分值较高,而疏水性区域(分值为正)分值低(图3)。因此,该蛋白属于亲水性蛋白。
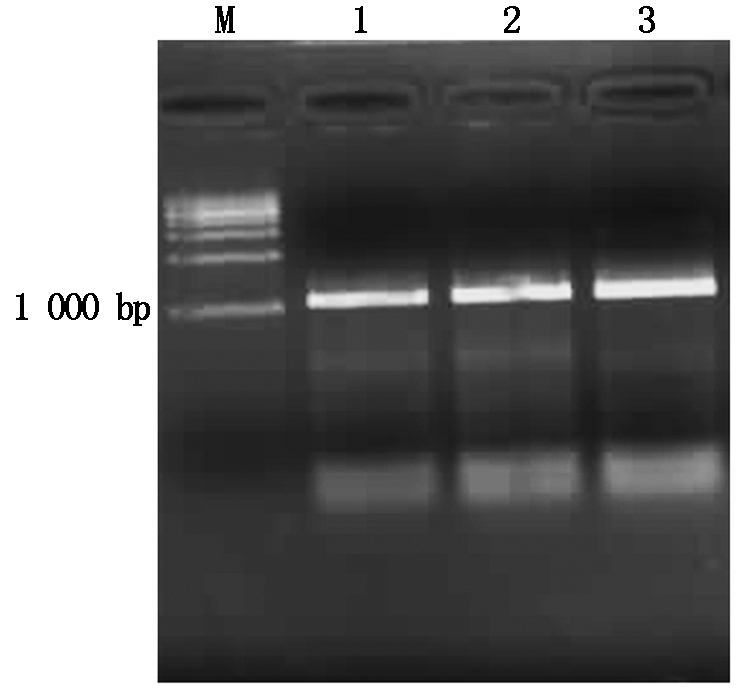
M.DNA 分子量标准;1~3.TaWRKY71a基因扩增产物。
M.DNA Marker;1-3.PCR product of TaWRKY71a.
图1 TaWRKY71a基因PCR扩增产物电泳
Fig.1 The electrophoresis detection of TaWRKY71a PCR product
2.2.2 TaWRKY71a蛋白亚细胞定位分析 序列分析表明,在氨基酸序列123-132位置含有核定位信号序列PSRKRKSEES,CELLO预测结果也表明,TaWRKY71a蛋白定位于细胞核(图4),这与其作为转录因子发挥作用是一致的。经分析,WRKY71a蛋白中没有发现信号肽,表明该蛋白不是分泌型蛋白。

横线部分为WRKY结构域;方框内部分为C2H2型锌指结构。
The sequence with underline means WRKY domain; The C2H2 zinc-finger structure are boxed.
图2 TaWRKY71a编码的氨基酸序列
Fig.2 Amino acid sequences of TaWRKY71a gene
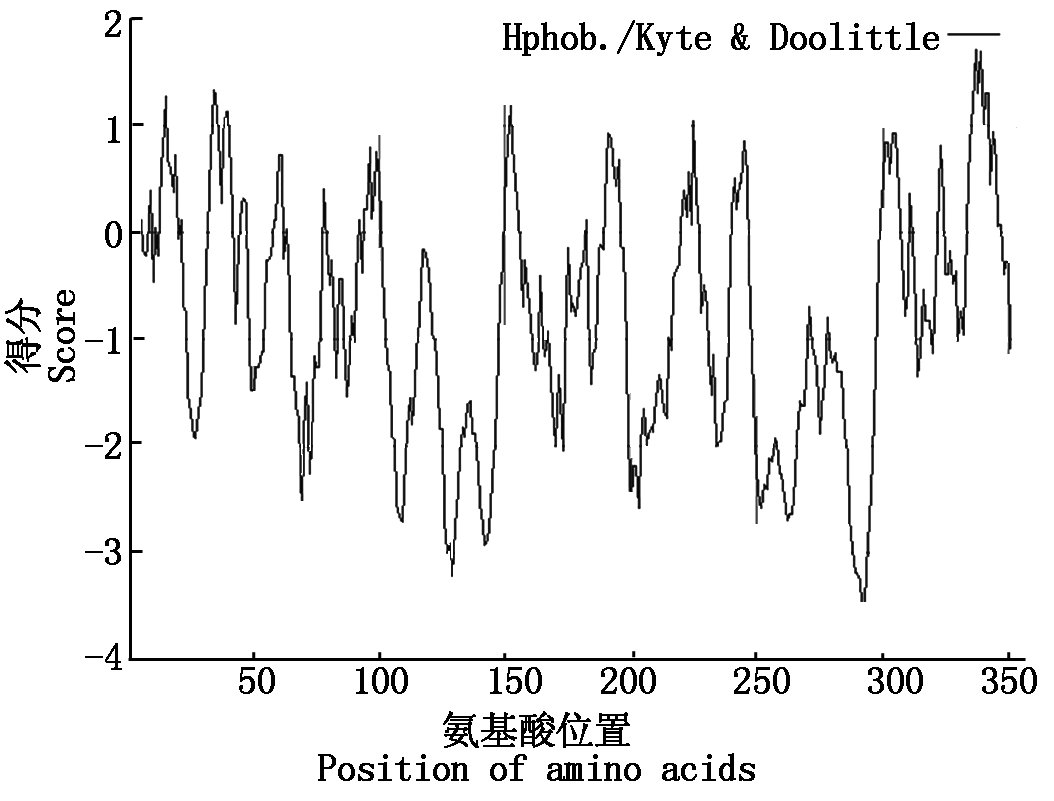
图3 TaWRKY71a蛋白的亲水性/疏水性分析
Fig.3 Hydrophilicity/hydrophobicity analysis of TaWRKY71a protein
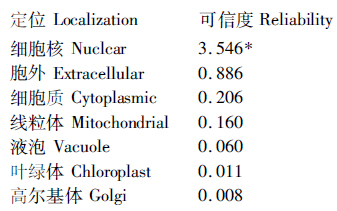
图4 TaWRKY71a蛋白的亚细胞定位分析
Fig.4 Subcellular localization analysis of TaWRKY71a protein
2.2.3 TaWRKY71a蛋白结构分析 CDD工具预测表明,TaWRKY71a蛋白的WRKYGQK序列位于开放阅读框的195-253区间,它是WRKY基因家族的保守结构域。另外还含有一个C2H2锌指结构,为Cx5Cx23HxH序列(图2、图5-A)。这样的结构特点说明TaWRKY71a属于WRKY基因家族第二亚族。
SOPMA预测表明,TaWRKY71a蛋白二级结构含有28.17%的α-螺旋,4.79%的β-转角,延伸链占16.34%,无规则卷曲所占比例达到了50.70%(图5-B)。
2.3 不同物种间TaWRKY71a蛋白的同源性比较
将TaWRKY71a蛋白与小麦和水稻WRKY71蛋白进行了多序列比对,结果显示,这3种WRKY蛋白同源性较高,尤其WRKY结构域氨基酸序列高度保守,都含有同样的WRKYGQK核心序列和C2H2型锌指结构(图6)。将小麦TaWRKY71a与一些禾本科植物及双子叶模式植物拟南芥的WRKY序列进行系统进化分析表明,TaWRKY71a与小麦WRKY33和WRKY71同源性最高,与其他禾本科植物的WRKY蛋白进化关系也较近。与拟南芥WRKY家族中的AtWRKY40蛋白同源性最高(图7)。
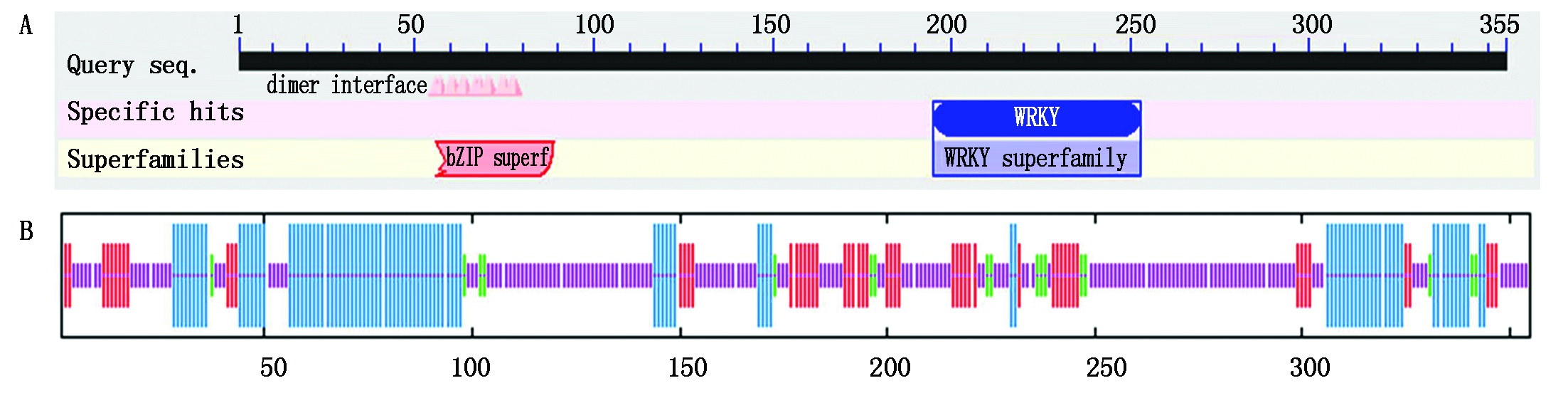
A.TaWRKY71a编码蛋白的保守结构域分析;B. SOPMA预测的TaWRKY71a蛋白二级结构。图中竖线按照由长到短递减依次表示α-螺旋、延伸链、β-转角和无规则卷曲。
A.Conserved domains analysis of TaWRKY71a protein;B. Predicted secondary structure of TaWRKY71a protein by SOPMA.The vertical lines in the graph according to descending order indicated alpha helix, extended strand, beta turn and random coil, respectively.
图5 TaWRKY71a蛋白结构分析
Fig.5 Structure analysis of TaWRKY71a protein

方框内部分为WRKYGQK核心序列和C2H2锌指结构。
The WRKYGQK core sequence and C2H2 zinc finger structure are boxed.
图6 TaWRKY71a与其他物种同源蛋白质的多序列比对
Fig.6 Multi-alignment of TaWRKY71a amino acid sequence with other WRKYs
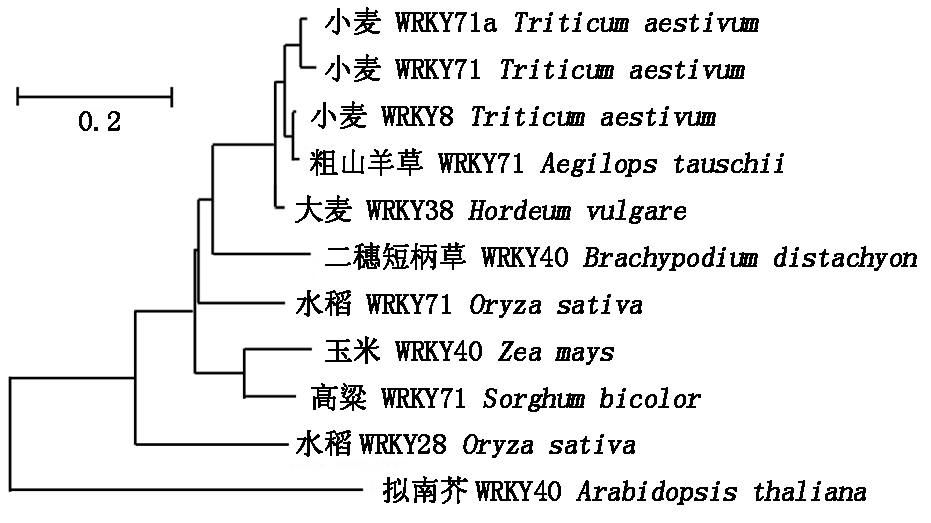
图7 小麦与其他物种WRKY蛋白的系统进化分析
Fig.7 Phylogenetic analysis of WRKY from wheat and other species
2.4 TaWRKY71a基因的表达分析
qRT-PCR分析结果表明(图8-A),在根、茎、叶、花和种子中均可检测到TaWRKY71a的表达,但表达程度不同。其中,在幼叶片中表达量最高,在幼根中的表达量较高,在茎中表达量最低。进一步研究了TaWRKY71a在不同胁迫因素刺激下表达模式,结果如图8-B-D,TaWRKY71a基因受ABA、NaCl和PEG胁迫的诱导;PEG处理0.5~1.0 h,TaWRKY71a基因表达明显增强,而后表达量基本恢复到对照水平;ABA和NaCl处理2~4 h,TaWRKY71a基因表达量达到最高,随后表达量降低。
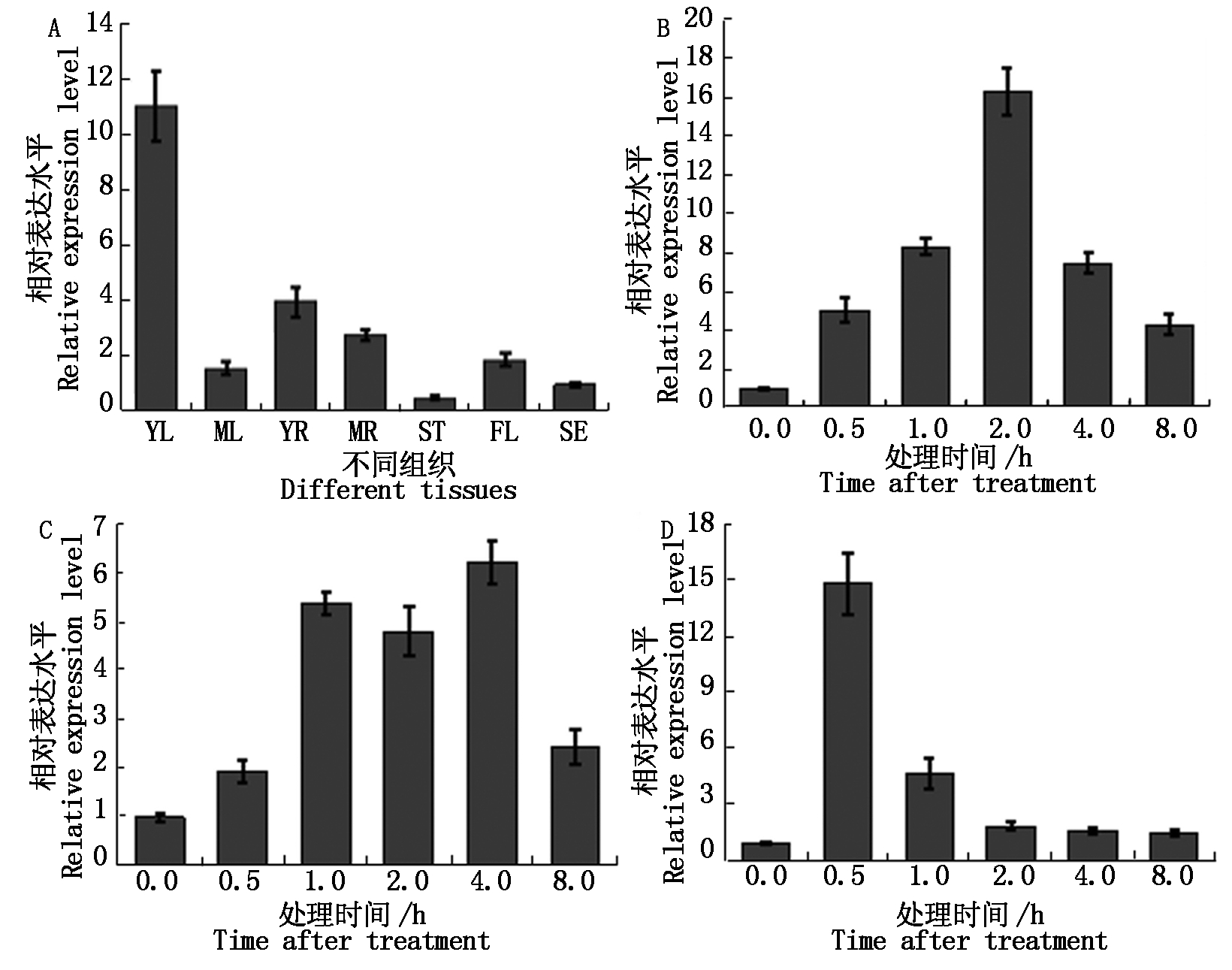
A.不同组织:YL.幼叶;ML.成熟叶;YR.幼根;MR.成熟根;ST.茎;FL.花;SE.种子;B.ABA处理;C.NaCl处理;D.PEG处理。
A.Different tissues:YL.Young leaves;ML.Mature leaves;YR.Young roots;MR.Mature roots;ST.Stems;FL.Flowers;SE.Seeds;B.ABA treatment;C.NaCl treatment;D.PEG treatment.
图8 TaWRKY71a基因的表达模式
Fig.8 Expression pattern of TaWRKY71a
3 讨论与结论
本研究对普通小麦扬麦158进行WRKY基因克隆,得到长为1 068 bp、编码355个氨基酸的基因序列,其与NCBI中已登录的小麦WRKY71基因的核苷酸及氨基酸序列相似性很高,因此,将该基因命名为TaWRKY71a。TaWRKY71a基因编码的氨基酸序列具有植物WRKY转录因子的典型保守结构域,包括一个WRKYGQK结构域和C2H2型锌指结构,这也说明所克隆的TaWRKY71a是植物WRKY基因家族中第二亚族的成员[1]。这段高度保守的WRKYGQK七肽序列(其有可能被修饰为WRKYGEK或WRKYGKK),以及其C端包含的锌指结构域是WRKY特异性与目标基因启动子中的W盒序列TTGACT/C结合必不可少的组件,WRKY结构域的突变往往会导致与DNA的结合活性减弱甚至消失[25]。
不同物种的WRKY基因都是多基因家族,而且保守性和同源性很高。系统进化分析表明,TaWRKY71a与小麦TaWRKY33、TaWRKY71、水稻OsWRKY71以及拟南芥AtWRKY40同源性较高。小麦TaWRKY33和TaWRKY71均受ABA诱导,促进植物应答高温、干旱等非生物胁迫过程[26-27]。在水稻中,OsWRKY71参与病原防御反应,并且是糊粉细胞中GA信号途径的转录抑制子[28-29]。拟南芥AtWRKY40受ABA诱导激活,但在植物应答非生物胁迫中起负调控作用[30]。因此,TaWRKY71a的功能及作用机制还有待进一步分析鉴定。此外,qRT-PCR结果表明,TaWRKY71a在小麦不同组织器官中均有表达,在幼叶中表达量最高。受到ABA、NaCl和PEG等胁迫因子的诱导。因此,笔者推测TaWRKY71a可能参与ABA介导的渗透胁迫调节。
WRKY转录因子超家族在植物的胁迫应答反应及植物生长发育过程中都发挥着重要的作用,后续笔者将进一步鉴定TaWRKY71a调控的上下游基因,并进行基因转化,以期深入阐明TaWRKY71a基因的功能及其调控机制,为小麦分子育种奠定基础。
参考文献:
[1] Rushton P J,Somssich I E,Ringler P,et al. WRKY transcription factors[J]. Trends in Plant Science,2010,15(5):247-258.
[2] Phukan U J,Jeena G S,Shukla R K. WRKY transcription factors:molecular regulation and stress responses in plants[J]. Frontiers in Plant Science,2016,7:760.
[3] 陈思雀,翁群清,曹红瑞,等. WRKY转录因子在生物和非生物胁迫中的功能和调控机理的研究进展[J]. 农业生物技术学报,2017,25(4):668-682.
[4] Jiang J,Ma S,Ye N,et al. WRKY transcription factors in plant responses to stresses[J]. Journal of Integrative Plant Biology,2017,59(2):86-101.
[5] Chen L,Song Y,Li S,et al. The role of WRKY transcription factors in plant abiotic stresses[J]. Biochimica et Biophysica acta,2012,1819(2):120-128.
[6] Rushton D L,Tripathi P,Rabara R C,et al. WRKY transcription factors:key components in abscisic acid signalling[J]. Plant Biotechnology Journal,2012,10(1):2-11.
[7] 李 岢,周春江. 植物WRKY转录因子的研究进展[J]. 植物生理学报,2014,50(9):1329-1335.
[8] Wang H Y,Wang H L,Shao H B,et al. Recent advances in utilizing transcription factors to improve plant abiotic stress tolerance by transgenic technology[J]. Frontiers in Plant Science,2016,7:67.
[9] Jiang Y,Deyholos M K. Functional characterization of Arabidopsis NaCl-inducible WRKY25 and WRKY33 transcription factors in abiotic stresses[J]. Plant Molecular Biology,2009,69(1/2):91-105.
[10] Li S,Zhou X,Chen L,et al. Functional characterization of Arabidopsis thaliana WRKY39 in heat stress[J]. Molecules and Cells,2010,29(5):475-483.
[11] Li S J,Fu Q T,Chen L G,et al. Arabidopsis thaliana WRKY25,WRKY26,and WRKY33 coordinate induction of plant thermotolerance[J]. Planta,2011,233(6):1237-1252.
[12] Qiu Y P,Yu D Q. Over-expression of the stress-induced OsWRKY45 enhances disease resistance and drought tolerance in Arabidopsis[J]. Environmental and Experimental Botany,2009,65(1):35-47.
[13] Zhou Q Y,Tian A G,Zou H F,et al. Soybean WRKY-type transcription factor genes,GmWRKY13,GmWRKY21,and GmWRKY54,confer differential tolerance to abiotic stresses in transgenic Arabidopsis plants[J]. Plant Biotechnology Journal,2008,6(5):486-503.
[14] 王 瑞,吴华玲,张 铭,等. 小麦TaWRKY51基因的克隆、表达分析和转基因功能鉴定[J]. 农业生物技术学报,2013,21(9):1019-1027.
[15] 刘自成,苗丽丽,王景一,等. 普通小麦转录因子基因TaWRKY35的克隆及功能分析[J]. 中国农业科学,2016,49(12):2245-2254.
[16] Wu H,Ni Z,Yao Y,et al. Cloning and expression profiles of 15 genes encoding WRKY transcription factor in wheat(Triticum aestivem L.)[J]. Progress in Natural Science,2008,18(6):697-705.
[17] Wang C,Deng P,Chen L,et al. A wheat WRKY transcription factor TaWRKY10 confers tolerance to multiple abiotic stresses in transgenic tobacco[J]. PLoS One,2013,8(6):e65120.
[18] 王俊斌,丁 博,李 明,等. 小麦磷脂酶Dδ基因的克隆及表达分析[J]. 麦类作物学报,2015,35(7):888-895.
[19] 王俊斌,李 明,丁 博,等. 小麦磷脂酶Dα的基因克隆及其编码序列的生物信息学分析[J]. 华北农学报,2013,28(1):117-122.
[20] Marchler-Bauer A,Lu S,Anderson J B,et al. CDD:a conserved domain database for the functional annotation of proteins[J]. Nucleic Acids Research,2011,39(Database issue):D225-D229.
[21] Gasteiger E,Hoogland C,Gattiker A,et al. Protein identification and analysis tools on the ExPASy server[M]. Totowa:Humana Press,2005:571-607.
[22] Geourjon C,Deléage G S. SOPMA:significant improvement in protein secondary structure prediction by consensus prediction from multiple alignments[J]. Computer Applications in the Biosciences,1995,11(6):681-684.
[23] Yu C,Chen Y,Lu C,et al. Prediction of protein subcellular localization[J]. Proteins,2006,64(3):643-651.
[24] Kosugi S,Hasebe M,Tomita M,et al. Systematic identification of cell cycle-dependent yeast nucleocytoplasmic shuttling proteins by prediction of composite motifs[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(25):10171-10176.
[25] Maeo K,Hayashi S,Kojima-Suzuki H,et al. Role of conserved residues of the WRKY domain in the DNA-binding of tobacco WRKY family proteins[J]. Bioscience Biotechnology and Biochemistry,2001,65(11):2428-2436.
[26] Xu Q,Feng W J,Peng H R,et al. TaWRKY71,a WRKY transcription factor from wheat,enhances tolerance to abiotic stress in transgenic Arabidopsis thaliana[J]. Cereal Research Communications,2014,42(1):47-57.
[27] He G H,Xu J Y,Wang Y X,et al. Drought-responsive WRKY transcription factor genes TaWRKY1 and TaWRKY33 from wheat confer drought and/or heat resistance in Arabidopsis[J]. BMC Plant Biology,2016,16(1):116.
[28] Zhang Z L,Xie Z,Zou X L,et al. A rice WRKY gene encodes a transcriptional repressor of the gibberellin signaling pathway in aleurone cells[J]. Plant Physiology,2004,134(4):1500-1513.
[29] Liu X,Bai X,Wang X,et al. OsWRKY71,a rice transcription factor,is involved in rice defense response[J]. Journal of Plant Physiology,2007,164(8):969-979.
[30] Chen H,Lai Z,Shi J,et al. Roles of arabidopsis WRKY18,WRKY40 and WRKY60 transcription factors in plant responses to abscisic acid and abiotic stress[J]. BMC Plant Biology,2010,10(1):281.