阿尔巴斯绒山羊是我国优秀的绒山羊品种之一,以其具有洁白、柔软和纤细的羊绒而享誉全球,具有非常高的经济价值,但是由于其产量不足,多年来限制了羊绒产业的发展。为了提升羊绒产业在我国经济发展中的重要地位,对绒山羊进行改良,提升羊绒的产量和品质已经迫在眉睫。搞清楚羊绒的生长机制是我们面临的首要问题。依据绒山羊皮肤毛囊的发生时间和结构特征不同,将其划分为初级毛囊和次级毛囊2种。其中,初级毛囊发育形成羊毛,次级毛囊发育形成羊绒[1-2]。毛囊是控制毛发生长的复杂皮肤辅助器官,它由表皮和真皮2个部分组织组成[3],其结构包括毛球、毛干、内根鞘、外根鞘和结缔组织鞘5个部分[4]。毛球由真皮毛乳头和毛发基质组成。真皮毛乳头细胞位于毛囊底部,它们分泌各种细胞因子以调节邻近组织,从而调节毛发的生长和更新[5]。因此,真皮毛乳头细胞被大家认为是毛囊的“指挥中心”[6]。所以,真皮毛乳头细胞可以用作研究毛囊生长和周期性变化的细胞模型。
MSX基因属于Hox基因家族成员。在脊椎动物中MSX分为3种亚形,分别为MSX1、MSX2和MSX3。它们在脊椎动物的皮肤、心脏、乳腺等多个器官的形成过程中发挥着重要作用[7-8]。有研究表明,MSX2基因调控了皮肤中上皮和间充质之间的信号转导,影响了毛囊的形态发生和周期性变化。过表达MSX2转基因小鼠,表皮因过度增殖而变厚,毛发短且髓质干瘪。而MSX2基因敲除小鼠的毛母质细胞减少,毛干形成异形,并且在脱毛后再进入生长期会发生延迟。因此,MSX2可以独立地调节毛囊进入生长期 [9]。也有研究者发现,MSX2在毛囊的基质细胞中表达,当MSX2缺乏时,小鼠会产生弯曲毛发[10]。由此认为,MSX2基因对毛发生长是必需的,它对毛囊的生长和周期性变化具有调控作用。本研究旨在探究MSX2基因对绒山羊真皮毛乳头细胞增殖能力的调控。
1 材料和方法
1.1 试验材料
山羊皮肤样本由内蒙古亿维白绒山羊有限责任公司提供,pSIREN-RetroQ-ZsGreen质粒和pDsRed2质粒在内蒙古大学省部共建草原家畜生殖调控与繁育国家重点实验室保存。DMEM/F12培养基、胎牛血清(FBS)、PBS、0.25%胰酶(Trypsin)购自Hyclone;冷冻保护剂(DMSO)购自日本和光;脂质体Lipofectamine 2000购自Invitrigen;质粒大提试剂盒EndoFree®Plasmid Maxi Kit购自QIAGEN,限制性内切酶、T4连接酶、反转录试剂盒PrimeScript®RT reagent Kit with gDNA Eraser、实时定量PCR试剂SYBR®Premix Ex TaqTM Ⅱ购自TaKaRa。α-SMA和CD133抗体购自Boster Biotech,MSX2、LEF-1、cyclin D1、β-actin抗体均购自abcam。
1.2 试验方法
1.2.1 绒山羊真皮毛乳头细胞的分离和培养 2017年9月于毛囊生长期,在内蒙古亿维白绒山羊有限责任公司的种羊场中,选择2~3岁的雌性绒山羊作为皮肤样本收集的对象。剃毛消毒后,切取腹部皮肤组织(1~2 cm2),通过机械法分离单根毛囊,然后用浓度为2 g/L的Ⅱ型胶原酶处理上述游离的毛囊约1 h,再通过机械分离法分离出真皮毛乳头细胞。最后用含有10% 新生牛血清的DMEM/F12培养液洗涤2~3遍,接种于培养皿中,置于37 ℃,5% CO2,100%饱和湿度的培养箱中进行培养,待细胞生长汇合度达到80%时,冻存一部分细胞,将其他细胞传代培养[11]。
1.2.2 免疫细胞化学 免疫细胞化学试验的目的主要是对分离得到的山羊真皮毛乳头细胞进行鉴定。将真皮毛乳头细胞培养在载玻片上。待细胞培养生长汇合度达90%时,开始进行试验。首先用0.01 mol/L PBS将上述待处理的细胞清洗3遍,洗去死细胞和培养液,然后用4%的多聚甲醛于4 ℃孵育30 min进行固定处理。固定好的细胞再用0.01 mol/L PBS清洗3遍,然后用0.5% Triton X-100进行通透处理10 min,再用0.01 mol/L PBS清洗3遍。而后用含有5% BSA的PBS 4 ℃过夜处理上述通透好的细胞,目的是为了避免抗体的非特异性结合。再用α-SMA(1∶100 稀释;Boster Biotech)和CD133(1∶100 稀释;Boster Biotech)抗体4 ℃过夜处理上述细胞。再用0.01 mol/L PBS清洗3遍,再用带有绿色荧光的二抗37 ℃ 60 min处理上述细胞。然后用1 mg/L的DAPI染细胞核5 min。最后将上述处理完毕的细胞置于载玻片上封片,通过共聚焦显微镜进行细胞荧光拍摄。
1.2.3 质粒的构建和转染 将扩增完整的MSX2基因CDS序列通过分子生物学技术连入pDsRed2骨架质粒中,完成MSX2的过表达载体。同时也设计并完成了骨架载体为pSIREN-RetroQ-ZsGreen的干扰载体的构建,干扰片段为5′-GCGGAAACACAAGACCAAT-3′。将上述构建好的载体经过测序确认正确后通过Lipofectamine 2000对真皮毛乳头细胞进行转染试验。细胞转染48 h后观察荧光效果,同时收集上述转染细胞用于下游的试验。
1.2.4 真皮毛乳头细胞生长曲线的绘制 取上述生长良好的细胞,经胰酶消化后,用新鲜培养基制成细胞悬液,根据细胞计数结果,按每孔5×104个/mL的细胞密度传代培养。之后每间隔24 h后进行细胞计数一次,每次计数3孔细胞,计算平均值,连续计数7 d。最终根据细胞计数结果绘制生长曲线。
1.2.5 Real-time PCR 将上述各组试验细胞用RNAiso Plus(TaKaRa Biotechnology,Dalian,China)试剂提取总RNA,然后用gDNA Eraser处理提取总RNA,目的是为了去除基因组DNA对之后试验的干扰,然后取等量的上述各组细胞总RNA进行反转录试验,制备各样本的cDNA。Real-time PCR试验中选择GAPDH基因为内参基因,用于修正试验数据。基因MSX2、LEF-1、cyclin D1、GAPDH的引物设计见表1。Real-time PCR 试验以SYBR Premix Ex Taq酶 (TaKaRa,Dalian,China),通过iQ5 系统 (Bio-Rad,Hercules,CA,USA)来完成。通过用2-ΔΔCt方法来比较各基因的Ct值,从而完成对上述样本中各基因的相对表达量分析。
表1 Real-time PCR反应各基因引物
Tab.1 Primers for Real-time PCR
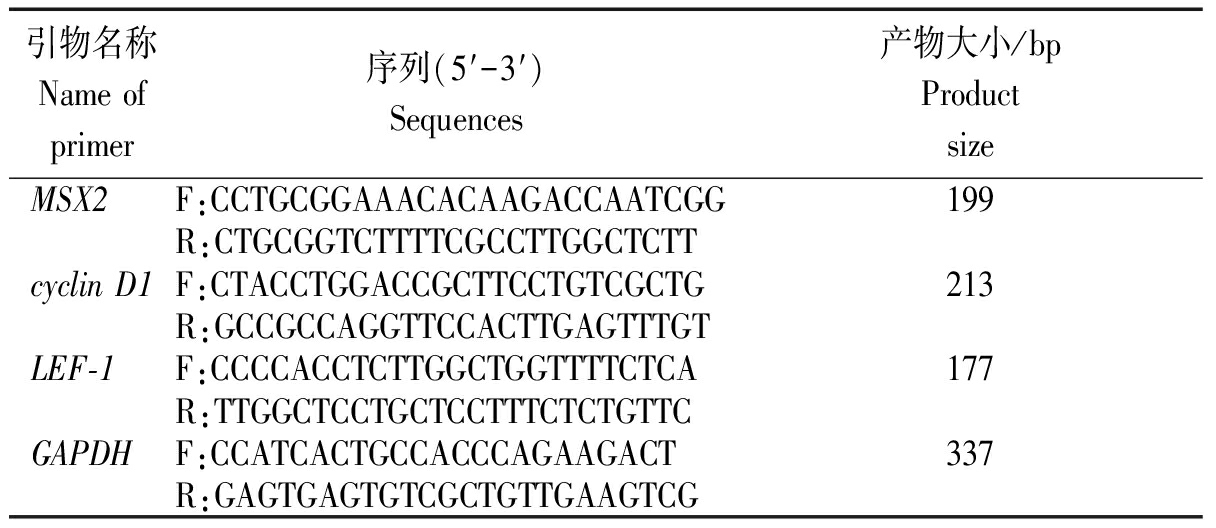
引物名称Name of primer序列(5′-3′)Sequences产物大小/bpProductsize MSX2F:CCTGCGGAAACACAAGACCAATCGG199R:CTGCGGTCTTTTCGCCTTGGCTCTTcyclin D1F:CTACCTGGACCGCTTCCTGTCGCTG213R:GCCGCCAGGTTCCACTTGAGTTTGTLEF-1F:CCCCACCTCTTGGCTGGTTTTCTCA177R:TTGGCTCCTGCTCCTTTCTCTGTTCGAPDHF:CCATCACTGCCACCCAGAAGACT337R:GAGTGAGTGTCGCTGTTGAAGTCG
1.2.6 Western Blot 提取上述各试验细胞的总蛋白质,选取等量的蛋白进行试验。首先用MSX2(1∶500 稀释;abcam)、LEF-1(1∶500稀释;abcam)、cyclin D1(1∶500稀释;abcam)、β-actin(1∶500稀释;abcam)抗体对各样本的蛋白质膜4%孵育过夜处理,然后用二抗(1∶1 000稀释;abcam)处理。
1.3 数据分析
数据通过Graphpad Prism 6软件进行统计分析。
2 结果与分析
2.1 真皮毛乳头细胞的体外培养和鉴定
本研究这2种细胞在体外培养中呈长梭形贴壁生长。培养5~7 d,这2种细胞会出现凝集生长现象。通过对细胞进行α-SMA 和 CD133表面标记的检测,发现均为阳性。由此说明,分离得到的细胞即为山羊的毛乳头细胞(图1)。

图1 山羊真皮毛乳头细胞的鉴定
Fig.1 Identification of Cashmere goat DPCs
2.2 真皮毛乳头细胞的过表达载体和干扰载体转染
分别对初级毛乳头细胞和次级毛乳头细胞进行MSX2过表达载体和干扰载体的转染。通过荧光的表达情况监测转染效率(图2)。通过Real-time PCR完成对各样本中MSX2基因和其他各相关基因的mRNA表达检测,用2-ΔΔCt方法比较各基因的Ct值,根据比较结果从而完成对各个试验组中各基因的相对表达量的分析。在结果分析中以未转染任何质粒的细胞作为试验对照组,在初级毛乳头细胞MSX2表达检测中发现,过表达试验组的MSX2表达量是对照的11.85倍,干扰试验组MSX2表达量是对照的0.31倍。同时,在次级毛乳头细胞MSX2表达检测中发现,过表达试验组的MSX2表达量是对照的10.59倍,在干扰试验组中MSX2表达量是对照的0.45倍(图3)。本研究结果表明,在真皮毛乳头细胞中,MSX2基因的过表达和干扰细胞系已被成功建立。
2.3 MSX2在真皮乳头细胞增殖中激活了LEF-1和 cyclin D1基因的表达
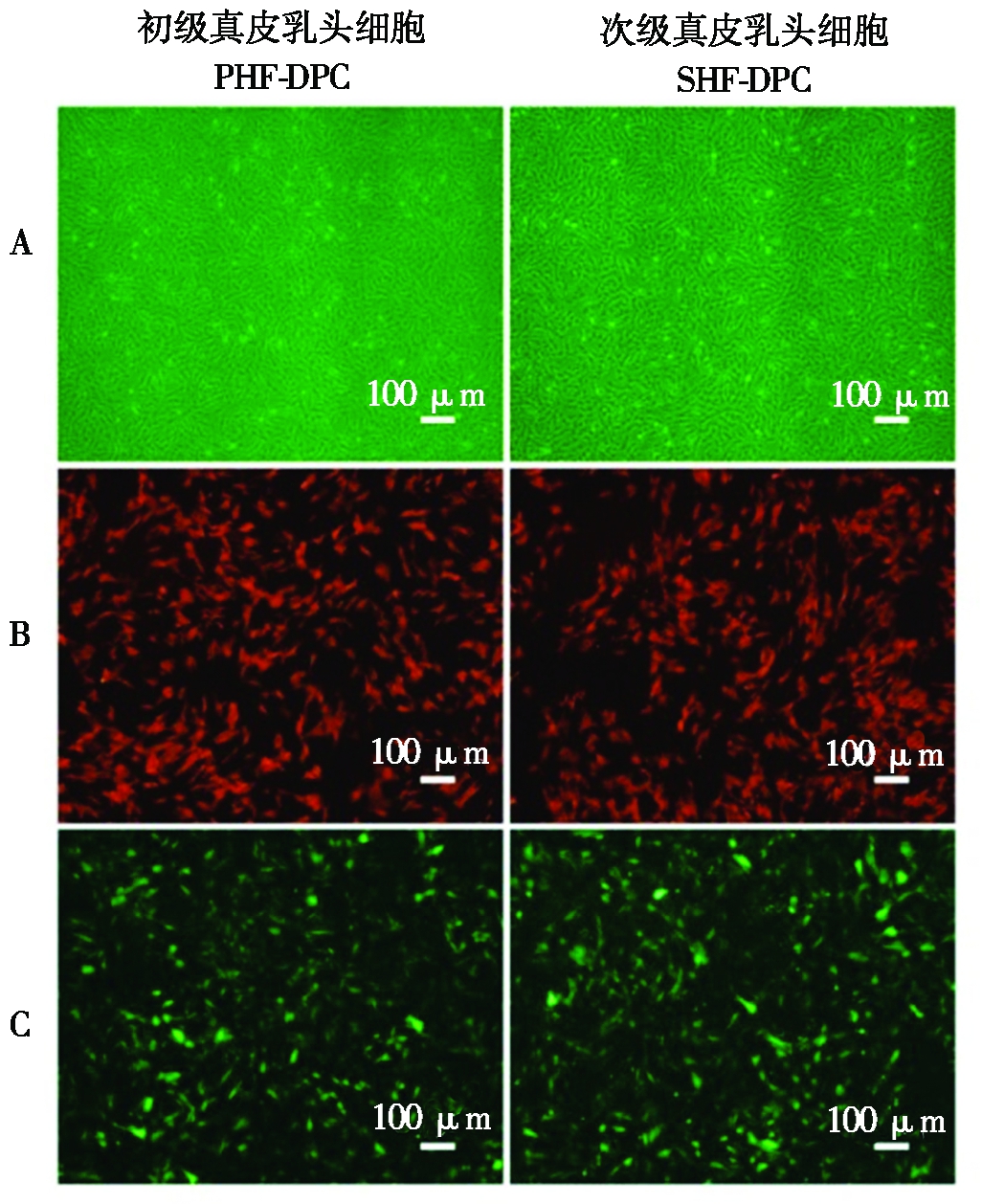
A.真皮毛乳头细胞;B.转染MSX2过表达载体的真皮毛乳头细胞;C.转染MSX2干扰载体的真皮毛乳头细胞。
A.Dermal papilla cells;B.DPCs transfected with the MSX2-overexpressing vector;C.DPCs transfected with the MSX2-interference vector.
图2 山羊真皮毛乳头细胞的转染
Fig.2 Plasmids were transfected into Cashmere goat dermal papilla cells
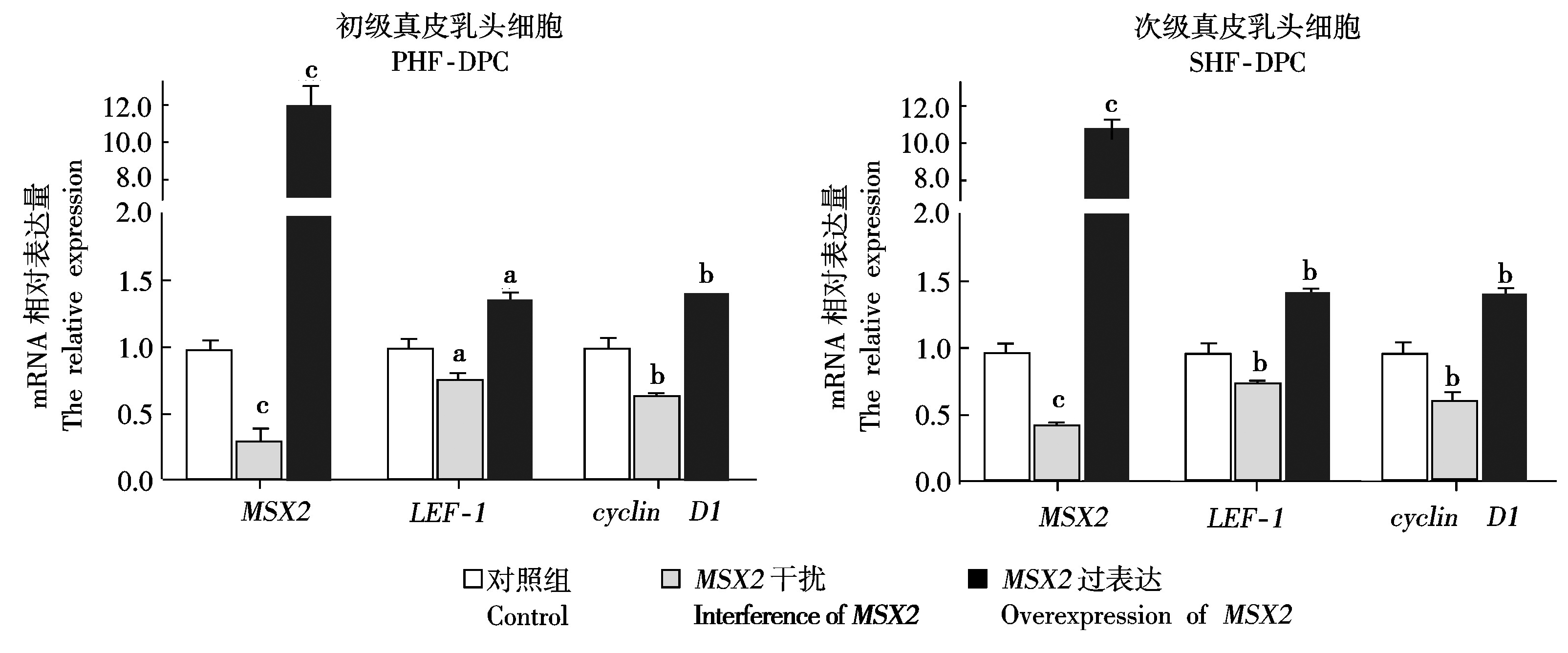
图中不同小写字母表示不同实验组间基因表达差异显著水平(P<0.05)。
Different letters represent significant difference in gene expression(P<0.05).
图3 MSX2、LEF-1 and cyclin D1基因的Real-time PCR检测
Fig. 3 The Real-time PCR analysis of MSX2,LEF-1 and cyclin D1 gene expression
通过Real-time PCR检测了MSX2、LEF-1和 cyclin D1基因的表达情况,研究表明,当MSX2过表达时,LEF-1和cyclin D1的表达量也随之增加。在MSX2干扰试验组中,LEF-1和cyclin D1的表达量也随之减少,并且也发现无论是在初级毛乳头细胞还是次级毛乳头细胞中都具有同样的表达趋势(图3)。同时在Western Blot试验中得到的结果与Real-time PCR检测的结果一致(图4)。LEF-1蛋白和cyclin D1蛋白的表达量随MSX2蛋白的表达量的增加而增加,随 MSX2蛋白表达量的减少而减少,这样进一步印证了Real-time PCR的试验结果。
2.4 MSX2对真皮毛乳头细胞增殖的影响
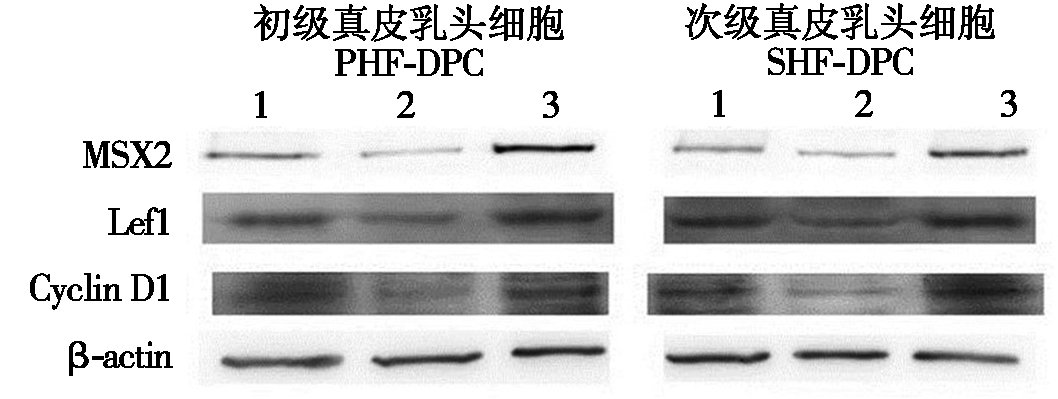
1.真皮毛乳头细胞;2.转染MSX2干扰载体的真皮毛乳头细胞;3.转染MSX2过表达载体的真皮毛乳头细胞。
1.Dermal papilla cells;2.DPCs transfected with the MSX2-interference vector;3.DPCs transfected with the MSX2-overexpressing vector.
图4 MSX2、LEF-1、cyclin D1和β-actin蛋白的Western Blot检测
Fig.4 The Western Blot analysis of MSX2,LEF-1,cyclin D1 and β-actin protein
通过各细胞株的生长曲线可以发现,在培养3 d后各组细胞的生长曲线表现差异,MSX2基因过表达试验组和干扰试验组分居对照组两侧。随着MSX2基因表达量的增加,细胞的增殖速度有所增加,而MSX2基因干扰试验组中细胞的生长速度慢于对照试验组。由此说明,MSX2基因的过表达促进毛乳头细胞增殖能力提高,而MSX2基因的下调使得毛乳头细胞增殖能力下降(图5)。
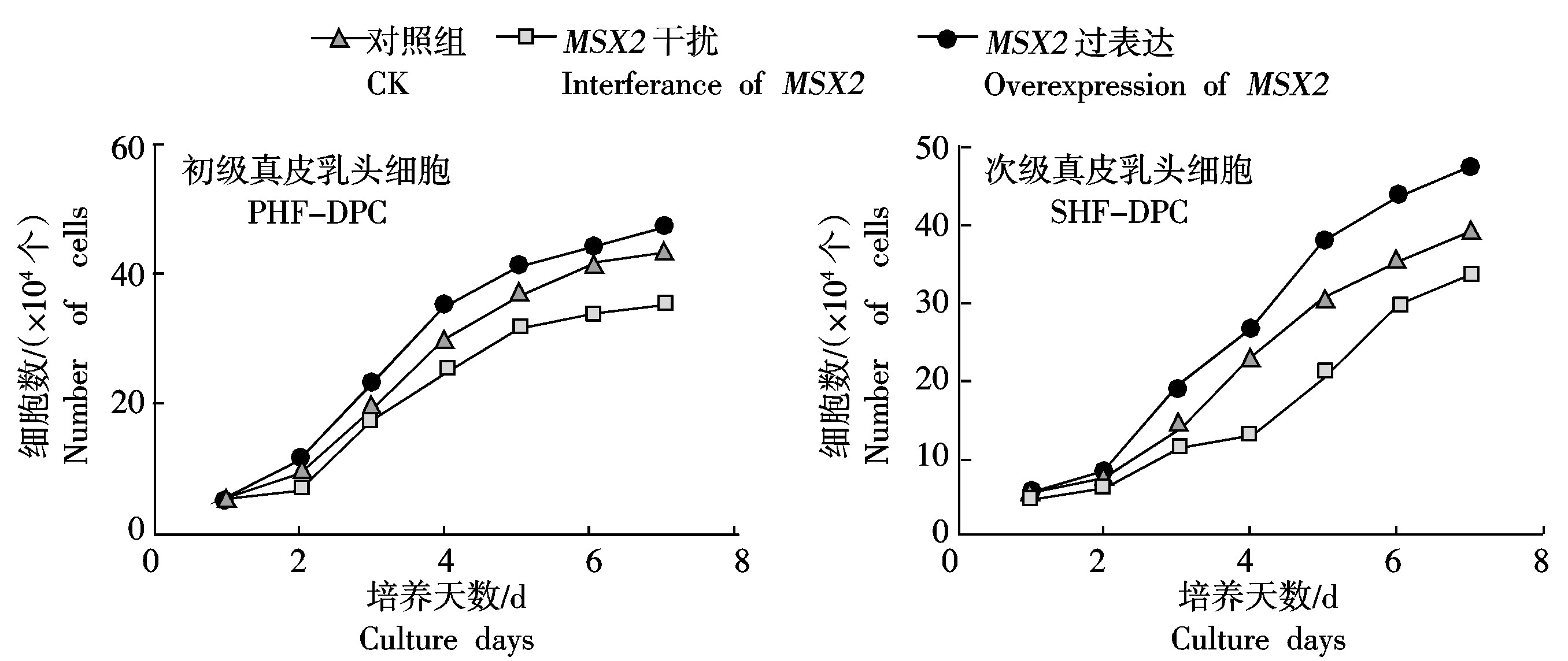
图5 真皮毛乳头细胞的生长曲线
Fig.5 The growth curve of dermal papilla cells
3 讨论与结论
毛囊是皮肤组织中复杂的亚器官结构,它经过生长期、退行期和休止期周期性生长[12]。毛囊发生时位于其基板处的间充质细胞凝聚,紧紧包裹基底细胞形成了真皮毛乳头细胞。真皮毛乳头细胞与其周围细胞相互作用形成毛球。因此,真皮毛乳头细胞被视为毛囊的生长调节中心[13]。所以,本研究选择真皮毛乳头细胞作为细胞模型来探究影响毛囊生长发育过程中相关信号分子的调节作用。
本研究的目的基因MSX2是参与毛囊发育和毛干分化过程中重要的信号因子之一。MSX2基因在动物胚胎发育过程中参与并维持了各组织的生长发育,它属于同源异形盒基因家族的成员之一[14-15]。有研究表明,当MSX2基因的表达异常时,会使得动物皮肤毛囊生长发育异常[16]。有研究发现,MSX2敲除小鼠脱发不是由于毛干的断裂,而是由于整个毛球的异常。毛球的异常可能是毛乳头或毛母质发生了异常,因为在毛囊的完整结构中,毛球部分包括真皮毛乳头细胞和毛母质,其中真皮毛乳头诱导毛母质增殖分化最终形成毛干。还有研究证明,MSX2的缺失将导致构成毛干的三层细胞的缺失,推测MSX2能够调控毛母质细胞的分化,因为MSX2在毛母质扩增迁移成为前皮质细胞和随后分化成毛发的区域中表达。MSX2不仅参与调节毛母质细胞和前皮质细胞之间的分化,还调控毛发周期的不同阶段之间的转换,影响了毛囊的生长发育过程[17]。因此,本研究就是讨论MSX2对真皮毛乳头细胞增殖的调控作用。
本试验结果表明,MSX2基因参与真皮毛乳头细胞的增殖调控。在真皮毛乳头细胞中,随着MSX2表达量的增加,细胞的增殖能力有所增加;相反,当MSX2表达量减少,细胞的增殖能力有所下降。这就有力地说明MSX2基因在毛乳头细胞的增殖过程中发挥着一定作用。毛囊的形态发生和周期性变化受到多种信号通路调节,包括:Wnt、Shh、Notch、BMP等[18]。在这些信号通路中,Wnt信号通路与毛囊生长和发育以及细胞周期维持密切相关,所以本研究也重点检测了Wnt信号通路中关键的几个信号分子的表达变化情况[19]。LEF-1是Wnt信号通路中关键的细胞调节因子,它们在毛囊的生长发育和周期性变化中作用显著,任何表达异常,都会使得毛囊生长发生变化。研究表明,MSX2的过表达可导致经典Wnt信号通路的活化,进而促进上皮间质转化。还有研究发现,MSX2的过表达会导致DKK1的表达减少,从而促进Wnt信号通路的转导。研究表明,MSX2可以激活Wnt信号通路,被激活的Wnt信号通路使得细胞内β-catenin积累并转移进入了细胞核中,LEF-1作为转录因子与β-catenin结合,完成转录功能,对下游靶基因的转录进行调控[20-21]。cyclin D1是Wnt信号通路中的一个靶基因,它是一个重要的细胞周期蛋白,通过介导CDK4和CDK6调节细胞从G1期向S期的增殖[22]。通过比较发现,随着MSX2基因表达量的增加,LEF-1、cyclin D1基因的表达量也会同步增加,最终促进了真皮毛乳头细胞的增殖。这就表明在真皮毛乳头细胞的增殖过程中,MSX2基因的表达变化引发了Wnt信号通路中LEF-1的表达变化,进而对cyclin D1基因的表达产生了影响,最终调节了真皮毛乳头细胞的增殖。
参考文献:
[1] Ji X Y,Wang J X,Liu B,et al. Comparative transcriptome analysis reveals that a Ubiquitin-Mediated proteolysis pathway is important for primary and secondary hair follicle development in cashmere goats[J]. PLoS One,2016,11(10):e0156124.
[2] Shi B,Ding Q,He X,et al. Tβ4-overexpression based on the piggyBac transposon system in cashmere goats alters hair fiber characteristics[J]. Transgenic Research,2017,26(1):77-85.
[3] Powell B,Crocker L,Rogers G. Hair follicle differentiation:expression,structure and evolutionary conservation of the hair type Ⅱ keratin intermediate filament gene family[J]. Development,1992,114(2):417-433.
[4] Xing Y,Xu W,Yang K,et al. Immunolocalization of Wnt5a during the hair cycle and its role in hair shaft growth in mice[J]. Acta Histochemica,2011,113(6):608-612.
[5] Jeong K H,Joo H J,Kim J E,et al. Effect of mycophenolic acid on proliferation of dermal papilla cells and induction of anagen hair follicles[J]. Clinical and Experimental Dermatology,2015,40(8):894-902.
[6] Morgan B A. The dermal papilla:an instructive niche for epithelial stem and progenitor cells in development and regeneration of the hair follicle[J]. Cold Spring Harbor Perspectives in Medicine,2014,4(7):a015180.
[7] Davidson D. The function and evolution of MSX genes:pointers and paradoxes[J]. Trends in Genetics,1995,11(10):405-411.
[8] Sylvia,Alappat. MSX homeobox gene family and craniofacial development[J]. Cell Research,2003,13(6):429-442.
[9] Ma L,Liu J,Wu T,et al. ′Cyclic alopecia′ in MSX2 mutants:defects in hair cycling and hair shaft differentiation[J]. Development,2003,130(2):379-389.
[10] Lu L,Di J,Wang Q,et al. Research advances on the biological formation mechanism of wool and hair crimps[J]. Acta Veterinaria et Zootechnica Sinica,2014,45(5):679-685.
[11] Zhu B,Xu T,Yuan J,et al. Transcriptome sequencing reveals differences between primary and secondary hair follicle-derived dermal papilla cells of the Cashmere goat(Capra hircus)[J]. PLoS One,2013,8(9):e76282.
[12] Kulessa H,Turk G,Hogan B L. Inhibition of Bmp signaling affects growth and differentiation in the anagen hair follicle[J]. The EMBO Journal,2000,19(24):6664-6674.
[13] Stenn K S,Paus R. Controls of hair follicle cycling[J]. Physiological Reviews,2001,81(1):449-494.
[14] Sun J,Ting M C,Ishii M,et al. MSX1 and MSX2 function together in the regulation of primordial germ cell migration in the mouse[J]. Developmental Biology,2016,417(1):11-24.
[15] Liang H,Zhang Q,Lu J,et al. MSX2 induces trophoblast invasion in human placenta[J]. PLoS One,2016,11(4):e0153656.
[16] Kim B K,Yoon S K. Hairless down-regulates expression of MSX2 and its related target genes in hair follicles[J]. Journal of Dermatological Science,2013,71(3):203-209.
[17] Cai J,Lee J,Kopan R,et al. Genetic interplays between MSX2 and FOXN1 are required for Notch1 expression and hair shaft differentiation[J]. Developmental Biology,2009,326(2):420-430.
[18] Jiang L,Xu J,Jin R,et al. Transcriptomic analysis of chicken cochleae after gentamicin damage and the involvement of four signaling pathways(Notch,FGF,Wnt and BMP)in hair cell regeneration[J]. Hearing Research,2018,361(1):66-79.
[19] Van Amerongen R,Nusse R. Towards an integrated view of Wnt signaling in development[J]. Development,2009,136(19):3205-3214.
[20] Andl T,Reddy S T,Gaddapara T,et al. WNT signals are required for the initiation of hair follicle development[J]. Developmental Cell,2002,2(5):643-653.
[21] Asally M,Yoneda Y. Beta-catenin can act as a nuclear import receptor for its partner transcription factor,lymphocyte enhancer factor-1(lef-1)[J]. Experimental Cell Research,2005,308(2):357-363.
[22] Hinz M,Krappmann D,Eichten A,et al. NF-kappaB function in growth control:regulation of cyclin D1 expression and G0/G1-to-S-phase transition[J]. Molecular and Cellular Biology,1999,19(4):2690-2698.