过氧化物酶(Peroxidase,POD)是一种广泛存在于植物中的氧化还原酶,在结构上可以分为3类,最常见的是Ⅲ类分泌过氧化物酶(Secretory peroxidase),其生物学功能是催化除去H2O2,并参与有毒还原剂的氧化、木质素的生物合成和降解、苏木素化、生长素分解代谢、植物形态建成[1-4],并参与环境胁迫响应如伤害、病原体攻击和氧化应激反应等[5-7]。
目前,在许多植物中已经克隆到POD基因,如拟南芥(Arabidopsis thaliana)[8]、水稻(Oryza sativa)[9]、小桐子(Jatorpha curcas L.)[10]、银杏(Ginkgo biloba L.)[11]、割手密(Saccharum spontaneum)[12]、芋头(Colocasia esculenta)[13]、萝卜(Raphanus sativus L.)[14]、甘蔗(Saccharum spp.)[15]、巴西橡胶树(Hevea brasiliensis)[16]、石榴(Punica granatum L.)[17]以及陆地棉(Gossypium hirsutum)[18]等。其中,除了ScPOD02属于Ⅱ类胞外过氧化物酶外,其余基因均属于Ⅲ类分泌过氧化物酶。在功能研究方面,JcPOD73的表达受低温强烈诱导;GbPOD1和ScPOD02均显著受水杨酸、茉莉酸甲酯、脱落酸、聚乙二醇和盐处理的诱导表达,GbPOD1的表达还受金属Cu和Cd,以及甲基紫晶和机械伤害处理的显著诱导,而ScPOD02还受过氧化氢处理诱导表达。
烟草是我国重要的经济作物之一,也是一个植物科学研究的模式植物。在实际生产中,干旱、盐碱等非生物胁迫严重影响烟叶的产量及品质[19]。因此,研究烟草的过氧化物酶基因的结构与功能,对于烟草抗逆性的提高具有重要意义。然而,烟草POD基因克隆与功能研究方面的报道较少。罗秀云[20]从普通烟草中克隆出了属于Ⅲ类分泌过氧化物酶的烟草过氧化物酶基因Ntpx。Ntpx基因在根、茎、叶、花中均有表达,在花中表达量最高;同时,其表达还受到温度及脱落酸等植物激素的显著诱导。
虽然烟草POD基因已有克隆,但POD基因是一个多基因家族,具有高度多型性、功能多样性的特点。所以,本研究对普通烟草的POD基因进行了克隆,并研究了其组织器官及逆境胁迫表达模式,旨在为烟草过氧化物酶基因的功能及结构研究奠定理论基础。
1 材料和方法
1.1 试验材料及试剂
试验材料为烤烟品种K326(Nicotiana tabacum cv K326)。
从宝生物工程(大连)有限公司购买目的基因的克隆及回收使用的TRIzol试剂、cDNA合成试剂盒、限制性内切酶等试剂;从天根公司购买DNA凝胶纯化回收试剂盒;从南京唯赞生物科技有限公司购买大肠杆菌感受态DH5α;在上海生工生物工程有限公司完成了引物合成与测序。
1.2 试验方法
1.2.1 烟草幼苗的处理 挑选的烟草种子要饱满且大小一致,然后分别用75%的乙醇、10%的次氯酸钠溶液和无菌水浸泡及清洗数次后播种于MS培养基上。在16 h光/8 h暗,25 ℃的光照培养箱中培养14 d后,挑选长势一致的幼苗进行氧化(10 mmol/L H2O2)、低钾(10 μmol/L K+)、高盐(200 mmol/L NaCl)、干旱(5% PEG-6000)和ABA处理(1 μmol/L)。每处理设3次重复,处理0,3,6,12,24 h后,将烟苗整株在液氮中速冻,并置于-80 ℃冰箱中保存,用于RNA的提取。
低钾培养基的配制方法,参见张雪薇等[21]的方法进行。
选取正常生长62 d的无菌苗植株,分别取植株根、茎、叶和花(盛花期)在液氮中速冻,并置于-80 ℃冰箱中保存,用于RNA的提取。
1.2.2 烟草NtPOD1基因的克隆 参考GenBank收录的绒毛烟草(Nicotiana tomentosiformis)POD42序列(ID:XP_009613011.1),用DNAMAN软件设计全长扩增引物NtPOD1-F和NtPOD1-R(表1)。RNA的提取采用TRIzol法,并参照鲁黎明等[22]的方法进行。cDNA第一链的合成,参照反转录试剂盒按说明书进行。以反转录后的cDNA为模板,进行基因全长的扩增。扩增反应、电泳检测、目的片段纯化等试验步骤参照卓维等[23]的方法进行。最后,随机挑选3个阳性克隆送至上海生工生物工程有限公司测序。
1.2.3 烟草NtPOD1基因生物信息学分析 NtPOD1编码蛋白的理化性质和疏水性分别用ExPASy ProtParam tool分析和在线软件ProtScale分析;NtPOD1蛋白的二级结构和三级结构分别用IBCP的在线工具SOPMA和SWISS-MODEL的RasTop软件预测;NtPOD1蛋白质信号肽用 Signal-P 在线预测;NtPOD1的亚细胞定位用在线工具PSORT预测;NtPOD1编码蛋白氨基酸的结构域用NCBI数据库的 CDD分析;系统进化树运用Clustalx-2.0.9、Bio Edit及MEGA 5软件以邻近法构建。
1.2.4 烟草 NtPOD1基因的表达模式分析 用Primer Premier 5.0根据所克隆基因的cDNA序列设计qPCR引物NtPOD1-qF和NtPOD1-qR(表1),用烟草18S rRNA为内参进行qPCR扩增。RNA的提取及cDNA的合成,均按本研究1.2.2的方法进行。qRT-PCR扩增参照卓维等[23]的方法进行。基因相对表达水平用2-ΔΔCt方法进行计算。
表1 引物序列
Tab.1 Primer sequences
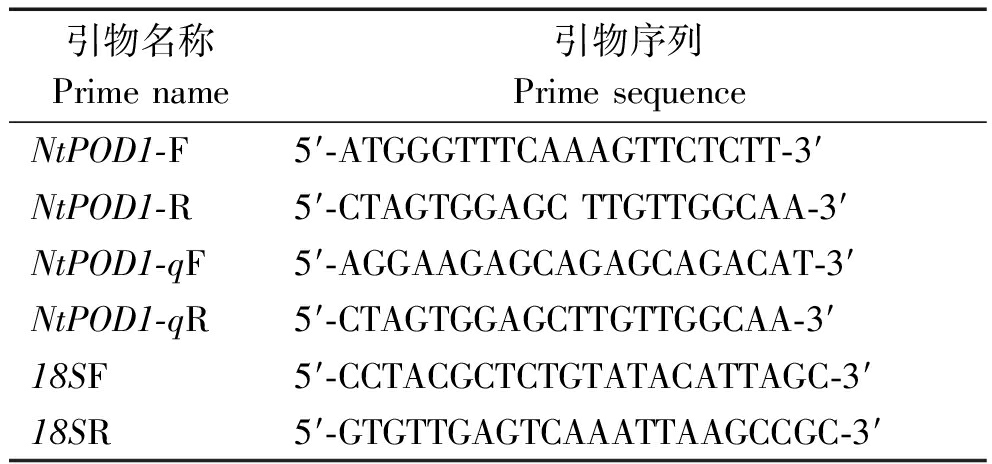
引物名称Prime name引物序列Prime sequenceNtPOD1-F5′-ATGGGTTTCAAAGTTCTCTT-3′NtPOD1-R5′-CTAGTGGAGC TTGTTGGCAA-3′NtPOD1-qF5′-AGGAAGAGCAGAGCAGACAT-3′NtPOD1-qR5′-CTAGTGGAGCTTGTTGGCAA-3′18SF5′-CCTACGCTCTGTATACATTAGC-3′18SR5′-GTGTTGAGTCAAATTAAGCCGC-3′
2 结果与分析
2.1 NtPOD1基因克隆及序列分析
进行PCR扩增的cDNA模板是以烟草叶片总RNA反转录合成的,电泳结果显示,在1 000 bp位置上有清晰的条带(图1)。将该条带进行回收纯化测序,结果显示,目的片段大小为981 bp。
利用DNAMAN软件进行分析及多重序列比对,推导出该基因编码326个氨基酸(aa)(图2),起始于ATG密码子和终止于TAG密码子。多重序列比对结果表明,其氨基酸序列与其他农作物POD氨基酸序列有相似的结构域,包括血红结合位点、活性位点、底物结合位点、钙离子结合位点(图3),于是将所克隆的基因命名为NtPOD1。
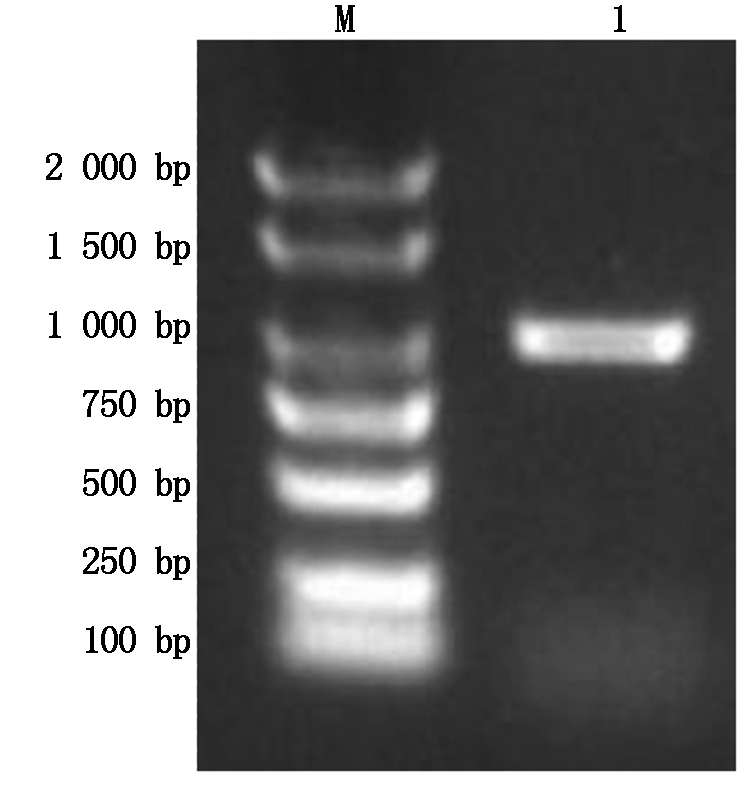
M.Marker;1.NtPOD1基因。
M.Marker;1.NtPOD1 gene PCR product.
图1 NtPOD1基因PCR扩增电泳
Fig.1 NtPOD1 gene PCR amplification electrophoresis

图2 NtPOD1基因的cDNA和氨基酸序列
Fig.2 cDNA and amino acid sequence of the NtPOD1 gene
2.2 NtPOD1基因的生物信息学分析
2.2.1 NtPOD1蛋白的理化性质和疏水性分析 利用ExPASy ProtParam tool软件,对NtPOD1编码蛋白进行了理化性质分析,结果显示:在NtPOD1基因编码的326个氨基酸中,亮氨酸(9.8%)含量最高,其次为颉氨酸(7.7%),然后为赖氨酸(7.4%)及精氨酸(7.1%)。该蛋白预测的分子量为37.19 ku,等电点PI为8.89,不稳定系数(Instability index)为37.34,说明该蛋白可能是一个稳定的蛋白。用在线软件ProtScale进行的疏水性分析,结果其亲水性平均指数为-0.362,预测该蛋白属于亲水性蛋白(图4)。
2.2.2 NtPOD1蛋白的二级结构和三级结构预测 NtPOD1蛋白的二级结构利用SOPMA进行预测发现,该结构包含了α-螺旋(Alpha helix)、延伸链(Extended strand)、β-转角(Beta turn)及无规则卷曲(Random coil),其参与的氨基酸比例分别为47.24%,11.66%,14.11%及26.99%(图5)。

圆点表示血红素结合位点与活性中心的氨基酸序列;星号表示底物结合结构域的氨基酸序列;加号表示Ca2+结合位点。
The origin indicates the amino acid sequence of the heme binding site and the active site;The asterisk indicates the amino acid sequence of the substrate binding domain;The plus sign indicates the Ca2 + binding site.
图3 NtPOD1氨基酸序列与其他植物POD的多重序列比对
Fig.3 Multiple sequence alignment of NtPOD1 amino acid sequence with other plant PODs
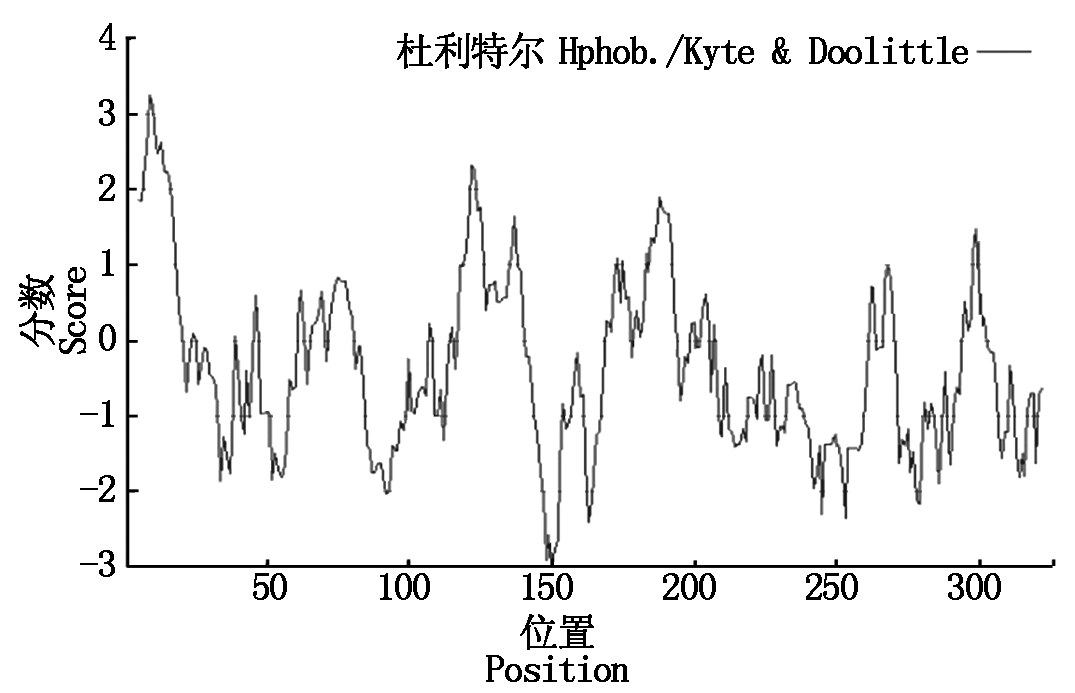
图4 NtPOD1蛋白的疏水性分析
Fig.4 Hydrophobicity analysis of target protein of NtPOD1
NtPOD1的三级结构运用 SWISS-MODEL的RasTop软件进行了预测,结果见图6。
2.2.3 NtPOD1蛋白信号肽预测及亚细胞定位分析 蛋白质信号肽的预测有助于其功能结构域区分和细胞定位。NtPOD1蛋白的信号肽位置及切割位点利用Signal-P4.1预测,用mean S-score来判断是否是分泌蛋白(图7)。预测结果显示,预测信号肽概率为1,表明该蛋白存在信号肽;切割位点最可能位于第21和22位点之间,即AFA-ED;其mean S-score为0.942,大于0.5,该蛋白属于分泌蛋白。
利用PSORT在线预测NtPOD1的亚细胞定位,结果显示,该蛋白在细胞外(包括细胞壁)占44.4%,在线粒体上占22.2%,在内质网中占22.2%,在高尔基中占11.1%。此结果说明,NtPOD1可能主要定位在细胞外(包括细胞壁)。
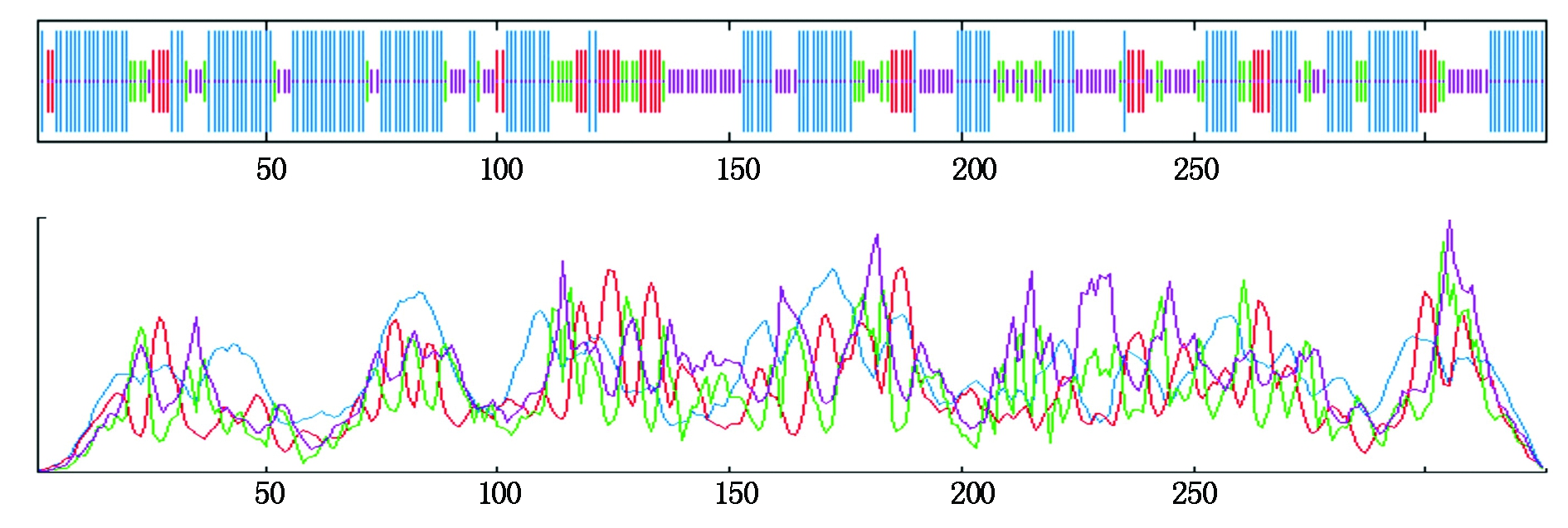
图5 NtPOD1蛋白的二级结构预测
Fig.5 Predicted secondary structure of target protein of NtPOD1
2.2.4 NtPOD1蛋白的结构域 CDD分析结果表明(图8),NtPOD1蛋白具有过氧化物酶完整的保守结构域,结构域由第26-320位氨基酸组成,包括血红素结合位点(Heme binding site)、活性位点(Active site)、底物结合位点(Substrate binding site)、钙离子结合位点(Calcium binding sites)。还含有分泌过氧化物酶(Secretory peroxidase,Cd00693)和植物过氧化物酶超家族(Plant-peroxidase-like superfamily,C100196)2个保守功能域。该结果表明,本研究所获得基因属于烟草的过氧化物酶基因家族。

图6 NtPOD1蛋白的三级结构预测
Fig.6 Prediction of tertiary structure of NtPOD1 protein
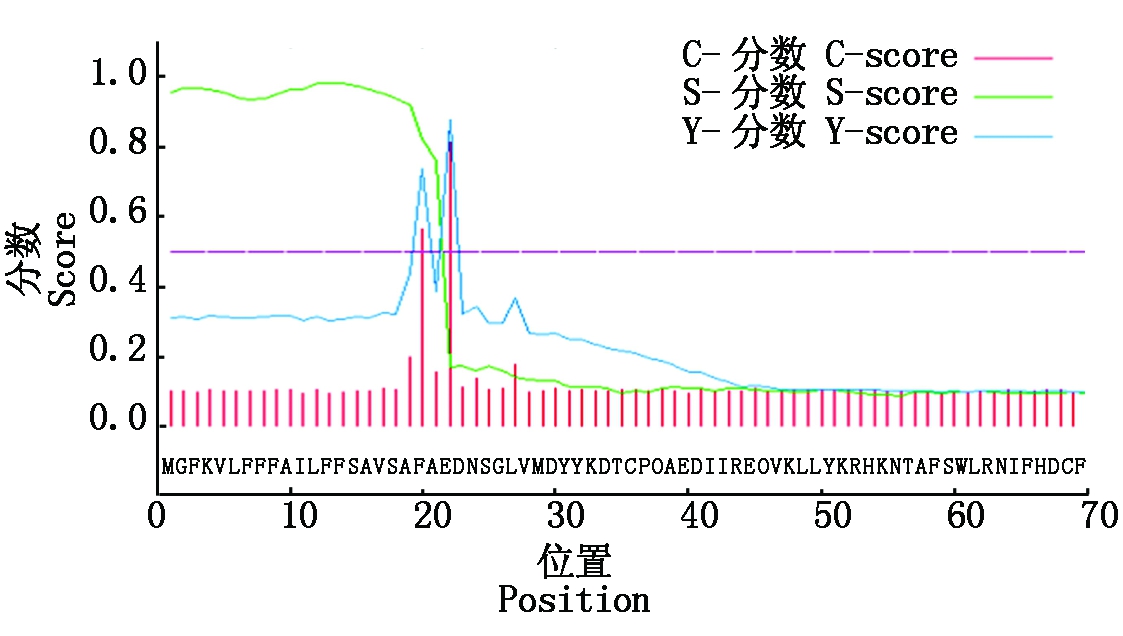
图7 NtPOD1的信号肽预测
Fig.7 Signal peptide prediction of NtPOD1
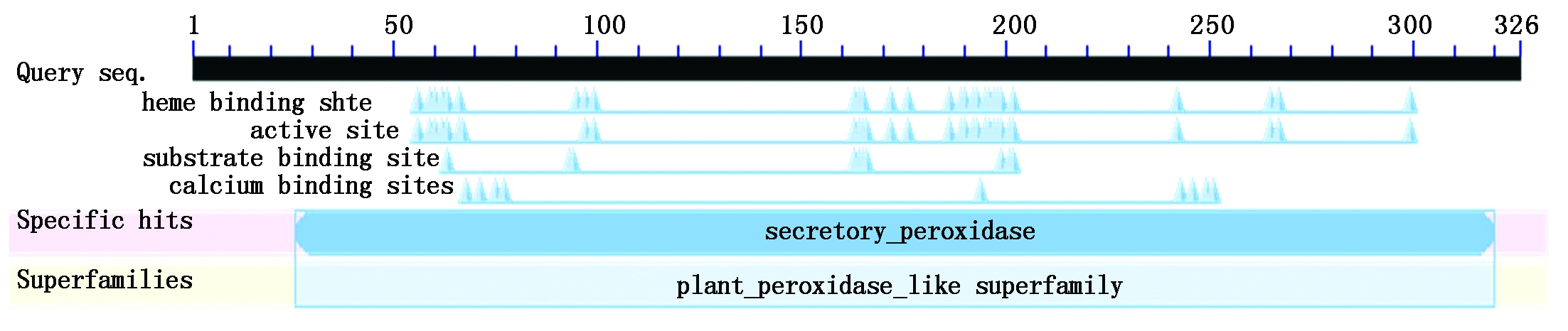
图8 NtPOD1的结构域分析
Fig.8 Structure domain analysis of NtPOD1
2.2.5 NtPOD1基因的同源性分析 在 NCBI 数据库中将NtPOD1编码的氨基酸序列进行 Blast 比对,然后构建系统进化树(图9),结果表明,NtPOD1与野生烟草(Nicotiana attenuata) POD42(XP_019240044.1)、美花烟草(Nicotiana sylvestris) POD42(XP_009779064.1)、马铃薯(Solanum tuberosum)POD42(XP_006348116.1)等具有较高的氨基酸序列同源性,分别为99%,99%,94%,与拟南芥(Arabidopsis thaliana)过氧化物酶ATP1a(CAA66862.1)的同源性最低,为81%。
同源性分析的结果表明,本研究所克隆的NtPOD1可能是烟草的过氧化物酶基因。
2.3 NtPOD1基因的组织表达分析
采用qPCR的方法分析了NtPOD1基因在根、茎、叶、花等组织的表达量,结果显示,NtPOD1在根、茎、叶、花中均有表达(图10),在叶中的表达量最高。叶中表达量分别是茎的1.1倍、根的1.5倍、花的28.5倍。说明,NtPOD1的表达不存在组织特异性。
NtPOD1基因在根、茎、叶及花中均有表达,暗示NtPOD1基因广泛参与了烟草的生长发育过程。
2.4 NtPOD1基因在非生物逆境胁迫下的表达分析
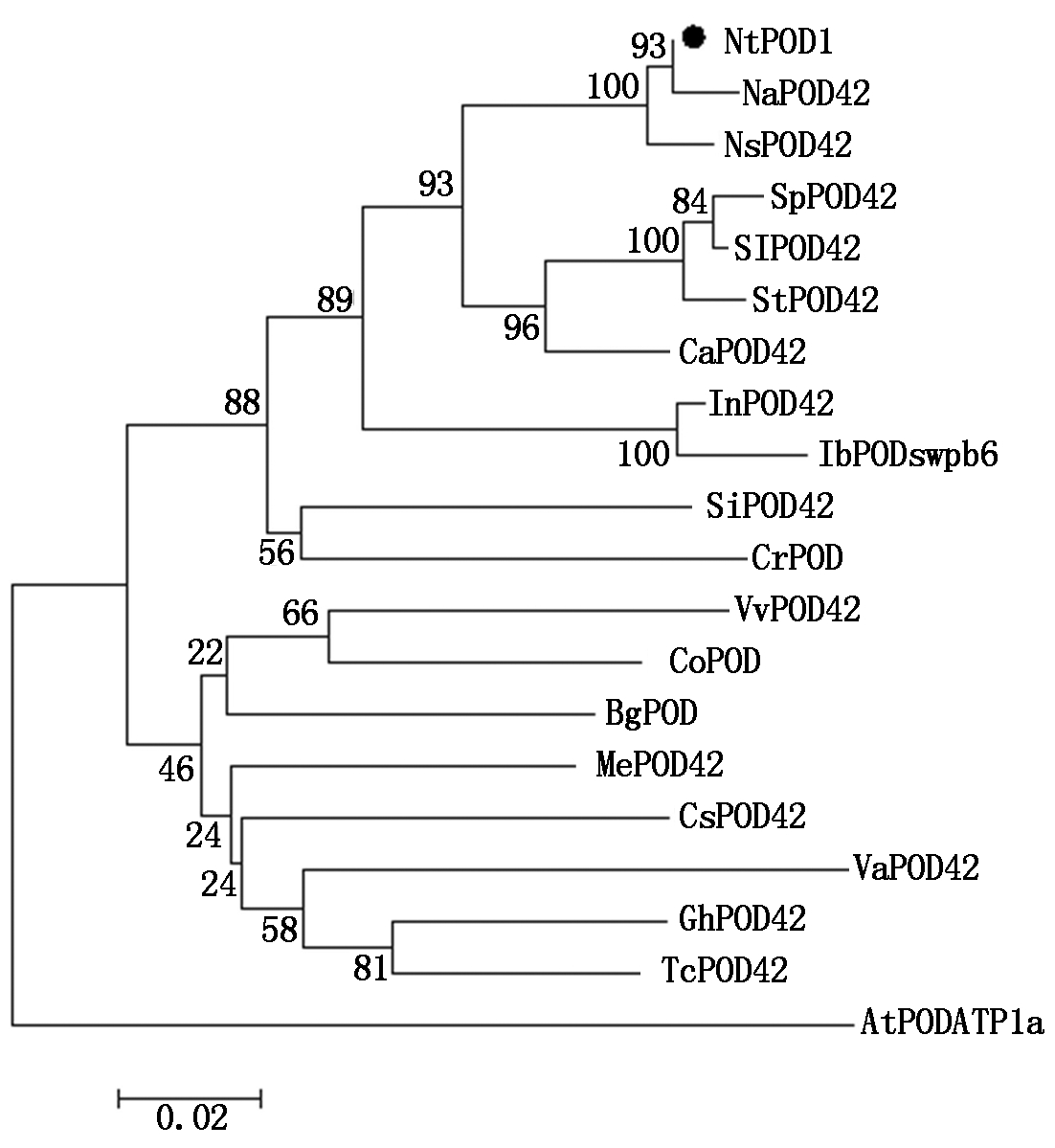
Na.野生烟草(XP_019240044.1);Ns.美花烟草(XP_009779064.1);St.马铃薯(XP_006348116.1);Sl.番茄(XP_004232712.1);Sp.潘那利番茄(XP_015066723.1);Ca.辣椒(XP_016560122.1);In.牵牛花(XP_019171850.1);Ib.红薯(AFY26877.1);Si.芝麻(XP_011096066.1);Cr.长春花(AAY26520.1);Gh.陆地棉(XP_016749469.1);Co.油菜(ACT21094.1);Tc.可可(XP_007026071.1);Me.木薯(XP_021587652.1);Bg.木榄(ADD54644.1);Va.红豆(XP_017406176.1);Cs.黄瓜(XP_004145112.1);Vv.葡萄(XP_002274769.1);At.拟南芥(CAA66862.1)。
Na.Nicotiana attenuata;Ns.Nicotiana sylvestris;St.Solanum tuberosum;Sl.Solanum lycopersicum;Sp.Solanum pennellii;Ca.Capsicum annuum;In.Ipomoea nil;Ib.Ipomoea batatas;Si.Sesamum indicum;Cr.Catharanthus roseus;Gh.Gossypium hirsutum;Co.Camellia oleifera;Tc.Theobroma cacao;Me.Manihot esculenta;Bg.Bruguiera gymnorhiza;Va.Vigna angularis;Cs.Cucumis sativus;Vv.Vitis vinifera;At.Arabidopsis thaliana.
图9 NtPOD1系统进化分析
Fig.9 Homology analysis of NtPOD1
为了探索NtPOD1是否参与烟草的非生物胁迫响应,对NtPOD1在低钾(10 μmol/L K+)、5% PEG-6000、10 mmol/L H2O2、200 mmol/L NaCl和1 μmol/L ABA处理后的表达量进行了分析,结果表明,5% PEG-6000和H2O2处理后,表达量上调,分别在24,12 h达到最大,分别为对照的2.79倍和5.52倍(图11)。200 mmol/L NaCl处理后,表达量下调,呈现先下降-升高-下降的趋势;1 μmol/L ABA和低钾处理后,表达量受到诱导,分别在24,12 h达到最大,分别为对照的3.53倍和3.67倍(图12)。试验表明,NtPOD1基因受非生物胁迫刺激诱导,说明NtPOD1基因可能在烟草的应激反应中发挥作用。

多重比较采用Duncan′s法,图中不同组织之间不同小写字母表示P<0.05差异显著。图11-12同。
Multiple comparisons using Duncan′s method,the figure in different lowercase letters between different organizations P <0.05 significant difference.The same as Fig.11-12.
图10 NtPOD1在不同组织中的相对表达量分析
Fig.10 Analysis of relative expression of NtPOD1 in different tissues
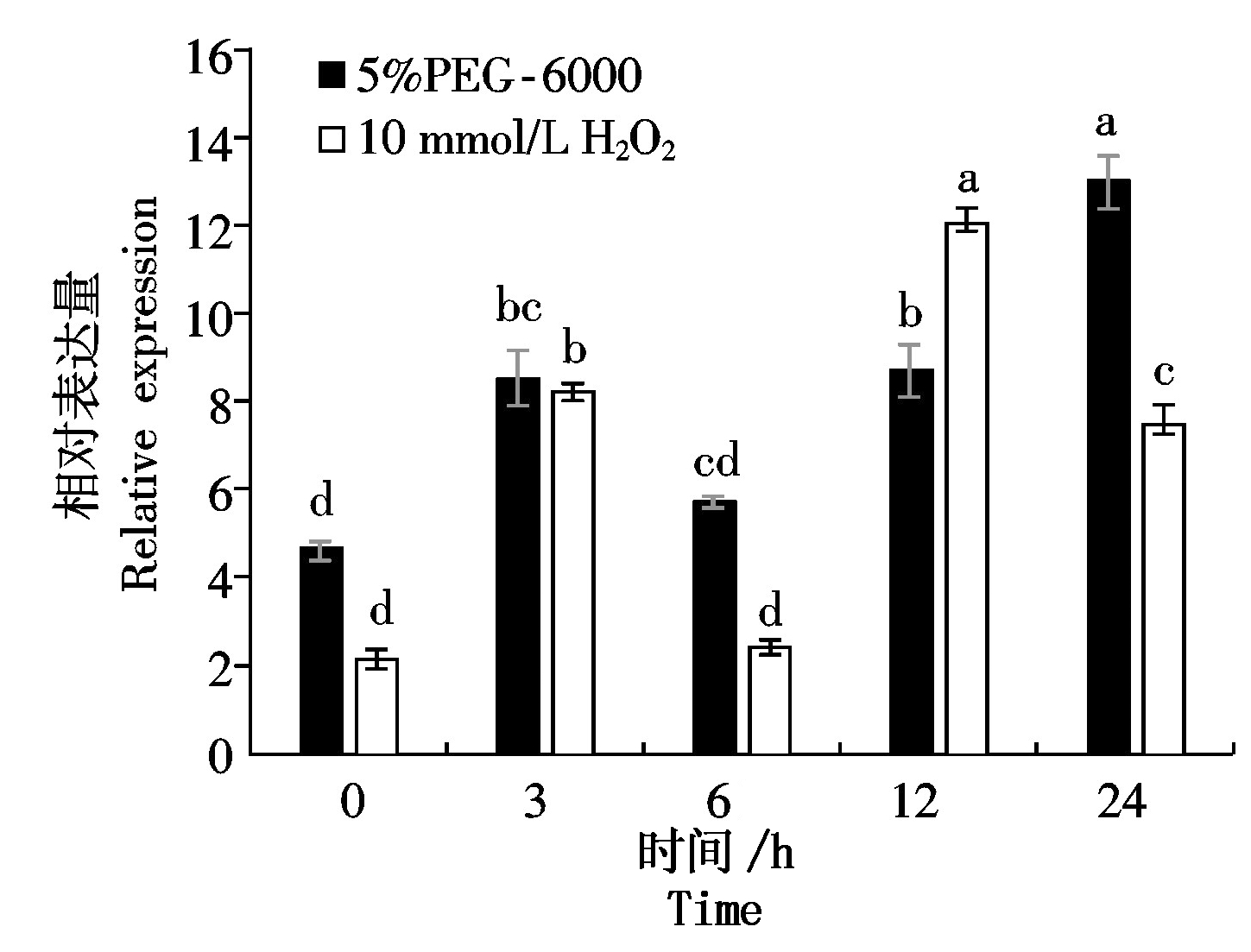
图11 NtPOD1在 5% PEG-6000和10 mmol/L H2O2处理下的相对表达量
Fig.11 Relative expression of NtPOD1 under 5% PEG-6000 and 10 mmol/L H2O2 treatment
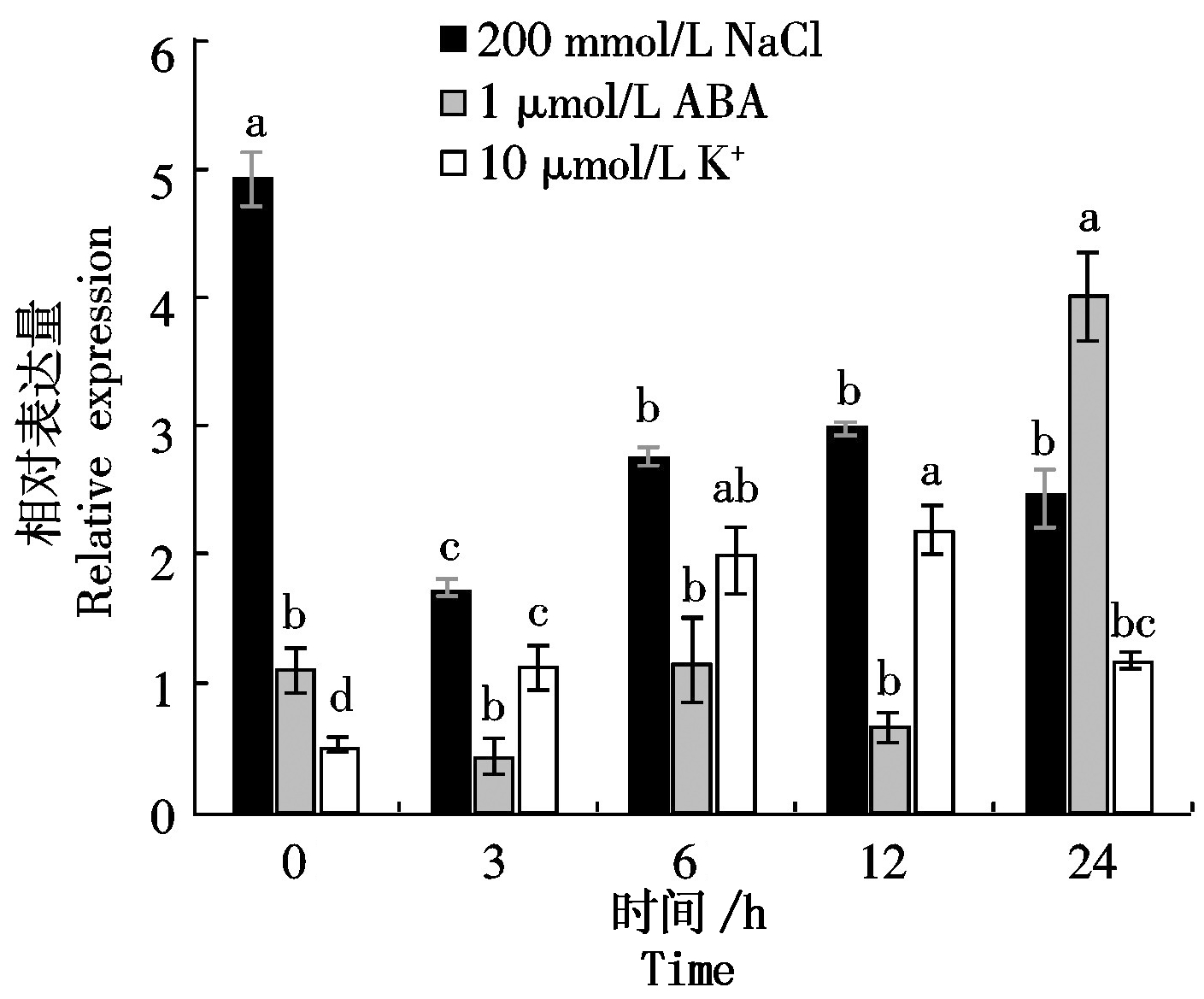
图12 NtPOD1在200 mmol/L NaCl、1 μmol/L ABA和10 μmol/L K+处理下的相对表达量
Fig.12 Relative expression of NtPOD1 under 200 mmol/L NaCl,1 μmol/L ABA and 10 μmol/L K+ treatment
3 讨论
过氧化物酶(POD)在植物正常生长和应激反应中发挥着重要作用,是植物重要的保护酶类,在高等植物中分布较为广泛。根据结构的不同可将过氧化物酶分为3类[24],Ⅰ类为胞内过氧化物酶,包括抗坏血酸-过氧化物酶(Ascorbic acid-peroxidase,APx)、细胞色素C-过氧化物酶(Cytochrome C-peroxidase,Ccp)等;Ⅱ类为胞外过氧化物酶,包括锰-过氧化物酶(Manganese-peroxidase,MnP)、木质素酶-过氧化物酶(Ligninase-peroxidase,LiP)等;Ⅲ类是分泌过氧化物酶(Secretory peroxidase),如辣根过氧化物酶(Horseradish peroxidase,HRP)。分泌过氧化物酶是植物血红素依赖性过氧化物酶,催化涉及过氧化氢作为电子受体的多步氧化反应,含有4个保守的二硫键和2个保守的钙结合位点[25]。
本研究从烤烟品种K326中克隆到一个cDNA序列,在 NCBI 数据库中进行 Blast 结果显示,该基因与渐窄叶烟草POD42、美花烟草POD42、马铃薯POD42等具有很高同源性,说明其可能是一个POD基因。该基因编码蛋白的功能结构域分析结果表明,该蛋白具有过氧化物酶完整的peroxidase-4保守结构域,包括血红结合位点、活性位点、底物结合位点、钙离子结合位点,还含有2个保守功能域。与闫师杰等[26]、郑雯等[27]、王海波等[10]、程华等[11]、罗秀云[20]等研究的结果一致,NtPOD1属于植物血红素依赖性过氧化物酶超家族的Ⅲ类的分泌氧化酶。在结构方面,NtPOD1蛋白二级结构以α-螺旋和无规则卷曲为主,与石榴的PgPOD[17]和小桐子的JcPOD73[10]结构相似。NtPOD1的亚细胞定位预测结果与Ren等[28]研究毛果杨的PtPRX6和PtPRX24定位结果相似。同源性、结构功能域与结构分析等均证明了NtPOD1属于植物血红素依赖性过氧化物酶超家族的Ⅲ类的分泌氧化酶。
NtPOD1在根、茎、叶、花中均有表达,与前人的研究结果相一致[10-11,18,20],说明POD基因的表达并没有组织特异性。但不同的POD基因在各个组织中的表达水平并不相同,如NtPOD1在叶中表达量最高,Ntpx基因在花中表达量最高[20],GbPOD1[11]和JcPOD73[10]在茎中表达量最高。此外,郭媖等[18]从陆地棉中克隆的2个相似性达99%的POD基因,在不同组织、不同生长阶段的表达亦有所不同。由此说明,作为多基因家族的POD基因,具有高度多型性及功能多样性的特点。
作为植物的重要保护酶类,POD基因在植物的胁迫响应中发挥着重要作用。研究表明,银杏GbPOD01基因在ABA及PEG胁迫下表达量下调[11],白杨PoPOD1基因在PEG胁迫下表达量下调[7]。甘蔗ScPOD02基因在ABA、PEG 及NaCl 胁迫下表达量上调[15],Ntpx基因在ABA和干旱胁迫下,表达量上调[20]。本研究结果表明,NtPOD1的表达同样受干旱、盐、H2O2、低钾和ABA处理诱导。其在ABA和PEG模拟干旱处理下的表达模式,与Ntpx基因相一致[20];NtPOD1在NaCl 胁迫下表达量下调,则与GbPOD01及PoPOD1基因的盐诱导表达相类似[7,11]。同时,NtPOD1基因受10 mmol/L H2O2和低钾(10 μmol/L K+)强烈诱导,上调表达。由此说明,NtPOD1基因参与了烟草低钾、干旱、盐、H2O2和ABA的胁迫响应,并可能在烟草的应激反应中发挥重要作用。
本研究克隆出了烟草过氧化物酶基因NtPOD1,其表达没有组织特异性。NtPOD1基因的表达受非生物胁迫的诱导,但其在烟草生长发育及胁迫响应中的具体作用,尚有待进一步研究。
参考文献:
[1] Tian G,Li H,Qiu W.Advances on research of plant peroxidases[J]. Journal of Wuhan Botanical Research,2001,19(4):332-344.
[2] 刘 莉,孙虹丽,程召阳,等. 砀山酥梨褐皮芽变果皮中木质素生物合成相关基因克隆与表达分析[J]. 华北农学报,2013,28(6):88-92.
[3] 夏时云,麦瑜玲,林书瀚,等. 红掌叶片离体培养过程中酶活性及可溶性蛋白质含量的变化[J]. 华北农学报,2007,22(6):195-198.
[4] 赵昶灵,王树会. 剪叶对云南烤烟漂浮苗抗氧化酶活性和根系形态建成的效应[J]. 云南农业大学学报,2014,29(1):84-92.
[5] 梁艳荣,胡晓红,张颍力,等. 植物过氧化物酶生理功能研究进展[J]. 内蒙古农业大学学报:自然科学版,2003,24(2):110-113.
[6] Valério L,De Meyer M,Penel C,et al. Expression analysis of the Arabidopsis peroxidase multigenic family[J]. Phytochemistry,2004,65(10):1331-1342.
[7] Bae E K,Lee H,Lee J S,et al. Molecular cloning of a peroxidase gene from poplar and its expression in response to stress[J]. Tree Physiology,2006,26(11):1405-1412.
[8] Tognolli M,Penel C,Greppin H,et al. Analysis and expression of the class Ⅲ peroxidase large gene family in Arabidopsis thaliana[J]. Gene,2002,288(1/2):129-138.
[9] Passardi F,Longet D,Penel C,et al. The class Ⅲ peroxidase multigenic family in rice and its evolution in land plants[J]. Phytochemistry,2004,65(13):1879-1893.
[10] 王海波,郭俊云,赵志军,等. 小桐子过氧化物酶73基因的克隆及表达分析[J]. 核农学报,2017,31(1):29-36.
[11] 程 华,李琳玲,王 燕,等. 银杏过氧化物酶基因POD1的克隆及表达分析[J]. 华北农学报,2010,25(6):44-51.
[12] 胡小文,姚艳丽,邢淑莲,等. 割手密过氧化物酶基因(SsPOD-1)cDNA克隆与功能分析[J]. 热带作物学报,2015,36(7):1290-1296.
[13] 莫俊杰,梁钾贤,胡汉桥,等. 芋头过氧化物酶基因克隆[J]. 广东农业科学,2016,43(9):37-43.
[14] 王林嵩,李小娟,李芳军,等. 萝卜过氧化物酶基因片段的cDNA克隆及花期表达谱分析[J]. 中国蔬菜,2009(6):14-20.
[15] 苏亚春,王竹青,李 竹,等. 甘蔗过氧化物酶基因ScPOD02的克隆与功能鉴定[J]. 作物学报,2017,43(4):510-521.
[16] 邓玉杰,余海洋,张 宇,等. 一个巴西橡胶树过氧化物酶基因克隆与生物信息学分析[J]. 热带农业工程,2014,38(4):1-8.
[17] 冯立娟,焦其庆,尹燕雷,等. 石榴果皮POD基因的克隆与序列分析[J]. 山东农业科学,2017,49(3):16-20.
[18] 郭 媖,郭旺珍,张天真. 两个陆地棉过氧化物酶cDNA的克隆和鉴定[J]. 作物学报,2007,33(6):891-897.
[19] 刘国顺. 烟草栽培学[M]. 北京:中国农业出版社,2003.
[20] 罗秀云. 烟草中Ntpx基因的克隆及表达特性研究[D]. 长沙:湖南农业大学,2015.
[21] 张雪薇,刘 仑,李立芹,等. 烟草NtCBL1基因的克隆,表达载体构建及表达分析[J]. 植物研究,2017,37(3):387-394.
[22] 鲁黎明,王林忠,杨铁钊,等. 烟草总RNA高效提取方法研究[J]. 分子植物育种,2006,4(S2):157-160.
[23] 卓 维,陈 倩,鲁黎明,等. 烟草NtCIPK2基因的克隆及表达分析[J]. 浙江农业学报,2017,29(10):1597-1604.
[24] Welinder K G. Superfamily of plant,fungal and bacterial peroxidases[J]. Current Opinion in Structural Biology,1992,2(3):388-393.
[25] 刘 稳. 植物过氧化物酶超家族的分子结构[J]. 生命科学,2002,14(4):212-214.
[26] 闫师杰,廉双秋,李晓丹,等. 鸭梨过氧化物酶基因全长克隆与序列分析[J]. 东北农业大学学报,2013,44(1):86-90.
[27] 郑 雯,张永丽,王家保,等. 荔枝果皮2个POD同源基因的生物信息学分析及酶活测定[J]. 热带作物学报,2011,32(3):437-442.
[28] Ren L L,Liu Y J,Liu H J,et al. Subcellular relocalization and positive selection play key roles in the retention of duplicate genes of populus class Ⅲ peroxidase family[J]. The Plant Cell,2014,26(6):2404-2419.