摘要:为探明外源H2S和H2O2对NaCl胁迫下加工番茄幼苗的生理调节作用,以耐盐性弱的KT-32和耐盐性强的KT-7这2个加工番茄品系为材料,采用盆栽法,设置0.5,1.5,3.0 mmol/L 3个H2O2浓度水平,研究50 μmol/L H2S 和H2O2共处理对250 mmol/L NaCl 胁迫下加工番茄幼苗的生长、渗透调节、物质积累和活性氧代谢的影响。结果表明,外源H2S 和H2O2共处理缓解了NaCl胁迫对加工番茄幼苗生长的抑制作用,使加工番茄幼苗仍保持较强的光合色素含量、较高的相对含水量和根系活力,降低了电解质渗出率、MDA含量、H2O2含量和![]() 产生速率,增强了加工番茄幼苗叶片中抗氧化酶SOD、POD和CAT活性,其中在2个品系中,50 μmol/L H2S和1.5 mmol/L H2O2共处理时可溶性糖分别比单独50 μmol/L H2S处理提高了24.0%和29.4%,脯氨酸含量分别提高了25.8%和21.3%,缓解盐胁迫效果最为显著。综上,外源H2S和H2O2之间存在着一定程度的协同作用,可以诱导增强NaCl胁迫下加工番茄幼苗植株渗透调节能力、提高清除活性氧的酶促系统的防御能力,从而减弱加工番茄细胞内活性氧自由基对质膜的伤害,进而提高加工番茄幼苗对盐胁迫的适应性。其结果可为探讨H2S 和H2O2 这2种信号分子协同作用、缓解加工番茄幼苗盐胁迫的生理机制提供理论依据。
产生速率,增强了加工番茄幼苗叶片中抗氧化酶SOD、POD和CAT活性,其中在2个品系中,50 μmol/L H2S和1.5 mmol/L H2O2共处理时可溶性糖分别比单独50 μmol/L H2S处理提高了24.0%和29.4%,脯氨酸含量分别提高了25.8%和21.3%,缓解盐胁迫效果最为显著。综上,外源H2S和H2O2之间存在着一定程度的协同作用,可以诱导增强NaCl胁迫下加工番茄幼苗植株渗透调节能力、提高清除活性氧的酶促系统的防御能力,从而减弱加工番茄细胞内活性氧自由基对质膜的伤害,进而提高加工番茄幼苗对盐胁迫的适应性。其结果可为探讨H2S 和H2O2 这2种信号分子协同作用、缓解加工番茄幼苗盐胁迫的生理机制提供理论依据。
关键词:H2O2;H2S;NaCl胁迫;加工番茄幼苗
盐胁迫是农业生产的限制因子之一,主要通过破坏清除活性氧(ROS)的酶促系统,使得活性氧![]() 含量增加,导致细胞产生氧化胁迫和膜系统损伤及代谢紊乱[1],使叶绿素降解、根系活力下降、核酸断裂及蛋白质变性,脯氨酸和丙二醛含量增加,抑制植物的生长,严重时引起植物细胞死亡[2]。新疆是我国加工番茄主要产区,其总产量占全国加工番茄产量的90%以上[3],但新疆现有耕地由于丰富的含盐母质和滴灌农业的发展等原因,盐碱土壤面积不断扩大,严重影响了加工番茄(Solanum lycopersicum)的种植;改善土壤母质和提高加工番茄的耐盐性仍然是当前新疆红色番茄产业待解决的一个核心问题。硫化氢(H2S)作为一种内源气体信号分子,在调节植物生长发育和缓解植物逆境胁迫方面发挥着重要作用;近年来大量研究表明,一定浓度的外源H2S能促进植物种子萌发、调控根的发育和侧根的形成[4-5]、调节气孔运动[6]和增强光能利用率[7]、提高盐胁迫下加工番茄幼苗的生物量、降低电解质渗出率和丙二醛含量,增加盐胁迫下加工番茄幼苗叶片中 SOD、POD、CAT 的活性[8],从而缓解盐胁迫对植物的伤害。过氧化氢(Hydrogen peroxide,H2O2)是细胞代谢过程中产生的一种具有毒害作用的活性氧[9],但近年来研究表明,H2O2作为一种信号分子广泛参与植物生长发育的调控[10],及对各种逆境胁迫的应答过程[11-12];H2O2预处理能够打破种子休眠,促进种子萌发,提高抗氧化酶活性,降低膜脂过氧化程度,缓解叶绿体膜的伤害,从而增强黄瓜(Cucumis sativus ) [13]、燕麦(Avena sativa ) [14]和玉米(Zea mays) [15]幼苗的耐盐性。此外,H2O2作为第二信使在细胞程序性死亡[16]、配体与受体的相互作用、酶的激活、基因的表达和诱导植物抗病性等过程中发挥着重要作用[17]。但在植物中H2S和H2O2这2种信号分子之间的相互作用与植物抗盐性之间的关系目前尚不了解,也未见有外源H2S和H2O2对加工番茄幼苗盐胁迫生理影响的报道。
含量增加,导致细胞产生氧化胁迫和膜系统损伤及代谢紊乱[1],使叶绿素降解、根系活力下降、核酸断裂及蛋白质变性,脯氨酸和丙二醛含量增加,抑制植物的生长,严重时引起植物细胞死亡[2]。新疆是我国加工番茄主要产区,其总产量占全国加工番茄产量的90%以上[3],但新疆现有耕地由于丰富的含盐母质和滴灌农业的发展等原因,盐碱土壤面积不断扩大,严重影响了加工番茄(Solanum lycopersicum)的种植;改善土壤母质和提高加工番茄的耐盐性仍然是当前新疆红色番茄产业待解决的一个核心问题。硫化氢(H2S)作为一种内源气体信号分子,在调节植物生长发育和缓解植物逆境胁迫方面发挥着重要作用;近年来大量研究表明,一定浓度的外源H2S能促进植物种子萌发、调控根的发育和侧根的形成[4-5]、调节气孔运动[6]和增强光能利用率[7]、提高盐胁迫下加工番茄幼苗的生物量、降低电解质渗出率和丙二醛含量,增加盐胁迫下加工番茄幼苗叶片中 SOD、POD、CAT 的活性[8],从而缓解盐胁迫对植物的伤害。过氧化氢(Hydrogen peroxide,H2O2)是细胞代谢过程中产生的一种具有毒害作用的活性氧[9],但近年来研究表明,H2O2作为一种信号分子广泛参与植物生长发育的调控[10],及对各种逆境胁迫的应答过程[11-12];H2O2预处理能够打破种子休眠,促进种子萌发,提高抗氧化酶活性,降低膜脂过氧化程度,缓解叶绿体膜的伤害,从而增强黄瓜(Cucumis sativus ) [13]、燕麦(Avena sativa ) [14]和玉米(Zea mays) [15]幼苗的耐盐性。此外,H2O2作为第二信使在细胞程序性死亡[16]、配体与受体的相互作用、酶的激活、基因的表达和诱导植物抗病性等过程中发挥着重要作用[17]。但在植物中H2S和H2O2这2种信号分子之间的相互作用与植物抗盐性之间的关系目前尚不了解,也未见有外源H2S和H2O2对加工番茄幼苗盐胁迫生理影响的报道。
本研究以耐盐性不同的加工番茄品系为试验材料,在NaCl胁迫下喷施外源H2S和H2O2溶液,通过加工番茄幼苗生长、渗透调节、物质积累和活性氧代谢的变化,探讨这2种信号分子缓解盐胁迫生理机制的调节作用,为提高加工番茄的耐盐性提供理论依据。
耐盐性弱的 KT-32和耐盐性强的KT-7这2个加工番茄品系,外源H2S溶液用NaHS进行配制。
1.2.1 试验设计 于2017年5-7月在石河子大学农学院试验站进行试验。5月10号,选取籽粒饱满、大小均匀、无病虫害的加工番茄品系种子,用10%高锰酸钾溶液消毒10 min,蒸馏水冲洗4次,然后将KT-32和KT-7这2个品系做好标记,分别放在垫有滤纸的培养皿内催芽。当2个品系种子大约80%露白后,于5月12日播种在以蛭石为主要基质的育苗盘中,待子叶展平时,用Hoagland营养液浇灌。当幼苗长至三叶一心时选取长势整齐一致的幼苗移栽于以蛭石为主要基质的营养钵中继续培养,当番茄幼苗四叶一心时进行不同处理,其中,NaCl处理直接溶于Hoagland 营养液中进行根部浇灌,H2S和H2O2以叶片喷施方式,每天9:00左右喷施50 μmol/L H2S(NaHS),下午18:30左右喷施 H2O2溶液。
试验设置6个处理,每个处理3个重复,处理5 d后测定相关生理指标。
①Hoagland +蒸馏水(CK);②Hoagland+250 mmol/L NaCl(NaCl);③Hoagland+250 mmol/L NaCl+叶面喷施 50 μmol/L H2S(H2S);④Hoagland+250 mmol/L NaCl+叶面喷施50 μmol/L NaHS+0.5 mmol/L H2O2溶液 (T1);⑤Hoagland+250 mmol/L NaCl+叶面喷施50 μmol/L NaHS+1.5 mmol/L H2O2溶液(T2);⑥Hoagland+250 mmol/L NaCl+叶面喷施50 μmol/L NaHS+3.0 mmol/L H2O2溶液(T3)。
1.2.2 生理指标及测定方法 处理5 d后分别测量加工番茄幼苗株高、茎粗、地上部和地下部鲜干质量;叶片相对含水量测定采用称重法[18];叶绿素含量采用高俊凤[19]方法进行测定;根系活力采用氯化三苯基四氮唑(TTC)法测定[20];植物膜透性的测定采用电解质外渗法[20];可溶性糖含量和脯氨酸含量测定采用李合生[21]方法。加工番茄幼苗叶片中MDA含量![]() 产生速率和H2O2含量根据高俊凤[19]方法测定;SOD、POD、CAT 保护酶活性测定参照Qiu等[22]的方法进行。
产生速率和H2O2含量根据高俊凤[19]方法测定;SOD、POD、CAT 保护酶活性测定参照Qiu等[22]的方法进行。
试验数据均由3次重复来计算平均值和标准误差,用于相关计算和处理,数据统计分析采用Microsoft Excel 2010进行原始数据处理,选用SPSS 19.0数据处理系统(Statistical product and service solutions)进行方差分析,并运用Duncan′s法进行差异显著性检验,以平均值±标准误(Means±SD)表示,用SigmaPlot 12.5作相应图表。
从表1可以看出,与CK相比,2个加工番茄品系幼苗在NaCl胁迫下植株苗干质量和根干质量显著降低,并且显著抑制了2个加工番茄品系的生长;H2S处理后,2个品系幼苗的茎粗、苗鲜质量、根鲜质量、苗干质量和根干质量比NaCl胁迫下都有着不同程度的增加,其中在KT-7 中,株高、茎粗和根鲜质量达到显著差异 (P<0.05);在T1、T2和T3处理中,2个品系幼苗形态指标与NaCl胁迫相比在T1和T2处理中有着显著性的差异,茎粗和根鲜质量在T3处理中也有着显著性差异,且在KT-32 中,T1、T2和T3处理下株高与H2S处理相比差异达到显著水平。从总体来看,在T2处理下幼苗生长的各项形态指标除KT-32的苗干质量外,其余都与H2S处理相比有着不同程度的增加;说明NaCl胁迫显著抑制了加工番茄幼苗的正常生长,而外源H2S和H2O2共同处理能有效缓解NaCl胁迫对加工番茄幼苗造成的伤害,并在T2处理下缓解效应达到最佳。
表1 H2S和H2O2对NaCl胁迫下加工番茄幼苗形态指标的影响
Tab.1 Effect of exogenous H2S and H2O2 on the growth characteristics of processing tomato seedlings under NaCl stress
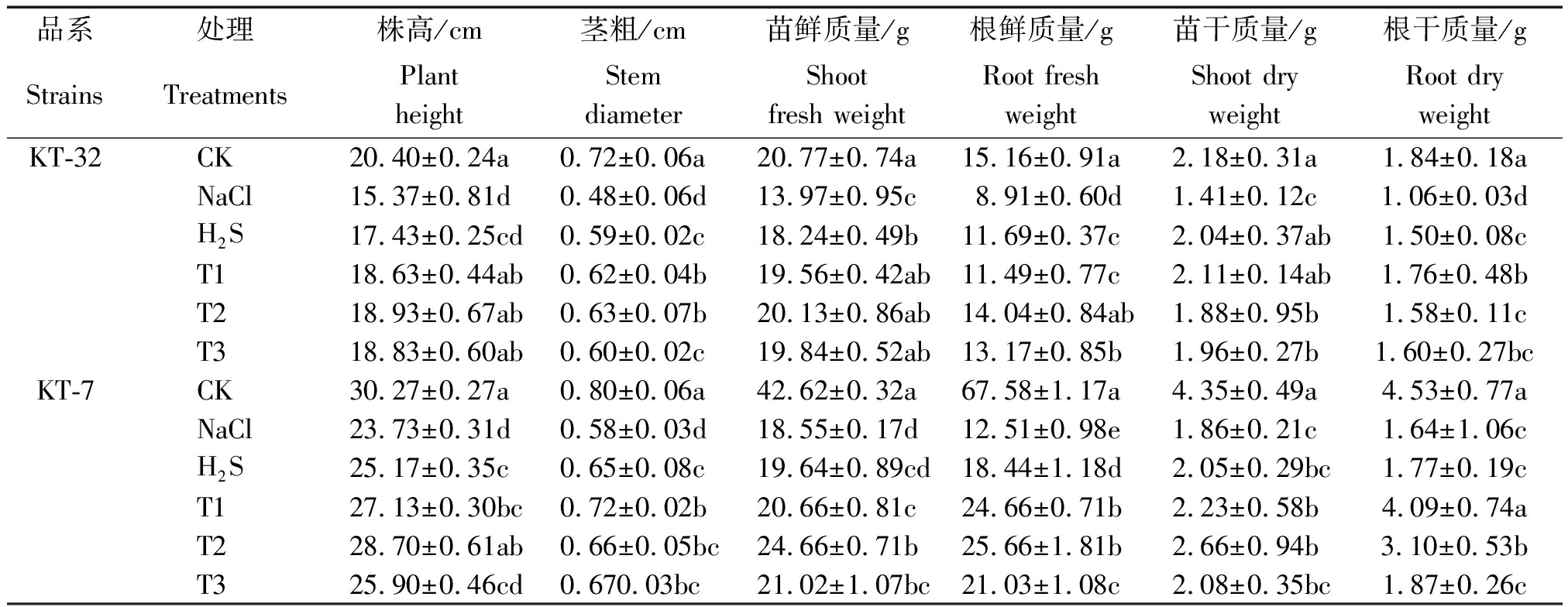
品系处理株高/cm茎粗/cm苗鲜质量/g根鲜质量/g苗干质量/g根干质量/gStrainsTreatmentsPlantheightStemdiameterShootfresh weightRoot freshweightShoot dryweightRoot dryweightKT-32CK20.40±0.24a0.72±0.06a20.77±0.74a15.16±0.91a2.18±0.31a1.84±0.18aNaCl15.37±0.81d0.48±0.06d13.97±0.95c8.91±0.60d1.41±0.12c1.06±0.03dH2S17.43±0.25cd0.59±0.02c18.24±0.49b11.69±0.37c2.04±0.37ab1.50±0.08cT118.63±0.44ab0.62±0.04b19.56±0.42ab11.49±0.77c2.11±0.14ab1.76±0.48bT218.93±0.67ab0.63±0.07b20.13±0.86ab14.04±0.84ab1.88±0.95b1.58±0.11cT318.83±0.60ab0.60±0.02c19.84±0.52ab13.17±0.85b1.96±0.27b1.60±0.27bcKT-7CK30.27±0.27a0.80±0.06a42.62±0.32a67.58±1.17a4.35±0.49a4.53±0.77aNaCl23.73±0.31d0.58±0.03d18.55±0.17d12.51±0.98e1.86±0.21c1.64±1.06cH2S25.17±0.35c0.65±0.08c19.64±0.89cd18.44±1.18d2.05±0.29bc1.77±0.19cT127.13±0.30bc0.72±0.02b20.66±0.81c24.66±0.71b2.23±0.58b4.09±0.74aT228.70±0.61ab0.66±0.05bc24.66±0.71b25.66±1.81b2.66±0.94b3.10±0.53bT325.90±0.46cd0.670.03bc21.02±1.07bc21.03±1.08c2.08±0.35bc1.87±0.26c
注:同列数据后不同小写字母表示不同处理间差异达到0.05的显著性水平。表2同。
Note:Different small letters in the figure mean significant difference among treatment at 0.05 level.The same as Tab.2.
由表 2可知,与CK相比,NaCl胁迫显著降低了2个加工番茄品系的光合色素含量,在叶面喷施H2S溶液后,光合色素含量比NaCl胁迫有着显著性增加(P<0.05)。用不同浓度H2O2溶液处理后,T2和T3处理中2个加工番茄品系的光合色素含量比H2S单独处理提升效果更为明显;除叶绿素b含量外,其余光合色素含量均在 T2 处理下光合色素含量差异达到显著水平;其中在KT-32中叶绿素 a、b、a+b、类胡萝卜素含量比H2S单独处理分别提升了27.5%,82.4%,53.8%和16.6%;在KT-7中,叶绿素 a、b、a+b、类胡萝卜素含量比H2S单独处理分别提升了34.4%,33.0%,34.1%和16.2%;在KT-32品系中,叶绿素 a、a+b含量在T1和T2处理下与T3处理相比差异达到显著水平,而T1处理和T2处理相比差异不显著;在KT-7品系中,光合色素含量在T1处理下与T2和T3处理相比差异均达到显著水平,而T2处理和T3处理相比差异不显著;就T2和T3处理相比,光合色素的含量并不随着H2O2浓度的增大而增加,说明一定浓度的外源H2S和H2O2共同处理能够缓解加工番茄幼苗因NaCl胁迫而引起的光合色素下降。
由图1-A可知,NaCl胁迫显著降低了加工番茄幼苗叶片相对含水量,H2S处理后,相对含水量有所增加,但与NaCl胁迫相比差异不显著;在KT-32品系中,T1、T2和T3处理叶片中相对含水量与单独H2S处理相比显著提高,差异达到显著水平(P<0.05),但不同浓度H2O2处理间差异不显著;在KT-7品系中,叶面喷施外源H2S和不同浓度H2O2处理后叶片中相对含水量都有着不同程度的增加,H2O2各处理与NaCl胁迫相比差异都达到显著水平,相对含水量基本接近CK,而T1、T2和T3处理与H2S处理相比差异不显著。
表2 外源H2S和H2O2对NaCl胁迫下加工番茄幼苗光合色素的影响
Tab.2 Effect of exogenous H2S and H2O2 on photosynthetic pigment of processing tomato seedlings under NaCl stress
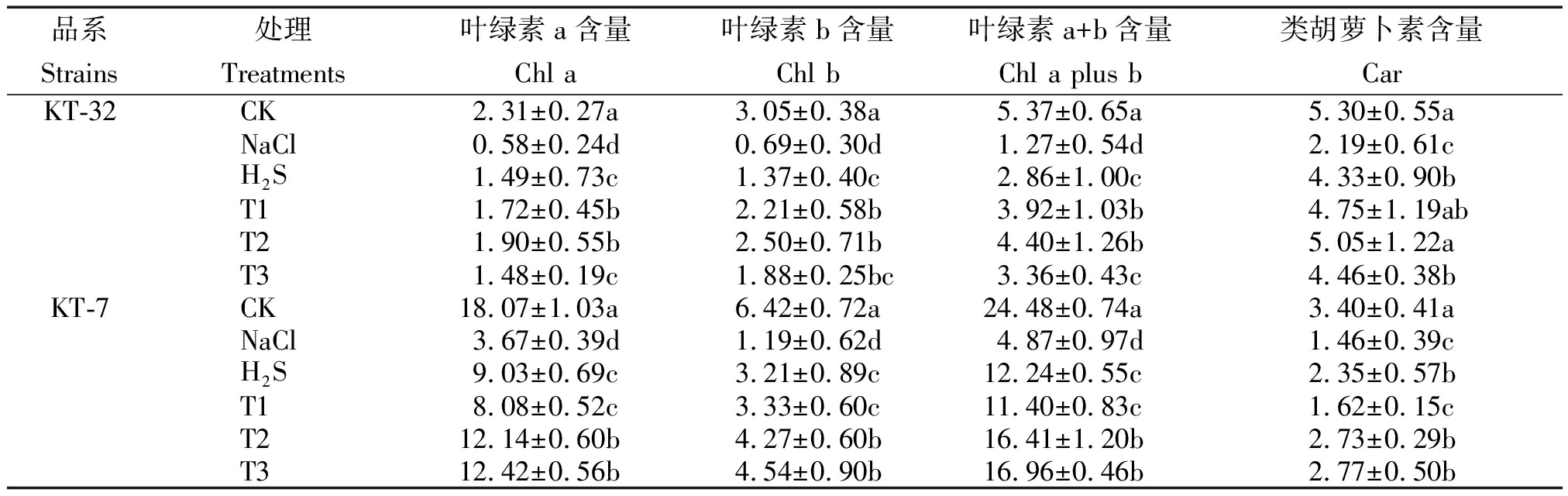
品系处理叶绿素a含量叶绿素b含量叶绿素a+b含量类胡萝卜素含量StrainsTreatmentsChl aChl bChl a plus bCarKT-32CK2.31±0.27a3.05±0.38a5.37±0.65a5.30±0.55aNaCl0.58±0.24d0.69±0.30d1.27±0.54d2.19±0.61cH2S1.49±0.73c1.37±0.40c2.86±1.00c4.33±0.90bT11.72±0.45b2.21±0.58b3.92±1.03b4.75±1.19abT21.90±0.55b2.50±0.71b4.40±1.26b5.05±1.22aT31.48±0.19c1.88±0.25bc3.36±0.43c4.46±0.38bKT-7CK18.07±1.03a6.42±0.72a24.48±0.74a3.40±0.41aNaCl3.67±0.39d1.19±0.62d4.87±0.97d1.46±0.39cH2S9.03±0.69c3.21±0.89c12.24±0.55c2.35±0.57bT18.08±0.52c3.33±0.60c11.40±0.83c1.62±0.15cT212.14±0.60b4.27±0.60b16.41±1.20b2.73±0.29bT312.42±0.56b4.54±0.90b16.96±0.46b2.77±0.50b
由图1-B可知,NaCl胁迫显著抑制了加工番茄幼苗根系活力,当在叶面喷施H2S溶液处理后显著增强了加工番茄幼苗的根系活力,与NaCl胁迫相比达到差异显著;T1、T2和T3处理与H2S处理相比显著增强了加工番茄幼苗的根系活力,且2个品系均在T2处理下差异达到显著水平,T1、T2和T3各处理间存在一定的差异性;说明外源H2S和H2O2共用可以显著缓解因NaCl胁迫引起的相对含水量和根系活力下降,且呈现一定的浓度效应,2个品系幼苗均在T2处理下缓解效果达到最佳。
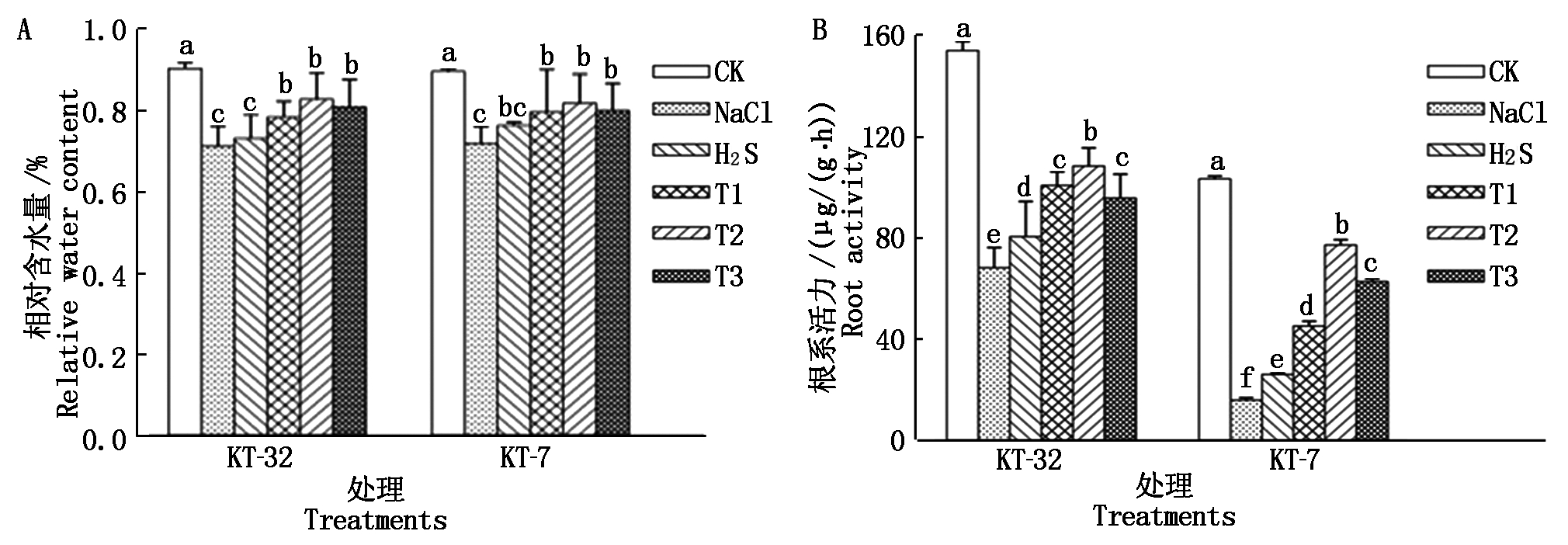
图中不同小写字母表示处理间差异达0.05显著水平。图2-4同。
Different small letters in the figure mean significant difference among treatment at 0.05 level. The same as Fig.2-4.
图1 外源H2S和H2O2 对NaCl胁迫下加工番茄幼苗叶片相对含水量和根系活力的影响
Fig.1 Effect of exogenous H2S and H2O2 on relative water content and root activity of processing tomato seedlings under NaCl stress
如图2-A所示,同CK相比,NaCl胁迫使2个品系加工番茄幼苗叶片的可溶性糖含量显著增加(P<0.05);叶面喷施H2S处理后明显提升了加工番茄幼苗叶片的可溶性糖含量,与NaCl胁迫相比达到显著差异;在KT-32品系中,T1和T2处理显著提升了NaCl胁迫下番茄叶片的可溶性糖含量;在KT-7品系中,与H2S处理相比,T2处理显著促进了NaCl胁迫引起的叶片中可溶性糖累积的效应,同时外源H2O2各处理间达到显著差异;T2处理下2个品系中加工番茄幼苗叶片可溶性糖量较H2S处理有所提升,提升幅度分别为24.0%和29.4%,差异达到显著水平。
由图2-B可知,同CK相比,NaCl胁迫下加工番茄幼苗叶片中脯氨酸含量显著增加;H2S处理后,在KT-32和KT-7品系中脯氨酸含量较NaCl处理分别提高了18.1%和26.8%,达到显著差异;在KT-32的T1、T2和KT-7的T2、T3处理后,2个品系中加工番茄幼苗叶片脯氨酸含量较H2S处理有所提升,且在T2处理下脯氨酸含量分别提高了25.8%和21.3%,差异达到显著水平。
由图3-A可知NaCl胁迫使加工番茄幼苗电解质渗出率显著升高;与NaCl胁迫相比,单独H2S处理可使2个品系加工番茄幼苗电解质渗出率显著降低;T1、T2和T3处理后,均使幼苗电解质渗出率下降,其中T2处理与H2S处理相比,差异达到显著水平,下降效果最为明显,说明外源H2S和H2O2共用可以有效缓解NaCl胁迫对细胞膜透性造成的破坏。
由图3-B、C可知,NaCl胁迫显著增加了加工番茄幼苗叶片中MDA含量和![]() 的产生速率,在KT-32品系中,MDA含量和
的产生速率,在KT-32品系中,MDA含量和![]() 分别比CK增加了3.3,4.0倍;在KT-7品系中,分别比CK增加了1.4倍和83.4%;与NaCl胁迫相比,H2S处理下MDA含量和
分别比CK增加了3.3,4.0倍;在KT-7品系中,分别比CK增加了1.4倍和83.4%;与NaCl胁迫相比,H2S处理下MDA含量和![]() 的产生速率都有所下降,但在T1、T2处理后,MDA含量及H2O2和
的产生速率都有所下降,但在T1、T2处理后,MDA含量及H2O2和![]() 产生速率下降效果更为明显,且在T2处理下,MDA含量与H2S处理相比差异达到显著水平(P<0.05),缓解效果最佳;在KT-32品系中,MDA含量和
产生速率下降效果更为明显,且在T2处理下,MDA含量与H2S处理相比差异达到显著水平(P<0.05),缓解效果最佳;在KT-32品系中,MDA含量和![]() 产生速率分别下降了56.2%,55.1%;在KT-7品系中,MDA含量和
产生速率分别下降了56.2%,55.1%;在KT-7品系中,MDA含量和![]() 产生速率分别下降了52.4%,37.2%。
产生速率分别下降了52.4%,37.2%。
由图3-D可知,与CK相比,NaCl胁迫显著提高了加工番茄幼苗叶片中内源H2O2的含量,在KT-32和KT-7品系中,NaCl胁迫下内源H2O2的含量分别比CK增加了4.5,2.6倍。T1、T2和T3处理与NaCl胁迫相比,显著降低了加工番茄幼苗叶片内源H2O2的含量,在T2处理下,与NaCl胁迫相比,两品系中内源H2O2含量分别下降了34.5%,29.7%,T1、T2和T3处理与H2S处理相比,2个品系幼苗叶片内源H2O2的含量有所提升,但内源H2O2的含量始终比NaCl胁迫下低;且在T2处理下2个品系加工番茄幼苗叶片内源H2O2的含量与H2S处理比较相近,由此可以得知,外源H2S和H2O2处理降低了加工番茄幼苗叶片内源H2O2的含量。
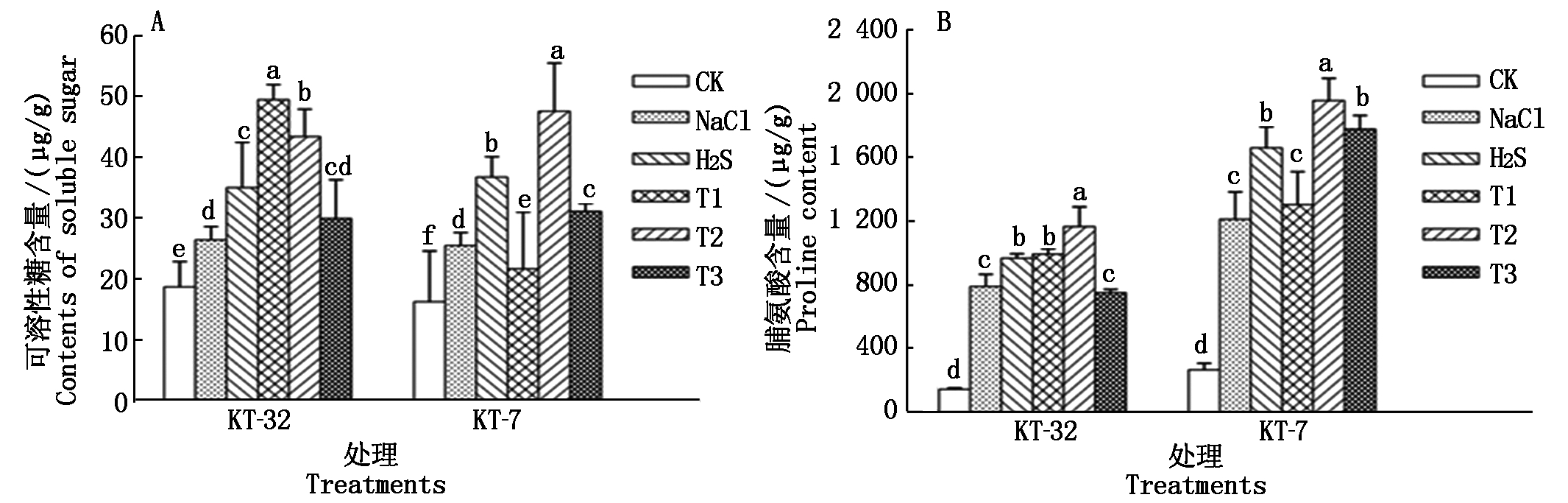
图2 外源H2S和H2O2对NaCl胁迫下加工番茄幼苗可溶性糖含量和脯氨酸含量的影响
Fig.2 Effect of exogenous H2S and H2O2 soluble sugar content and free proline accumulation of processing tomato seedlings under NaCl stress

图3 外源H2S和H2O2对NaCl胁迫下加工番茄幼苗电解质渗出率、MDA和内源H2O2含量以及![]() 产生速率的影响
产生速率的影响
Fig.3 Effect of exogenous H2S and H2O2 on electrolytic leakage,MDA and endogenous H2O2 content and ![]() produces the rate of processing tomato seedlings under NaCl stress
produces the rate of processing tomato seedlings under NaCl stress
由图4可知,在KT-32和KT-7品系中,同CK相比,NaCl胁迫处理可使加工番茄幼苗叶片中SOD、POD和CAT 3种抗氧化酶的活性显著下降(P<0.05);加工番茄幼苗用H2S处理后,幼苗叶片中3种抗氧化酶的活性都有所增强,且与NaCl胁迫相比差异达到显著水平;用外源50 μmol/L H2S和不同浓度H2O2处理后,在KT-32品系中,T2处理与H2S处理相比加工番茄幼苗叶片中SOD和POD这2种抗氧化酶的活性均达到显著差异,CAT未达显著差异,T3处理下3种抗氧化酶的活性均达到显著差异水平;在KT-7品系中,T2处理下加工番茄幼苗叶片中SOD、POD和CAT的活性与单独H2S处理相比分别提高了34.3%,20.0%,60.1%,均达到显著差异。这表明外源H2S和H2O2共同处理可有效缓解加工番茄幼苗因NaCl胁迫引起的抗氧化酶的活性下降,减少了活性氧物质的累积,从而降低加工番茄细胞内活性氧自由基对质膜的伤害,减轻了NaCl胁迫对加工番茄幼苗的伤害。
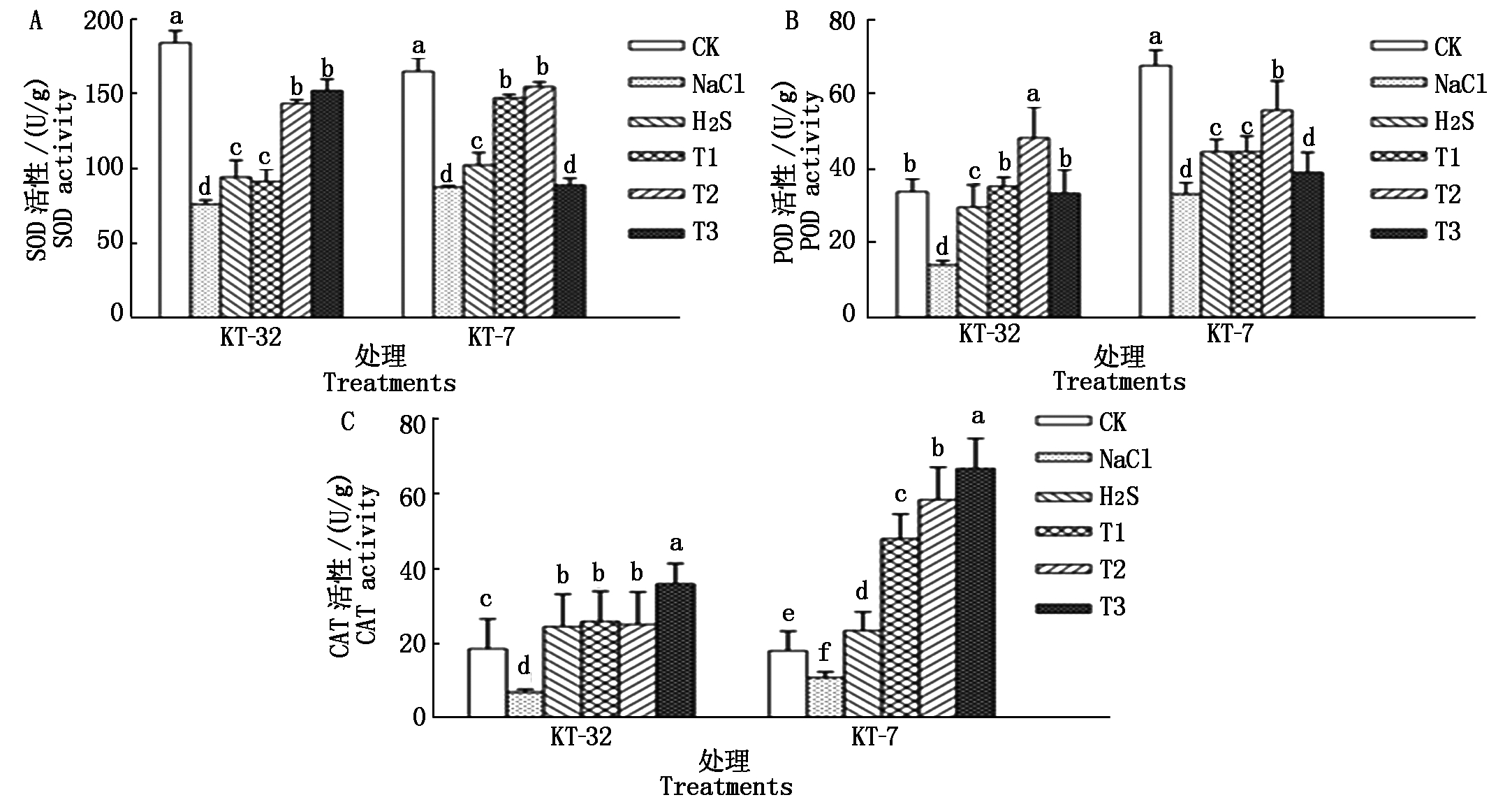
图4 外源H2S和H2O2对NaCl胁迫下加工番茄幼苗抗氧化酶活性的影响
Fig.4 Effect of exogenous H2S and H2O2 on electrolytic autioxidant enzyme activities of processing tomato seedlings under NaCl stress
外源H2S和H2O2二者作为信号分子在植物受到环境胁迫时各自对植物生长发育的影响成为当今农业科学的研究热点,但H2S和H2O2这2种信号分子之间的相互作用与植物抗盐性之间的关系目前还未见有相关报道。在新疆这种特殊的盐碱地条件下,研究外源H2S和H2O2对NaCl胁迫下加工番茄幼苗生理特性影响,可以给当前新疆红色番茄产业的发展提供一定的理论依据,从而促进加工番茄产业的发展。
从本试验数据分析结果来看,NaCl胁迫显著抑制了加工番茄幼苗的生长,外源施加H2S处理后不但显著提高了NaCl胁迫下加工番茄幼苗、茎粗、根鲜质量和光合色素含量,而且增强了其根系活力,这与郑州元等[8]、景举伟等[23]在加工番茄(Lycopersicon esculentum)幼苗上的结论一致,叶面喷施外源H2O2溶液后(T1、T2和T3处理)有效缓解了NaCl胁迫对加工番茄幼苗生长的抑制作用,这与外源H2O2能够缓解受旱小麦(Triticum aestivum )[24]生长受抑的结果一致,且缓解效果比H2S处理明显;说明外源H2S和 H2O2共用能有效缓解NaCl胁迫对加工番茄幼苗生长的抑制作用,从而提高加工番茄幼苗的耐盐性。
本试验分析结果表明,NaCl胁迫下2个品系加工番茄幼苗中游离脯氨酸和可溶性糖的含量明显增加,H2S处理后幼苗叶片中游离脯氨酸和可溶性糖的含量显著增加,这与郑州元等[8]在加工番茄(Lycopersicon esculentum)幼苗上的研究结果一致;T2处理后游离脯氨酸提升效果比H2S处理下更为明显,且进一步提升了2个品系加工番茄幼苗叶片内可溶性糖的含量,即当H2O2浓度为1.5 mmol/L时,提升效果最为明显,差异达到显著水平,这与外源过氧化氢提高燕麦(Avena sativa)耐盐性刘建新等[14]的结果一致;说明外源H2S和H2O2相互作用可以通过对加工番茄幼苗叶片内游离脯氨酸和可溶性糖的提升来增强幼苗的渗透调节能力,有效缓解NaCl胁迫对细胞膜透性造成的破坏,从而增强加工番茄的抗逆性。
本研究表明,在NaCl胁迫下,植物叶片中电解质渗出率、MDA和内源H2O2含量以及![]() 产生速率显著升高,抗氧化酶SOD、POD和CAT活性显著降低,这与何庆元等[25]在盐胁迫下大豆(Soybean )上的研究结果一致,说明NaCl胁迫破坏了加工番茄清除活性氧的酶促系统;外施H2S和H2O2处理后显著增强了NaCl胁迫下加工番茄幼苗叶片中抗氧化酶SOD、POD和CAT活性,降低了MDA和内源H2O2含量以及
产生速率显著升高,抗氧化酶SOD、POD和CAT活性显著降低,这与何庆元等[25]在盐胁迫下大豆(Soybean )上的研究结果一致,说明NaCl胁迫破坏了加工番茄清除活性氧的酶促系统;外施H2S和H2O2处理后显著增强了NaCl胁迫下加工番茄幼苗叶片中抗氧化酶SOD、POD和CAT活性,降低了MDA和内源H2O2含量以及![]() 产生速率,这与外源H2O2处理可提高小麦(Triticum aestivum)[26]和燕麦(Avena sativa)[27]幼苗耐盐性上的研究结果一致;但T1、T2和T3处理与H2S处理相比,2个品系幼苗叶片内源H2O2的含量有所提升,其原因可能是由CAT直接催化H2O2生成H2O和O2的能力弱于SOD催化
产生速率,这与外源H2O2处理可提高小麦(Triticum aestivum)[26]和燕麦(Avena sativa)[27]幼苗耐盐性上的研究结果一致;但T1、T2和T3处理与H2S处理相比,2个品系幼苗叶片内源H2O2的含量有所提升,其原因可能是由CAT直接催化H2O2生成H2O和O2的能力弱于SOD催化![]() 生成H2O2能力所致;因为植物体在生长过程中,为防止膜脂过氧化对细胞膜造成伤害,机体会形成SOD、POD和CAT等自由基清除酶系,起着消除细胞内活性氧和维持活性氧的动态平衡等重要作用,SOD具有消除植物叶片细胞中内源H2O2含量,CAT负责把H2O2变为H2O,消除植物体内H2O2的酶类,使活性氧保持在最低水平,保护质膜不受伤害的功能[28];也有可能是由于所喷施的外源H2O2进入植物体内所产生的影响,确切原因尚需进一步研究证明。但外源H2S和H2O2相互作用下幼苗叶片中内源H2O2的含量始终比NaCl胁迫下低,且在T2处理下2个品系加工番茄幼苗叶片内源H2O2的含量与外源H2S处理比较相近,说明外施H2S和H2O2溶液能有效促进清除ROS的酶促系统的运转,从而增强加工番茄的ROS清除能力,降低内源H2O2和
生成H2O2能力所致;因为植物体在生长过程中,为防止膜脂过氧化对细胞膜造成伤害,机体会形成SOD、POD和CAT等自由基清除酶系,起着消除细胞内活性氧和维持活性氧的动态平衡等重要作用,SOD具有消除植物叶片细胞中内源H2O2含量,CAT负责把H2O2变为H2O,消除植物体内H2O2的酶类,使活性氧保持在最低水平,保护质膜不受伤害的功能[28];也有可能是由于所喷施的外源H2O2进入植物体内所产生的影响,确切原因尚需进一步研究证明。但外源H2S和H2O2相互作用下幼苗叶片中内源H2O2的含量始终比NaCl胁迫下低,且在T2处理下2个品系加工番茄幼苗叶片内源H2O2的含量与外源H2S处理比较相近,说明外施H2S和H2O2溶液能有效促进清除ROS的酶促系统的运转,从而增强加工番茄的ROS清除能力,降低内源H2O2和![]() 的积累,减轻 NaCl胁迫诱导的氧化损伤。
的积累,减轻 NaCl胁迫诱导的氧化损伤。
由此可以表明,外源H2S 和H2O2这2种信号分子在生物体系反应中信号转导途径相似,且二者在NaCl胁迫下存在着一定程度的协同作用,可以诱导增强NaCl胁迫下加工番茄幼苗植株渗透调节能力、提高清除活性氧的酶促系统的防御能力和加工番茄幼苗叶片中游离脯氨酸、可溶性糖含量,降低电解质渗出率和丙二醛含量,从而减弱加工番茄细胞内活性氧自由基对质膜的伤害,维持细胞膜的稳定性和完整性,使加工番茄幼苗仍保持较强的光合色素含量、相对含水量和根系活力,从而提高加工番茄幼苗的耐盐性;并且表明外源H2S 和H2O2这2种信号分子呈现一定的浓度效应,T2处理(50 μmol/L H2S和1.5 mmol/L H2O2)效果最为显著。
参考文献:
[1] Deinlein U,Stephan A B,Horie T,et al. Plant salt-tolerance mechanisms[J]. Trends in Plant Science,2014,19(6):371-379.
[2] 宋旭丽,侯喜林,胡春梅,等. NaCl胁迫对超大甜椒种子萌发及幼苗生长的影响[J]. 西北植物学报,2011,31(3):569-575.
[3] 努尔帕提曼·买买提热依木,齐曼·尤努斯,谭敦炎.盐胁迫对4种短命植物种子萌发及植株生长的影响[J]. 西北植物学报,2011,31(8):1618-1627.
[4] Fang T,Cao Z,Li J,et al. Auxin-induced Hydrogen sulfide generation is involved in lateral root formation in tomato[J]. Plant Physiology and Biochemistry,2014,76:44-51.
[5] Jia H,Hu Y,Fan T,et al. Hydrogen sulfide modulates actin-dependent auxin transport via regulating ABPs results in changing of root development in Arabidopsis[J]. Scientific Reports,2015,5:8251.
[6] 裴雁曦. 植物中的气体信号分子硫化氢:无香而立,其臭如兰[J]. 中国生物化学与分子生物学报,2016,32(7):721-733.
[7] 郑州元,林海荣,崔辉梅. 外源硫化氢对盐胁迫下加工番茄幼苗光合参数及叶绿素荧光特性的影响[J]. 核农学报,2017,31(7):1426-1435.
[8] 郑州元,林海荣,崔辉梅. 外源硫化氢对盐胁迫下加工番茄幼苗生理生化特性的影响[J]. 华北农学报,2017,32(1):208-214.
[9] Singh R,Singh S,Parihar P,et al. Reactive oxygen species(ROS):beneficial companions of plants′ developmental processes[J]. Frontiers in Plant Science,2016,7(7):1299.
[10] You J,Chan Z L. ROS regulation during abiotic stress responses in crop plants[J]. Frontiers in Plant Science,2015,6(6):1092.
[11] 蒋景龙,李 丽,徐 皓,等. 山黧豆根系对H2O2诱导氧化胁迫的生理应答[J]. 西北植物学报,2014,34(9):1795-1800.
[12] 蒋景龙. 外源 H2O2对低温胁迫下柑橘叶片抗寒性的影响[J]. 西北植物学报,2016,36(3):499-505.
[13] 刘忠静,郭延奎,林少航,等. 外源过氧化氢对干旱胁迫下温室黄瓜叶绿体超微结构和抗氧化酶的影响[J]. 园艺学报,2009,36(8):1140-1146.
[14] 刘建新,王金成,王瑞娟,等. 外源过氧化氢提高燕麦耐盐性的生理机制[J]. 草业学报,2016,25(2):216-222.
[15] De Azevedo Neto A D,Prisco J T,Enéas-Filho J,et al. Hydrogen peroxide pre-treatment induces salt-stress acclimation in maize plants[J]. Journal of Plant Physiology,2005,162(10):1114-1122.
[16] 徐芬芬,徐 鹏,胡志涛,等. 外源过氧化氢对盐胁迫下水稻幼苗根系生长和抗氧化系统的影响[J]. 杂交水稻,2017,32(1):74-77.
[17] Fan B,Shen L,Liu K L,et al. Interaction between nitric oxide and hydrogen peroxide in postharvest tomato resistance response to Rhizopus nigricans[J]. Journal of the Science of Food and Agriculture,2008,88(7):1238-1244.
[18] 周自云,梁宗锁,李 硕,等. 干旱-复水对酸枣相对含水量、保护酶及光合特征的影响[J]. 中国生态农业学报,2011,19(1):93-97.
[19] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[20] 邹 琦. 植物生理学实验技术[M]. 北京:中国农业出版社,2004.
[21] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[22] Qiu Z B,Yuem L T. The damage repair role of He-Ne laser on wheat expoed to osmotic stress[J]. Canadian Journal of Plant Science,2010,75(6):680-686.
[23] 景举伟,李 顺,赵 艳,等. 外源H2S对![]() 胁迫下番茄幼苗生理生化特性的影响[J]. 西北植物学报,2015,35(6):1173-1181.
胁迫下番茄幼苗生理生化特性的影响[J]. 西北植物学报,2015,35(6):1173-1181.
[24] Qiu Z B,Sun L,Li J T,et al. Protecting effect of exogenous hydoogen peroxide on wheat seedlings damage by water stress[J]. Bulletin of Botanical Research,2010,30(3):294-298.
[25] 何庆元,向仕华,吴 萍,等. 硫化氢对盐胁迫条件下大豆抗氧化酶活性的影响[J]. 大豆科学,2015,34(3):427-431.
[26] 李金亭,赵萍萍,邱宗波,等. 外源H2O2对盐胁迫下小麦幼苗生理指标的影响[J]. 西北植物学报,2012,32(9):1796-1801.
[27] 刘建新,王金成,王瑞娟,等. 燕麦幼苗对盐胁迫的响应及过氧化氢对响应的调节[J]. 生态学杂志,2015,34(9):2506-2511.
[28] 蔡妙珍,罗安程,林咸永,等. Ca2+对过量Fe2+胁迫下水稻保护酶活性及膜脂过氧化的影响[J]. 作物学报,2003,29(3):447-451.
Abstract:The effects of exogenous H2S and H2O2 physiological regulation on the processing tomato seedlings under NaCl stress were investigated,KT-32 with weak salt tolerance and KT-7 with strong salt tolerance as the materia. Research of 50 μmol/L H2S and H2O2 were determined by pot culture under the conditions of 0.5,1.5,3.0 mmol/L. Effects of cotreatment on the growth,osmoregulation,material accumulation and reactive oxygen metabolism of seedlings of processed tomato under 250 mmol/L NaCl stress.The results showed that the cotreatment of exogenous H2S and H2O2 alleviated the inhibitory effect of NaCl stress on the growth of seedlings of processed tomato seedlings,and maintained a strong photosynthetic pigment content,relatived water content and root activity in processed tomato seedlings.And decreased the electrolyte leakage rate,the content of MDA,the content of H2O2 and the production rate of ![]() free radical and enhanced the activities of antioxidant enzymes SOD,POD and CAT activity. Among the two strains,soluble sugar increased 24.0% and 29.4% by compared with 50 μmol/L H2S treatment alone at 50 μmol/L H2S and 1.5 mmol/L H2O2 ,proline content increased by 25.8% and 21.3%,respectively,and the effect of salt stress alleviation was the most significant.In summary,there were a certain degree of synergy between exogenous H2S and H2O2,which could enhance the osmotic regulatory capacity of plants under enhanced NaCl stress in tomato seedling plants to enhance the removal of reactive oxygen species H2S and H2O2 in the tomato seedlings,and then weakened the injury of reactive oxygen species on the plasma membrane in processed tomato cells and then increased the adaptability of tomato seedlings to salt stress. The synergistic effect of the two signaling molecules will provide the theoretical basis for alleviating the physiological mechanism of salt stress in tomato seedlings.
free radical and enhanced the activities of antioxidant enzymes SOD,POD and CAT activity. Among the two strains,soluble sugar increased 24.0% and 29.4% by compared with 50 μmol/L H2S treatment alone at 50 μmol/L H2S and 1.5 mmol/L H2O2 ,proline content increased by 25.8% and 21.3%,respectively,and the effect of salt stress alleviation was the most significant.In summary,there were a certain degree of synergy between exogenous H2S and H2O2,which could enhance the osmotic regulatory capacity of plants under enhanced NaCl stress in tomato seedling plants to enhance the removal of reactive oxygen species H2S and H2O2 in the tomato seedlings,and then weakened the injury of reactive oxygen species on the plasma membrane in processed tomato cells and then increased the adaptability of tomato seedlings to salt stress. The synergistic effect of the two signaling molecules will provide the theoretical basis for alleviating the physiological mechanism of salt stress in tomato seedlings.
Key words:H2O2;H2S;NaCl stress;Processing tomato seedlings
中图分类号:S641.01
文献标识码:A
文章编号:1000-7091(2018)03-0159-08
doi:10.7668/hbnxb.2018.03.024
收稿日期:2017-02-13
基金项目:留学回国人员科技活动项目( 2010LX005)