过氧化物酶(Prxs)是一种基于硫醇的家族过氧化物酶,广泛分布于从古细菌到哺乳动物等生物体中 [1]。Prxs蛋白在活性氧(ROS)和NO信号通路相互作用中扮演着重要角色,它们可以利用含硫醇的蛋白质(如硫氧还蛋白Trx)来减少细胞中通过其催化半胱氨酸残基产生的过氧化氢(H2O2)、过氧亚硝酸盐和有机过氧化物 [2-3]。在植物中,Prxs基于它们的基因组序列被分成4个不同的亚类 [4]:1-Cys Prx、2-Cys Prx(A、B)、Prx Ⅱ(A-F)和Prx Q,其中,2-Cys Prx、PrxQ和PrxⅡ E定位于叶绿体,1-Cys Prx定位在核,Prx Ⅱ A-D定位于细胞质,PrxⅡ F定位于线粒体 [5-6]。广义上,Prxs除了具有众所周知的过氧化物酶功能之外,还参与了细胞增殖、分化、凋亡,细胞内信号转导和保护自由基敏感蛋白等生物功能 [7]。
在对酵母和人类细胞的研究中,氧化处理或热休克导致2-Cys Prx过氧化,且伴随着构象的形成和高分子量复合物的形成,这种结构修饰与从过氧化物酶到伴侣活性的功能转换有关 [8-9]。2015年,Awad [10]证明了2-Cys Prx能够参与细胞中自由水-结合水循环,并保护光合结构免受氧化应激损伤。此外,在对马铃薯植物的研究中证明2-Cys Prx的过表达导致对甲基紫精或高温的耐受性增强 [11]。在对拟南芥的研究中,Cerveau [12]报道了在生理环境限制下2-Cys Prx过氧化和寡聚化之间没有明显的关系,这表明2-Cys Prx伴侣功能在植物中是非必需的。此外,Dangoor等 [13]发现了2-Cys Prx能氧化组氨酸丰富的硫氧还蛋白,并在昼夜转化期间传递调节光合电子传递链的氧化还原信号。此外,植物2-Cys Prx与一些不属于Trx超家族的蛋白质相互作用产生一种碳代谢的酶:果糖-1,6-双磷酸酶(FBPase),参与了叶绿素的合成和亲环素蛋白(Cyp20-3)的折叠 [14]。以上研究表明,2-Cys Prx在机体氧化还原信号转导方面发挥着重要的作用。
目前,人们对2-Cys Prx基因在动物、人体及其他植物中氧化还原信号调控机制工作已经做了很多,而在桃果实中的研究还很少。本试验以肥城桃果实为材料,通过PCR技术和RACE-PCR技术克隆得到桃果实2-Cys Prx基因全长,对其生物信息学进行了分析,并在DH5α中成功表达出蛋白,以期深入了解桃果实2-Cys Prx蛋白结构及功能,从而为揭示2-Cys Prx在氧化还原信号调控途径提供理论基础和技术支撑。
1 材料和方法
1.1 材料及处理
本试验以肥城桃(Prunus persica (L.)Batsch cv.Feicheng)果实为材料,桃果实的处理参照Jing等 [15]的方法,取样切块后液氮冷冻,于-80 ℃保存。
大肠杆菌菌种E.coli DH5α、E.coli BL21表达载体pET-30a质粒由山东农业大学化学与材料科学学院化学生物学实验室保存,克隆载体pMD 18-T Vector购自宝生物公司。本试验所需引物(由华大基因科技公司合成)如表1所示。
表1 PCR引物及序列 Tab.1 PCR primers and sequences
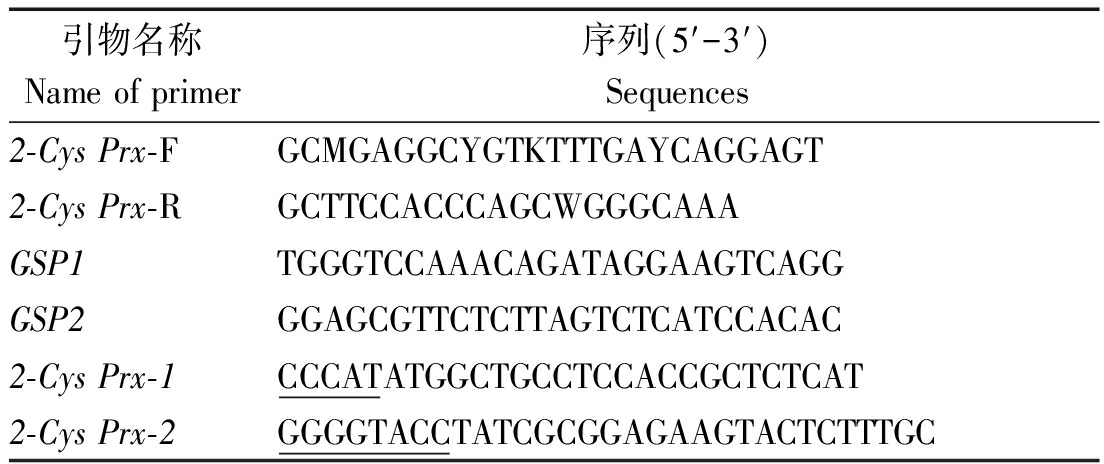
引物名称Name of primer序列(5′-3′)Sequences2-Cys Prx-FGCMGAGGCYGTKTTTGAYCAGGAGT2-Cys Prx-RGCTTCCACCCAGCWGGGCAAAGSP1TGGGTCCAAACAGATAGGAAGTCAGGGSP2GGAGCGTTCTCTTAGTCTCATCCACAC2-Cys Prx-1CCCATATGGCTGCCTCCACCGCTCTCAT2-Cys Prx-2GGGGTACCTATCGCGGAGAAGTACTCTTTGC
注:CCCAT为NdeⅠ酶切位点,GGGGTACC为Kpn Ⅰ酶切位点。
Note:CCCAT is Nde Ⅰ restriction site,GGGGTACC is Kpn Ⅰ restriction site.
1.2 试验方法
1.2.1 材料处理 参考改良CTAB法[16]提取桃果实总RNA,并使用超微量紫外分光光度计测定RNA浓度。使用宝生物公司的PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit合成1st-Strand cDNA。
1.2.2 2-Cys Prx基因中间片段序列的克隆 从NCBI中检索其他植物2-Cys Prx蛋白的mRNA序列,用Primer Premier 5.0设计兼并引物,以1.2.1得到的cDNA为模板构建PCR标准反应体系扩增,将反应后的产物进行1%琼脂糖凝胶电泳,将含有中间片段的凝胶切块使用Gel Extraction Kit(康为世纪)试剂盒回收DNA。将目的片段连接pMD18-T Vector构建克隆载体,转染DH5α。经菌液PCR检测筛选出阳性克隆载体,送出测序。
1.2.3 2-Cys Prx基因全长的获取及生物信息学的分析 根据测序所得2-Cys Prx基因中间片段,设计RACE引物GSP1、GSP2。使用TaKaRa的SMART RACE cDNA试剂盒并按照说明书操作分别进行3′、5′-RACE,并将RACE产物进行1%的琼脂糖凝胶电泳,切掉电泳后的琼脂糖凝胶并使用试剂盒回收DNA,按照1.2.2的方法构建克隆载体。测序后将得到的5′端序列、3′端序列与中间片段拼接,获得肥城桃果实2-Cys Prx基因cDNA全长。在NCBI网站检索不同物种2-Cys Prx氨基酸序列,通过DNAMAN软件对比并分析同源性,使用MEGA 4.1软件构建系统进化树。分别使用ProtScale和ProtParam在线服务器分析2-Cys Prx蛋白的亲水性及理化性质。使用psiPRED对2-Cys Prx蛋白的二维结构进行模拟分析。
1.2.4 肥城桃果实2-Cys Prx蛋白的表达 根据2-Cys Prx基因全长,设计含酶切位点的引物2-Cys Prx-1和2-Cys Prx-2,将获得的2-Cys Prx的基因全长与pMD18-T Vector连接构建克隆载体,分别将克隆载体与pET-30a质粒用限制性内切酶双酶切,用宝生物T4 DNA 连接酶将目的片段连接得到重组质粒pET-30a-2-Cys Prx,并导入表达菌株BL21中,经PCR扩增验证后进行蛋白的诱导表达。取150 μL菌液加入到LB液体培养基中,37 ℃恒温摇菌至λ=600 nm处吸光度值在0.6~0.8,向菌液中加入IPTG诱导剂至终浓度为1 mmol/L,37 ℃诱导10 h,取3 mL菌液用于15%的SDS-PAGE检测。
2 结果与分析
2.1 桃果实2-Cys Prx基因全长的获得
对比不同植物2-Cys Prx基因序列,确定保守区并设计引物,以cDNA为模板进行扩增,琼脂糖凝胶电泳结果如图1-A,中间片段长度450 bp左右,与预期长度相符。将该片段切胶回收并克隆送至基因公司测序,根据目的片段设计RACE引物,RACE结果如图1-B、C所示,5′-RACE与3′-RACE均得到与预期相符合的目的条带,将相应基因拼接得到2-Cys Prx基因全长,共1 424 bp。
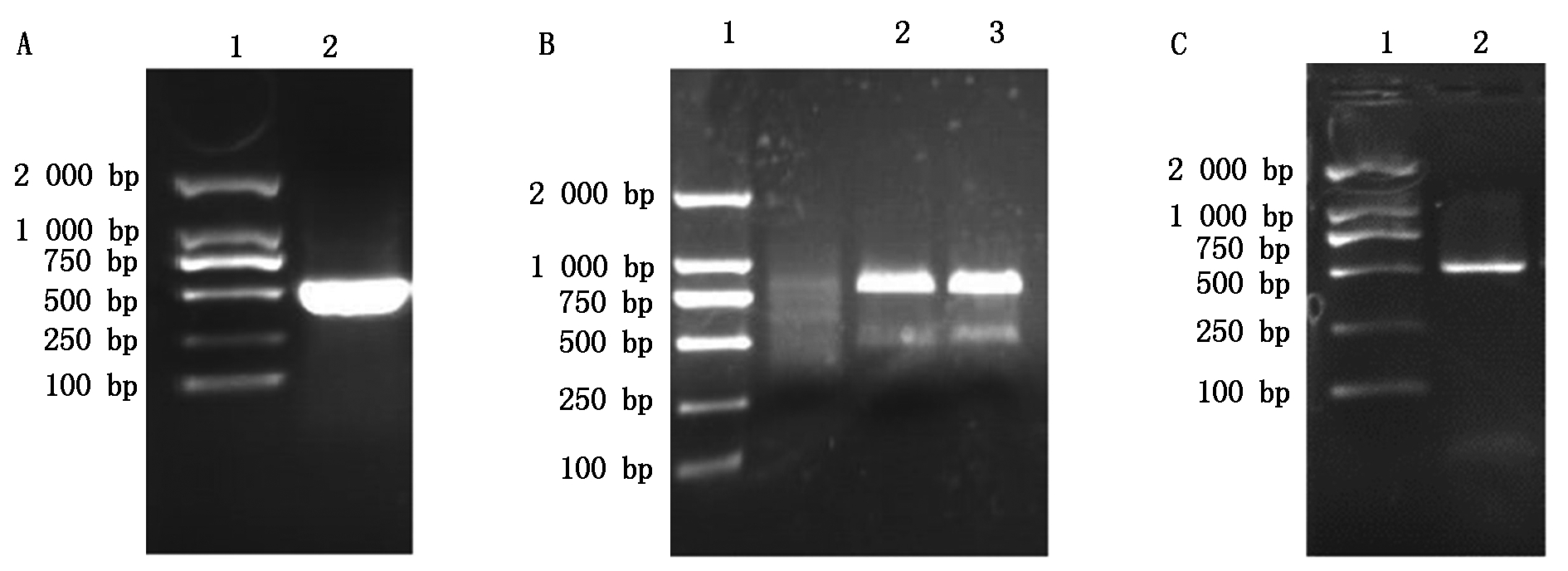
A.2-Cys Prx基因中间片段的获得:1.DL2000 DNA分子量标准,2.PCR产物;B.5′ RACE-PCR:1.DL2000 DNA分子量标准,2~3.5′ RACE-PCR产物;C.3′ RACE-PCR:1.DL2000 DNA分子量标准,2.3′ RACE-PCR产物。
A. Middle sequences of 2-Cys Prx gene:1. DL2000 Marker,2. Product of PCR;B.5′ RACE-PCR:1.DL2000 Marker,2-3.5′ RACE-PCR products;C.3′ RACE-PCR:1.DL2000 Marker,2. 3′ RACE-PCR products.
图1 桃果实2-Cys Prx基因克隆
Fig.1 Gene cloning of 2-Cys Prx in peach

图2 桃果实2-Cys Prx基因全长(A)及氨基酸序列(B)
Fig.2 Full length sequence of cDNA (A) and amino acid sequence (B) of 2-Cys Prx
2.2 2-Cys Prx基因的生物信息学分析
对2-Cys Prx基因序列进行生物信息学分析,该序列(图2-A)含有起始密码子ATG(173 bp)和终止密码子TAG(985 bp),具有完整的开放阅读框。阅读框共有813个碱基,编码270个氨基酸(图2-B)。通过ProtParamtool在线预测2-Cys Prx蛋白分子式为C1342H2110N348O403S4,分子量29.696 ku,由4 207个原子组成,理论等电点为6.23,不稳定系数为34.69。经ProtScale在线分析得到该蛋白疏水性平均值为-0.126,说明2-Cys Prx为亲水性蛋白。采用TMHMM对跨膜结构预测,结果发现,2-Cys Prx氨基酸序列中不存在跨膜结构域,为膜外蛋白(图3),采用psiPRED对桃果实2-Cys Prx二级结构进行预测(图4),进一步分析发现β折叠、α螺旋结构和无规则卷曲交替出现,该蛋白有9个β折叠结构及4个α螺旋结构,与植物其他Prx的二级结构无明显区别,说明Prx的二级结构在进化上高度保守。
2.3 2-Cys Prx蛋白氨基酸序列同源比对和系统进化分析
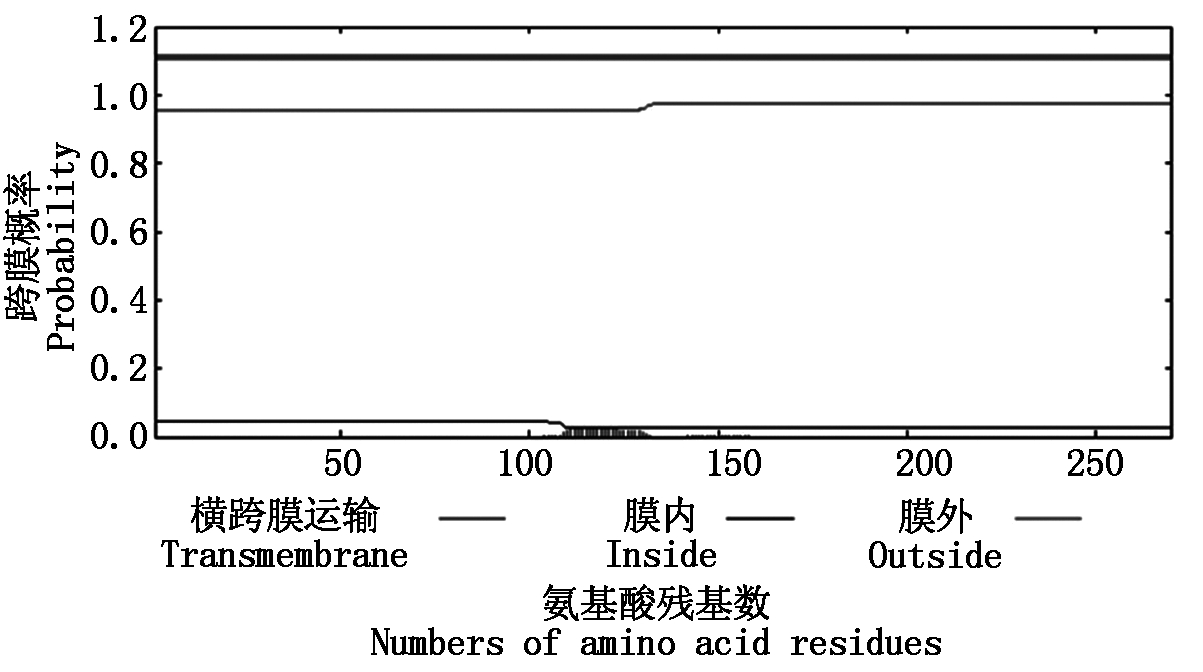
图3 2-Cys Prx跨膜结构预测
Fig.3 The transmembrane helices prediction of 2-Cys Prx
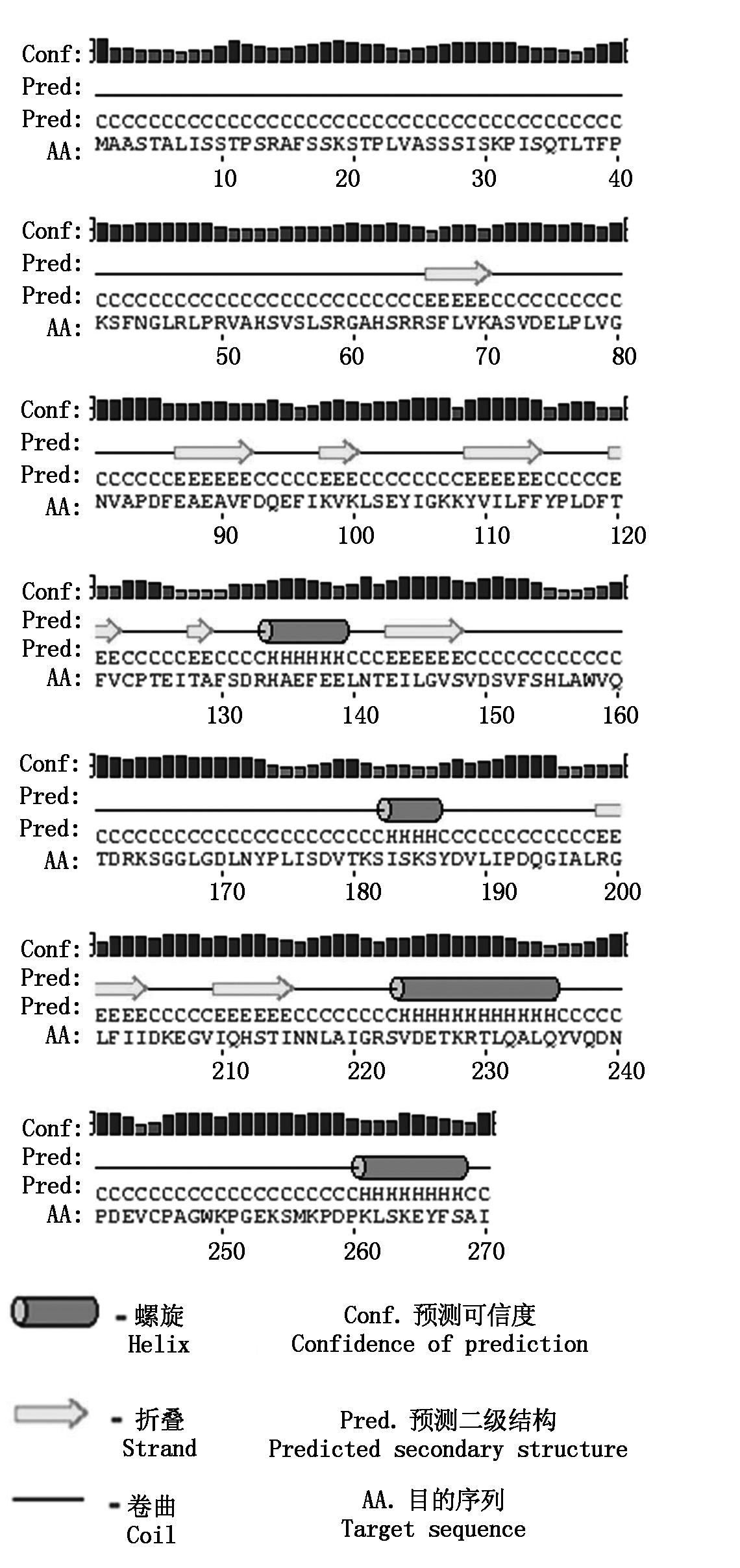
图4 2-Cys Prx蛋白二级结构预测预测
Fig.4 The secondary structure prediction of 2-Cys Prx protein
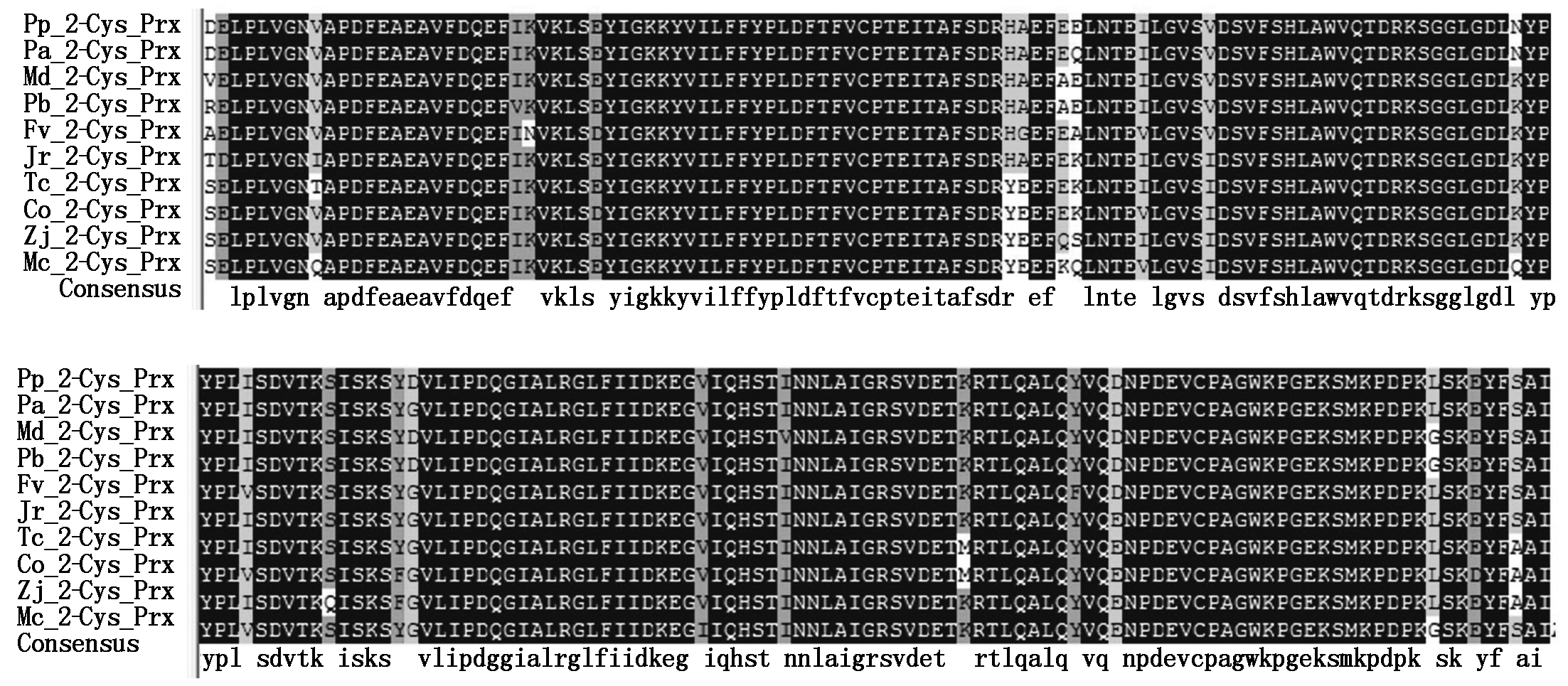
Pp.肥城桃;Pa.樱桃;Md.苹果;Pb.白梨;Fv.野草莓;Jr.核桃;Tc.可可;Co.长果种黄麻;Zj.枣;Mc.苦瓜。
Pp. Prunus persica;Pa. Prunus avium;Md. Malus domestica;Pb. Pyrus×bretschneideri;Fv. Fragaria vesca;Jr. Juglans regia;Tc. Theobroma cacao;Co. Corchorus olitorius;Zj. Ziziphus jujuba;Mc. Momordica charantia.
图5 肥城桃果实2-Cys Prx氨基酸与其他植物2-Cys Prx氨基酸序列比对
Fig.5 Alignment of amino acid sequence of 2-Cys Prx in peach with 2-Cys Prx proteins in other plants
将获取的桃果实2-Cys Prx氨基酸序列在NCBI数据库进行Blast,与其他植物的2-Cys Prx氨基酸序列对比(图5),结果表明,桃(Prunus persica)果实2-Cys Prx与其他植物2-Cys Prx氨基酸序列相近,其中与樱桃(Prunus avium)、苹果(Malus domestica)、白梨(Pyrus×bretschneideri)、野草莓(Fragaria vesca)、核桃(Juglans regia)、可可(Theobroma cacao)、长果种黄麻(Corchorus olitorius)、枣(Ziziphus jujuba)、苦瓜(Momordica charantia)同源性分别为98.15%,87.08%,86.35%,84.81%,76.19%,75.56%,74.54%,79.14%,74.45%,表明植物的2-Cys Prx蛋白具有较高的保守性。系统进化树结果表明(图6),肥城桃果实2-Cys Prx与樱桃2-Cys Prx亲缘关系最近。

分支上的数值表示1 000次重复计算得到的Bootstrap值。
The values on the branches represent the Bootstrap values obtained by the 1 000 iteration.
图6 肥城桃果实2-Cys Prx系统进化树分析
Fig.6 Phylogenetic tree of 2-Cys Prx in peach
2.4 2-Cys Prx蛋白表达
将重组质粒pET-30a-2-Cys Prx导入大肠杆菌BL21(DE3)中,加IPTG至终浓度为1 mmol/L,诱导2-Cys Prx重组蛋白表达,得到重组蛋白。电泳结果如图7所示,2-Cys Prx重组蛋白表达成功,蛋白分子量大小为29.7 ku。
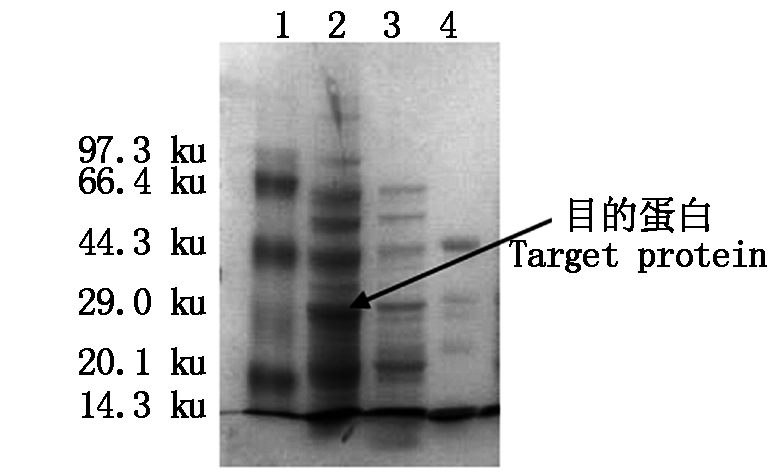
1.低分子量蛋白标准;2.含pET-30a-2-Cys Prx质粒经IPTG诱导的蛋白粗提物;3.含pET-30a质粒未诱导的蛋白粗提物;4.含重组pET-30a-2-Cys Prx质粒未诱导的蛋白粗提物。
1. Standard protein molecular mass Markers;2. Protein extracts containing pET-30a-2-Cys Prx plasmid with IPTG induction; 3. Protein extracts containing pET-30a plasmid without IPTG induction; 4. Protein extracts containing pET-30a-2-Cys Prx plasmid without IPTG induction.
图7 2-Cys Prx重组蛋白15%聚丙烯酰胺凝胶电泳
Fig.7 Recombinant 2-Cys Prx protein in 15% SDS-PAGE
3 结论与讨论
本研究采用同源克隆的方法获得了2-Cys Prx基因的中间片段,利用PCR技术和RACE-PCR技术获得了桃果实2-Cys Prx基因序列全长,运用Blast技术对基因库进行检索,结果发现,肥城桃果实与已公布的碧桃2-Cys Prx BAS1基因序列一致,肥城桃果实2-Cys Prx开放阅读框长813 bp,共编码270个氨基酸。对2-Cys Prx的生物信息学进行分析,结果发现,桃果实2-Cys Prx与樱桃2-Cys Prx同源性最高。通过TMHMM分析,结果表明,桃果实2-Cys Prx不含有信号肽序列和跨膜结构域,属于膜外蛋白。此外,本试验体外表达出了蛋白,蛋白分子量大小为29.7 ku。
1988年,人们首次在酵母细胞中发现过氧化物还原酶,后来这一新的、进化高度保守的抗氧化蛋白家族被证明广泛存在于原核生物和真核生物中,并在生物体内发挥着重要的作用[17]。2-Cys Prx广泛存在于细胞和组织中,其功能主要以抗氧化为主,2-Cys Prx主要分布于细胞质、线粒体以及内质网中,2-Cys Prx分布的广泛性也体现了其生理功能的重要性,分布于不同部位的2-Cys Prx的功能也存在一定的差异和互补。在植物中,2-Cys Prx A和B具有在氧化时形成二聚体的能力[18]。在不同温度、渗透和胁迫条件下,拟南芥质体2-Cys Prx可以经历不同的过氧化状态和寡聚化状态的变化[19]。2-Cys Prxs是通过与硫氧还蛋白和硫氧还蛋白还原酶偶联从NADPH接收电子的过氧化物酶[12,20]。在对酵母2-Cys Prx的研究中发现,Prx通过形成多聚体变成分子伴侣来阻止蛋白的聚集,以此来增加酵母在温度胁迫条件下的耐受性[21]。最近的研究表明,2-Cys Prxs通过与特定的氧化还原敏感分子相互作用,在各种信号网络中起关键调节作用[6],本研究为下一步桃果实2-Cys Prx蛋白的功能研究提供了理论依据。
Prx蛋白不仅具有抗氧化功能,还在真核生物中参与了H2O2介导的信号转导过程,这一转导功能是基于Prx蛋白对H2O2的高度的亲和力。近几年的研究发现,蛋白质N末端保守的Cys残基能与H2O2发生氧化反应,生成Cys-SOH,Cys-SOH相邻单位上的Cys-SH结合生成二硫化物,生成的二硫化物能被Trx还原,H2O2则被Prxs还原为H2O,转化为乙醇并被清除细胞,从而起到为细胞解毒的作用[22-23]。这表明,在植物体中,Prxs与Trx相互作用参与了氧化还原反应及多种信号转导,本研究为探讨桃果实2-Cys Prx对维持氧化还原平衡状态提供了理论依据,为进一步分析2-Cys Prx基因结构和亚细胞定位奠定了基础。
参考文献:
[1] Pulido P C,Cejudo F J. An antioxidant redox system in the nucleus of wheat seed cells suffering oxidative stress[J]. Plant Journal,2009,57(1):132-145.
[2] Camejo D. Salinity-induced changes in S-nitrosylation of pea mitochondrial proteins[J]. Proteomics,2013,79:87-99.
[3] Calderon A. Glutathionylation of pea chloroplast 2-Cys Prx and mitochondrial Prx Ⅱ F affects their structure and peroxidase activity and sulfiredoxin deglutathionylates only the 2-Cys Prx[J]. Front Plant Sci,2017,8:118.
[4] Cheng F,Yin L L,Zhou J,et al. Interactions between 2-Cys peroxiredoxins and ascorbate in autophagosome formation during the heat stress response in Solanum lycopersicum[J]. Journal of Experimental Botany,2016,67(6):1919-1933.
[5] Bhardwaj P K,Kumar S. 2-Cys peroxiredoxin responds to low temperature and other cues in Caragana jubata,a plant species of cold desert of Himalaya[J]. Molecular Biology Reports,2014,41(5):2951-2961.
[6] Park J,Lee S,Kang S W,et al. 2-cys peroxiredoxins:emerging hubs determining redox dependency of Mammalian signaling networks[J]. International Journal of Cell Biology,2014:715867.http://dx.doi.org/10.1155/2014/715867.
[7] Bernal-Bayard B P. Molecular recognition in the interaction of chloroplast 2-Cys peroxiredoxin with NADPH-thioredoxin reductase C(NTRC)and thioredoxin x[J]. FEBS Letters,2014,588(23):4342-4357.
[8] Moon J C,Hah Y S,Kim W Y,et al. Oxidative stress-dependent structural and functional switching of a human 2-Cys peroxiredoxin Isotype Ⅱ that enhances HeLa cell resistance to H2O2-induced cell death[J]. Journal of Biological Chemistry,2005,280(31):28775-28784.
[9] Hong S H,Lee S S,Chung J M,et al. Site-specific mutagenesis of yeast 2-Cys peroxiredoxin improves heat or oxidative stress tolerance by enhancing its chaperone or peroxidase function[J]. Protoplasma,2017,254(1):327-334.
[10] Awad J. 2-cysteine peroxiredoxins and thylakoid ascorbate peroxidase create a water-water cycle that is essential to protect the photosynthetic apparatus under high light stress conditions[J]. Plant Physiology,2015,167(4):1592-1603.
[11] Kim M D,Kim Y H,Kwon S Y,et al. Overexpression of 2-cysteine peroxiredoxin enhances tolerance to methyl viologen-mediated oxidative stress and high temperature in potato plants[J]. Plant Physiology and Biochemistry,2011,49(8):891-897.
[12] Cerveau D. Characterization of the Arabidopsis thaliana 2-Cys peroxiredoxin interactome[J]. Plant Science,2016,252:30-41.
[13] Dangoor I,Peled-Zehavi H,Wittenberg G,et al. A chloroplast light-regulated oxidative sensor for moderate light intensity in Arabidopsis[J]. Plant Cell,2012,24(5):1894-1906.
[14] Dietz K J. Thiol-based peroxidases and ascorbate peroxidases:why plants rely on multiple peroxidase systems in the photosynthesizing chloroplast? [J].Molecules and Cells,2016,39(1):20-25.
[15] Jing G,Zhou J,Zhu S. Effects of nitric oxide on mitochondrial oxidative defence in postharvest peach fruits[J]. Journal of the Science of Food and Agriculture,2016,96(6):1997-2003.
[16] 陈长宝,朱树华,周 杰. 改良CTAB法提取成熟肥城桃果实的总RNA[J]. 山东农业科学,2009(5):102-104.
[17] Barrancomedina S,Kakorin S,L zaro J J,et al. Thermodynamics of the dimer-decamer transition of reduced human and plant 2-cys peroxiredoxin[J]Biochemistry,2008,47(27):7196-7204.
zaro J J,et al. Thermodynamics of the dimer-decamer transition of reduced human and plant 2-cys peroxiredoxin[J]Biochemistry,2008,47(27):7196-7204.
[18] Lee E M,Lee S S,Tripathi B N,et al. Site-directed mutagenesis substituting cysteine for serine in 2-Cys peroxiredoxin (2-Cys Prx A) of Arabidopsis thaliana effectively improves its peroxidase and chaperone functions[J]. Annals of Botany,2015,116(4):713-725.
[19] Cerveau D,Ouahrani D,Marok M A,et al. Physiological relevance of plant 2-Cys peroxiredoxin overoxidation level and oligomerization status[J]. Plant Cell and Environment,2016,39(1):103-119.
[20] Pace P E,Peskin A V,Han M H,et al. Hyperoxidized peroxiredoxin 2 interacts with the protein disulfide-isomerase ERp46[J].Biochemical Journal,2013,453(3):475-485.
[21] Peskin A V,Low F M,Paton L N,et al. The high reactivity of peroxiredoxin 2 with H2O2 is not reflected in its reaction with other oxidants and thiol reagents[J]. Journal of Biological Chemistry,2007,282(16):11885-11892.
[22] Dietz K J. Peroxiredoxins in plants and cyanobacteria[J]. Antioxidants & Redox Signaling,2011,15(4):1129-1159.
[23] Gao J. Enhanced fermentative performance under stresses of multiple lignocellulose-derived inhibitors by overexpression of a typical 2-Cys peroxiredoxin from Kluyveromyces marxianus[J].Biotechnol Biofuels,2017,10:79.