苹果树体形状一般分为柱型、短枝型、普通型和下垂型,其中柱型的矮化程度最高,表现为节间短、腋芽萌发产生大量短侧枝,很少或无侧生延长新梢,冠形极其紧凑,非常适合高密度种植。因此,该性状形成的机制一直是众多学者研究的热点。
微管是细胞骨架的重要组成成分,是由亚单位α/β微管蛋白(α/β-tubulin)异二聚体形成原丝,然后装配成中空的管状结构[1]。微管对植物的正常生长发育具有重要作用,主要参与了植物细胞生长的关键过程,包括细胞的分裂和形态建成[2-3]。例如,微管的聚集能够促进植物顶端的生长[4],通过调节纤维素微纤维的沉积方向参与细胞壁的形成过程,影响细胞壁的组分和结构,进而影响细胞的伸长[5-7]。微管还影响被子植物花粉管的生长[8]。有研究发现,植物体中微管的减少、变短和分离都能导致植株的矮化[9]。微管还广泛参与调节植物的生物和非生物胁迫[10-11],并对维持高尔基体和内质网等细胞器的形态和功能具有重要作用[12-13]。
植物中的微管蛋白氨基酸序列相似性极高[14]。在拟南芥(Arabidopsis thaliana(L.)Heynh.)[15]、毛果杨(Populus trichocarpa Torr.&Gray)[16]、玉米(Zea mays L.)[17-18]、水稻(Oryza sativa L.)[19]、梨(Pyrus spp.)[20]、亚麻 (Linum usitatissimum L.)[21]、柳(Salix babylonica L.)[22-23]等植物上已报道了大量的微管蛋白基因。目前,苹果上还未见有关微管蛋白基因的报道。
前期研究中,青岛农业大学果树育种课题组从西洋梨基因组中鉴定了一组β-微管蛋白基因,有7个基因在茎尖组织中表达。其中,定位于chr16上的转录本号为PCP044487.1的基因在矮生型和普通型梨茎尖中的转录水平差异显著,推测该基因可能与梨矮生性状形成的分子调控有关[20]。在苹果基因组中搜索发现,转录本号为MDP0000749824.1的蛋白与PCP044487.1相似性最高。本研究欲以柱型苹果品种舞姿和普通型苹果品种烟富3号为代表,探讨该基因在这2种不同株型上的表达特征,同时,对该基因及其启动子序列特征进行分析,为进一步深入研究该基因的功能提供依据。
1 材料和方法
1.1 植物材料
2017年5月中旬,在田间选取5年生的普通型苹果品种烟富3号和柱型苹果品种舞姿各3株(即3次重复),基砧均为八棱海棠,选取旺盛生长的梢端组织(长度约为0.5 cm),投入液氮速冻,置于-80 ℃保存备用。
选取幼嫩的本氏烟草叶片用于亚细胞定位研究。
1.2 试验方法
1.2.1 RNA的提取与反转录 采用北京原平皓生物技术有限公司的EASYspin植物RNA快速提取试剂盒提取茎尖总RNA。采用Fermentas公司的RevertAid First-strand cDNA Synthesis Kit试剂盒进行反转录反应,具体步骤参考试剂盒说明书。将反转录产物稀释20倍用于qRT-PCR分析。
1.2.2 MDP0000749824.1基因在2个不同株型苹果品种茎尖中的转录水平分析 从苹果基因组数据库(https://www.rosaceae.org/species/malus/all)序列,据此设计qRT-PCR分析用引物(F:5′-GGTCATGTTTAGGAGGAAGG-3′;R:5′-CCAGCTCTTCCTCATCATAC-3′)。以苹果Actin(GenBank登录号:XM_017335931.1)作为内参基因(F:5′-CCAAAGGCTAATCGGGAGAAA-3′;R:5′-ACTGGCGTAGAGGGAAAGAACA-3′)。引物由上海生工公司合成。转录水平在实时荧光定量PCR仪Light Cycler® 480Ⅱ(Roche)上分析。qRT-PCR采用10 μL体系,包含1×LightCycler 480 Green Ⅰ Master(Roche)5.0 μL、模板cDNA 1.0 μL、正、反向引物(0.25 μmol/L)各0.5 μL、2.0 mmol/L MgCl2 3.0 μL。反应条件是95 ℃预变性10 min;95 ℃变性10 s,55 ℃退火10 s,72 ℃延伸20 s,共进行45个循环。PCR结束后,先升温至95 ℃ 5 s,再降温至65 ℃ 1 min,然后升温到97 ℃。在65~97 ℃的升温过程中收集荧光(每变化0.2 ℃收集1次荧光)。待温度冷却至40 ℃终止反应。每个反应3次重复。使用2-ΔΔCt方法[24]对荧光值的变化曲线进行分析,计算目的片段的转录水平。用SPSS软件对转录水平数据进行显著性差异分析。
1.2.3 MDP0000749824.1基因CDS序列克隆及特征分析 根据下载的CDS序列信息设计1对PCR引物(F:5′-ATGAGAGAAATCTTGCAC-3′;R:5′-TCAGTTCTCCAGCTCTTCCT-3′),以烟富3号、舞姿茎尖RNA的反转录产物为模板,PCR扩增程序为95 ℃预变性5 min;然后依次进行95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共30个循环;最终在72 ℃下终延伸10 min。从1%的琼脂糖凝胶上用试剂盒Agrose Gel DNA Recovery Kit Ver.2.0(TaKaRa)回收目的基因。将回收产物连接到pMD®18-T Simple Vector载体上,并转化到感受态细胞E.coli DH5α,然后进行测序,以获取该基因的全长CDS序列。用DNAMAN软件进行序列比对分析。
在苹果基因组数据库Apple Gene Set(https://www.rosaceae.org/species/malus/all)中搜索该基因序列,分析其外显子和内含子结构特点,并进行相应的染色体定位。
1.2.4 MDP0000749824.1蛋白理化性质及其进化分析 用在线软件Protparam(http://web.expasy.org/protparam/)分析蛋白理化性质;用SOMPA(http://www.expasy.ch/tools)和Phyre2在线软件(http://www.sbg.bio.ic.ac.uk/phyre2)对蛋白二级与三级结构进行分析;将MDP0000749824.1与NCBI中提交的梨、桃、油菜、拟南芥、水稻、高粱和玉米等物种的β-微管蛋白氨基酸序列进行比对分析,使用MEGA 7软件构建系统发育树。
1.2.5 MDP0000749824.1蛋白亚细胞定位 利用得到的苹果MDP0000749824.1全长CDS序列,通过引物(Up-5′-GGATCCATGGGGAGGGGAAAG/CCCAAGATGAAGGGCCGT-3′-Dn)引入酶切位点Kpn Ⅰ和Xba Ⅰ,以烟富3号苹果cDNA为模板进行PCR扩增。扩增程序:95 ℃变性3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃延伸10 min。使用Agrose Gel DNA Recovery Kit Ver.2.0(TaKaRa)胶回收试剂盒回收目的条带。用Kpn Ⅰ和Xba Ⅰ双酶切Cam35S-GFP空载体后,将所回收的目的片段和Cam35S-GFP空载体用重组连接酶连接,获得Cam35S-MDP0000749824-GFP重组载体,将重组载体转化至E.coli DH5α感受态细胞(Amp+)后进行菌落PCR检测,挑取阳性菌落用于测序验证。将融合载体转化农杆菌GV3101,在幼嫩的烟草叶片进行瞬时表达。使用激光共聚焦显微镜FV10-ASW(OLYMPUS)观察绿色荧光定位情况。
1.2.6 启动子克隆及序列分析 采用植物基因组DNA提取试剂盒(北京天根)提取基因组DNA。在苹果基因组中截取MDP0000749824.1基因编码序列上游约1 600 bp的参考序列,据此设计引物(F:5′-ACTTATCTGGAAATCACGCTCTT-3′;R:5′-GTTCCCACATTGTCCAG-3′)。分别以舞姿和烟富3号的DNA为模板,进行PCR扩增。PCR反应体系、扩增程序和后续的克隆转化以及测序分析等同1.2.3。利用在线软件PlantCare(http://bioinformatics.Psb.ugent.be/webtools/plantcare/html/)对启动子的顺式作用元件进行预测分析。
2 结果与分析
2.1 MDP0000749824.1在2个具有不同株型苹果品种茎尖中的转录水平比较
实时荧光定量PCR技术分析检测结果表明,MDP0000749824.1在柱型苹果品种舞姿茎尖中的转录水平显著低于普通型苹果品种烟富3号,后者约是前者的3.8倍(图1)。
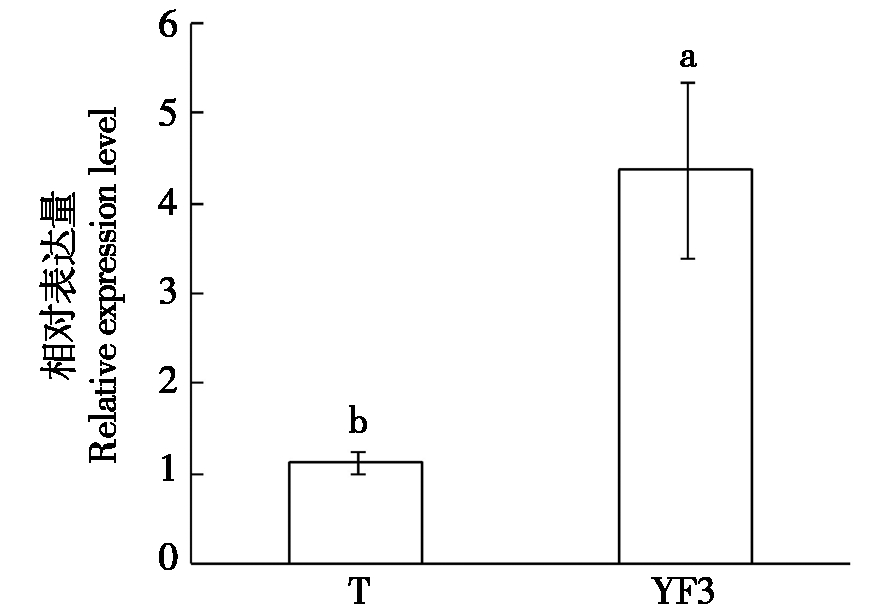
T.舞姿(柱型);YF3.烟富3号(普通型);不同小写字母表示差异显著(P≤0.05)。图7同。
T.Telamon(Colummar type);YF3.Yanfu 3(Standard type);Different lowercase letters mean significant difference at P≤0.05.The same as Fig.7.
图1 MDP0000749824.1在2个具有不同株型的苹果品种茎尖中的转录水平比较
Fig.1 Tanscriptional levels comparison of MDP0000749824.1 gene in apical stem between two apple varieties with different types of tree form
2.2 MDP0000749824.1基因结构与染色体定位
以柱型苹果品种舞姿及普通型苹果品种烟富3号新梢茎尖组织cDNA为模板,经MDP0000749824.1 CDS特异性引物PCR扩增后,均获得一段1 332 bp核苷酸序列。在苹果基因组中搜索发现,该基因位于16号染色体上(Chr16:16834724-16836980)(图2),整个基因含有3个外显子和2个内含子(图3)。DNAMAN比对结果表明,烟富3号和舞姿上该基因的编码序列完全一致。
2.3 MDP0000749824.1蛋白结构及理化性质分析
MDP0000749824.1基因编码一个含有443个氨基酸的蛋白质,含有植物β-微管蛋白的保守序列,包括微管蛋白GTP结合位点片段GGGTGSG和磷酸化位点片段MREI(图4)。
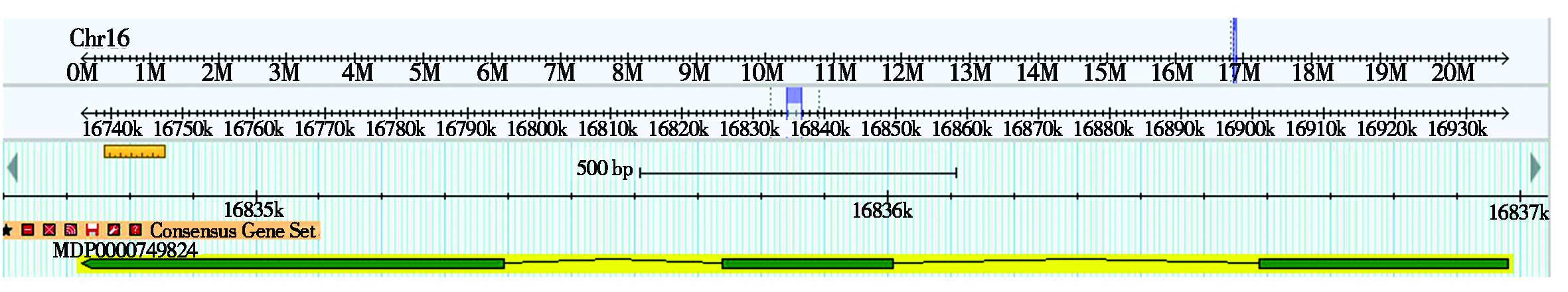
图2 MDP0000749824.1在苹果基因组中染色体上的位置
Fig.2 Chromosome position of MDP0000749824.1 in apple genome
在线软件ProtParam分析显示,MDP0000749824.1编码蛋白的分子式为C2192H3371N597O676S33,蛋白分子质量为49.96 ku,等电点pI为4.90,其中包含带正电残基(Arg+Lys)36个,带负电残基(Asp+Glu)57个。进一步分析表明,该蛋白的不稳定系数为31.74,脂肪系数为71.06,平均亲水性系数为-0.349。MDP0000749824.1蛋白亲水性分析发现,其C端偏向疏水性,N端偏向亲水性,亲水性与疏水性交替出现在该蛋白的中间部分,其中,达-2.0以下的亲水峰有9处,达2.0以上的疏水峰有2处。
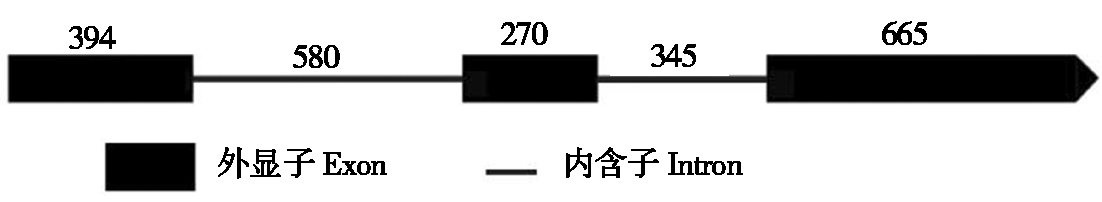
数字代表碱基数量。 Numbers represent the base length.
图3 MDP0000749824.1基因外显子及内含子结构特征
Fig.3 Structure of exons and introns for gene MDP0000749824.1

图4 MDP0000749824.1基因编码的氨基酸序列
Fig.4 Amino acid sequence encoded by gene MDP0000749824.1
利用SOPMA在线软件分析发现,MDP0000749824.1蛋白的二级结构中,α螺旋所占比例最大,为39.50%;不规则卷曲结构次之,比例为29.12%;β转角最少,仅为11.29%。用Phyre2预测MDP0000749824.1的三级结构的覆盖度为96%。
2.4 MDP0000749824.1蛋白亚细胞定位
克隆MDP0000749824.1全长CDS序列,构建了Cam35S-MDP0000749824.1-GFP融合载体,并将其转入烟草叶片上皮细胞中,激光共聚焦显微镜下的观察结果显示,该蛋白定位在细胞膜和微管中(图5)。

UV.绿色通道;DIC.明场通道;Merge.绿色和明场重叠通道;1.Cam35S-MDP0000749824.1-GFP烟草上皮细胞瞬时表达;2.空白对照。
UV.Green channel;DIC.Bright field channel;Merge.Overlays of green and bright field channel;1.Transient expression of Cam35S-MDP0000749824.1-GFP fusion protein in tobacco epidermis cells;2.Postive control.
图5 MDP0000749824.1蛋白在烟草叶片中的亚细胞定位
Fig.5 Subcellular location of protein MDP0000749824.1 in tobacco leaves
2.5 蛋白序列进化分析
将来自不同物种的高度同源的26条蛋白序列进行系统进化分析,结果发现,苹果的MDP0000749824.1与白梨(XP 009364903.1)、梅(XP 008220629.1)、碧桃(XP 007211186.1)等蔷薇科木本植物的相似性较大,而与玉米(NP 001167651.1)、水稻(pir||JC2510)、高粱(XP 002456503.2)、小立碗藓(XP 001767462.1)、拟南芥(NP 196786.1)等非木本植物的相似性较低(图6)。

图6 苹果MDP0000749824.1与其他物种同源蛋白的系统进化分析
Fig.6 Phylogenetic relationship among MDP0000749824.1 and other homologous proteins
2.6 启动子序列比对与顺式作用元件分析
分别以舞姿及烟富3号的DNA为模板,用启动子特异性引物PCR扩增后,均获得一段1 661 bp的核苷酸序列,二者有6处碱基差异(图7)。通过Neural Network Promoter Prediction软件(http://www.fruitfly.org/seq_tools/promoter.html)在线预测该启动子转录起始位点为翻译起始密码子上游700 nt的A碱基。序列中除存在多数启动子具有的基本转录元件外,还发现了一些顺式调控元件,如赤霉素、脱落酸、茉莉酸甲酯和水杨酸等激素响应元件,分生组织表达相关顺式调控元件和光调控元件等(表1)。然而,这6处差异均不在预测的调控元件位置。

方框内代表启动子上的顺式作用元件;TSS.转录起始位点;M.起始密码子。
The boxes represent the promoter cis-acting elements.TSS.Transcription start site;M.Start codon.
图7 两个不同苹果品种中MDP0000749824.1基因启动子序列比对分析
Fig.7 Alignment and analysis of promoter sequence for MDP0000749824.1 between two different apple varieties
表1 应用PlantCare在线预测的启动子区顺式作用元件
Tab.1 Cis-acting regulatory elements prediction of promoter sequence by PlantCare
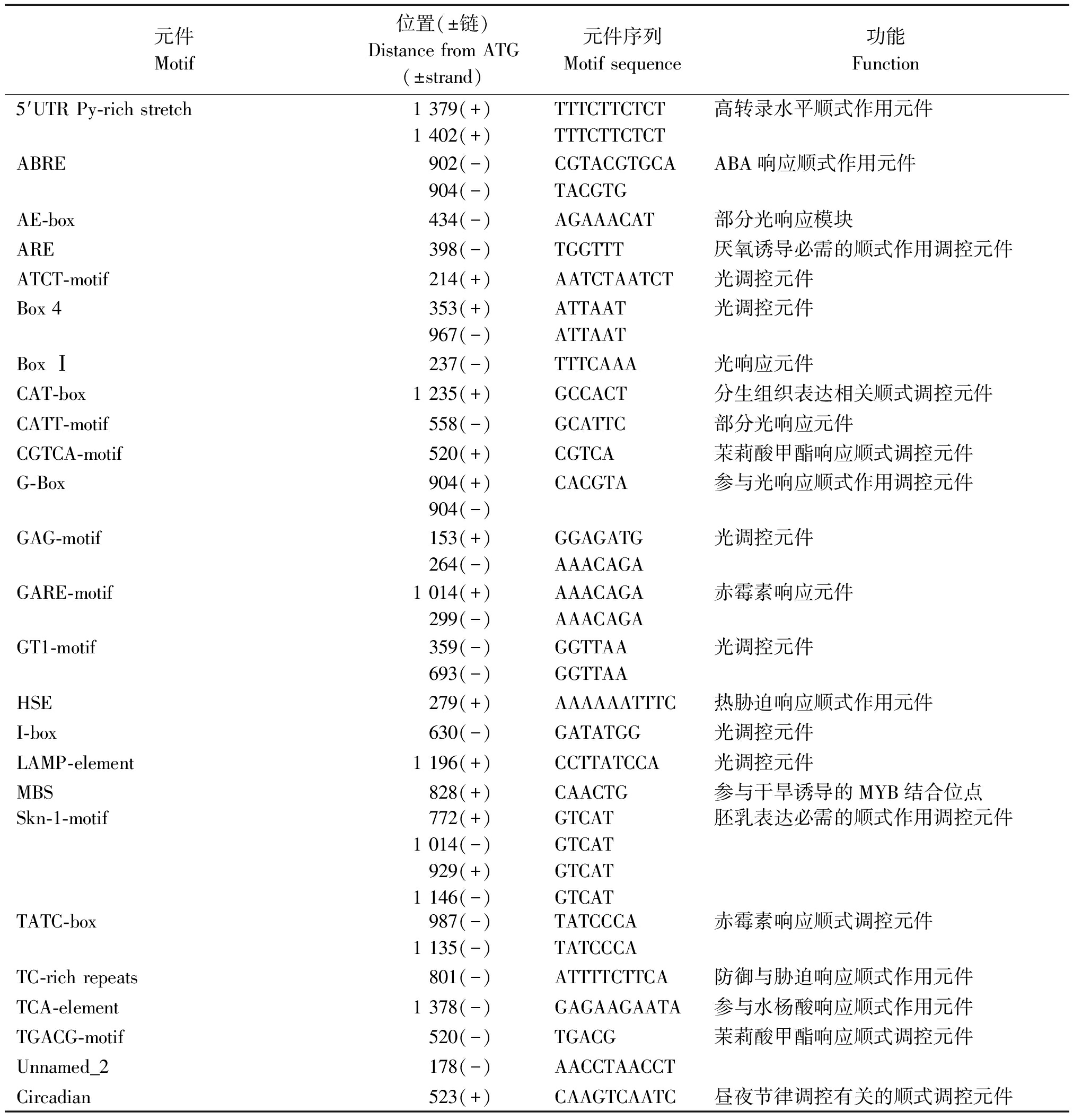
元件Motif位置(±链)Distance from ATG(±strand)元件序列Motif sequence功能Function5′UTR Py-rich stretch1 379(+)1 402(+)TTTCTTCTCTTTTCTTCTCT高转录水平顺式作用元件ABRE902(-)904(-)CGTACGTGCATACGTGABA响应顺式作用元件AE-box434(-)AGAAACAT部分光响应模块ARE398(-)TGGTTT厌氧诱导必需的顺式作用调控元件ATCT-motif214(+)AATCTAATCT光调控元件Box 4353(+)967(-)ATTAATATTAAT光调控元件Box Ⅰ237(-)TTTCAAA光响应元件CAT-box1 235(+)GCCACT分生组织表达相关顺式调控元件CATT-motif558(-)GCATTC部分光响应元件CGTCA-motif520(+)CGTCA茉莉酸甲酯响应顺式调控元件G-Box904(+)904(-)CACGTA参与光响应顺式作用调控元件GAG-motif153(+)264(-)GGAGATGAAACAGA光调控元件GARE-motif1 014(+)299(-)AAACAGAAAACAGA赤霉素响应元件GT1-motif359(-)693(-)GGTTAAGGTTAA光调控元件HSE279(+)AAAAAATTTC热胁迫响应顺式作用元件I-box630(-)GATATGG光调控元件LAMP-element1 196(+)CCTTATCCA光调控元件MBS828(+)CAACTG参与干旱诱导的MYB结合位点Skn-1-motif772(+)1 014(-)929(+)1 146(-)GTCATGTCATGTCATGTCAT胚乳表达必需的顺式作用调控元件TATC-box987(-)1 135(-)TATCCCATATCCCA赤霉素响应顺式调控元件TC-rich repeats801(-)ATTTTCTTCA防御与胁迫响应顺式作用元件TCA-element1 378(-)GAGAAGAATA参与水杨酸响应顺式作用元件TGACG-motif520(-)TGACG茉莉酸甲酯响应顺式调控元件Unnamed_2178(-)AACCTAACCTCircadian523(+)CAAGTCAATC昼夜节律调控有关的顺式调控元件
3 讨论
柱型苹果因极其紧凑的生长习性,非常适合高密度种植。因此,苹果柱型性状形成的生理机制以及分子机制一直是众多学者探讨的热点问题[25-33]。
微管作为细胞骨架的重要组成,对植物的生长发育是有重要影响的。微管蛋白不仅在保持细胞的形态方面起支撑作用,而且对细胞壁的形成也起到了决定性作用,同时,还参与了细胞运动与细胞内物质运输。因此,微管蛋白的合成会直接影响到细胞的生长与分裂,因而可能会对茎的伸长生长造成影响。本试验通过同源克隆的方法获得了苹果微管蛋白基因MDP0000749824.1的CDS和启动子序列。通过qRT-PCR分析发现,MDP0000749824.1基因在柱型苹果品种舞姿茎尖中的转录水平明显低于普通型苹果品种烟富3号。但序列比对分析表明,这2个品种中,该基因的编码序列没有差异。尽管二者在启动子序列上检测到6处碱基差异,但均不在重要调控元件位置。可见,该基因的表达差异不应该是由于两品种间其特异的序列差异引起的,而极有可能是受到了柱型基因调控的影响。进一步研究发现,MDP0000749824.1基因启动子序列上存在多个与脱落酸、赤霉素、茉莉酸甲酯和水杨酸等激素调节相关的元件。前人研究发现,柱型苹果茎尖中自由型IAA和CTK的含量明显高于普通型苹果,且柱型苹果茎尖组织中的活性赤霉素含量明显偏低[34-38],可见,柱型性状的形成与激素调控密切相关。因此,该基因在2个品种上的转录水平差异可能是由2种不同株型间的内源激素水平差异导致的。
苹果柱型性状产生的根源取决于位于10号染色体上的Co基因,围绕该基因的分离鉴定尽管已经作了大量的研究[28-29,33],但目前仍难给出最终的定论。柱型表型应该是受Co基因牵动的一个分子网络调控的综合效应。根据本研究结果,笔者推测,β-微管蛋白基因MDP0000749824.1是位于Co调控网络中的一个重要成员,Co基因是通过对内源激素的影响,使该微管蛋白的合成受阻,最终影响到了茎的伸长,致使节间变短,植株矮化。关于这个问题,笔者将进一步设计研究方案,并作进一步的深入探讨。
参考文献:
[1] 高囡囡,鲍 岚. 微管蛋白的翻译后修饰及功能研究[J]. 生命科学,2015,27(3):363-373.
[2] Rasmussen C G,Wright A J,Müller S. The role of the cytoskeleton and associated proteins in determination of the plant cell division plane[J]. The Plant Journal :for Cell and Molecular Biology,2013,75(2):258-269.
[3] Krtková J,Benáková M,Schwarzerová K. Multifunctional microtubule-associated proteins in plants[J]. Frontiers in Plant Science,2016,7(436):474.
[4] Hiwatashi Y,Sato Y,Doonan J H. Kinesins have a dual function in organizing microtubules during both tip growth and cytokinesis in Physcomitrella patens[J]. The Plant Cell,2014,26(3):1256-1266.
[5] Paredez A R,Somerville C R,Ehrhardt D W. Visualization of cellulose synthase demonstrates functional association with microtubules[J]. Science,2006,312(5779):1491-1495.
[6] Lindeboom J,Mulder B M,Vos J W,et al. Cellulose microfibril deposition:coordinated activity at the plant plasma membrane[J]. Journal of Microscopy,2008,231(2):192-200.
[7] Gutierrez R,Lindeboom J J,Paredez A R,et al. Arabidopsis cortical microtubules position cellulose synthase delivery to the plasma membrane and interact with cellulose synthase trafficking compartments[J]. Nature Cell Biology,2009,11(7):797-806.
[8] Onelli E,Idilli A I,Moscatelli A. Emerging roles for microtubules in angiosperm pollen tube growth highlight new research cues[J]. Frontiers in Plant Science,2015,6:51.
[9] Catterou M,Dubois F,Schaller H,et al. Brassinosteroids,microtubules and cell elongation in Arabidopsis thaliana. Ⅱ. Effects of brassinosteroids on microtubules and cell elongation in the bul1 mutant[J]. Planta,2001,212(5/6):673-683.
[10] Hardham A R. Microtubules and biotic interactions[J]. The Plant Journal:for Cell and Molecular Biology,2013,75(2):278-289.
[11] Microtubules N P. Signalling and abiotic stress[J]. Plant Journal,2013,75(2):309.
[12] Wang W Z,Lazareva E,Kyreev I,et al. The role of microtubules in the maintenance of regular localization and arrangement of Golgi apparatus in root cells of Triticum aestivum L.[J]. Process Biochemistry,2012,47(11):1545-1551.
[13] Hamada T,Ueda H,Kawase T,et al. Microtubules contribute to tubule elongation and anchoring of endoplasmic reticulum,resulting in high network complexity in Arabidopsis[J]. Plant Physiology,2014,166(4):1869-1876.
[14] Liaud M F,Brinkmann H,Cerff R. The beta-tubulin gene family of pea:primary structures,genomic organization and intron-dependent evolution of genes[J]. Plant Molecular Biology,1992,18(4):639-651.
[15] Snustad D P,Haas N A,Kopczak S D,et al. The small genome of Arabidopsis contains at least nine expressed beta-tubulin genes[J]. The Plant Cell,1992,4(5):549-556.
[16] Oakley R V,Wang Y S,Ramakrishna W,et al. Differential expansion and expression of alpha-and beta-tubulin gene families in Populus[J]. Plant Physiology,2007,145(3):961-973.
[17] Villemur R,Joyce C M,Haas N A,et al. Alpha-tubulin gene family of maize(Zea mays L.). Evidence for two ancient alpha-tubulin genes in plants[J]. Journal of Molecular Biology,1992,227(1):81-96.
[18] Villemur R,Haas N A,Joyce C M,et al. Characterization of four new beta-tubulin genes and their expression during male flower development in maize(Zea mays L.)[J]. Plant Molecular Biology,1994,24(2):295-315.
[19] Yoshikawa M,Yang G,Kawaguchi K,et al. Expression analyses of beta-tubulin isotype genes in rice[J]. Plant & Cell Physiology,2003,44(11):1202-1207.
[20] 侯董亮,王彩虹,田义轲,等. 梨β-微管蛋白基因及其在矮生型与普通型梨茎尖中的表达差异[J]. 园艺学报,2016,43(2):320-328.
[21] Gavazzi F,Pigna G,Braglia L,et al. Evolutionary characterization and transcript profiling of β-tubulin genes in flax(Linum usitatissimum L.)during plant development[J]. BMC Plant Biology,2017,17(1):237.
[22] 睢金凯,饶国栋,张建国. 柳树β-微管蛋白基因家族的克隆和序列分析[J]. 西北植物学报,2016,36(5):902-909.
[23] Rao G,Zeng Y,He C,et al. Characterization and putative post-translational regulation of α-and β-tubulin gene families in Salix arbutifolia[J]. Scientific Reports,2016,6:19258.
[24] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J]. Methods,2001,25(4):402-408.
[25] Blazek J. Segregation and general evaluation of spur type or compact growth habits in apples[J]. Acta Horticulturae,1992,317(317):71-80.
[26] Fallahi E,Simons B R,Fellman J K,et al. Tree growth and productivity and postharvest fruit-quality in various strains of delicious apple[J]. Journal of the American Society for Horticultural Science,1994,119(3):389-395.
[27] 杨佩芳,郝燕燕,田彩芳. 苹果短枝型品种导管分子的解剖学研究[J]. 园艺学报,2000,27(1):52-54.
[28] Bai T,Zhu Y,Fernández-Fernández F,et al. Fine genetic mapping of the Co locus controlling columnar growth habit in apple[J]. Molecular Genetics and Genomics,2012,287(5):437-450.
[29] Moriya S,Okada K,Haji T,et al. Fine mapping of Co,a gene controlling columnar growth habit located on Apple(Malus × domestica Borkh.)linkage group 10[J]. Plant Breeding,2012,131(5):641-647.
[30] Zhang Y G,Guo S X,Dai H Y. Morphological differences of vessels in the secondary xylem of columnar and standard apple trees[J]. Phyton,International Journal of Experimental Botany,2012,81(1):229-232.
[31] 宋 杨,张艳敏,吴树敬,等. 短枝型苹果赤霉素受体基因MdGID1a及其启动子克隆和表达分析[J]. 园艺学报,2013,40(11):2237-2244.
[32] Talwara S,Grout B,Toldam-Andersen T B. Modification of leaf morphology and anatomy as a consequence of columnar architecture in domestic apple(Malus ×domestica Borkh.)trees[J]. Scientia Horticulturae,2013,164(2):310-315.
[33] Wolters P J,Schouten H J,Velasco R,et al. Evidence for regulation of columnar habit in apple by a putative 2OG-Fe(Ⅱ)oxygenase[J]. The New Phytologist,2013,200(4):993-999.
[34] Lee J M,Looney N E. Absisic acid levels and genetic compaction in apple seedlings[J]. Canadian Journal of Plant Science,1977,57(1):81-85.
[35] Looney N E,Lane W D. Spur-type growth mutants of McIntosh apple a review of their genetics,physiology and field performance[J]. Acta Horticulturae,1984,146(146):31-46.
[36] Watanabe M,Suzuki A,Komori S,et al. Comparison of endogenous IAA and cytokinins in shoots of columnar and normal type apple trees[J]. Engei Gakkai Zasshi,2004,73(1):19-24.
[37] Watanabe M,Bessho H,Suzuki A,et al. Seasonal changes of IAA and cytokinin concentration in shoots of columnar type apple trees[J]. Acta Horticulturae,2008,774(774):75-80.
[38] Krost C,Petersen R,Lokan S,et al. Evaluation of the hormonal state of columnar apple trees(Malus × domestica)based on high throughput gene expression studies[J]. Plant Molecular Biology,2013,81(3):211-220.