猕猴桃(Actinidia deliciosa(A.Chev.)C.F.Liang et A.R.Ferguson)富含多种人体必需的营养元素,因此,猕猴桃在世界范围内都广受欢迎 [1]。我国是猕猴桃最大生产国,其中陕西省猕猴桃种植面积与产量已达到6.1万hm2和103.4万t,位居全国第一 [2]。猕猴桃是多年生果树,且比一般果树吸收土壤营养更多,一般通过施肥向土壤补充树体生长发育所需的营养。农民长期凭经验盲目施肥,导致土壤品质严重下降,威胁猕猴桃产业的健康发展 [3]。目前,应对猕猴桃园土壤病害主要采用化学药剂灌根、翻土晾晒、加大化肥用量等方法 [4],不仅效果不理想,反而进一步加剧了猕猴桃果园土壤品质的下降。科学合理施肥和提高肥料利用率是从根本上改良土壤的关键所在,其中向土壤中投加生物菌肥则是目前的研究热点之一。
生物菌肥由有益微生物发酵而成,能改善土壤根际环境、抑制土传病害的生物性肥料 [5]。生物菌肥兼具微生物肥料和有机肥的双重效应,既有利于提高产品品质,增产增收,又可培肥土壤,提高土壤酶活性,改善土壤微生物群落结构 [6]。在有益微生物中,枯草芽孢杆菌具有抑制病原菌生长、提高土壤酶活力等作用,是一种应用广泛的生防菌 [7];解磷细菌由于可以定殖在植株根际,并分泌有机酸和磷酸酶使土壤速效磷含量升高,从而促进植株生长 [8]。腐植酸是一种具有较强离子交换能力和吸附能力的新型肥料,不仅可以促进作物产量提升,还能改善土壤肥力 [9]。将有益微生物添加到腐植酸中制成生物菌肥,近几年来在蔬菜方面的研究硕果累累,能够显著提高番茄、辣椒等蔬菜产量 [10-11]。
生物菌肥对高龄猕猴桃根际土壤的微生物、酶活性等研究相对较少,尤其是生物菌肥对猕猴桃整个生长周期内果园土壤酶活性及养分的动态影响过程更是罕见报道。本研究旨在验证腐植酸微生物肥料在猕猴桃果园土壤改良及果实品质的影响,以期为生物菌肥在猕猴桃上的合理利用提供指导。
1 材料和方法
1.1 试验地概况
本试验于2016年3月-2017年3月在陕西省眉县金渠村(E.107.79°,N.34.21°)进行。
1.2 试验材料
供试猕猴桃品种为秦美,树龄20年。
试验所用菌株解磷菌与生防菌均为西北农林科技大学生命科学学院曹翠玲教授实验室前期试验中从猕猴桃根际土壤中分离得到。解磷菌为巨大芽孢杆菌(Bacillus megaterium),发酵液有效菌数为2.35×108 cfu/mL;生防菌为枯草芽孢杆菌(Bacillus subtilis),菌剂有效菌数为2.40×108 cfu/g;腐植酸为西蒙兰恩牌高活性腐植酸(腐植酸≥38%、水溶性腐植酸≥25%、有机质≥56%、pH值8~10)。试验所用微生物肥料均为本实验室制备,且符合国家菌肥生产标准(GB 20287-2006)农用微生物菌剂之要求。
1.3 试验设计与样品采集
试验设置3个处理:JY.500 g腐植酸+解磷菌500 mL;KY.500 g腐植酸+生防菌500 g;JKY.500 g腐植酸+解磷菌250 mL+生防菌250 g;CK.以农户传统施肥方式(在发芽期时施用,氮磷钾含量分别为:25∶10∶5)为对照。随机选取园内长势一致的健康植株20株,每一处理重复5次。根据一般猕猴桃根系分布情况,采用环施法,将以树干为中心,50 cm为半径、20 cm深的表层土移开,把肥料均匀撒施后将土回填。随后的田间管理由农户统一进行。
在猕猴桃各生长期,于树干50 cm半径内,采集15~20 cm深的根系土,取部分鲜土测定土壤微生物群落结构,其余土风干后过孔径为0.154 mm筛测定土壤酶活性及理化性质。采样时间分别为:2016年3月29日(发芽期,测定空白土性质)、2016年5月10日(开花期)、2016年7月5日(膨大期)、2016年10月15日(果实成熟期)及2017年4月1日(次年发芽期)。在果实成熟期时,采集猕猴桃果实(在果树距地面2.0~2.3 m的高度、东南西北各方向上取大小一致的熟果4个,16个/棵),测定猕猴桃果实品质。
1.4 测定指标及方法
1.4.1 土壤微生物群落测定 稀释涂布平板计数法对细菌、真菌、酵母菌及放线菌数量进行测定。土壤细菌数量采用牛肉膏蛋白胨培养基测定;土壤放线菌数量采用高氏1号培养基测定,土壤真菌、酵母菌数量采用孟加拉红培养基测定[12]。
1.4.2 土壤酶活性测定 蔗糖酶活性用3,5-二硝基水杨酸比色法测定,以1 g土1 d后催化产生的葡萄糖的毫克数表示;脲酶活性用靛酚蓝比色法测定,以1 g土1 d后催化产生的NH3-N的毫克数表示;蛋白酶活性用茚三酮比色法测定,以1 g土1 d后催化产生的甘氨酸的微摩尔数表示;多酚氧化酶活性用焦性没食子酸比色法测定,以1 g土1 h后催化产生的紫色没食子素的毫克数表示;磷酸酶活性用磷酸苯二钠法测定,以1 g土1 h后催化产生的苯酚的微克数表示 [13]。
1.4.3 土壤理化性质 土壤全氮用凯氏定氮法测定;土壤硝态氮和铵态氮含量利用AA3型流动分析仪测定;土壤全磷含量用HClO4-H2SO4消解-钼锑抗显色法测定;土壤速效磷含量利用NaHCO3浸提-钼锑抗比色法测定;土壤全钾利用NaOH熔融-火焰分光光度法测定;土壤速效钾利用NH4OAc浸提-火焰分光光度法测定。土壤有机质含量利用重铬酸钾容量法(外加热法)测定;土壤pH值利用pH计测定 [14]。
1.4.4 果实品质 对新采的果实利用天平测定单果重,用GY-1型硬度计测定果实硬度;当果实硬度达到1.0~1.2时,采用蒽酮比色法测定果实可溶性糖含量,采用NaOH 滴定法测定并以柠檬酸计果实可滴定酸含量,以钼蓝比色法测定果实抗坏血酸含量 [15]。果实产量由果农收获后记录得到。
1.5 数据处理
所得数据利用Microsoft Excel 2007处理汇总并进行灰度关联分析,采用SPSS 23.0软件进行统计分析和差异显著性分析,并用Origin Pro 9.0作图(LSD法,P<0.05)。
2 结果与分析
2.1 不同腐植酸复合微生物肥料处理对土壤微生物数量的影响
表1 不同处理对土壤微生物结构的影响
Tab.1 The influence of different treatment on soil microbiology structure
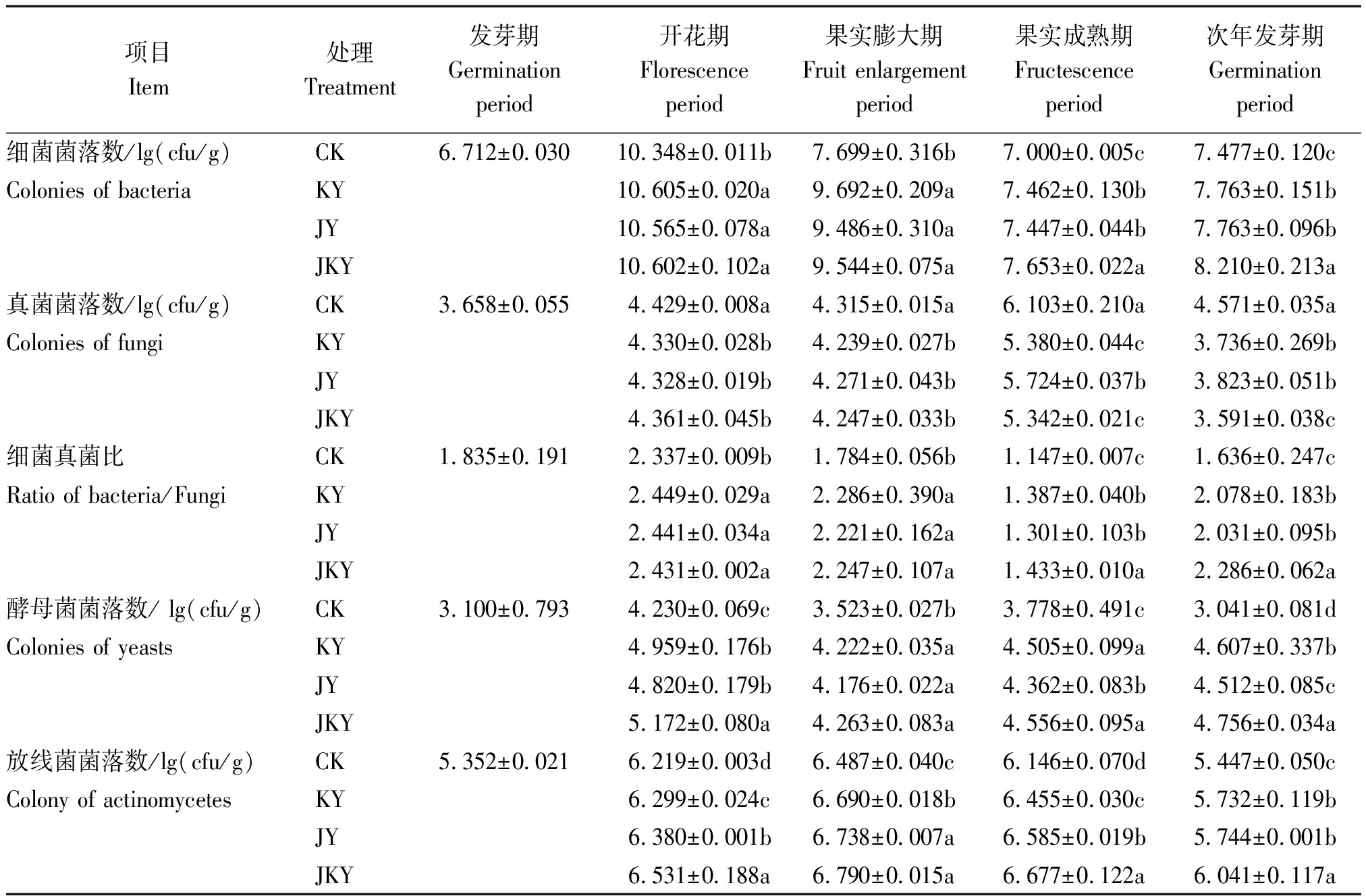
项目Item处理Treatment发芽期Germination period开花期Florescence period果实膨大期Fruit enlargement period果实成熟期Fructescence period次年发芽期Germination period细菌菌落数/lg(cfu/g)CK6.712±0.030 10.348±0.011b 7.699±0.316b7.000±0.005c 7.477±0.120c Colonies of bacteriaKY10.605±0.020a9.692±0.209a 7.462±0.130b 7.763±0.151b JY10.565±0.078a 9.486±0.310a 7.447±0.044b 7.763±0.096b JKY10.602±0.102a 9.544±0.075a 7.653±0.022a 8.210±0.213a 真菌菌落数/lg(cfu/g)CK3.658±0.055 4.429±0.008a 4.315±0.015a 6.103±0.210a 4.571±0.035a Colonies of fungiKY4.330±0.028b 4.239±0.027b 5.380±0.044c 3.736±0.269b JY4.328±0.019b 4.271±0.043b 5.724±0.037b 3.823±0.051b JKY4.361±0.045b 4.247±0.033b 5.342±0.021c 3.591±0.038c 细菌真菌比CK1.835±0.1912.337±0.009b 1.784±0.056b 1.147±0.007c 1.636±0.247c Ratio of bacteria/FungiKY2.449±0.029a 2.286±0.390a 1.387±0.040b 2.078±0.183b JY2.441±0.034a 2.221±0.162a 1.301±0.103b2.031±0.095b JKY2.431±0.002a 2.247±0.107a 1.433±0.010a 2.286±0.062a 酵母菌菌落数/ lg(cfu/g)CK3.100±0.793 4.230±0.069c 3.523±0.027b 3.778±0.491c 3.041±0.081d Colonies of yeastsKY4.959±0.176b 4.222±0.035a 4.505±0.099a 4.607±0.337bJY4.820±0.179b4.176±0.022a 4.362±0.083b 4.512±0.085c JKY5.172±0.080a 4.263±0.083a 4.556±0.095a 4.756±0.034a 放线菌菌落数/lg(cfu/g)CK5.352±0.0216.219±0.003d 6.487±0.040c 6.146±0.070d 5.447±0.050cColony of actinomycetesKY6.299±0.024c 6.690±0.018b 6.455±0.030c 5.732±0.119b JY6.380±0.001b 6.738±0.007a 6.585±0.019b 5.744±0.001b JKY6.531±0.188a 6.790±0.015a 6.677±0.122a 6.041±0.117a
注:数值是平均值与3次重复的标准误,不同小写字母表示同一时期不同处理间差异显著(P﹤0.05)。表2-3同。
Note:Values are given as mean±SD from triplicate determinations,different small letters meant significant difference among treatments at the same stage at 0.05 level. The same as Tab.2-3.
由表1可知,3种腐植酸复合微生物肥料处理均可以显著提高猕猴桃土壤细菌数量,降低土壤真菌数量(以鲜质量计),进而促使土壤细菌真菌比升高,其中,JKY的作用最为显著,整体表现为:JKY>KY>JY>CK。处理组能够显著提高土壤酵母菌数量(以鲜质量计),这种对酵母菌的生长促进作用一直持续到次年发芽期,且JKY的促进作用好于KY、JY。同时,各处理的土壤放线菌数量也显著高于对照,整体表现为:JKY>JY>KY>CK。解磷菌和生防菌混施的JKY在促进细菌真菌比升高、酵母菌增多、放线菌数量提升上效果显著。另外,微生物数量在猕猴桃整个生长周期内的变化趋势可能与气候、温度及猕猴桃的生长特点有关。
2.2 不同腐植酸复合微生物肥料处理对土壤酶活性的影响
土壤酶是土壤生物化学作用的驱动力,是表征土壤肥力的指标,与微生物、理化性质密切相关 [16]。根据猕猴桃不同生长时期酶活性变化结果(图1)可以看出,5种土壤酶活性整体受气候变化和猕猴桃生理阶段影响比较大,因此,温度较高且果树生理活动剧烈的果实膨大期各酶活性最高。
由图1可知,在开花期时,JKY蔗糖酶活性比KY、JY、CK分别高15.06%,18.25%,70.15%,磷酸酶活性分别高8.56%,5.10%,60.23%,蛋白酶活性分别高7.95%,15.23%,126.12%,脲酶活性分别高45.27%,19.23%,142.57%,多酚氧化酶活性分别高19.76%,28.76%,106.22%,各处理均显著高于CK。
在果实膨大期,JKY蔗糖酶的活性比KY、JY、CK分别高28.65%,32.36%,48.65%,磷酸酶活性分别高16.17%,4.85%,41.31%,蛋白酶活性分别高2.69%,5.02%,13.74%,脲酶活性分别高12.28%,2.13%,21.17%,多酚氧化酶活性分别高11.49%,25.97%,110.87%。
在果实成熟期时,JKY蔗糖酶活性比KY、JY、CK分别高38.87%,27.90%,255.51%,磷酸酶活性分别高26.16%,10.94%,45.20%,蛋白酶活性分别高11.54%,20.00%,34.37%,脲酶活性分别高62.30%,8.32%,177.41%,多酚氧化酶活性分别高2.11%,24.15%,182.04%。
次年发芽期时,JKY蔗糖酶活性比KY、JY、CK分别高31.14%,30.63%,126.88%,磷酸酶活性分别高6.21%,5.47%,30.23%,蛋白酶活性分别高4.31%,26.95%,59.79%,脲酶活性分别高0.57%,3.02%,68.63%,多酚氧化酶活性分别高17.95%,54.36%,107.21%。这一时期,JKY、KY间磷酸酶、多酚氧化酶活性差异不显著。由上述分析可知,在猕猴桃的整个生长周期内,3个施加腐植酸复合微生物肥料组的5种土壤酶活性均显著高于采用传统施肥方式的对照组,其中腐植酸复合微生物肥料JKY对土壤酶活性的提升效果最好。

A.发芽期;B.开花期;C.果实膨大期;D.果实成熟期;E.次年发芽期;数值是平均值与3次重复的标准误;不同小写字母表示同一时期不同处理间差异显著(P﹤0.05)。
A.Germination period;B.Florescence period;C.Fruit enlargement period;D.Fructescence period;E.Germination period;Values are given as mean±SD from triplicate determinations;Different small letters meant significant difference among treatments at the same stage at 0.05 level.
图1 不同处理对土壤酶活性的影响
Fig.1 Effects of different treatments on soil enzyme activities
2.3 不同腐植酸复合微生物肥料处理对土壤理化性质的影响
2.3.1 不同处理对土壤氮素含量的影响 土壤全氮含量相对稳定,相同时期各处理的全氮含量变化不大;土壤中硝态氮和铵态氮是土壤有效氮的主要形式,也是植株与微生物主要的利用形式。由表2可知,JKY、KY、JY组土壤全氮含量在猕猴桃各生长时期均显著高于CK组,而3组间差异不显著。JKY、KY、JY对土壤硝态氮含量有显著促进作用,处理间整体趋势为:JKY>KY>JY>CK(P<0.05);其中,在开花期时,JKY组土壤硝态氮含量比KY、JY、CK分别高12.14%,48.08%,111.11%,这一时期猕猴桃需要吸收氮素供给新生器官的生长;在果实膨大期时,植株吸收氮素营养供给果实,对果实产量与品质至关重要,是植株吸收氮素的第2个高峰。土壤铵态氮被果树吸收后可以转化为谷氨酰胺,在呼吸作用、光合作用及蛋白质合成上具有重要作用 [17]。果实膨大期和成熟期可利用的有效氮含量高,有利于猕猴桃果实营养的累积 [18],铵态氮含量表现为:JKY>KY>JY>CK(P<0.05)。
2.3.2 不同处理对土壤磷素含量的影响 磷元素参与许多重要的生理过程,是果树生长发育的物质基础,其中在猕猴桃果实生长时期吸收的磷占全部磷吸收量的55.39% [19]。由表2可知,施加腐植酸复合微生物肥料各组的土壤速效磷含量高于CK组,其中,果实膨大期时各组速效磷含量最高,此时JKY组土壤速效磷含量比KY、JY、CK组分别高出25.58%,12.28%,53.69%;开花期与次年发芽期时,JKY、KY、JY无显著差异;在果实膨大期、果实成熟期时,JKY和JY组土壤速效磷含量显著高于KY,其中成熟期,分别高出25.21%,23.46%(P<0.05)。JY的土壤速效磷含量高于KY,可能是由于JY中添加了解磷菌。猕猴桃的整个生长周期内,各组间土壤全磷含量变化总体表现为:JKY>JY>KY>CK,其中,施加腐植酸复合微生物肥料的3组高于传统施肥组,且均达到了显著水平。
表2 各处理对土壤理化性质的影响
Tab.2 The influence of different treatment on soil physical and chemical properties

生长时期Growth period处理Treatmentunit全氮/(g/kg)Soil total nitrogen 硝态氮/(mg/kg)Nitrate nitrogen铵态氮/(mg/kg)Ammonium nitrogen全磷/(g/kg)Total phosphorus速效磷/(mg/kg)Available phosphorus全钾/(g/kg)Total potassium速效钾/(g/kg)Available potassium有机质/(g/kg)Organic matterpH发芽期CK0.21±0.0113.61±0.307.42±0.403.18±0.04149.01±2.762.64±0.160.17±0.0129.52±0.157.97±0.02GerminationKYperiodJYJKY开花期 CK0.22±0.02b26.02±0.29d9.37±0.62b3.12±0.10d165.37±3.51b3.49±0.00c0.19±0.00b29.79±0.22b7.95±0.02aFlorescenceKY0.29±0.00a48.75±0.37b14.92±0.45a4.00±0.03c196.37±3.07a4.47±0.01ab0.24±0.01a33.88±0.90a7.74±0.06bcperiodJY0.28±0.01a36.92±1.00c15.03±1.39a4.57±0.09b198.48±1.42a4.23±0.35b0.20±0.00a33.29±0.80a7.77±0.03bJKY0.30±0.02a54.67±0.47a16.68±1.38a5.00±0.07a201.58±8.92a4.73±0.36a0.26±0.00a34.99±0.42a7.69±0.02c果实膨大期 CK0.24±0.01b20.56±0.58d15.97±0.43c3.05±0.28d177.12±7.52d3.75±0.36b0.35±0.03b30.24±0.56c7.83±0.02aFruit enlargementKY0.29±0.00a48.10±0.98b18.39±1.30b4.06±0.06c216.77±0.00c5.24±0.39a0.42±0.00a34.99±0.67b7.58±0.08bperiodJY0.29±0.00a35.27±3.06c16.83±0.35c4.29±0.03b242.44±2.83b5.24±0.35a0.40±0.00a34.05±0.60b7.67±0.02bJKY0.29±0.01a52.43±1.29a21.82±0.12a4.55±0.03a272.21±10.16a6.72±0.35a0.43±0.01a36.68±1.26a7.58±0.08b果实成熟期CK0.21±0.00b19.72±0.09d17.38±2.25b2.34±0.00b164.30±8.87c2.50±0.00d0.21±0.01d29.49±0.99c7.79±0.07aFructescenceKY0.32±0.01a33.01±0.71b19.18±0.72ab4.15±0.00a172.99±1.53b4.58±0.59b0.25±0.00b35.16±0.70ab7.42±0.04bc periodJY0.30±0.05a31.20±0.73c17.81±1.82b4.23±0.52a213.57±0.59a3.33±0.00c0.23±0.00c34.65±0.62b7.43±0.03bJKY0.32±0.02a42.80±0.80a21.53±2.46a4.30±0.17a216.60±4.60a5.83±0.00a0.26±0.00a36.30±1.05a7.33±0.04c次年发芽期CK0.21±0.00b7.55±0.18d8.44±0.13c1.83±0.00c93.96±4.74b2.22±0.00d0.19±0.00c28.87±2.31b7.83±0.01aGermination KY0.32±0.02a12.18±0.35b10.67±0.02b2.22±0.00b110.46±2.15a4.16±0.01b0.22±0.01b35.00±0.35a7.42±0.02bperiodJY0.32±0.00a13.49±0.23c11.12±1.09b2.20±0.15b114.99±1.12a3.89±0.48c0.21±0.00b35.43±0.76a7.37±0.10bJKY0.33±0.01a16.46±0.83a17.16±0.07a2.41±0.02a125.86±9.86a5.26±0.49a0.25±0.02a36.15±2.84a7.35±0.03b
2.3.3 不同处理对土壤钾素含量的影响 钾元素可以促进果树果实产量和品质的提高,有“品质元素”的美誉 [20],猕猴桃在果实生长时期钾素需求最为旺盛,占整个生理时期的74.28%,因此,果实膨大期时土壤钾素含量最高。由表2可知,各施加腐植酸复合微生物肥料组的土壤速效钾含量均显著高于CK组(P<0.05),其中,在果实膨大期,JKY组土壤速效钾含量分别较KY、JY、CK组高2.38%,7.50%,22.86%(P<0.05);果实成熟期时,JKY组分别较KY、JY、CK组高4.00%,13.04%,21.00%(P<0.05)。 3种腐植酸复合微生物肥料均能显著提高土壤全钾含量,其中JKY组和KY组对土壤全钾含量的影响更为显著。
2.3.4 不同处理对土壤pH值及有机质含量的影响 如表2所示,施加3种腐植酸复合微生物肥料后,土壤pH值均降低。在处理1年后的次年发芽期,JKY、KY、JY组土壤pH值分别较CK组降低了0.48,0.41,0.46个单位(P<0.05)。在猕猴桃的整个生长周期内,JKY、KY、JY组土壤pH值分别比CK组降低了0.25~0.48个单位,0.21~0.41个单位,0.16~0.46个单位。
猕猴桃各生长时期,JKY、KY、JY组土壤有机质含量均显著高于CK(表2)。其中,在果实膨大期时,各处理的土壤有机质含量最高,此时JKY组比KY、JY、CK组分别高4.83%,7.72%,21.30%;果实成熟期时,JKY组比KY、JY、CK组分别高3.24%,4.76%,23.09%(P<0.05)。
2.4 不同腐植酸复合微生物肥料处理对猕猴桃产量和品质的影响
从表3可以看出,3种腐植酸复合微生物肥料处理均能明显提高猕猴桃果实产量,JKY、KY、JY组别较CK组增产34.38%,25.00%,28.13%。同时3种复合微生物肥料处理组单果重也显著提高,分别是CK组的1.21,1.19,1.25倍,3组之间无显著差异。刚采摘时的果实硬度一定程度上反映猕猴桃的保鲜能力,本研究结果显示,3种复合微生物肥料处理的猕猴桃果实硬度均显著高于CK组,分别较其高出37.03%,46.86%,38.36%。从表3还可以看出,JKY组的可溶性糖含量显著高于KY、JY及CK组,分别是该3个处理组的1.20,1.13,1.25倍。根据国家绿色食品标准NY/T 425-2000,猕猴桃可滴定酸含量(以柠檬酸含量计)应不高于1.5%,本研究中复合微生物肥料处理组的果实可滴定酸含量均符合这一标准且低于CK组(JKY、KY、JY组分别较CK低8.95,4.96,9.40个百分点)。
表3 不同菌剂处理对猕猴桃产量及品质的影响
Tab.3 The influence of different treatment on output and quality of kiwifruit
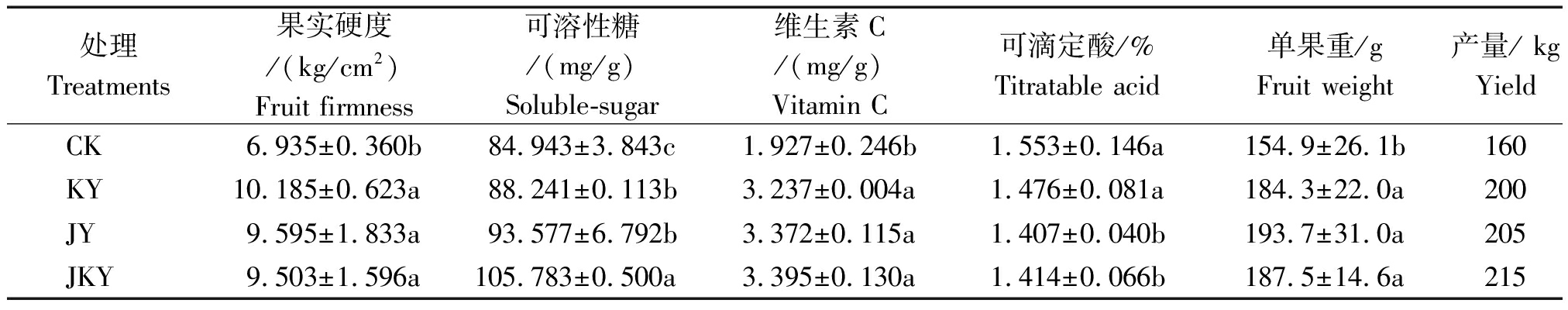
处理Treatments果实硬度/(kg/cm2)Fruit firmness 可溶性糖/(mg/g)Soluble-sugar 维生素C/(mg/g)Vitamin C 可滴定酸/%Titratable acid 单果重/gFruit weight 产量/ kgYieldCK6.935±0.360b84.943±3.843c1.927±0.246b1.553±0.146a154.9±26.1b160KY10.185±0.623a88.241±0.113b3.237±0.004a1.476±0.081a184.3±22.0a200JY9.595±1.833a93.577±6.792b3.372±0.115a1.407±0.040b193.7±31.0a205JKY9.503±1.596a105.783±0.500a3.395±0.130a1.414±0.066b187.5±14.6a215
2.5 土壤养分指标相关性分析与果实品质灰度关联分析
通过对土壤主要养分指标之间的相关性分析可知(表4),土壤全氮含量与蔗糖酶及铵态氮含量间存在显著相关性,与有机质含量间存在极显著相关性。蔗糖酶活性与全氮、全磷含量间存在显著相关性,与其余指标相关性极显著。磷酸酶活性与土壤硝态氮、全氮含量以及全磷、速效磷、速效钾含量、全钾含量存在极显著相关关系。蛋白酶和脲酶活性与除有机质含量、全氮含量以及全磷含量外的其他各项指标存在极显著相关关系。
土壤养分指标反映土壤状态,良好的土壤状态有利于树体对营养的吸收利用,从而促进果实品质及产量的提升。土壤酶活性与理化性质各指标间相关性很强,JKY各指标均高于KY、JY、CK,但是果实品质各指标并没有按照这一趋势变化,为定量评价不同处理对果实品质的影响,选取单果重、果实硬度、Vc含量、可溶性糖含量、可滴定酸含量5个指标进行消除量纲处理后,进行灰度关联分析(表5),果实品质关联度为:JY(0.99)>JKY(0.96)>KY(0.88)>CK(0.81),JY对果实品质的影响略高于JKY。
3 讨论
同一作物或近源作物在同一地块连续种植后,即使正常管理也会出现土壤品质下降、作物生育状况转劣的现象,即连作障碍 [21]。眉县等地种植猕猴桃历史很长,果树无法倒茬导致根际土壤养分条件降低,进而引发猕猴桃产量下降或品质降低的现象,甚至出现黄化、根腐病等土传病害,威胁猕猴桃产业健康发展。将微生物菌肥应用于连作土壤,已经在棉花、辣椒、黄瓜、烟草等作物的促生作用上取得一定效果 [22-24]。生物有机肥应用于猕猴桃果园土壤报道还很少,孙家骏等 [25-26]报道了生物有机肥对猕猴桃土壤微生物与酶活性的影响,但并未提及土壤理化性质与果实品质,本研究将解磷菌、生防菌与腐植酸制成的复合肥料应用于高龄猕猴桃根际,探究其对土壤微生物群落、酶活性、理化性质及果实品质的影响。
表4 土壤理化性质与土壤酶活性之间的相关性分析
Tab.4 Correlation of soil physical,chemistry properties and soil enzymes activity
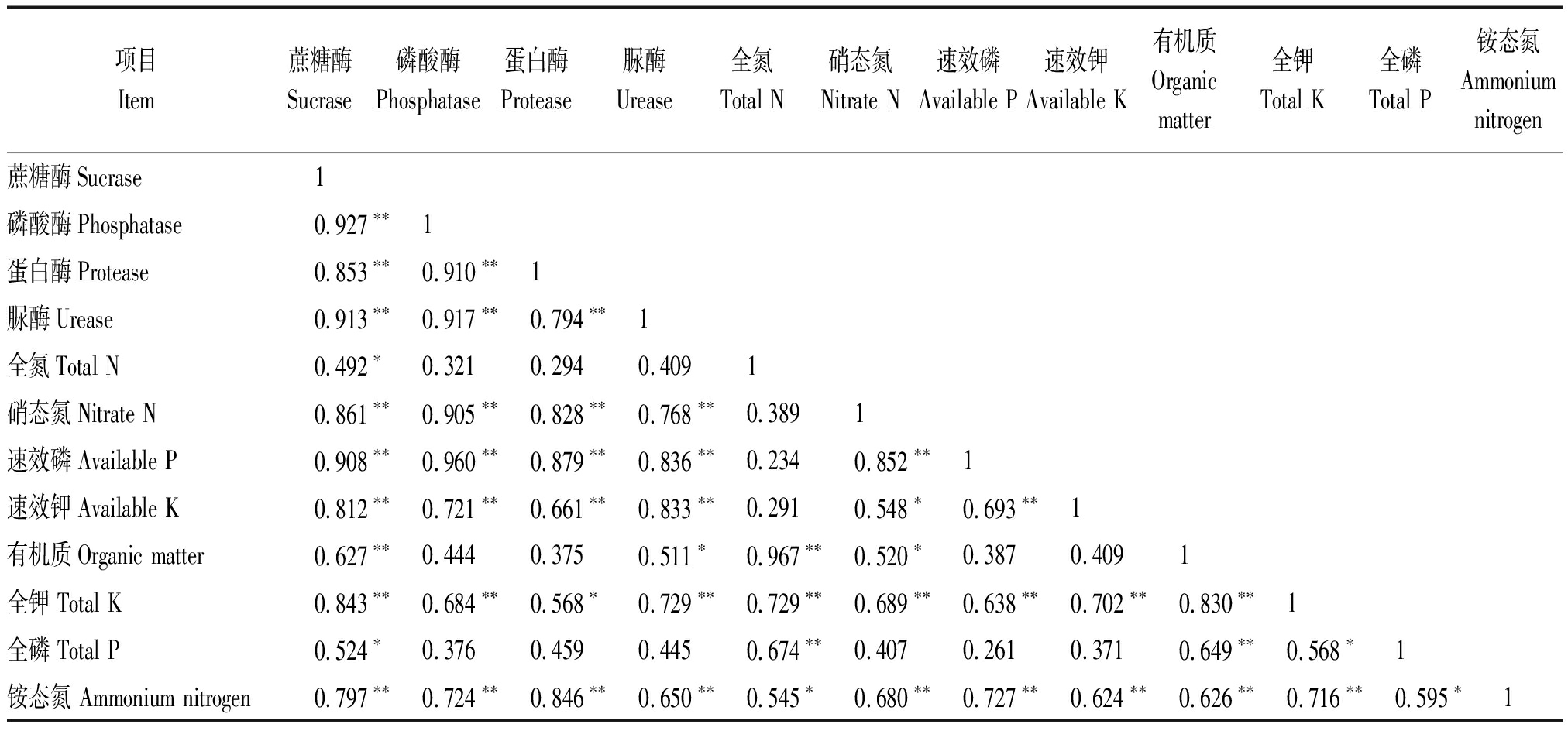
项目Item蔗糖酶Sucrase磷酸酶Phosphatase蛋白酶Protease脲酶Urease全氮Total N硝态氮Nitrate N速效磷Available P速效钾Available K有机质Organicmatter全钾Total K全磷Total P铵态氮Ammonium nitrogen蔗糖酶Sucrase1磷酸酶Phosphatase0.927∗∗1蛋白酶Protease0.853∗∗0.910∗∗1脲酶Urease0.913∗∗0.917∗∗0.794∗∗1全氮Total N0.492∗0.3210.2940.4091硝态氮Nitrate N0.861∗∗0.905∗∗0.828∗∗0.768∗∗0.3891速效磷Available P0.908∗∗0.960∗∗0.879∗∗0.836∗∗0.2340.852∗∗1速效钾Available K0.812∗∗0.721∗∗0.661∗∗0.833∗∗0.2910.548∗0.693∗∗1有机质Organic matter0.627∗∗0.4440.3750.511∗0.967∗∗0.520∗0.3870.4091全钾 Total K0.843∗∗0.684∗∗0.568∗0.729∗∗0.729∗∗0.689∗∗0.638∗∗0.702∗∗0.830∗∗1全磷 Total P0.524∗0.3760.4590.4450.674∗∗0.4070.2610.3710.649∗∗0.568∗1铵态氮 Ammonium nitrogen0.797∗∗0.724∗∗0.846∗∗0.650∗∗0.545∗0.680∗∗0.727∗∗0.624∗∗0.626∗∗0.716∗∗0.595∗1
注:**.差异极显著。
Note:**.Significant difference.
表5 各处理果实品质关联系数与关联度
Tab.5 Relation coefficients and degrees of fruit properties indexes
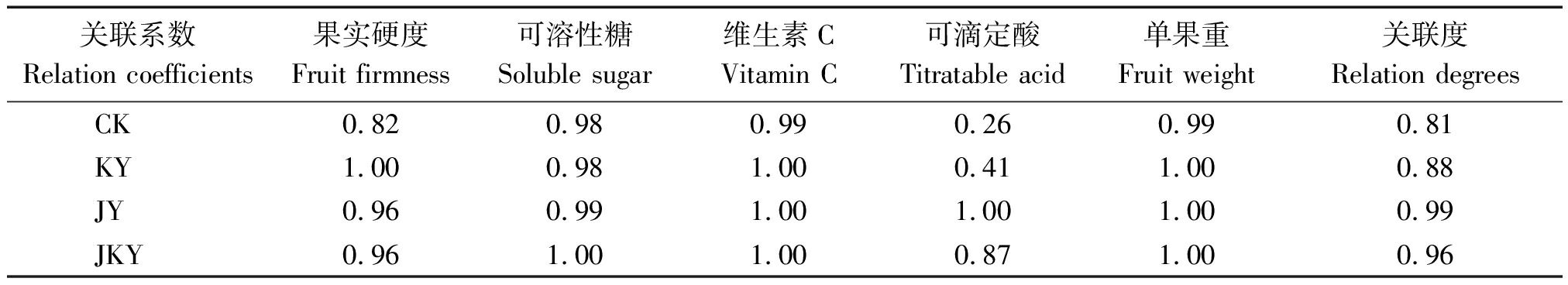
关联系数Relation coefficients果实硬度Fruit firmness 可溶性糖Soluble sugar维生素CVitamin C 可滴定酸Titratable acid 单果重Fruit weight 关联度Relation degreesCK0.82 0.98 0.99 0.26 0.99 0.81 KY1.00 0.98 1.00 0.41 1.00 0.88 JY0.96 0.99 1.00 1.00 1.00 0.99 JKY0.96 1.00 1.00 0.87 1.00 0.96
微生物是土壤中最活跃的组成部分,较好的微生物群落结构及较高的微生物活力可以促进植株对土壤养分的利用,提高土壤酶的转化效率,增强土壤抗病能力[27-28]。尹淑丽等[29]、冯莉等[30]发现,菌肥的施用可以降低作物根际真菌的数量,提高细菌放线菌数量。本研究中,施加JKY、KY、JY这3种复合微生物肥料后,细菌、放线菌数量较CK显著增高,真菌数量降低且细菌真菌比显著提高,与前人研究结果一致。细菌是土壤中最丰富的类群,其数量的增加表示土壤营养改善,腐植酸复合微生物肥料JKY可以向土壤直接提供生防菌、解磷菌以及其他营养物质进而促进土壤中细菌数量的增高。细菌数量的增多通过对生长底物的竞争也会抑制真菌的数量。同时,枯草芽孢杆菌和巨大芽孢杆菌对真菌存在抑制作用也是导致真菌数量降低的一个原因 [31]。虽然真菌整体数量降低,但酵母菌数量显著升高,酵母菌具有增加土壤养分、提高通气性、促进植物根系生长的作用 [32]。具体哪些真菌数量被抑制以及酵母的种类还有待进一步研究。
土壤酶可以将有机质转化为被植物利用的无机物,其活性在一定程度上反映土壤肥力,其活性与微生物活性成正相关 [33]。蔗糖酶反映土壤有机质转化,影响作物生长 [34],中性磷酸酶促进土壤有机磷向植株可以利用的无机磷转化,脲酶与蛋白酶加快蛋白、尿素等含氮化合物分解利用 [35-36],土壤多酚氧化酶可以促进土壤中酚酸类物质降解,对消除连作障碍具有积极作用 [37]。孙薇等[38]、张静等[39]研究发现,施用菌肥后,蔗糖酶活性、磷酸酶活性、脲酶活性显著提升。刘思宇 [40]研究发现,施用菌肥有利于提高蛋白酶、多酚氧化酶活性。本试验结果显示,3种腐植酸复合微生物肥料均能显著提高土壤蔗糖酶、脲酶、蛋白酶、多酚氧化酶、磷酸酶活性,与上述结论相符;这可能主要因为微生物菌剂能加速有机化合物分解,为土壤酶活反应提供了足量的底物。张峰等 [41]研究表明,生物菌肥能够明显提高库尔勒香梨土壤矿质养分含量;朱丹等 [5]研究结果表明,施用谷特菌肥可明显改善青稞根际土壤理化性状;韩光等 [42]将复合型PGPR和苜蓿联合使用能够提高新垦地土壤矿质养分和有机质含量。本研究结果显示,土壤酶活性与土壤理化性质的各项指标间存在有显著或极显著相关性,土壤酶活性增强,土壤理化性质显著提高,与前人研究结果一致。猕猴桃生长的最适宜土壤pH值是5.5~6.5,而陕西眉县高龄猕猴果园土壤的pH值偏高(7.7~7.9)不利于猕猴桃树体的生长;本研究中,施用3种腐植酸复合微生物肥料后的1年内土壤pH值下降0.16~0.48个单位,这与罗玉兰等 [43]的研究结果是一致的。
大量研究表明,不同微生物菌剂能够显著提高水蜜桃、库尔勒香梨单果质量、含糖量及降低可滴定酸含量 [44-45];促进黄瓜生长,提高产量和果实中可溶性糖、维生素C含量 [46]。本研究结果也显示,经过JKY、KY、JY复合微生物肥料处理后,猕猴桃果实产量、单果重、果实硬度、维生素C含量、可溶性糖含量提高,可滴定酸含量降低,果实品质显著增加。通过灰度关联分析可知,猕猴桃果实品质增高,与JY、JKY、KY关系显著;3个处理可以改善根系土壤微生物群落结构,提高微生物活性。微生物活性增加促进土壤酶活性的提高,这有利于土壤养分活化被植株吸收利用,进而促进猕猴桃果树生长发育,提高果实产量和品质。
腐植酸复合微生物肥料能够在猕猴桃的整个生长周期内改善土壤微生物群落结构,提高土壤酶活性,提高土壤养分含量,最终促进果实品质的提升。但该腐植酸复合微生物肥料在2年或者3年甚至更长一段时间内对土壤的改良作用有待进一步研究。另外,施用该种肥料的时间、用量、方式对肥料效果的影响也需要进一步探究,以期使腐植酸复合微生物肥料能被大幅度推广使用,为广大果农朋友解忧。
参考文献:
[1] Jesion I,Leontowicz M,Leontowicz H,et al. The influence of"Hayward"kiwi fruit(Actinidia deliciosa)from organic and conventional cultivations on the content of some trace elements in the rat kidneys and assessment of copper,manganese and zinc bioavailability/Wpxyw owoców kiwi"Haywar[J]. Ochrona ![]() i Zasobów Naturalnych-Environmental Protection and Natural Resources,2013,24(4):51-54.
i Zasobów Naturalnych-Environmental Protection and Natural Resources,2013,24(4):51-54.
[2] 胡 凡,石 磊,李 茹,等. 陕西关中地区猕猴桃施肥现状评价[J]. 中国土壤与肥料,2017(3):44-49.
[3] 王西锐. 猕猴桃重茬栽植障碍问题探讨[J]. 西北园艺:果树专刊,2015(3):4-5.
[4] 张学武,韩建君,宋晓斌,等. 猕猴桃根腐病发生规律及防治技术研究[J]. 西南林业大学学报,2004,24(4):42-44.
[5] 朱 丹,张 磊,韦泽秀,等. 菌肥对青稞根际土壤理化性质以及微生物群落的影响[J]. 土壤学报,2014,51(3):627-637.
[6] 陈建明,葛顺峰,沙建川,等. 微生物菌肥促进苹果花脸病植株氮素吸收和果实增产[J]. 植物营养与肥料学报,2017,23(5):1296-1302.
[7] 殷幼平,袁训娥,李 强,等. 生防菌枯草芽孢杆菌CQBS03的绿色荧光蛋白基因标记及其在柑橘叶片上的定殖[J]. 中国农业科学,2010,43(17):3555-3563.
[8] Khan A A,Jilani G,Akhtar M S,et al. Phosphorus solubilizing bacteria:occurrence,mechanisms and their role in crop production[J]. Journal of Agriculture & Biological Sciences,2012,2(1):80-85.
[9] Adani F,Genevini P,Zaccheo P,et al. The effect of commercial humic acid on tomato plant growth and mineral nutrition[J]. Journal of Plant Nutrition,1998,21(3):561-575.
[10] 高 亮. 腐植酸复合微生物肥料对蔬菜生长及土壤腐殖质组分的影响研究 [J]. 腐植酸,2014(3):11-16.
[11] 高 觅,章学梅,任 鹏,等. 腐植酸复合微生物肥在蔬菜上的应用研究[J]. 腐植酸,2014(6):20-23.
[12] 林雁冰,薛泉宏,颜 霞. 覆盖模式及小麦根系对土壤微生物区系的影响[J]. 中国生态农业学报,2008,16(6):1389-1393.
[13] 周礼恺,张志明. 土壤酶活性的测定方法 [J]. 土壤通报,1980(5):37-38,49.
[14] 南京农业大学. 土壤农化分析 [M].2版.北京:农业出版社,1981.
[15] 曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007.
[16] 武瑞平,李 华,曹 鹏. 风化煤施用对复垦土壤理化性质酶活性及植被恢复的影响研究[J]. 农业环境科学学报,2009,28(9):1855-1861.
[17] 王 建,同延安. 猕猴桃树对氮素吸收,利用和贮存的定量研究[J]. 植物营养与肥料学报,2008,14(6):1170-1177.
[18] 魏 斌,李友明,翟广生,等. 氮素营养对猕猴桃营养功能特征及果实产量的影响[J]. 安徽农业科学,2015(12):98-101.
[19] 王 建,同延安,高义民. 关中地区猕猴桃树体周年磷素需量动态规律研究[J]. 干旱地区农业研究,2008,26(6):119-123.
[20] Fallahi E,Righetti T L,Raese J T. Ranking tissue mineral analyses to identify mineral limitations on quality in fruit[J]. Journal of the American Society for Horticultural Science American Society for Horticultural Science,1988,113(3):382-389.
[21] 李天来,杨丽娟. 专题导读:作物连作障碍的克服——难解的问题[J]. 中国农业科学,2016,49(5):916-918.
[22] 马云艳,徐万里,唐光木,等. 生防链霉菌配施棉秆炭对连作棉田土壤微生物区系的影响[J]. 中国生态农业学报,2017,25(3):400-409.
[23] 张 婷. 生防菌与秸秆复合应用对设施蔬菜主要土传病害的防效和机制初探 [D].北京:中国农业科学院,2013.
[24] 谭 萍,王仁刚,田 红,等. 两种烟草根结线虫生防菌对土壤中微生物数量的影响[J]. 湖南农业科学,2016(4):69-71.
[25] Wicaksono W A,Jones E E,Casonato S,et al. Biological control of Pseudomonas syringae pv. actinidiae(Psa),the causal agent of bacterial canker of kiwifruit,using endophytic bacteria recovered from a medicinal plant[J]. Biological Control,2018,116:103-112.
[26] 孙家骏,付青霞,谷 洁,等. 生物有机肥对猕猴桃土壤酶活性和微生物群落的影响[J]. 应用生态学报,2016,27(3):829-837.
[27] Bonanomi G,Antignani V,Capodilupo M A. Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases[J]. Soil Biology & Biochemistry,2010,42(2):136-144.
[28] 王传杰,肖 婧,蔡岸冬,等. 不同气候与施肥条件下农田土壤微生物生物量特征与容量分析[J]. 中国农业科学,2017,50(6):1067-1075.
[29] 尹淑丽,张丽萍,张根伟,等. 复合微生态菌剂对黄瓜根际土壤微生物数量及酶活的影响[J]. 微生物学杂志,2012,32(1):23-27.
[30] 冯 莉,张玲华,田兴山. 荧光假单胞菌对烟草根际微生物种群数量及根系活力的影响[J]. 农业环境科学学报,2007,26(S):537-539.
[31] 林福呈,李德葆. 枯草芽孢杆菌(Bacillus subtilis)S9对植物病原真菌的溶菌作用[J]. 植物病理学报,2003,33(2):174-177.
[32] Botha A. The importance and ecology of yeasts in soil[J]. Soil Biology & Biochemistry,2011,43(1):1-8.
[33] Cui H B,Tian C,Zhou J,et al. The effects of nano-scale hydroxyapatite on the speciation of Cu and Cd and enzymatic activities in soils[J]. Journal of Agro-environment Science,2011,30(5):874-880.
[34] 杨鹏鸣,周俊国. 不同肥料对土壤蔗糖酶和过氧化氢酶活性的影响[J]. 广东农业科学,2011,38(11):78-80.
[35] 文 嘉,曾光明,安 赫,等. 改性沸石改良底泥对土壤中微生物生物量碳及酶活性的影响[J]. 农业环境科学学报,2017,36(2):302-307.
[36] 蔡 红,沈仁芳. 改良茚三酮比色法测定土壤蛋白酶活性的研究[J]. 土壤学报,2005,42(2):306-313.
[37] 郝建朝,吴沿友,连 宾,等. 土壤多酚氧化酶性质研究及意义[J]. 土壤通报,2006,37(3):470-474.
[38] 孙 薇,钱 勋,付青霞,等. 生物有机肥对秦巴山区核桃园土壤微生物群落和酶活性的影响[J]. 植物营养与肥料学报,2013,19(5):1224-1233.
[39] 张 静,杨江舟,胡 伟,等. 生物有机肥对大豆红冠腐病及土壤酶活性的影响[J]. 农业环境科学学报,2012,31(3):548-554.
[40] 刘思宇. EM菌肥对黄瓜苗期根际土壤酶活性的影响[J]. 中国瓜菜,2016,29(1):11-13.
[41] 张 峰,李世强,乔金玲,等. 生物菌肥对库尔勒香梨腐烂病的发生及土壤养分的影响[J]. 中国农学通报,2017,33(3):57-60.
[42] 韩 光,张 磊,邱 勤,等. 复合型PGPR和苜蓿对新垦地土壤培肥效果研究[J]. 土壤学报,2011,48(2):405-411.
[43] 罗玉兰,田 龚,张冬梅,等. 微生物菌剂对连栋大棚土壤养分及硝态氮累积的影响[J]. 中国农学通报,2015,31(13):224-228.
[44] 范洁群,褚长彬,吴淑杭,等. 不同微生物菌肥对桃园土壤微生物活性和果实品质的影响[J]. 上海农业学报,2013,29(1):51-54.
[45] 李玉华,许前欣,李明悦,等. 微生物菌肥对库尔勒香梨产量,品质的影响[J]. 天津农业科学,2006,12(2):48-50.
[46] 赵 贞,杨延杰,林 多,等. 微生物菌肥对日光温室黄瓜生长发育及产量品质的影响[J]. 中国蔬菜,2012,1(18):149-153.