植物转脂蛋白(Lipid transfer proteins,LTPs)是一类小分子量的碱性蛋白,因其能与脂类结合,并在膜之间进行脂类的转运而被命名。因其对各种脂类(包括磷脂、脂肪酸和辅酶A等)都具有较高的亲和力,又被称为非专一性转脂蛋白(non-specific lipid transfer proteins,nsLTPs)[1-3]。它们在结构上的典型特征是分子内都含有一个由8个半胱氨酸组成的保守基序(C-Xn-C-Xn-CC-Xn-CXC-Xn-C-Xn-C)(通常被称为8CM),这8个半胱氨酸形成4对二硫键,所以转脂蛋白分子具有较高的耐高温、耐变性等特性[4]。核磁共振、红外和Raman光谱分析表明,LTPs蛋白分子主要由4个或5个α-螺旋组成,分子内有一疏水空穴,可结合并容纳脂质分子[4-5]。根据分子量的大小,植物LTPs成员最初被分为2种类型:Ⅰ型和Ⅱ型。其中,Ⅰ型LTPs含有大约90个氨基酸,而Ⅱ型LTPs含有大约70个氨基酸;这种类型的LTPs成员之间在序列相似性(大约30%)及转脂效率方面都有很大差异[6]。随后发现,苔藓、地钱等低等植物中的LTPs不能归属以上2种传统的分类类型。因此,Edstam等[2]根据半胱氨酸之间的距离、保守内含子的位置以及翻译后糖基磷脂酰肌醇锚(GPI-anchor)的添加与否,把LTPs重新划分为1、2、C、D、E、F、G、H、J和K型。
由于具有膜间转移脂分子的功能,植物LTPs最初被认为参与生物膜系统的生物合成[7],然而N-端信号肽的发现和胞外定位,使人们开始重新认识LTPs的功能。现有研究表明,LTPs涉及植物多种生理过程,包括参与蜡质的合成和运输、生殖器官的发育以及提高植物抗病性、促进细胞壁的伸长、调节果胶降解活性等[6];其中,研究较多的是其在蜡质的合成和运输、生殖器官的发育以及在提高植物抗病性当中的作用。相对于生物抗性而言,人们对LTPs在非生物抗性中作用的研究相对偏少,并且多数是间接证据。例如Cameron等[8]研究发现,LTPs可以在特定组织的表面聚集成较高的浓度,并以此来适应外界环境胁迫;Jiang等[9]研究发现,在过量表达一个盐诱导转录因子-WRKY25的拟南芥中,有3个LTPs家族成员的表达量明显上升,表明LTPs参与了拟南芥的抗盐信号途径;Wang等[10]研究发现,LTPs基因的表达可以被极端温度、渗透胁迫以及干旱等环境胁迫所诱导;Yang等[11]发现,菜豆根尖中的1个LTP基因表达可以被渗透胁迫(PEG处理)强烈诱导。
前期研究从玉米中克隆了1个LTP基因家族成员,并命名为ZmLTP3(GenBank Accession No. JX435819)。经RT-PCR分析发现,ZmLTP3基因的表达可以被多种非生物胁迫因子(尤其是高盐)所诱导[12]。在本研究中,构建Ubiquitin启动子驱动的表达载体,利用花粉管通道法转化玉米,以期获得其响应非生物逆境胁迫的直接证据。
1 材料和方法
1.1 试验材料
植物材料:玉米自交系京2416,由北京农业生物技术研究中心玉米课题组保存。
菌株:大肠杆菌(Trans1-T1 Phage Resistant);植物表达载体:改造后的pGreen0229由北京农业生物技术研究中心玉米课题组保存。
试剂:限制性内切酶、rTaq酶和Marker购自TaKaRa公司;KOD酶购自东洋纺公司;PCR回收试剂盒购自Premaga公司;其他试剂均为国产分析纯,购自生工生物工程(上海)股份有限公司。
1.2 试验方法
1.2.1植物表达载体的构建 玉米ZmLTP3基因的cDNA片段经PCR扩增并测序验证正确后,通过Mlu Ⅰ/Not Ⅰ克隆位点构建到改造后的植物表达载体pGreen0229[13](图1)。
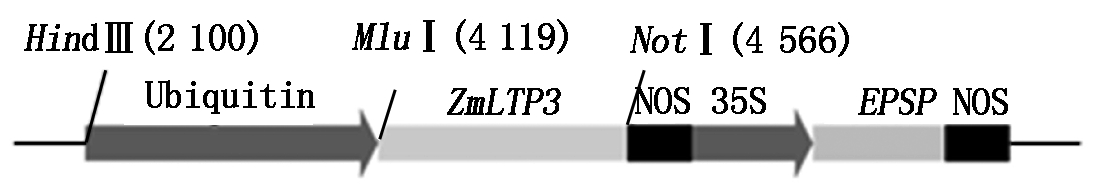
图1 ZmLTP3基因表达载体的构建
Fig.1 Construction of the ZmLTP3 expression vector
1.2.2 玉米的基因转化 参考李杰等[13]方法提取质粒、混合穿膜肽Tat 2,并通过花粉管通道法转化玉米。
1.2.3 转基因株系的鉴定
1.2.3.1 转化植株的筛选 收取转化后的玉米种子,种植于试验田中,将收获的种子种植于田间,在玉米幼苗长至三叶期时,喷洒浓度为200 mg/L的草甘膦,以筛选生长正常的植株。
1.2.3.2 转化植株的PCR检测 四叶一心期时,选取草甘膦抗性较强的植株,用CTAB法提取其幼嫩叶片的总DNA,进行PCR检测。用于PCR检测的片段起点位于EPSP基因上游199 bp的启动子序列处,终点位于EPSP基因的第1 000 bp处,长度为1 199 bp。引物如下:
上游引物:5′-TGTGCAGAACCCATCTCTTATC-3′;
下游引物:5′-CGACAGCGAGAATCGGATATT-3′。
PCR反应体系:2.5 μL 10×Buffer,2 μL dNTP,1 μL玉米基因组DNA,上下游引物各1 μL,0.5 μL rTaq酶,17 μL ddH2O。
PCR反应条件:94 ℃预变性5 min;98 ℃变性10 s,65 ℃退火30 s,72 ℃反应1.5 min,35个循环;72 ℃延伸7min。
1.2.3.3 转化植株的免疫检测 参考QualiPlateTM Kit for LibertyLink® PAT/EPSP说明书直接检测EPSP基因的表达。
1.2.4 转基因玉米的耐盐性鉴定 将鉴定的转基因阳性株系加代,并对每一代进行PCR及EPSP检测验证,以保证获得转ZmLTP3基因的纯合体株系。将京2416自交系(CK)及转基因T3纯合体株系(OE)种子种植于基质中,基质成分为花卉土和蛭石等体积混合。将萌发的玉米放置于日长/夜长为12 h/12 h,白天、夜间温度分别为27,16 ℃,相对湿度为60%~70%的环境中。待玉米长至三叶一心期时开始,选取生长一致的幼苗进行盐胁迫处理,并进行相关形态、生理指标的测定。盐胁迫处理方法为:用250 mmol/L的NaCl溶液浇灌玉米幼苗至水分饱和状态,之后随时用250 mmol/L的NaCl溶液补充,保证基质的湿润状态。分别于盐处理的前1(0 d),7,14 d测量各种生理指标;于盐处理14 d后测量各种形态指标;于盐处理7 d拍照。玉米相关形态指标、叶绿素及MDA含量、相对外渗电导率等测定方法参照张宪政[14]主编的《作物生理研究法》进行,SOD、POD及CAT活性测定参考Kumar等[15]的方法。试验共设置3个重复,每次分别处理约50株各供试材料作为1次重复。
1.3 数据分析
采用Excel 2007、SPSS 20.0软件对数据进行统计和方差分析。
2 结果与分析
2.1 载体构建及遗传转化
北京农业生物技术研究中心玉米实验室之前改造后的植物表达载体中含有Mlu Ⅰ和Not Ⅰ多克隆位点,而ZmLTP3序列中无这2个酶切位点,故选择Mlu Ⅰ/Not Ⅰ作为本试验的连接位点。经常规的酶切、连接及转化后提取质粒,用Mlu Ⅰ/Not Ⅰ酶切验证,结果如图2所示。电泳后在相应位置检测到载体和目的片段,表明ZmLTP3序列已被成功连接到载体中。
载体验证正确后,用李杰等[13]方法提取质粒、混合穿膜肽Tat 2,选择100株左右长势良好的玉米自交系作为受体,用花粉管通道法进行转化[13]。待成熟后,将转化株单独收获晒干脱粒,收获的种子1万粒左右,用于以后的除草剂筛选验证。
2.2 转基因玉米抗除草剂筛选
喷施草甘膦14 d后,大部分玉米植株叶片枯黄,表现出药害症状,并且不能恢复,最后枯萎死亡;只有极少部分植株没有表现药害症状,叶片依旧保持绿色,健康生长,表现出明显的除草剂抗性(图3)。推测19株正常生长的植株很可能是转基因阳性株系,被用作下一步的分子鉴定。
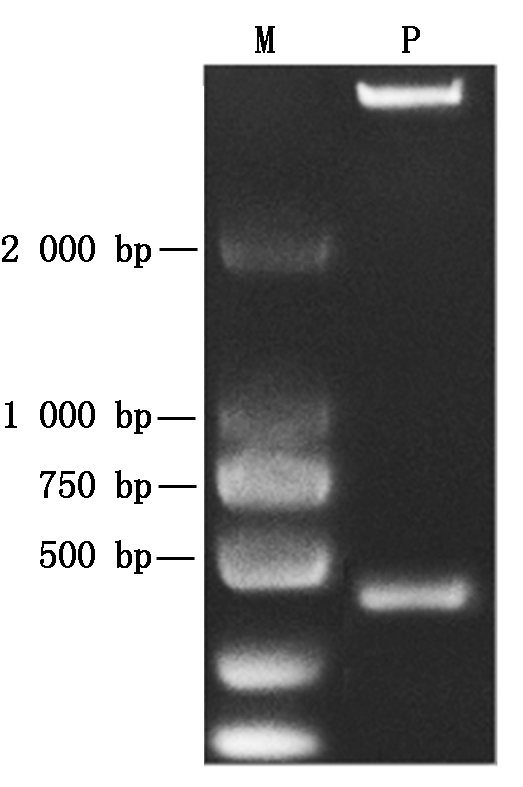
M.DL2000 Marker;P.重组质粒。
M.DL2000 Marker;P.Recombined plasmid control.
图2 重组质粒Mlu Ⅰ/Not Ⅰ酶切验证
Fig.2 Identification of the recombined plasmid by digestion of Mlu Ⅰ/Not Ⅰ

图3 转基因玉米植株除草剂抗性鉴定
Fig.3 Identification of herbicide resistance in transgenic maize
2.3 转基因玉米的PCR检测
对19株草甘膦抗性幼苗分别提取其幼叶基因组DNA,用于PCR检测,扩增结果如图4所示,以ddH2O及非转基因的自交系阴性对照均未扩增出阳性条带,19个草甘膦抗性株系中只有2、3、4、6、7、8、10、15、18、19这10个株系可扩增出目标片段。
2.4 转基因玉米株系免疫分析
对PCR鉴定呈阳性的株系进一步做免疫鉴定,结果如图5所示。除CK组外,2、3、6、7、8、10、15、18、19这9个转基因株系均有明显的检测条带,说明EPSP基因已经在转基因玉米株系中成功表达,进而证明ZmLTP3基因已经被成功转到玉米株系中。
2.5 转基因玉米株系的耐盐性鉴定
2.5.1 盐胁迫对玉米植株生长的影响 在转基因阳性株系中分别选取株系6、10和18做下一步的耐盐性鉴定,分别记作OE6、OE10和OE18。图6为高盐处理7 d后的株系,可以看出,未转基因的对照植株生长瘦弱、叶片萎蔫变黄严重,而3个转基因株系生长状况相对较好,株高、茎基宽、叶面积等指标明显优于对照。
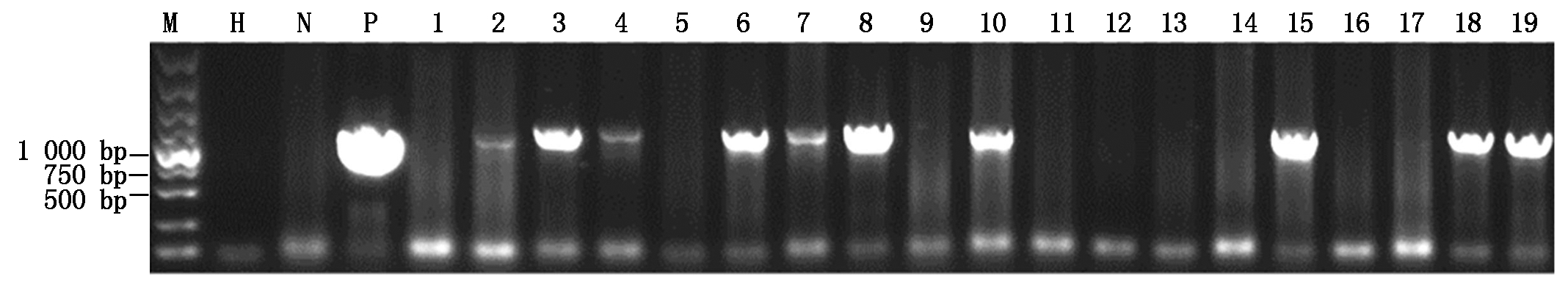
M. DL5000 Marker;H.ddH2O;N.非转基因自交系2416植株;P.质粒对照;1~19.草甘膦抗性株系。图5同。
M.DL5000 Marker;H.Water control;N.Non-transgenic maize 2416;P.Plasmid control;1-19.Herbicide resistance lines.The same as Fig.5.
图4 转基因株系的PCR检测
Fig.4 PCR analysis of the transgenic maize lines

图5 转基因株系EPSPS检测
Fig.5 EPSPS detection of the transgenic maize lines

图6 盐胁迫对转基因株系生长的影响
Fig.6 Effects of drought stress on growth of transgenic plants
进一步的形态学指标测量结果如表1所示,在盐胁迫处理的14 d后,所有转基因株系的株高和根长都极显著高于对照;而茎基宽、鲜质量及干质量则显著高于对照。结果表明,在高盐胁迫条件下,转基因株系的生长状况显著优于对照。
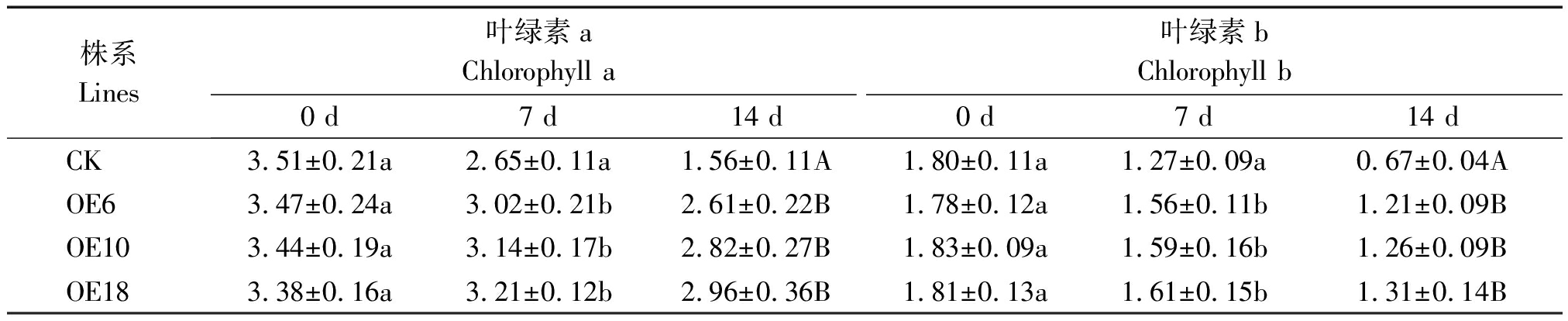
2.5.2 盐胁迫对玉米叶片叶绿素含量的影响 光合色素是叶片光合作用的基础,光合色素含量的高低在一定程度上决定了光合能力的强弱。由表2可知,正常生长条件下,转基因株系叶绿素a、b含量(以鲜质量计)与对照无明显差异,随着盐胁迫处理时间的延长,所有试验株系叶片中叶绿素含量都明显下降。盐胁迫处理7 d后转基因株系叶绿素含量显著高于对照;盐胁迫处理14 d后转基因株系叶绿素含量则极显著高于对照;转基因株系间叶绿素含量差异不显著,说明在盐胁迫条件下,转基因株系能够维持较高叶绿素水平,进而维持较高的光合能力。
表1 盐胁迫下CK与转基因株系部分形态学指标测定
Tab.1 Partial morphological analysis of transgenic and CK plants under salt stress
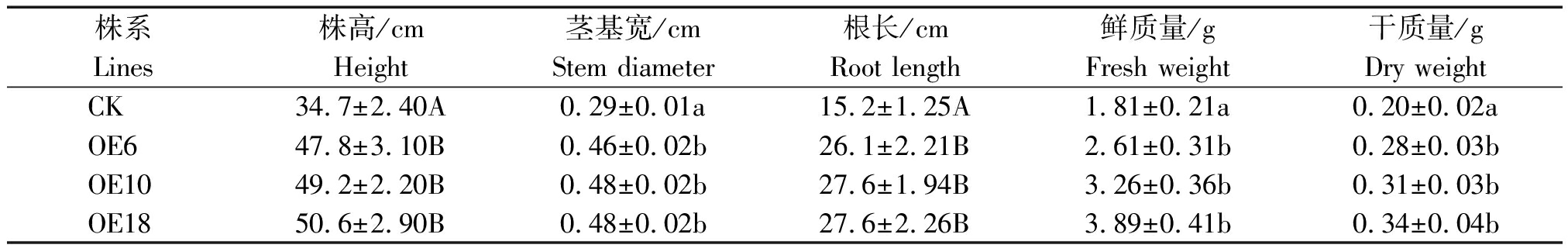
株系Lines株高/cmHeight 茎基宽/cmStem diameter根长/cmRoot length鲜质量/gFresh weight干质量/gDry weightCK34.7±2.40A0.29±0.01a15.2±1.25A1.81±0.21a0.20±0.02aOE647.8±3.10B0.46±0.02b26.1±2.21B2.61±0.31b0.28±0.03bOE1049.2±2.20B0.48±0.02b27.6±1.94B3.26±0.36b0.31±0.03bOE1850.6±2.90B0.48±0.02b27.6±2.26B3.89±0.41b0.34±0.04b
注:表中同列不同小写字母表示P<0.05水平下差异显著;不同大写字母表示P<0.01水平下差异极显著。表2-4同。
Note:Values followed by different lowercase and capital letters within each column indicated significant differences at level of P<0.05 and P<0.01,respectively. The same as Tab.2-4.
表2 盐胁迫下CK与转基因株系叶片叶绿素含量的测定
Tab.2 Chlorophyll content analysis in leaves of transgenic and CK plants under salt stress mg/g
株系Lines叶绿素aChlorophyll a叶绿素bChlorophyll b0 d7 d14 d0 d7 d14 dCK3.51±0.21a2.65±0.11a1.56±0.11A1.80±0.11a1.27±0.09a0.67±0.04AOE63.47±0.24a3.02±0.21b2.61±0.22B1.78±0.12a1.56±0.11b1.21±0.09BOE103.44±0.19a3.14±0.17b2.82±0.27B1.83±0.09a1.59±0.16b1.26±0.09BOE183.38±0.16a3.21±0.12b2.96±0.36B1.81±0.13a1.61±0.15b1.31±0.14B
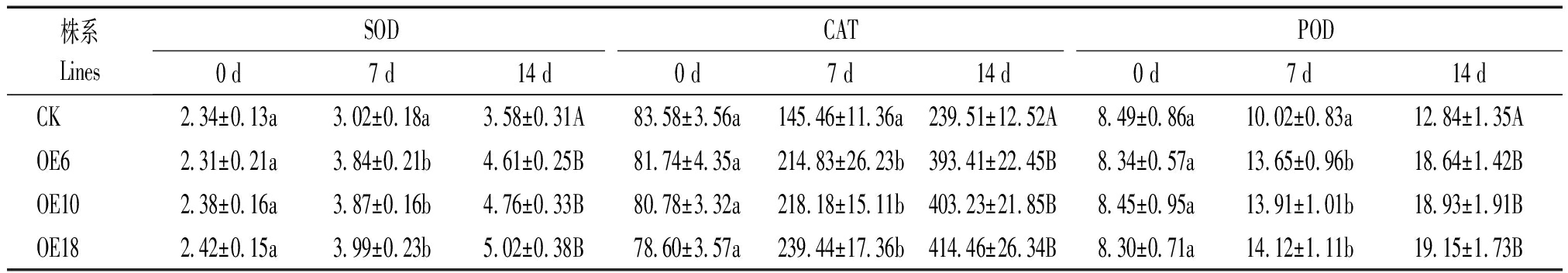
2.5.3 盐胁迫对玉米植株体内保护酶活性的影响 逆境经常导致植物体内活性氧的大量产生,而SOD、POD和CAT是消除活性氧伤害的重要保护膜系统。由表3可知,当植株受到盐胁迫时,对照与转基因株系叶片中的SOD、POD、CAT均呈现上升的趋势,在处理14 d后转基因株系叶片中保护酶活性极显著高于对照,各转基因株系之间无显著差异。结果表明,过量表达ZmLTP3基因可以提高高盐条件下植株体内SOD、POD、CAT等保护酶的活性,从而提高植株耐盐性。
表3 盐胁迫下CK与转基因株系叶片保护酶活性的测定
Tab.3 Protective enzyme activity analysis in leaves of CK and transgenic plants under salt stress U/mg
株系LinesSODCATPOD0 d7 d14 d0 d7 d14 d0 d7 d14 dCK2.34±0.13a3.02±0.18a3.58±0.31A83.58±3.56a145.46±11.36a239.51±12.52A8.49±0.86a10.02±0.83a12.84±1.35AOE62.31±0.21a3.84±0.21b4.61±0.25B81.74±4.35a214.83±26.23b393.41±22.45B8.34±0.57a13.65±0.96b18.64±1.42BOE102.38±0.16a3.87±0.16b4.76±0.33B80.78±3.32a218.18±15.11b403.23±21.85B8.45±0.95a13.91±1.01b18.93±1.91BOE182.42±0.15a3.99±0.23b5.02±0.38B78.60±3.57a239.44±17.36b414.46±26.34B8.30±0.71a14.12±1.11b19.15±1.73B
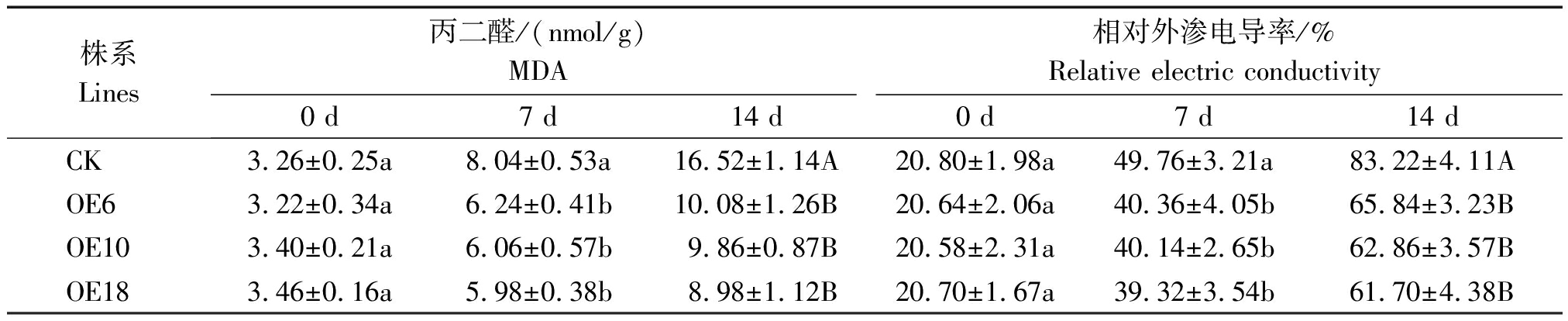
2.5.4 盐胁迫对玉米植株体内MDA含量和相对外渗电导率的影响 MDA和相对电导率都是衡量细胞膜受伤害程度大小的指标。由表4可知,对照与转基因株系叶片内的MDA含量和相对外渗电导率随着盐胁迫时间的延长而增加;盐胁迫处理7 d后转基因株系的MDA含量及相对外渗电导率显著低于对照;盐胁迫处理14 d后,转基因株系的MDA含量及相对外渗电导率则极显著低于对照。试验结果表明,过量表达ZmLTP3基因可以在一定程度上维持盐胁迫条件下膜系统的稳定性。
表4 盐胁迫下CK与转基因株系叶片MDA和相对外渗电导率的测定
Tab.4 MDA content and relative electric conductivity analysis of transgenic and CK plants under salt stress
株系Lines丙二醛/(nmol/g)MDA相对外渗电导率/%Relative electric conductivity0 d7 d14 d0 d7 d14 dCK3.26±0.25a8.04±0.53a16.52±1.14A20.80±1.98a49.76±3.21a83.22±4.11AOE63.22±0.34a6.24±0.41b10.08±1.26B20.64±2.06a40.36±4.05b65.84±3.23BOE103.40±0.21a6.06±0.57b9.86±0.87B20.58±2.31a40.14±2.65b62.86±3.57BOE183.46±0.16a5.98±0.38b8.98±1.12B20.70±1.67a39.32±3.54b61.70±4.38B
3 结论与讨论
盐胁迫能显著影响植物的生长和发育,在盐胁迫的早期阶段植物的叶片及茎生长都被明显抑制。叶片和茎的缓慢生长有利于保持有限的碳水化合物含量,从而维持植物体基本的代谢[16]。本研究分别比较了在正常及盐胁迫条件下转基因株系及对照的株高、茎基宽、根长、植株鲜质量及干质量等形态学指标。结果表明,在正常条件下转基因株系和对照的上述指标没有明显差异,但是在盐胁迫条件下,转基因株系的茎基宽、鲜质量及干质量则显著高于对照,而株高及根长则极显著高于对照,说明转基因株系在盐胁迫条件下可以维持较好的生长状态。在盐胁迫条件下转基因株系的叶绿素含量也显著或者极显著高于对照株系,说明转基因植株在盐胁迫条件下可以维持较高的叶绿素水平,这可能是其具有较高生物量及较好生长状态的重要原因之一。
转脂蛋白主要位于植物地上部器官的表皮组织,以利于把脂质转移到植物体表面[17]。研究表明,在盐胁迫条件下植物的细胞壁及细胞膜的成分均发生改变[18]。转脂蛋白可能参与修复逆境导致的细胞膜、细胞壁等细胞成分的破坏,从而维持细胞结构的稳定性[19]。MDA含量和外渗电导率是衡量细胞膜系统受伤害程度的重要指标。在本研究中,盐胁迫条件下转基因株系体内的MDA含量和外渗电导率均显著或者极显著低于对照植株,与前人研究结果相一致。同时,相对于对照株系,盐胁迫条件下转基因株系体内的3种重要保护膜的活性也一直维持在较高水平,这说明过量表达ZmLTP3基因可以显著减少盐胁迫条件下的活性氧伤害,提高植株的耐盐性,但其确切的作用机制还有待进一步研究。
参考文献:
[1] Ng T B,Cheung R C,Wong J H,et al. Lipid-transfer proteins[J]. Biopolymers,2012,98(4):268-279.
[2] Edstam M M,Viitanen L,Salminen T A. Evolutionary history of the Non-Specific lipid transfer proteins[J]. Molecular Plant,2011,4(6):947-964.
[3] Smith L J,Roby Y,Allison J R,et al. Molecular dynamics simulations of barley and maize lipid transfer proteins show different ligand binding preferences in agreement with experimental data[J]. Biochemistry,2013,52(30):5029-5038.
[4] Edstam M M,Laurila M,Hoglund A,et al. Characterization of the GPI-anchored lipid transfer proteins in the moss Physcomitrella patens[J]. Plant Physiology and Biochemistry,2014,75:55-69.
[5] Salminen T A,Blomqvist K,Edqvist J. Lipid transfer proteins:classification,nomenclature,structure,and function[J]. Planta,2016,244(5):971-997.
[6] Yeats T H,Rose J K. The biochemistry and biology of extracellular plant lipid-transfer proteins(LTPs)[J]. Protein Science,2008,17(2):191-198.
[7] Deeken R,Saupe S,Klinkenberg J,et al. The nonspecific lipid transfer protein AtLtpI-4 is involved in suberin formation of Arabidopsis thaliana crown galls[J]. Plant Physiology,2016,172(3):1911-1927.
[8] Cameron K D,Teece M A,Smart L B. Increased accumulation of cuticular wax and expression of lipid transfer protein in response to periodic drying events in leaves of tree tobacco[J]. Plant Physiology,2006,140(1):176-183.
[9] Jiang Y,Deyholos M K. Functional characterization of Arabidopsis NaCl-inducible WRKY25 and WRKY33 transcription factors in abiotic stresses[J]. Plant Molecular Biology,2009,69(1/2):91-105.
[10] Wang N J,Lee C C,Cheng C S,et al. Construction and analysis of a plant non-specific lipid transfer protein database(nsLTPDB)[J]. BMC Genomics,2012,13(S1):S9.
[11] Yang Z B,Eticha D,Rotter B,et al. Physiological and molecular analysis of polyethylene glycol-induced reduction of aluminium accumulation in the root tips of common bean(Phaseolus vulgaris)[J]. New Phytologist,2011,192(1):99-113.
[12] 孙小艳,朱 泳,赵明敏,等. 玉米转脂蛋白基因ZmLTP3的克隆及表达特性分析[J]. 玉米科学,2014,22(1):62-66.
[13] 李 杰,郭欣慰,张中保,等. 将拟南芥ATNCED3基因导入玉米自交系的研究[J]. 作物杂志,2014(1):58-62.
[14] 张宪政. 作物生理研究法[M]. 北京:农业出版社,1992.
[15] Kumar P,Tewari R K,Sharma P N. Modulation of copper toxicity-induced oxidative damage by excess supply of Iron in maize plants[J]. Plant Cell Reports,2008,27(2):399-409.
[16] Zhou Y,Tang N,Huang L,et al. Effects of salt stress on plant growth,antioxidant capacity,glandular trichome density,and volatile exudates of schizonepeta tenuifolia Briq[J]. International Journal of Molecular Sciences,2018,19(1):252.
[17] Jacq A,Pernot C,Martinez Y,et al. The Arabidopsis lipid transfer protein 2(AtLTP2)is involved in Cuticle-Cell wall interface integrity and in etiolated hypocotyl permeability[J]. Frontiers in Plant Science,2017,8:263.
[18] Chalbi N,Martínez-Ballesta M C,Youssef N B,et al. Intrinsic stability of Brassicaceae plasma membrane in relation to changes in proteins and lipids as a response to salinity[J]. Journal of Plant Physiology,2015,175:148-156.
[19] Liu F,Zhang X,Lu C,et al. Non-specific lipid transfer proteins in plants:presenting new advances and an integrated functional analysis[J]. Journal of Experimental Botany,2015,66(19):5663-5681.