水稻是重要的粮食作物之一,提高稻米产量和品质是水稻遗传育种学和分子生物学追求的永恒目标。水稻籽粒大小相关性状包括粒长、粒宽、粒厚和千粒质量等既是水稻产量的重要构成因子之一,也显著影响稻米的外观品质、加工品质、蒸煮和食味品质[1-3]。培育适宜大小的籽粒品种将有助于水稻的高产与优质,其遗传与发育机制一直是水稻育种家和分子生物学家研究的热点之一[4-5]。
籽粒大小相关性状均为多基因控制的数量性状,受籽粒的长、宽、厚、长宽比和千粒质量等性状直接影响。不同遗传群体和环境中检测到的QTL存在较大差异,相同群体在不同生态环境下所检测到的QTL也不尽相同[4-8]。近20年来,研究者利用不同类型的遗传群体和环境共鉴定1 265个籽粒大小相关的QTL,不均匀地分布于12 条染色体上,多数QTL的定位区间较大、贡献率较小且存在明显的基因间和基因与环境间的互作效应,真正克隆的QTL数量相对较少[6-8]。其中,9个籽粒大小的QTL被克隆,分别是GW2、GS2、GS3、GW5、GS5、GW8、qGL3、GIF1和TGW6,有14个QTL被精细定位(http://www.gramene.org/,http://www.ricedata.cn/gene/,2016),包括gw3、gw8.1、gw9.1、qGL3a、GW3、GW6、qGL4b、qGL7、qGS7、qSS7、qGT8、GW11、GW12和qTGW3.2[4-5]。近年来,虽然对于粒形的分子调控机理取得了一定的进展,但上述研究也反映出了籽粒大小相关性状遗传调控的复杂性,不同品种的籽粒大小性状的调控基因存在显著差异[9-10]。
鉴于此,本研究以龙稻5和中优早8杂交衍生的RILs群体为试验材料,对不同环境下检测到的籽粒大小相关的QTL进行比较分析,以期发掘稳定表达的主效QTL,进一步丰富调控籽粒大小的分子机理。
1 材料和方法
1.1 试验材料与田间试验
以龙稻5(Longdao 5,LD5)和中优早8(Zhongyouzao 8,ZYZ8)杂交衍生的重组自交系(Recombinant inbred lines,RILs)群体为试验材料,共180个株系。试验于2015,2016,2016年分别于沈阳、南昌和海南试验基地进行,单苗栽插,每系种植3行,田间管理同当地大田栽培管理。
1.2 试验方法
1.2.1 性状测定 成熟后取10个典型稻穗,混合脱粒后选取20个稻粒测定籽粒大小性状,包括粒长、粒宽、粒厚和千粒质量,并计算长宽比和籽粒体积,2次重复,取均值统计分析。
1.2.2 遗传图谱构建 采用2%的CTAB法提取水稻基因组DNA。PCR扩增总体积(12 μL)包括DNA模板2.0 μL、上下游引物(10 μmol/L)各1.5 μL、6 μL的2×Mix混合体系,1.0 μL ddH2O。扩增程序为:94 ℃ 4 min;94 ℃ 45 s,55~58 ℃ 45 s,72 ℃ 45 s,32个循环;72 ℃ 10 min,12 ℃保存。PCR扩增产物用4%~5%的琼脂糖凝胶电泳检测,凝胶成像仪拍照保存数据。分子遗传图谱包括223对分子标记(SSR、InDel和ILP标记),覆盖水稻基因组约1 514.0 cM,标记间的平均距离为6.79 cM,平均每对染色体上的标记数为18.58。
1.2.3 QTL分析 采用Wang等[11] QTL ICI Mapping v4.0的完备区间作图(ICIM)方法进行QTL分析,LOD的阈值设为2.40,当实际求得的LOD值大于LOD阈值时,就判定该区段存在1个QTL,同时估算每个QTL的加性效应值和贡献率大小。QTL的命名遵循McCouch等[12]的原则。
2 结果与分析
2.1 表型分析
不同生态环境下,龙稻5均表现出短小圆粒,籽粒较小,中优早8均表现为细长大粒,中优早8千粒质量极显著大于龙稻5,双亲籽粒大小相关性状均存在显著或极显著差异;RILs群体中不同株系籽粒大小相关性状存在较大幅度变异,呈现双向超亲分离,峰度和偏度值接近于1.00,近似连续的正态分布,这表明籽粒大小性状均为多基因控制的数量性状,符合QTL作图的要求(表1)。
表1 亲本和RILs群体籽粒大小相关性状表型分析
Tab.1 Seed size traits from the parents and RILs population

性状Trait环境Environment亲本Parents重组自交系群体RILspopulation龙稻5LD5中优早8ZYZ8均值±标准误Mean±Std变幅Range峰度Skewness偏度Kurtosis粒长/mm沈阳6.79±0.329.82±0.23∗∗8.11±0.636.79~9.850.26-0.47SL南昌6.96±0.209.74±0.18∗∗8.31±0.606.96~9.810.29-0.50三亚6.97±0.279.18±0.30∗∗8.13±0.626.84~9.580.10-0.86粒宽/mm沈阳3.18±0.082.80±0.10∗∗3.06±0.242.53~3.66-0.02-0.60SW南昌3.12±0.062.78±0.07∗∗2.94±0.222.39~3.45-0.10-0.37三亚3.03±0.082.83±0.21∗∗2.98±0.232.42~3.55-0.02-0.38粒厚/mm沈阳2.22±0.082.15±0.07∗2.10±0.131.77~2.38-0.16-0.41ST南昌2.20±0.031.89±0.12∗2.05±0.121.80~2.420.27-0.17三亚2.15±0.052.03±0.07∗2.08±0.131.81~2.560.220.34籽粒长宽比沈阳2.13±0.063.51±0.20∗∗2.67±0.272.09~3.510.450.01SLW南昌2.23±0.073.50±0.13∗∗2.84±0.292.21~3.780.460.03三亚2.30±0.123.24±0.18∗∗2.74±0.272.02~3.450.34-0.09籽粒体积/mm3沈阳47.80±4.4659.00±1.93∗∗52.53±8.7734.59~75.230.18-0.54SV南昌47.90±2.2151.20±3.85∗∗50.24±7.3035.07~74.920.300.11三亚45.40±2.7452.70±5.74∗∗50.68±8.2933.36~71.730.22-0.62千粒质量/g沈阳23.62±0.9226.82±2.01∗∗24.54±3.1216.50~28.280.14-0.15TGW南昌22.62±0.6325.83±1.51∗∗24.53±4.0215.50~30.280.16-0.14三亚19.62±1.5224.85±1.23∗∗23.85±4.5212.50~35.280.17-0.12
注:SL.粒长;SW.粒宽;ST.粒厚;SLW.籽粒长宽比;SV.籽粒体积;TGW.千粒质量;* 和** 分别表示0.05 和0.01 水平的显著性。表2同。
Note:SL. Seed length;SW. Seed width;ST.Seed thickness;SLW.Seed length/width;SV.Seed volume;TGW.Thousand grain weight;*and**represent significant differences at the 5% and 1% level,respectively.The same as Tab.2.
2.2 QTL分析
共检测到控制籽粒大小性状的35个QTL,分布于第2,3,4,5,8,10,11号染色体上,LOD值介于2.40~7.97,解释5.76%~38.88%的表型变异,其中,qST8、qSL11、qSV11和qTGW11能在3个环境下被同时检测到,qSV2b、qST3、qSLW3、qSLW8、qTGW8、qSW8和qSV8能在2个环境下被重复检测到,其余QTL仅能在单一环境下被发现(表2、图1)。
表2 籽粒大小性状QTL分析
Tab.2 Putative QTL for seed size traits were detected in RILs population
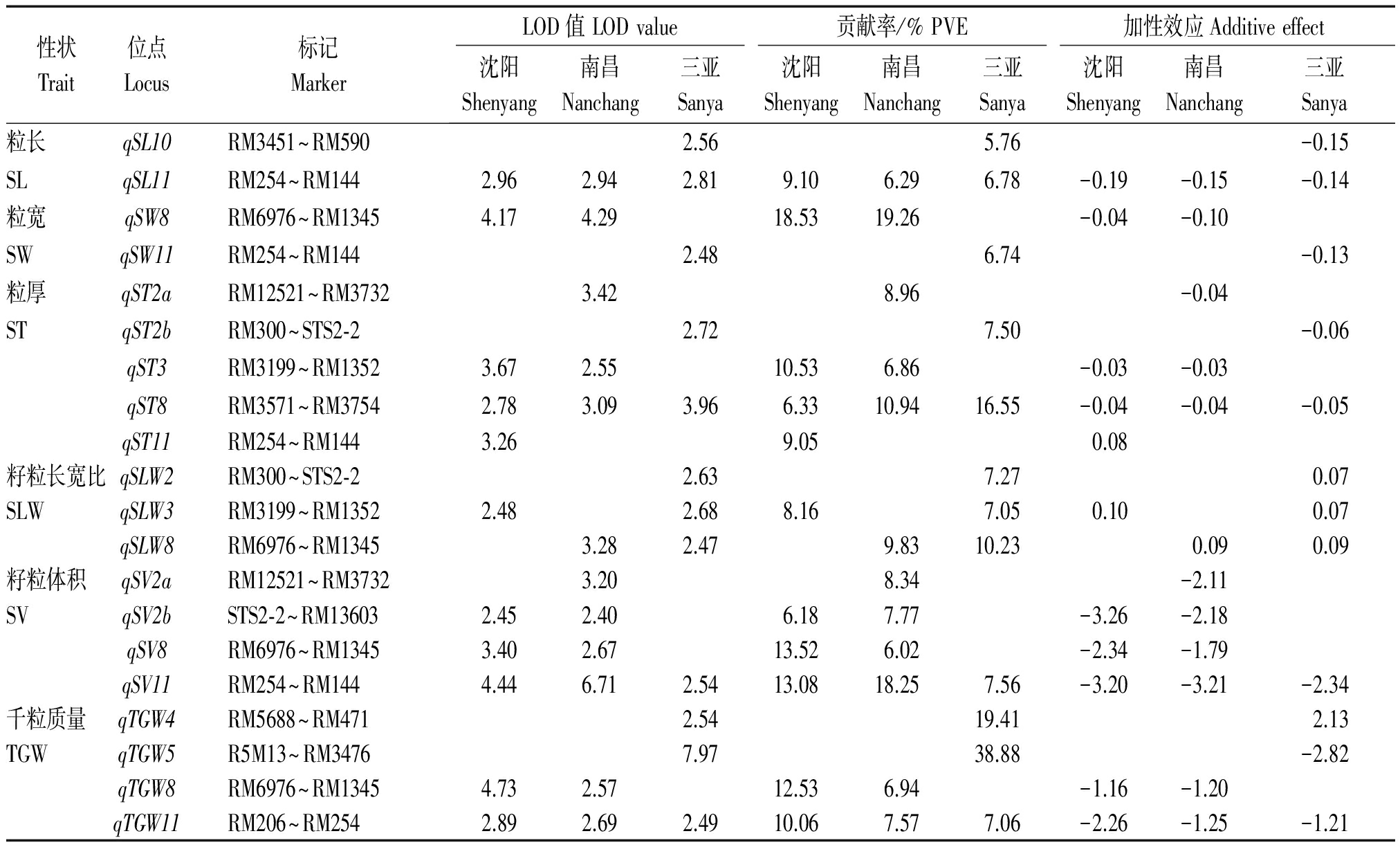
性状Trait位点Locus标记MarkerLOD值LODvalue贡献率/%PVE加性效应Additiveeffect沈阳Shenyang南昌Nanchang三亚Sanya沈阳Shenyang南昌Nanchang三亚Sanya沈阳Shenyang南昌Nanchang三亚Sanya粒长qSL10RM3451~RM5902.565.76-0.15SLqSL11RM254~RM1442.962.942.819.106.296.78-0.19-0.15-0.14粒宽qSW8RM6976~RM13454.174.2918.5319.26-0.04-0.10SWqSW11RM254~RM1442.486.74-0.13粒厚qST2aRM12521~RM37323.428.96-0.04STqST2bRM300~STS2⁃22.727.50-0.06qST3RM3199~RM13523.672.5510.536.86-0.03-0.03qST8RM3571~RM37542.783.093.966.3310.9416.55-0.04-0.04-0.05qST11RM254~RM1443.269.050.08籽粒长宽比qSLW2RM300~STS2⁃22.637.270.07SLWqSLW3RM3199~RM13522.482.688.167.050.100.07qSLW8RM6976~RM13453.282.479.8310.230.090.09籽粒体积qSV2aRM12521~RM37323.208.34-2.11SVqSV2bSTS2⁃2~RM136032.452.406.187.77-3.26-2.18qSV8RM6976~RM13453.402.6713.526.02-2.34-1.79qSV11RM254~RM1444.446.712.5413.0818.257.56-3.20-3.21-2.34千粒质量qTGW4RM5688~RM4712.5419.412.13TGWqTGW5R5M13~RM34767.9738.88-2.82qTGW8RM6976~RM13454.732.5712.536.94-1.16-1.20qTGW11RM206~RM2542.892.692.4910.067.577.06-2.26-1.25-1.21

![]() 、
、![]() 和■分别表示1、2和3个环境下籽粒大小相关的QTL。
和■分别表示1、2和3个环境下籽粒大小相关的QTL。![]() ,
,![]() and■QTL for seed size traits were detected one,two and three environments,respectively.
and■QTL for seed size traits were detected one,two and three environments,respectively.
图1 控制籽粒大小相关性状的QTL在染色体上的分布
Fig.1 Chromosome location of putative QTL for seed size traits
检测到2个调控籽粒长度相关的QTL,分别位于第10,11号染色体上,其中,qSL11在3种不同生态环境下稳定表达,增效等位基因来自中优早8;共检测到2个影响籽粒宽度相关的QTL,其中,qSW8能在2个环境下被检测到,分别解释18.53%和19.26%的表型变异;检测到5个调控籽粒厚度相关的QTL,分别为qST2a、qST2b、qST3、qST8和qST11,其中, qST3和qST8能在不同环境下被重复检测到;检测到3个影响籽粒长宽比相关的QTL,分别位于第2,3和8号染色体上,qSLW3和qSLW8能在2个环境下被检测到,增效等位基因均来自龙稻5;检测到4个调控籽粒体积相关的QTL,分布于第2,8和11号染色体上,其中,qSV11在3种生态环境下稳定表达,分别解释13.08%,18.25%和7.56%表型变异,qSV2b和qSV8均在沈阳和南昌环境下稳定表达,增效等位基因均来自中优早8;与千粒质量相关的QTL是qTGW4、qTGW5、qTGW8和qTGW11,其中qTGW8和qTGW11能在2个以上环境下被发现,是2个稳定表达的主效QTL。此外,籽粒大小相关的QTL成簇分布于第2,3,8和11号染色体上,位于第8和11号染色体上检测到的2个QTL簇qSS8(qSW8、qST8、qSLW8、qSV8和qTGW8)和qSS11(qSL11、qSV11和qTGW11)存在明显的多效性和环境顿感特性,对籽粒大小具有明显的调控作用。
3 讨论与结论
籽粒大小是直接影响水稻产量和品质性状的重要指标之一,其遗传与发育机制一直是水稻育种家和分子生物学家研究的热点[2,13-14]。适当增加水稻籽粒体积可以提高产量,但随着籽粒体积的增加,往往导致稻米加工和外观品质恶化,尤其是垩白性状[15-16]。近年来,随着经济社会的发展和人们生活水平的日益提高,人们对优质稻米的需求日益增强。因此,发掘与利用籽粒大小相关基因对培育高产优质品种具有重要的意义。
水稻籽粒大小性状均属于典型的数量性状,受多基因控制,且易受环境的影响[2,4,17-19]。高方远等[20]利用细长粒川106B与川345B 构建的F2群体对粒型性状进行QTL分析,检测到8个粒型相关的QTL,最终将qGT8精细定位在SG930~SG950的11.2 kb内;刘丹等[21]利用RILs群体共检测到27个控制粒形性状的QTL,相关QTL成簇分布在第3,5,12 号染色体上,其中,qGW5不同环境下稳定性较好,qGL12b和qGT12b是一个新的调控籽粒大小的多效性QTL簇;Yao等[5]以籼-粳和粳-粳交衍生的2种RILs群体为试验材料,对籽粒大小性状进行QTL分析,共检测到78个相关位点,QTL成簇分布在第3,5,9,10,12号染色体上,遗传背景对籽粒大小相关性状QTL检测存在显著影响,GS3和DEP1基因是影响籽粒大小的重要因素;王松凤等[22]共检测到19个籽粒大小的QTL,其中仅有6个QTL能在不同环境下稳定表达。本研究在3个生态环境下共检测到35个控制籽粒大小的QTL,分布于第2,3,4,5,8,10,11号染色体上,单一QTL解释5.78%~38.88%表型变异,qST8、qSL11和qSV11、qTGW11能在3个环境被检测到, qSV2b、qST3、qSLW3、qSLW8、qTGW8、qSW8和qSV8能在2个环境下被发现,其余QTL仅能在单一环境下表达;籽粒大小相关QTL在第2,3,8,11号染色体上形成多效性QTL簇,其中,位于第8和11号染色体上qSS8(qST8、qSW8、qSLW8、qSV8 和qTGW8)和qSS11(qSL11、qSV1和qTGW11)是2个稳定表达的多效QTL簇,具有明显的多效性和对环境相对钝感特性;其中qSS11与Oh等[23]已精细定位的qTGW11位于相近区域,而位于第8染色体的RM6976~RM3571区间的多效性QTL-qSS8能调控籽粒宽、厚、长宽比、籽粒体积和千粒质量,位于已克隆的GW8/OsSPL16基因下端区域[24-25],可能是一个新的环境钝感的主效QTL,具有一定的研究和育种价值,品种资源课题组正在构建次级群体对主效QTL qSS8进行精细定位和功能分析,以期阐述相关基因对籽粒大小调控的分子机理。
此外,与粒长、粒宽和千粒质量相比,有关籽粒厚度的研究报道甚少[26-30]。控制水稻籽粒大小性状的各基因都是紧密联系、相互依赖的;粒厚与粒宽呈现显著或极显著的正相关,与粒重也呈正相关,与长宽比呈极显著负相关关系,且粒厚对稻米品质性状具有明显的影响[1-3,5,31-32]。本研究中,共检测到5个粒厚相关的QTL,分布于第2,3,8和11号染色体上,单一QTL解释6.33%~16.55%的表型变异;其中qST3和qST8能在不同生态环境下稳定表达,是2个新的稳定调控粒厚的主效QTL,是粒厚进一步研究的热点区域。
参考文献:
[1] 徐正进,邵国军,韩 勇,等. 东北三省水稻产量和品质及其与穗部性状关系的初步研究[J]. 作物学报,2006,32(12):1878-1883.
[2] 黄海祥,钱 前. 水稻粒形遗传与长粒型优质粳稻育种进展[J]. 中国水稻科学,2017,31(6):665-672.
[3] 厉新民,林鸿宣. 全基因组关联分析实现水稻粒型自然变异的分子解析[J]. 植物学报,2016,51(4):411-415.
[4] Huang R Y,Jiang L R,Zheng J S,et al. Genetic bases of rice grain shape:so many genes,so little known[J]. Trends in Plant Science,2013,18(4):218-226.
[5] Yao X Y,W J Y,Liu J,et al. Comparison and analysis of QTLs for grain and hull thickness related traits in two recombinant inbred line populations(RILs)in rice(Oryza sativa L.)[J]. Journal of Integrative Agriculture,2016,15(11):2437-2450.
[6] Bai X,Luo L,Yan W,et al. Genetic dissection of rice grain shape using a recombinant inbred line population derived from two contrasting parents and fine mapping a pleiotropic quantitative trait locus qGL7[J]. BMC Genetics,2010,11(1):16.
[7] Fan C,Xing Y,Mao H,et al. GS3,a major QTL for grain length and weight and minor QTL for grain width and thickness in rice,encodes a putative transmembrane protein[J].Theoretical and Applied Genetics,2006,112(6):1164-1171.
[8] Weng J,Gu S,Wan X,et al. Isolation and initial characterization of GW5,a major QTL associated with rice grain width and weight[J]. Cell Research,2008,18(12):1199-1209.
[9] 黎毛毛,徐 磊,任军芳,等. 粳稻粒形性状的数量性状基因座检测[J]. 中国农业科学,2009,42(7):2255-2261.
[10] 刘 进,李 清,张 宇,等. 不同年份水稻粒形性状的QTL分析[J]. 核农学报,2014,28(12):2153-2158.
[11] Wang J K,Li H H,Zhang L Y,et al. Users′manual of QTL IciMapping V4[EB/OL],2014.
[12] McCouch S R,Cho Y G,Yano M,et al. Report on QTL nomenclature[J]. Rice Genet Newslett,1997,14:11-13.
[13] 李兴星,郑 剑,周军杰,等. 粳稻资源热粳35重要农艺性状的QTLs定位[J]. 植物生理学报,2016,52(8):1176-1190.
[14] Segami S,Yamamoto T,Oki K,et al. Detection of novel QTLs regulating grain size in Extra-large grain rice (Oryza sativa L.) lines[J]. Rice,2016,9:34.
[15] 王 军,朱金燕,周 勇,等. 基于染色体单片段代换系的水稻粒形QTL定位[J]. 作物学报,2013,39(4):617-625.
[16] 周立军,江 玲,刘 喜,等. 水稻千粒重和垩白粒率的QTL 及其互作分析[J]. 作物学报,2009,35(2):255-261.
[17] 高志强,占小登,梁永书,等. 水稻粒形性状的遗传及相关基因定位与克隆研究进展[J]. 遗传,2011,33(4):314-321.
[18] Sun L,Ma D P,Yu H H,et al. Identification of quantitative trait loci for grain size and the contributions of major grain-size QTLs to grain weight in rice[J]. Molecular Breeding,2013,31(2):451-461.
[19] 李生强,崔国昆,关成冉,等. 基于水稻单片段代换系的粒形QTL定位[J]. 中国水稻科学,2011,25(2):163-168.
[20] 高方远,罗正良,任鄄胜,等. 水稻粒厚主效位点qGT8精细定位和候选基因分析[J]. 中国农业科学,2015,48(24):4859-4871.
[21] 刘 丹,王嘉宇,柴永山,等. 利用籼粳交RILs群体的水稻粒形QTLs定位[J]. 沈阳农业大学学报,2015,46(4):385-390.
[22] 王松凤,李 辉,刘 喜,等. 水稻粒形相关性状及千粒重QTL的稳定性分析[J]. 南京农业大学学报,2008,31(3):1-7.
[23] Oh J M,Balkunde S,Yang P,et al. Fine mapping of grain weight QTL, tgw11 using near isogenic lines from a cross between Oryza sativa and O.grandiglumis[J]. Genes Genomics,2011,33(3):259-265.
[24] Wang S K,Wu K,Yuan Q B,et al. Control of grain size,shape and quality by OsSPL16 in rice[J]. Nature Genetics,2012,44(8):950-954.
[25] Xie X B,Song M H,Jin F X,et al. Fine mapping of a grain weight quantitative trait locus on rice chromosome 8 using near-isogenic lines derived from a cross between Oryza sativa and Oryza rufpogon[J]. Theoretical and Applied Genetics,2006,113(5):885-894.
[26] 佘 东,刘强明,李大露,等. 利用Ⅱ-32B/A7444组合CSSL群体定位水稻7个穗部性状QTL[J]. 作物学报,2017,43(5):658-668.
[27] 方先文,张云辉,肖西林,等. 基于重组自交系群体的水稻粒形QTL定位[J]. 江苏农业学报,2017,33(2):241-247.
[28] 叶乃忠,曾 盖,唐 伟,等. 日本晴/R1126水稻重组自交系群体粒形性状 QTL 定位[J]. 华北农学报,2016,31(1):90-95.
[29] Fang N,Xu R,Huang L J,et al. Small grain 11 controls grain size,grain number and grain yield in rice[J]. Rice,2016,9:64.
[30] 汪玉琼,杨窑龙,冷语佳,等. 水稻小粒基因SG10的鉴定和精细定位[J]. 中国水稻科学,2017,31(6):580-589.
[31] Sun L,Li X,Fu Y,et al. GS6,a member of the GRAS gene family,negatively regulates grain size in rice[J]. Journal of Integrative Plant Biology,2013,55(10):938-949.
[32] Wan X Y,Wan J M,Jiang L,et al. QTL analysis for rice grain length and fine mapping of an identified QTL with stable and major effects[J]. Theoretical and Applied Genetics,2006,112(7):1258-1270.