藏鸡是我国特有的优良地方品种,主要产于青藏高原[1]。其为了适应高原地区特殊的气候生态环境,形成了具有抗寒、抗病、耐粗饲和优良药用价值等特点[2],并且藏鸡肉含有人体必需氨基酸、脂肪含量低、蛋白含量高、腿肌率高及腹脂率低等特点[3]。因此,阐明其肉质性状的形成机理具有重要意义。肌内脂肪(Intramuscular fat,IMF)可从肉的嫩度、风味与多汁等方面调节动物肉品质[4],是影响肉质的重要因素之一。因此,从IMF沉积调控机制角度入手来阐明肉质性状具有重要的理论及实际意义。
骨骼肌中高表达的GTP结合蛋白(GTP binding protein overexpressed in skeletal muscle)属于Ras相关GTP结合蛋白中Rad/Gem/Kir(RGK)亚群[5],高表达于Ⅱ型糖尿病患者的骨骼肌中[6],可以调节通过Rho激酶(Rho kinase,ROK)介导调节电压依赖性钙通道(VDCC)信号传导和细胞骨架重排,抑制ROK调节器[7-9]。目前,关于GEM基因的研究主要集中于小鼠和细胞系的电压依赖性钙通道、细胞骨架调节以及蛋白结构等方面。直至2003年龚海霞等[10]在肥胖大鼠脂肪基因表达谱系研究中发现,在正常大鼠和食源性肥胖大鼠的腹部脂肪组织中GEM基因存在差异表达,推测GEM基因为肥胖相关的差异表达基因,但小鼠3T3-L1细胞系中却存在不同的报道,即GEM基因在细胞系诱导分化的过程中表达水平无显著变化[11]。说明GEM基因在脂质积累和脂肪细胞分化中的作用可能具有物种特异性,且关于GEM基因在鸡脂肪沉积中的作用尚未见报道。
为了阐明GEM基因在鸡肌内脂肪沉积中的调控作用,本试验以藏鸡为研究对象,利用RT-PCR方法克隆藏鸡GEM基因序列,利用生物信息学方法阐明该基因的生物学特征,利用荧光定量PCR(Quantitative Real-time PCR,qPCR)方法检测该基因的组织和时序表达特性,进而构建其组织和时序表达谱,并将基因表达与不同发育阶段不同肌肉组织IMF含量进行相关分析,研究结果可为揭示该基因在藏鸡优良肉质性状形成中的作用机理提供重要的数据,同时为该基因调控其他物种脂肪沉积的分子机制提供关键依据。
1 材料和方法
1.1 试验材料
1.1.1 组织样品采集 选取1,81,119,154,210 d不同日龄健康的藏鸡为试验动物,饲养条件相同,且均购自成都益生康健农业有限公司藏鸡养殖基地(位于四川省彭州市新兴镇狮山村老虎崖)。现场放血法屠宰后,采集各个日龄藏鸡不同部位的肌肉组织并同时采集154日龄公母藏鸡心脏、肝脏、脾脏、肺脏、肾脏和皮下脂肪等组织样品,置于液氮内保存备用。
本试验所有样品RNA的提取均是按照TRIzol试剂盒使用说明来进行,并且均满足如下条件:1%琼脂糖凝胶电泳检测有3条清晰条带;紫外光分光光度计测定OD260/280值为1.8~2.0;然后将获得的RNA按照RevertAid First Strand cDNA Synthesis Kit说明书反转录成cDNA备用。
1.1.2 主要试剂 pMD-19T Vector、TRIzol和SYBR® Premix Ex TaqTM(2×)购于TaKaRa公司; E.coli DH5α感受态细胞、2×GC-Rich PCR Master Mix及DNA胶回收试剂盒购于TIANGEN公司;反转录试剂盒购于Thermo公司;氨苄青霉素购于成都BIOSHARP公司。
1.2 试验方法
1.2.1 藏鸡GEM基因克隆序列 根据GenBank上原鸡GEM基因序列(NM_213579.1),利用PrimerPremier 5.0软件设计PCR克隆引物(表1)。克隆扩增体系和条件分别为:cDNA 1 μL,10 μmol/L Sense primer 1 μL,10 μmol/L Antisense primer 1 μL,2×GC-Rich PCR Master Mix 12.5 μL,ddH2O 9.5 μL;预变性95 ℃ 4 min;95 ℃变性45 s,60 ℃退火70 s,72 ℃延伸60 s,38个循环;72 ℃延伸10 min。扩增产物利用DNA胶回收试剂盒说明书进行纯化,然后将其与PMD-19T载体连接2 h(16 ℃),转化DH5α后筛选和鉴定菌落,并将电泳结果符合预期条带大小的菌液送至成都擎科梓熙生物技术有限公司测序。
表1 克隆和荧光定量PCR引物信息
Tab.1 Primers informations for reverse transcription PCR (RT-PCR) and quantitative Real-time PCR(qPCR)
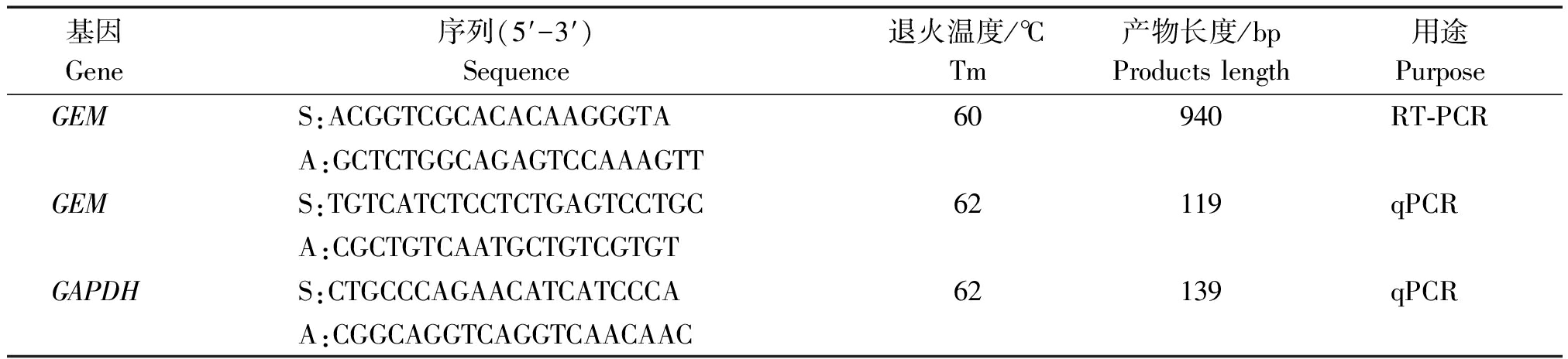
基因Gene序列(5′-3′)Sequence退火温度/℃Tm产物长度/bpProductslength用途PurposeGEMS:ACGGTCGCACACAAGGGTA60940RT⁃PCRA:GCTCTGGCAGAGTCCAAAGTTGEMS:TGTCATCTCCTCTGAGTCCTGC62119qPCRA:CGCTGTCAATGCTGTCGTGTGAPDHS:CTGCCCAGAACATCATCCCA62139qPCRA:CGGCAGGTCAGGTCAACAAC
注:S.正义链引物;A.反义链引物;GAPDH.甘油醛-3-磷酸脱氢酶。
Note:S.Sense primer;A.Antisense primer; GAPDH.Glyceraldehyde-3-phosphate dehydrogenase.
1.2.2 藏鸡GEM基因序列分析 通过NCBI网站中ORF Finder(Open reading frame finder)在线程序寻找藏鸡GEM序列开放阅读框;蛋白质序列相似性比对由DNAMAN Version 5.2.10软件分析,NJ系统进化树由MEGA 7.0软件构建;蛋白基本理化性质(氨基酸组成、分子量、等电点、亲水性等)由ExPASy ProtParam推导;磷酸化位点、O糖基化位点和N糖基化位点分别由NetPhos 3.1、NetOGlyc 4.0和NetNGlyc 1.0预测;亚细胞定位、跨膜结构域的预测和信号肽分析分别利用PSORT II、TMHMM和SignaIP 4.1 Server软件来进行;蛋白质二、三级结构分别采用Hopfield和Swiss-model预测分析;应用Conserved Domains预测蛋白质结构域。
1.2.3 藏鸡GEM基因组织表达差异分析 根据前面获得的藏鸡GEM基因序列设计特异引物(表1)用于qPCR的检测。qPCR反应体系如下:cDNA 1 μL,Sense primer(10 μmol/L)1 μL,Antisense primer(10 μmol/L)1 μL ,SYBR® Premix Ex Taq TM
(2×)PCR 10 μL,补充ddH2O至20 μL。qPCR反应程序为:95 ℃ 3 min(预变性);95 ℃ 10 s(变性),60 ℃ 10 s(退火),72 ℃ 15 s(延伸),38个循环。以GAPDH作为内参基因,以准确矫正表达水平,同时每个组织样品设3个重复。
1.2.4 藏鸡GEM基因在胸肌和腿肌中的时序表达差异 选取不同生长发育(1,81,119,154,210 d)藏鸡公母鸡各8只,分别提取胸肌和腿肌总RNA,使用RevertAid First Strand cDNA Synthesis Kit进行反转录,利用qPCR检测GEM基因的表达水平。反应体系和反应程序同1.2.3(退火温度为62 ℃)。
1.2.5 数据统计及分析 依据qPCR所测得的Ct(GEM)和Ct(GAPDH)计算目的基因的相对表达量,Ct是qPCR反应中扩增产物的荧光信号强度达到设定阈值时所经过的扩增循环数,用2-ΔΔCt法对数据进行均一化处理,其中ΔCt= Ct(GEM)-Ct(GAPDH)、ΔΔCT= ΔCt(样品组)-ΔCt(对照组)。利用SPSS 18.0软件中一般线性模型(单因素)进行显著性检验,采用双变量相关对GEM mRNA表达水平与IMF含量进行相关性分析。P<0.05时,认为差异具有统计学意义。
2 结果与分析
2.1 藏鸡GEM基因的克隆
经2%琼脂糖凝胶电泳检测发现,克隆产物为条带单一的特异片段,且与预期目的产物大小相符。藏鸡GEM基因全长为940 bp,其中,ORF长度为894 bp,5′ UTR序列24 bp和3′ UTR序列22 bp,起始密码子和终止密码子分别为ATG和TAA,共编码297个氨基酸。对其碱基序列组成分析发现,A=28.6%,T=19.6%,C=23.3%,G=28.5%。C+G=51.8%,A+T=48.2%,说明该基因CDS区的DNA双链较稳定。提交至GenBank获得登录号为KY747399。经氨基酸序列比对发现,藏鸡GEM基因与原鸡(NP_998744.1)核苷酸序列相似性为99.33%,共检测5个碱基突变,c.347A>T(p.Glu115Asp)、c.566G>T(p.Leu188Phe)、c.598A>G(p.His199Arg)、c.875T>G(p.His291Asp)和c.876G>T(p.Gln292Tyr)。藏鸡GEM氨基酸序列与原鸡、绿头鸭、人和小鼠的相似性分别为98.32%,97.32%,83.50%和83.84%(图1)。
2.2 藏鸡GEM基因序列分析
藏鸡GEM蛋白分子式为C1481H2388N444O456S14,预测分析其分子质量为34.16 ku,理论等电点、不稳定指数和亲水性总平均值分别为9.01,81.35,-0.601,说明该蛋白为不稳定亲水蛋白。藏鸡GEM蛋白所编码的297个氨基酸中Ser(10.4%)、Arg(8.8%)和Val(8.4%)频率较高,同时带正电荷的残基总数(Arg+Lys)为29,多于带负电荷的氨基酸残基总数(Asp+Glu=41),因此整体带正电荷。预测结果表明,藏鸡GEM蛋白无信号肽序列及跨膜结构域,主要在线粒体(47.8%)和细胞核(43.5%)中发挥生物学作用,其次在过氧化物酶体(8.7%)中发挥生物学作用;该蛋白所具有的丝氨酸、苏氨酸和酪氨酸磷酸化位点分别为21,6,6个,存在2个N-糖基化位点(第5位对应氨基酸残基N-糖基化修饰概率为0.744 0,第192位对应氨基酸残基N-糖基化修饰概率为0.561 3),无O-糖基化位点。GEM二级结构预测结果显示,二级结构中无规卷曲占41.08%,α-螺旋占29.97%,延伸链占28.96%,无β-折叠。蛋白质三级结构预测结果与二级结构预测结果基本一致(图2)。蛋白质结构域预测结果显示(图3),藏鸡GEM蛋白具有RGK家族的典型结构域以及GTP/Mg2+ 结合位点,同时具有小G蛋白共有的SwitchⅠ、Switch Ⅱ和G1 BOX、G2 BOX、G3 BOX、G4 BOX、G5 BOX。

GenBank登录号:藏鸡.KY747399;原鸡.NP_998744.1;绿头鸭.XP_005030168.1;人.NP_005252.1;小鼠.NP_034406.2。GenBank accession number:Tibetan chicken.KY747399;Gallus gallus.NP_998744.1;Anas platyrhynchos. XP_005030168.1; Homo sapiens.NP_005252.1;Mus musculus.NP_034406.2.
图1 不同物种间GEM蛋白相似性分析
Fig.1 Similarity of GEM protein between different species
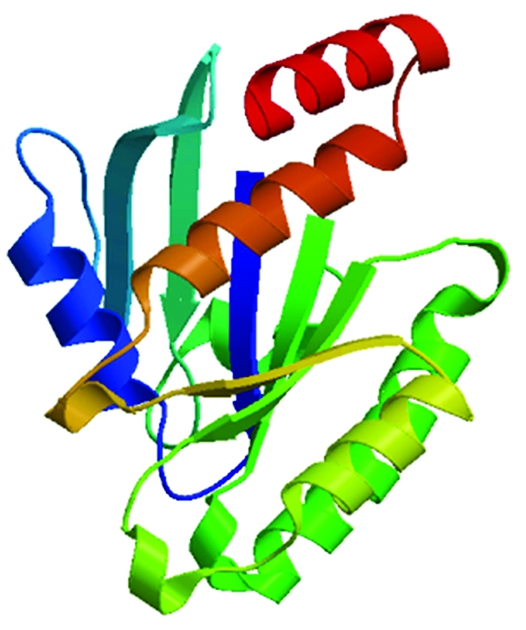
图2 GEM三级结构预测
Fig.2 Putativetertiary structure prediction of GEM
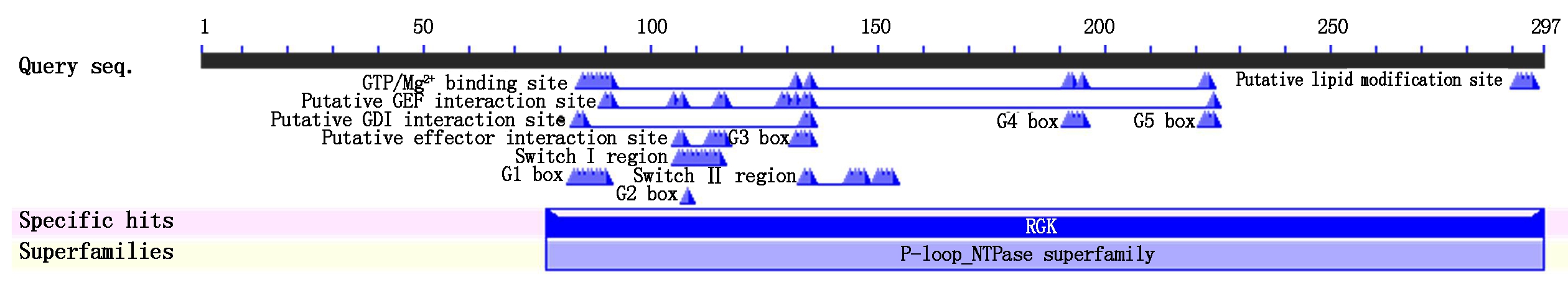
图3 藏鸡GEM推测的氨基酸序列生物学功能预测
Fig.3 Prediction of biological function of the deduced amino acid sequence of Tibetan chicken GEM
2.3 物种间GEM氨基酸序列同源性比较与系统进化树分析
利用NCBI中Blast(Basic local alignment search tool)程序对藏鸡GEM氨基酸序列与原鸡(NP_998744.1)、绿头鸭(XP_005030168.1)、猫(XP_004000024.1)、人(NP_005252.1)、猪(XP_001927011.3)、大鼠(NP_034406.2)、牛(NP_001077201.2)、小鼠(NP_034406.2)、猴(XP_001087849.1)、绵羊(XP_004012065.1)、狗(XP_013964797.1)和斑马鱼(NP_001039314.1)的氨基酸序列进行分析,其同源性依次为100%,98%,98%,84%,84%,84%,84%,84%,84%,83%,85%,75%,53%。同时利用以上物种的氨基酸序列构建系统进化树(图4),结果表明,该基因在进化上高度保守,藏鸡GEM与家禽属同一分支,亲缘关系最近。
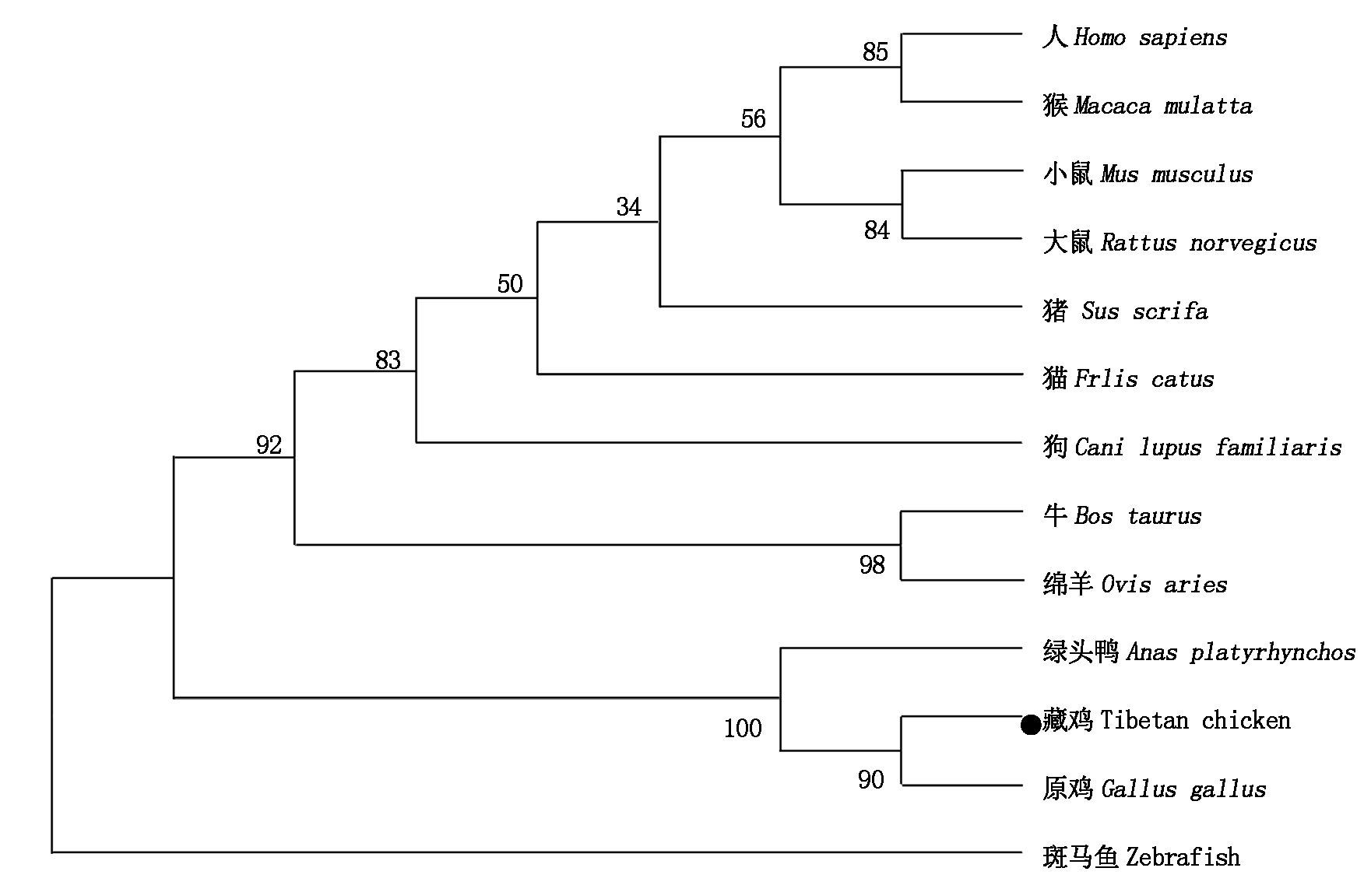
图4 不同物种间GEM氨基酸的进化树
Fig.4 Phylogenetic tree of GEM of various species
2.4 藏鸡GEM基因的组织表达谱
qPCR检测GEM基因在154日龄公鸡和母鸡不同组织的表达情况(图5),以GADPH为参照基因,以心组织的表达水平作为对照,结果显示,该基因普遍表达于公母藏鸡的多个组织,但表达模式具有性别差异。GEM基因在藏鸡的肺组织中表达水平最高,极显著高于其他各个组织(P<0.01),在公藏鸡的皮下脂肪中也存在较高水平的表达(P<0.01),在母藏鸡的脾中也存在较高的表达水平(P<0.01)。
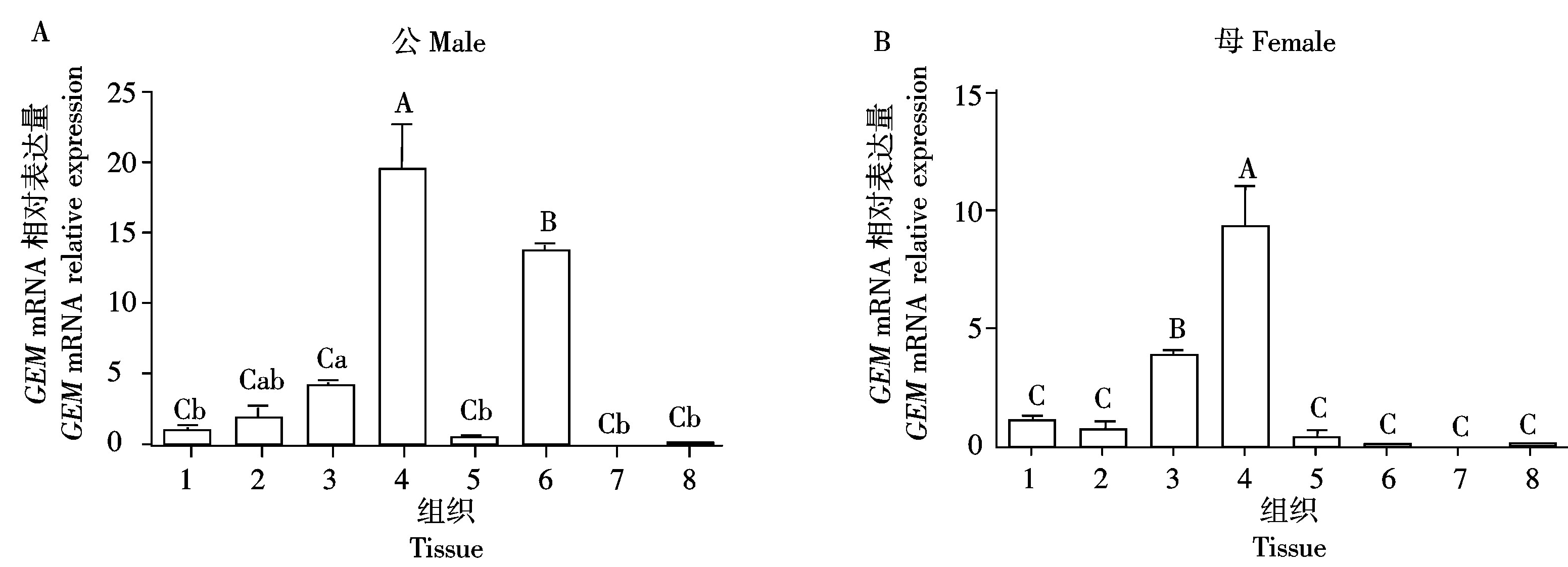
以心组织的表达水平为对照,GAPDH作为内参;1.心;2.肝;3.脾;4.肺;5.肾;6.皮下脂肪;7.胸肌;8.腿肌;不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05)。表6同。The expression level of the heart tissue was used as control,GAPDH was used as internal reference;1.Heart;2.Liver;3.Spleen;4.Lung;5.Kidney;6.Subcutaneous fat;7.Breast muscle;8.Thigh muscle;Different superscript lowercase and capital letters respectively showed extremely significant difference(P<0.05) and significant difference(P<0.01) . The same as Tab.6.
图5 GEM在藏鸡多个组织中的相对表达水平
Fig.5 GEM gene relative expression in multiple tissues of Tibetan chicken
2.5 藏鸡GEM基因的时序表达谱
本试验依据物种特点、脂肪发育的特点和西南民族大学现代生物技术实验室前期试验选择1~210日龄藏鸡的胸肌和腿肌[3],检测GEM基因的时序表达丰度(图6),结果表明,该基因在藏鸡胸肌表达水平随日龄的增长而逐渐降低,在119,154,210日龄时表达水平较低,均极显著低于前2个时期的表达水平(P<0.01);在1,81日龄时该基因的表达趋势存在性别差异,1日龄母鸡胸肌中表达量极显著高于81日龄的表达量(P<0.01),但在公藏鸡胸肌中差异不显著(P>0.05)。在藏鸡腿肌中的表达水平呈先上升后下降趋势,在119日龄公、母藏鸡胸肌中GEM表达水平显著高于其他日龄(P<0.01),不存在性别差异。
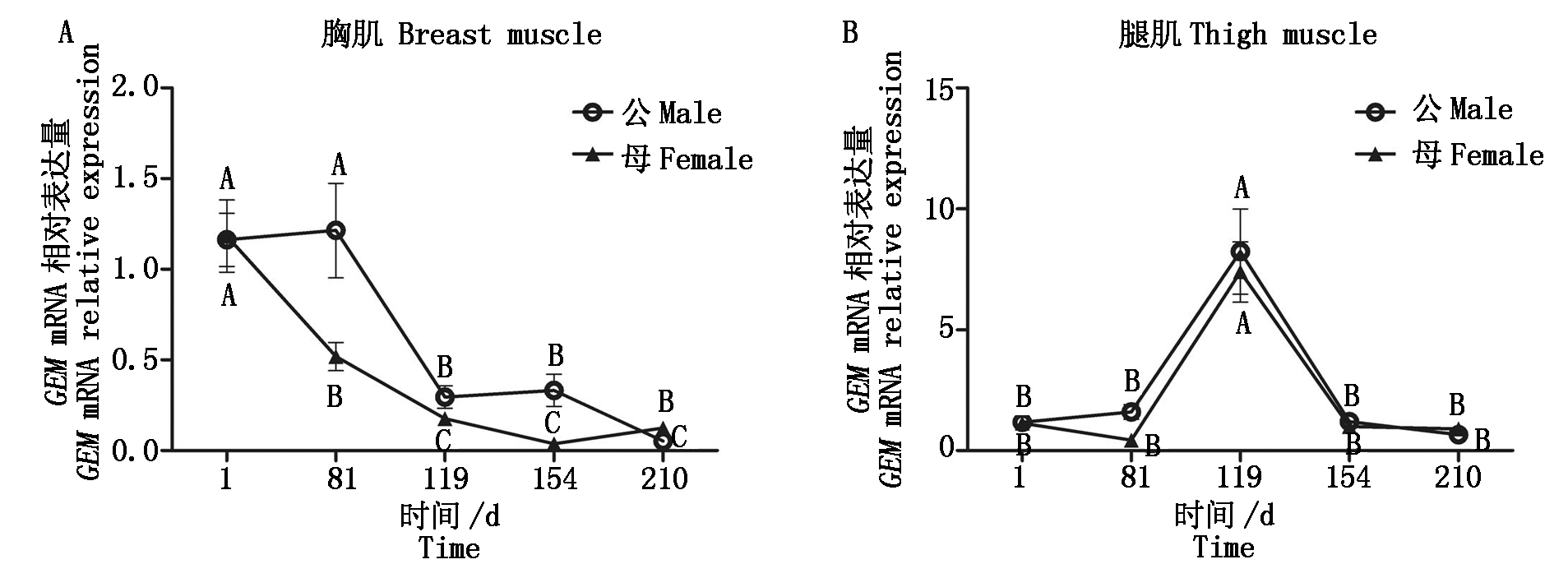
图6 藏鸡GEM基因在不同发育阶段胸肌和腿肌中的相对表达水平
Fig.6 GEM gene relative expression in breast muscle and thigh muscle of Tibetan chicken at different ages
2.6 藏鸡不同肌肉组织GEM mRNA表达水平与IMF含量的相关性分析
本试验中所用的不同发育阶段IMF含量数据为本实验室前期测定[12-13],藏鸡生长发育不同阶段胸肌和腿肌GEM基因表达水平与其IMF含量相关性分析结果表明,该基因的表达水平与相应的IMF含量呈不同程度的相关,且性别不同相关性相反(表2)。在81~210日龄藏鸡胸肌及81~119日龄藏鸡腿肌中,GEM mRNA相对表达水平与其IMF含量的显著性无性别差异,119~210日龄藏鸡腿肌GEM mRNA相对表达水平与IMF含量的显著性存在性别差异,且在公藏鸡上相关性达到显著水平(r=0.414,P<0.05)。
表2 藏鸡GEM mRNA表达水平与IMF含量的相关性分析
Tab.2 The correlation analysis GEM mRNA expression level and IMF content in Tibetan chickens
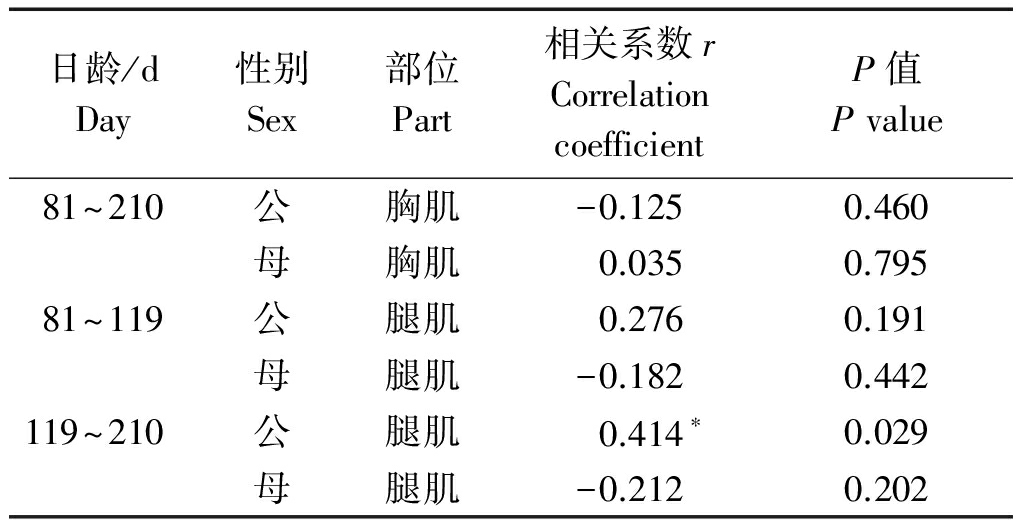
日龄/dDay性别Sex部位Part相关系数rCorrelationcoefficientP值Pvalue81~210公胸肌-0.1250.460母胸肌0.0350.79581~119公腿肌0.2760.191母腿肌-0.1820.442119~210公腿肌0.414∗0.029母腿肌-0.2120.202
注:*.差异显著(P<0.05)。
Note:*.Remarkable difference (P<0.05).
3 讨论与结论
GEM基因序列首次报道于1994年,该基因由有丝分裂原诱导的人类外周血T细胞克隆得到[6],随后受到学者广泛关注。GEM发挥功能主要是通过其蛋白不同结构位点介导来实现的[14],比如:GEM通过改变ROKβ的底物特异性(而不是阻断其催化活性)来抑制Rho激酶(ROK)介导的细胞骨架重排[9,15];GEM通过抑制生长激素分泌(通过L型钙通道的钙离子流刺激引起的)来抑制钙离子电压门控通道活性,并且该功能依赖于GTP和钙调素与GEM蛋白结合[16-17]。关于GEM在鸡脂肪沉积中的作用及机制则尚不清楚。
本研究克隆得到藏鸡GEM基因序列940 bp的基因序列,共编码297个氨基酸,经分析发现,藏鸡GEM基因具有RGK家族的典型结构域和GTP/Mg2+ 结合位点,同时具有小G蛋白共有的SwitchⅠ、SwitchⅡ和G1-5 BOX[18]。与原鸡相比,藏鸡GEM核苷酸序列具有5个碱基突变,均为错义突变。预测结果显示,藏鸡GEM蛋白具有33个磷酸化位点和2个糖基化位点,因磷酸化和糖基化是蛋白质翻译后的重要修饰方式[19 -20],故推测这些位点可能对调节藏鸡GEM蛋白功能起重要作用。氨基酸序列相似性比对分析指出,藏鸡GEM基因与原鸡、绿头鸭具有较高的同源性,同时通过构建进化树也显示出该基因序列在禽类动物中高度保守。
为了进一步阐明GEM基因在藏鸡脂肪沉积中的作用,本试验在获得该序列的基础上利用qPCR技术检测其在藏鸡各组织中的表达情况,获得其组织表达谱。结果显示,GEM基因在藏鸡多种组织中均有表达,且在肺组织中具有最高的表达水平,其次为皮下脂肪和脾组织,可能与这些组织是禽类脂质代谢的主要场所有关。这与其他学者在大鼠中的报道存在不同之处,如Maguire等[6] 研究发现,在小鼠胸腺、脾脏、肾脏、肺和睾丸组织中检测到最丰富的GEM mRNA,但在心脏、大脑、肝脏和骨骼肌细胞中GEM mRNA相对较少或没有转录。原因可能是由于GEM基因的组织表达特性具有物种特异性。时序表达结果显示,在藏鸡胸肌中GEM基因表达量随日龄增加逐渐减少,推测该基因主要在幼龄藏鸡的胸肌中发挥重要作用;而该基因在腿肌中的表达水平随日龄增加呈现先增加后降低的趋势,且在119日龄时达到峰值,与GEM基因在胸肌中的表达模式不同,提示该基因在不同部位肌肉组织发育过程中的分子机制可能存在差异。但在藏鸡同一部位肌肉组织中,该基因表达模式则不存在性别差异。由上可知,不同性别、年龄和组织部位均会影响GEM基因的表达。然而,GEM基因在时空上的广泛表达是否预示着其在脂代谢过程中发挥着重要的生物学功能,关于该基因功能鉴定及其作用机制有待进一步试验研究。在该基因的大量研究报道中并未涉及其与IMF沉积的关系。因此,为了揭示该基因与IMF沉积的关系,本研究对藏鸡不同发育阶段胸肌和腿肌中GEM基因表达水平与IMF含量进行相关性分析,结果显示,GEM基因在不同日龄不同部位的肌肉组织中的表达水平与相应IMF含量具有一定的相关性,并且存在性别差异,且GEM基因与藏鸡腿肌的IMF存在显著相关,推测可以作为藏鸡脂肪沉积的候选基因。本试验研究结果为在大鼠中的研究提供佐证[10],但该基因如何调控脂肪细胞分化、脂肪沉积、脂质代谢则需要进一步研究,这也是本实验室下一步的主要研究内容。
本试验克隆得到藏鸡GEM基因CDS全长940 bp,编码297个氨基酸。组织表达谱显示,GEM基因在藏鸡肺组织中存在较高水平的表达;时序表达谱显示,在藏鸡发育不同阶段的胸肌和腿肌中,GEM的表达模式具有性别差异,GEM基因在不同发育阶段胸肌及腿肌中的表达量与IMF含量呈不同程度相关且具有性别差异。本试验研究结果为进一步研究GEM基因在藏鸡脂质代谢中的作用提供了基础理论数据。
参考文献:
[1] 聂晓庆,林亚秋,徐亚欧,等. 藏鸡磷酸酪氨酸互作结构域1(PID1)的克隆及组织表达谱研究[J]. 畜牧兽医学报,2016,47(6):1102-1111.
[2] 王翔宇. 藏鸡胚胎低氧适应的转录组差异表达分析[D]. 北京:中国农业大学,2014.
[3] 林亚秋,徐亚欧,张润锋,等. 藏鸡Chemerin和ChemeR23基因时序表达及其与肌内脂肪含量的相关性研究[J]. 畜牧兽医学报,2015,46(8):1290-1299.
[4] 甘麦邻,堵晶晶,杨 琼,等. 动物肌内脂肪对肉质的影响及其分子机制研究进展[J]. 现代畜牧兽医,2017(10):51-57.
[5] Piddini E,Schmid J A,De Martin R,et al. The Ras-like GTPase Gem is involved in cell shape remodelling and interacts with the novel kinesin-like protein KIF9[J]. The EMBO Journal,2001,20(15):4076-4087.
[6] Maguire J,Santoro T,Jensen P,et al. Gem:an induced,immediate early protein belonging to the Ras family[J]. Science,1994,265(5169):241-244.
[7] Opatowsky Y,Sasson Y,Shaked I,et al. Structure-function studies of the G-domain from human gem,a novel small G-protein[J]. FEBS Letters,2006,580(25):5959-5964.
[8] Andrieu G,Quaranta M,Leprince C,et al. Gem GTPase acts upstream Gmip/RhoA to regulate cortical actin remodeling and spindle positioning during early mitosis[J]. Carcinogenesis,2014,35(11):2503-2511.
[9] Ward Y,Yap S F,Ravichandran V,et al. The GTP binding proteins Gem and Rad are negative regulators of the Rho-Rho kinase pathway[J]. Journal of Cell Biology,2002,157(2):291-302.
[10] 龚海霞,郭锡熔,陈荣华,等. 肥胖大鼠脂肪组织基因表达谱系研究[J]. 中华医学遗传学杂志,2003,20(3):268-271.
[11] 刘 勇,郭锡熔,潘晓勤,等. GEM基因在3T3-L1脂肪细胞诱导分化过程中的表达变化[J]. 现代诊断与治疗,2005,16(5):265-268.
[12] Li Q,Zuo L L,Lin Y Q,et al. Cloning and expression of SFRP5 in tibetan chicken and its relationship with IMF deposition[J]. Animal Biotechnology,2016,27(4):231-237.
[13] 林 森,林亚秋,朱江江,等. 藏鸡FTO基因表达的时空特性及与肌内脂肪含量的相关分析[J]. 畜牧兽医学报,2017,48(7):1191-1201.
[14] Ward Y,Spinelli B,Quon M J,et al. Phosphorylation of critical serine residues in gem separates cytoskeletal reorganization from down-regulation of Calcium Channel activity[J]. Molecular and Cellular Biology,2004,24(2):651-661.
[15] Hatzoglou A,Ader I,Splingard A A,et al. Gem associates with ezrin and acts via the Rho-GAP protein gmip to down-regulate the Rho pathway[J]. Molecular Biology of the Cell,2007,18(4):1242-1252.
[16] Ward Y,Kelly K. Gem protein signaling and regulation[J]. Methods Enzymol,2006,407:468-483.
[17] Gunton J E,Sisavanh M,Stokes R A,et al. Mice deficient in GEM GTPase show abnormal glucose homeostasis due to defects in Beta-Cell Calcium handling[J]. PLoS One,2012,7(6):e39462.
[18] 石佰丽,吕梦燕,赵秋雁. 小GTPase蛋白家族的研究进展[J]. 安徽农业科学,2012,40(5):2566-2569,2573.
[19] Kimj H,Lee J,Oh B,et al. Prediction of phosphorylation sites using SVMs[J]. Bioinformatics,2004,20(17):3179-3184.
[20] Gupta R,Brunak S. Prediction of glycosylation across the human proteome and the correlation to protein function [J]. Pac Symp Biocomput,2002,7:310-322.