表1 不同浓度的钾处理
Tab.1 Treatment with different concentrations of potassium
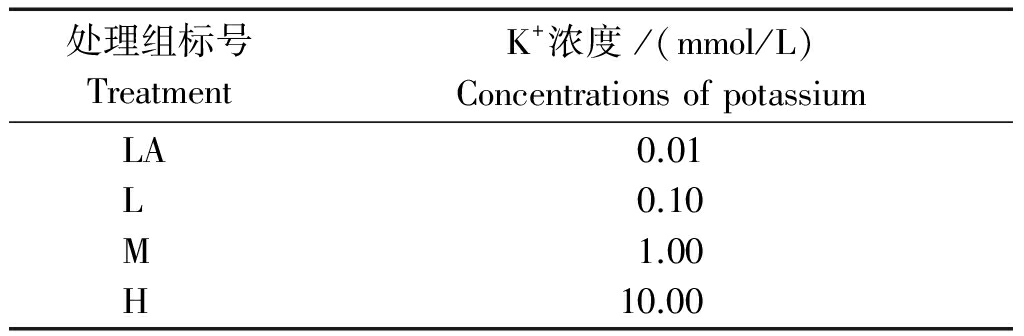
处理组标号TreatmentK+浓度/(mmol/L)ConcentrationsofpotassiumLALMH0.010.101.0010.00
摘要:为了研究不同钾素浓度对钾转运体KUP6和KUP7基因表达量的影响,通过水培法培养马铃薯幼苗,通过提取马铃薯总RNA,经检测合格后用反转录试剂盒合成其cDNA的第一链。运用实时荧光定量核酸扩增检测技术对幼苗叶片进行基因转录水平的检测。在马铃薯幼苗种植后的第10,20,30 天分别测定马铃薯幼苗根、茎和叶中钾的含量,并进行统计分析。结果表明:钾素浓度为1.00 mmol/L时,KUP6和KUP7基因表达量最高,且与其他处理有显著差异;钾素浓度低于0.10 mmol/L时,表达量较低,钾素浓度为10.00 mmol/L时该基因表达量也降低。表明较高和较低的钾离子浓度都不利于KUP6和KUP7基因的表达。通过对根、茎和叶内钾素含量测定表明:对于根系来说,钾素浓度在1.0 mmol/L时已到达其吸收饱和值;在钾素浓度为1.00,10.00 mmol/L的高钾水培中,马铃薯根、茎和叶钾素含量大于水培钾素浓度为0.01,0.10 mmol/L的低钾处理;在低钾水培条件下,茎叶随着培养时间的延长,其钾素含量之间的差异逐渐减小,而在高钾条件下,其差异逐渐增大。
关键词:马铃薯;钾转运体;qPCR;KUP6;KUP7
马铃薯(Solanum tuberosum L.)是茄科多年生的草本植物,它的块茎可供食用,是仅次于小麦、水稻和玉米的第四大重要粮食作物。内蒙古是我国马铃薯的主产区之一,马铃薯产业已经成为内蒙古地区农业经济发展的主导产业。马铃薯是喜钾作物,它对钾素的吸收量大于氮和磷,且钾素直接影响马铃薯的产量和质量[1-3]。K+是植物体内最为丰富的无机一价阳离子,可以参与植物的多种生理生化过程[4]。钾转运蛋白主要包括 KUP/HAK/KT 家族、HKT/Trk家族、CHX 家族和 KEA 家族。而其中的 KUP/HAK/KT家族是在生物界内最早被发现的,它不仅数目最多而且功能最丰富,它的主要作用是介导植物中钾离子等元素的吸收转运和根部生长素的运输[5-7]。目前,已在拟南芥、水稻、大麦、桃树中分别预测得到13,27,5,17个 KUP/HAK/KT钾转运体[8-11]。
研究不同钾素浓度下马铃薯钾转运体KUP6和KUP7基因表达量的不同,并分析它们之间的关系,以及不同钾浓度对马铃薯幼苗钾素含量的影响,从而探索马铃薯生长的适宜钾浓度,对提高马铃薯产量和提高钾素的利用效率具有十分重要的意义。
试验材料为脱毒马铃薯费乌瑞它组培苗,由内蒙古正丰马铃薯种业股份有限公司提供。试剂为柱式植物总RNA抽提纯化试剂盒,购自上海生工生物有限公司,反转录试剂盒和SYBR Premix Ex TaqTM 试剂盒购自宝生物工程有限公司。水培试剂购自上海国药集团化学试剂有限公司。
马铃薯组培苗置于 20 ℃,18 h 光照(光照强度9 000 lx)/6 h 黑暗条件下培养。水培营养液参照Hongland营养液,其中,4个钾素浓度(K2SO4)处理见表1,随机排列,4次重复。
表1 不同浓度的钾处理
Tab.1 Treatment with different concentrations of potassium

处理组标号TreatmentK+浓度/(mmol/L)ConcentrationsofpotassiumLALMH0.010.101.0010.00
在培养组培苗30 d时,随机选取不同处理的马铃薯幼苗,剪取叶片之前将剪刀浸入液氮处理,剪取的叶片放入事先做好标记的塑料袋中并放入液氮中保存。将取好的叶片放入研钵中进行充分研磨,使叶片磨成粉末,整个研磨过程中要及时加入液氮,防止叶片融化。采用柱式植物总RNA抽提纯化试剂盒提取马铃薯叶片总RNA。用超微量紫外可见分光光度计Q500对RNA进行浓度测定,琼脂糖凝胶电泳检测RNA 质量。选用TaKaRa公司生产的反转录试剂盒合成cDNA的第一链。
使用SYBR Green I 荧光染料法,在LightCycler480( Roche Diagnostics) 实时荧光定量PCR仪上对马铃薯幼苗转录表达水平进行分析。根据 SYBR Premix Ex TaqTM试剂盒说明书配制反应体系,每个反应3次重复。反应体系中含有 10 μL SYBR Premix Ex TaqTM,引物各1 μL(5 μmol/L),稀释的 cDNA 模板5 μL,灭菌水3 μL,总体系 20 μL。反应程序为 95 ℃ 预变性30 s;95 ℃ 变性 5 s,60 ℃ 退火 15 s,72 ℃ 延伸 30 s,40 个循环。反应结束后做溶解曲线分析,用2-ΔΔCt法分析数据。
分别在马铃薯幼苗种植后的10,20,30 d进行取样,选取具有代表性的3株,运用钼锑抗比色法[12]测定马铃薯幼苗根、茎、叶中钾的含量。
采用SPSS软件进行相关统计分析。
用试剂盒成功提取RNA后,由于实时荧光定量PCR需要高品质的RNA,所以需要对提取物先进行分析。由图1可知,较亮的带为28S RNA,下面较暗的带是18S RNA,28S带的亮度大概是18S带的2倍,而5S RNA带则不明显。所以,RNA未降解,可以用作后续试验。
图1 马铃薯RNA 电泳结果
Fig.1 The result of agar gel electrophoresis of potato
首先查询拟南芥中KUP6和KUP7基因表达的蛋白的一级结构,再从马铃薯中查找到与其一级结构最相似的蛋白,然后查看其基因序列,最后利用Premier 5.0 软件设计最适引物。荧光定量 PCR 所用引物见表2。
表2 引物序列
Tab.2 Primer sequence
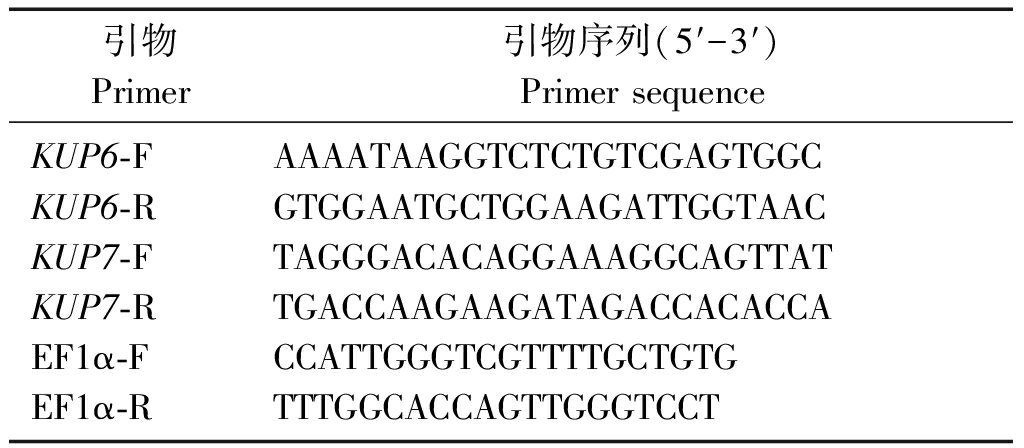
引物Primer引物序列(5′-3′)PrimersequenceKUP6⁃FKUP6⁃RKUP7⁃FKUP7⁃REF1α⁃FEF1α⁃RAAAATAAGGTCTCTGTCGAGTGGCGTGGAATGCTGGAAGATTGGTAACTAGGGACACAGGAAAGGCAGTTATTGACCAAGAAGATAGACCACACCACCATTGGGTCGTTTTGCTGTGTTTGGCACCAGTTGGGTCCT
通过实时荧光定量PCR检测了KUP6和KUP7基因表达水平,结果见图2,与钾离子浓度0.01 mmol/L相比,当钾离子浓度为0.10 mmol/L其基因表达量增加不明显;当钾离子浓度为1.00 mmol/L时,KUP6和KUP7基因表达量最高,且与其他处理之间都具有显著差异,分别为LA处理的2.82,2.28倍;而钾离子浓度为10.00 mmol/L时,与处理LA 和L 具有显著差异,KUP6和KUP7基因表达量分别为LA的1.68,1.86倍,说明过高或较低的钾离子浓度都不利于KUP6和KUP7基因的表达。
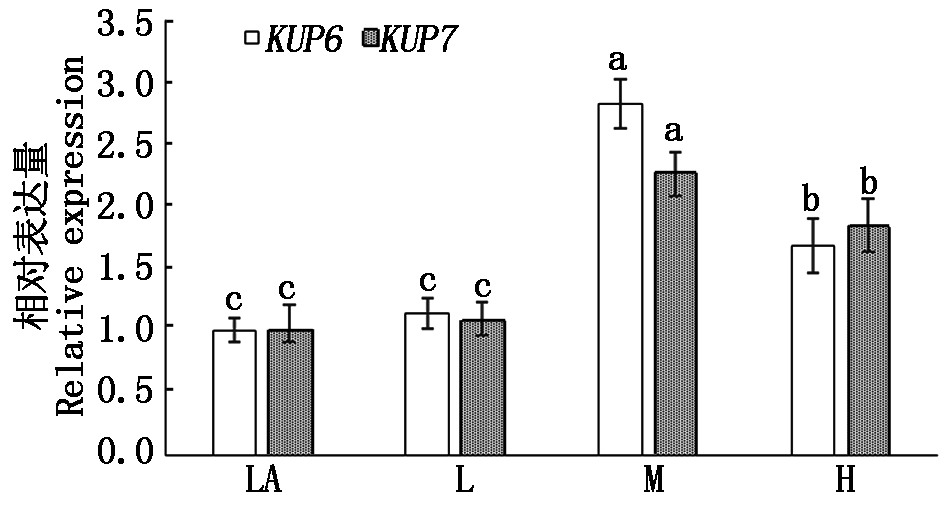
a、b、c.表示在0.05水平上显著。图3-5同。a,b,c.Correlation is significant at the 0.05 level.The same as Fig.3-5.
图2 实时荧光定量PCR基因表达量
Fig.2 The expression of KUP6 and KUP7 detected by qRT-PCR
从图3可以看出,在各个阶段H和M处理之间根系的钾素含量变化为30.2~32.5 g/kg,且在不同阶段两处理之间均无显著差异,说明M处理根系中钾素已经达到了饱和。在水培后20 d内,培养液钾素含量在0.01~1.00 mmol/L时,随着培养液钾素浓度的增加,根系钾素含量增加。在水培第10天,LA、L和M处理根系钾素浓度分别为1.5,24.9,32.5 g/kg;在水培第20天,LA、L和M处理根系钾素浓度分别为2.0,9.6,31.0 g/kg,且处理LA、L和M之间均具有显著差异。在水培30 d时,M处理和H处理与LA和L处理有显著差异,但L和LA处理之间没有显著变化。L处理钾素含量随着培养天数的增加呈下降的趋势。
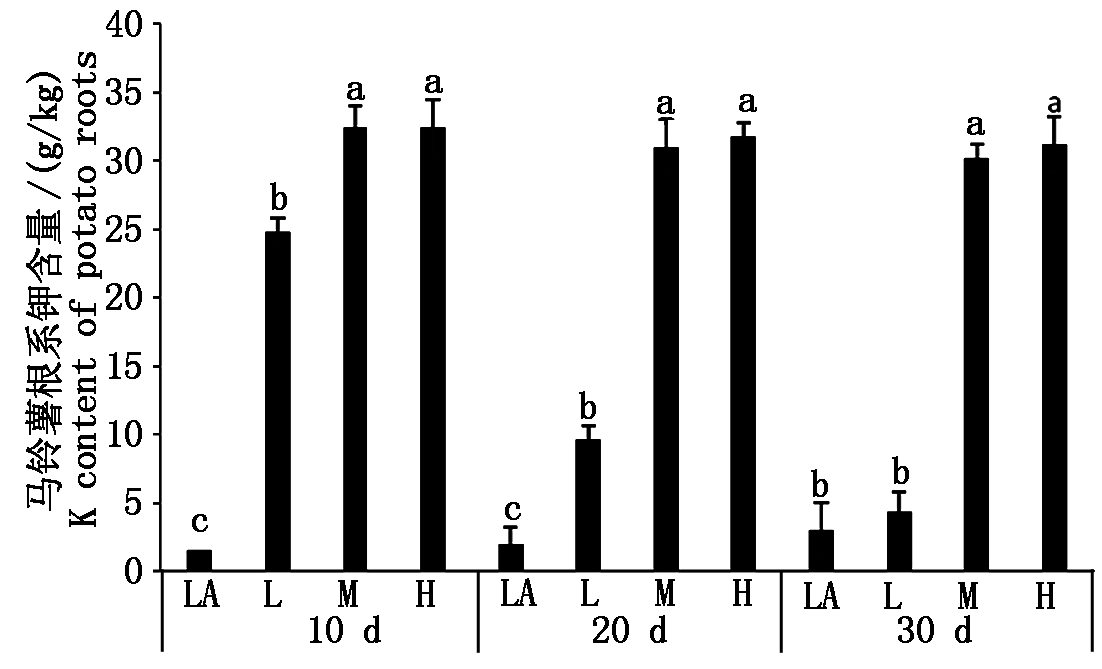
图3 不同处理下根系钾素的含量
Fig.3 The potassium content in potato roots
马铃薯茎中钾素含量随着培养液钾素浓度的增加而增加(图4),在水培后第20天内,处理H和M之间没有差异,但其与LA和L之间有显著差异,且L与LA之间也有显著差异。在水培第10天,LA、L和M处理中茎钾素浓度分别为2.0 ,26.3,37.1 g/kg;在水培第20天,LA、L和M处理中茎钾素浓度分别为13.2 ,24.0,58.3 g/kg;在水培第30天时,处理LA和L与M和H之间有显著差异,但在数值上差距倍数缩小,说明处理LA和L 在生长过程中累积了钾素,并维持了一定的钾素浓度;H处理的钾素含量达65.1 g/kg,与其他处理之间均具有显著差异,且随着培养天数的增加LA和H处理钾素茎内含量呈上升趋势。
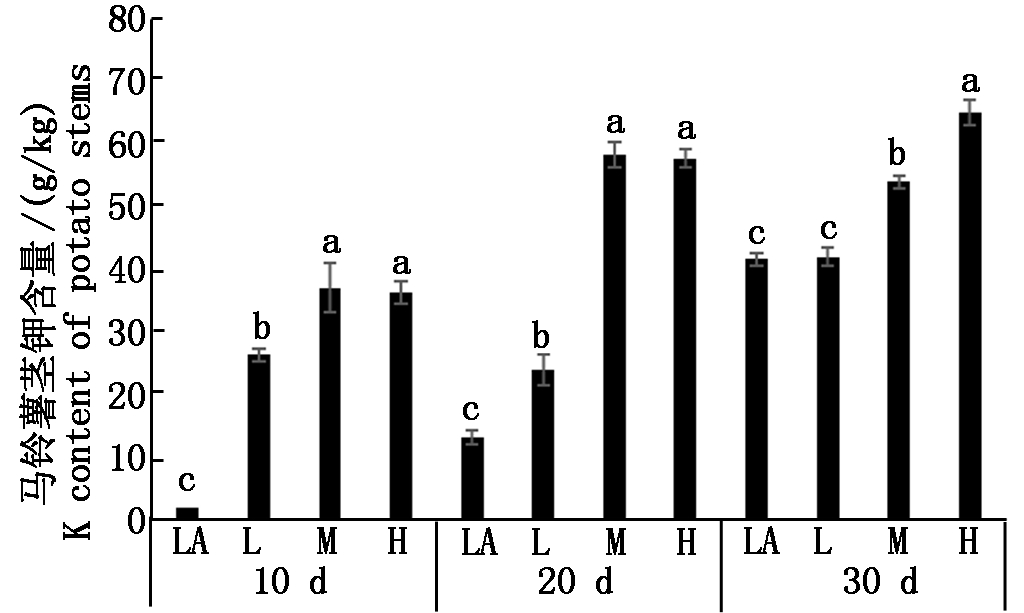
图4 不同浓度处理下茎中钾素的含量
Fig.4 The potassium content in potato stems
马铃薯叶中钾素含量也随着培养液钾素浓度的增加而增加(图5),在试验第10天,4个处理之间均具有显著差异,LA、L、M和H处理的钾素浓度分别为4.2,18.6,26.2,32.4 g/kg,说明水培10 d所测试的叶片钾素浓度与水培的钾素浓度呈一定的正相关性。在水培试验20 d时,L处理与LA处理之间无显著差异,H处理与M处理也没有显著差异,但M和H处理与LA和L之间具有显著差异。水培试验第30天,H处理钾素浓度达到46.0 g/kg,与其他处理之间有显著差异;M处理钾素浓度为32.9 g/kg,与LA和L均具有显著差异,LA和L之间无显著差异。
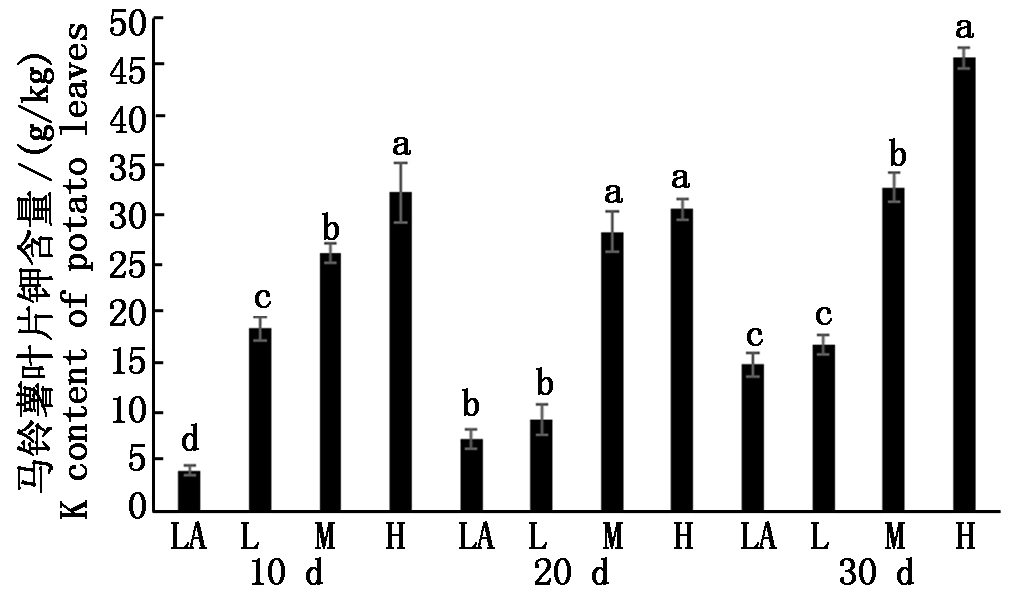
图5 不同浓度处理下叶中钾素的含量
Fig.5 The potassium content in potato leaves
植物细胞有2种机制来介导钾离子的跨膜吸收,它们分别是钾离子通道蛋白介导的低亲和性钾吸收系统和钾转运体介导的高亲和性钾吸收系统。当细胞外钾离子浓度高时,低亲和性钾转运系统发挥作用,这种吸收主要是由离子通道蛋白调节的被动运输的过程;当细胞外的钾离子浓度低时,高亲和性钾转运系统起主要作用。虽然对于多数植物来说,它们吸收钾离子主要依赖于低亲和性的钾转运系统,但是高亲和性钾转运系统也在植物生长发育中发挥了不可替代的作用,尤其是在外界存在低钾胁迫时,它能够让植物更好地生存。而且钾离子通道蛋白和钾转运体并不是只能在一种机制中起作用,钾离子通道蛋白可以在高亲和性钾吸收系统中起作用,钾转运体也可以在低亲和性钾吸收系统中起作用[13-15]。
已有的研究结果表明,KUP/HAK/KT家族是植物中一类非常重要的钾离子转运体蛋白,它们在钾离子高亲和性吸收系统中起作用,也就是在外界钾离子浓度过低时介导植物钾离子的吸收。而植物中的钾离子通道蛋白和钾转运体往往是通过转录水平的变化或翻译后蛋白的修饰来参与植物对低钾胁迫的响应[16-18]。
本试验利用实时荧光定量PCR法检测了不同钾素浓度下KUP6和KUP7转录水平基因表达量的变化,结果显示,低钾处理后KUP6和KUP7的表达水平都没有发生很显著的变化;在钾素浓度为1.00 mmol/L时,KUP6和KUP7的表达水平都上升明显;高钾处理后KUP6和KUP7的表达水平都上升但其上升的幅度减小了。而叶片中的钾素含量随着培养液钾素浓度的增大呈递增的趋势。以上试验结果说明,钾转运体KUP6和KUP7不仅是通过转录水平的调控来参与马铃薯对钾素的响应,很可能是由翻译后蛋白的修饰来响应钾素胁迫的,由于目前人们对于此类钾转运体蛋白生理功能的研究还非常有限[19-20],所以,还有很大的研究空间,希望本研究对马铃薯生长发育中合理分配钾素资源以及对钾转运体KUP6和KUP7的分子机制的后续研究有所帮助。
参考文献:
[1] 张 鑫,陈 杨,秦永林,等. 马铃薯钾素营养研究进展及营养诊断[J]. 北方农业学报,2016,44(1):109-112.
[2] 高 媛,韦艳萍,樊明寿. 马铃薯的养分需求[J]. 中国马铃薯,2011,25(3):182-187.
[3] Ngomat M S, Mworia M. Evaluation of the effects of potassium fertilizer on potato growth and yield in Saboti Sub County, Trans Nzoia County, Kenya[J]. International Journal of Academic Research in Environment & Geography, 2017, 4 (1): 33-40.
[4] Ma T L,Wu W H,Wang Y. Transcriptome analysis of rice root responses to potassium deficiency[J]. BMC Plant Biology,2012,12(1):161.
[5] Ahn S J,Shin R,Schachtman D P. Expression of Kt/KUP genes inArabidopsis and the role of root hairs in K+ uptake[J]. Plant Physiology,2004,134(3):1135-1145.
[6] 晁毛妮, 温青玉, 张晋玉, 等. 大豆KUP/HAK/KT钾转运体基因家族的鉴定与表达分析[J].西北植物学报, 2017, 37(2): 239-249.
[7] Anne-Aliénor V, Manuel N C, Meriem D, et al. Molecular biology of K+ transport across the plant cell membrane: what do we learn from comparison between plant species? [J]. Journal of Plant Physiology, 2014, 171(9): 748-769.
[8] 韩 敏. 钾转运体KUP7参与拟南芥响应低钾胁迫的功能研究[D]. 北京:中国农业大学,2015.
[9] Song Z Z, Ma R J, Yu M L. Genome-wide analysis and identification of KT/HAK/KUP potassium transporter gene family in peach (Prunus persica)[J]. Genetics and Molecular Research , 2015, 14(1): 774-787.
[10] Wang Y, Wu W H. Potassium transport and signaling in higher plants[J]. Annual Review of Plant Biology, 2013, 64(1):451-476.
[11] Song Z Z,Yang Y,Ma R J,et al. Transcription of potassium transporter genes of Kt/HAK/KUP family in peach seedlings and responses to abiotic stresses[J]. Biologia Plantarum,2015,59(1):65-73.
[12] 张永成,田 丰. 马铃薯试验研究方法[M]. 北京:中国农业科学技术出版社,2007:187.
[13] Mäser P,Thomine S,Schroeder J I,et al. Phylogenetic relationships within cation transporter families ofArabidopsis[J]. Plant Physiology,2001,126(4):1646-1667.
[14] Dennison K L,Robertson W R,Lewis B D,et al. Functions of AKT1 and AKT2 potassium channels determined by studies of single and double mutants ofArabidopsis[J]. Plant Physiology,2001,127(3):1012-1019.
[15] Hirsch R E,Lewis B D,Spalding E P,et al. A role for the AKT1 potassium channel in plant nutrition[J]. Science,1998,280(5365):918-921.
[16] Han M, Wu W, Wu W H, et al. Potassium transporter KUP7 is involved in K+ acquisition and translocation inArabidopsis root under K+-limited conditions[J]. Molecular Plant, 2016, 9(3):437-446.
[17] 宋毓峰,张 良,董连红,等. 植物KUP/HAK/KT家族钾转运体研究进展[J]. 中国农业科技导报,2013(6):92-98.
[18] Zhang Z,Zhang J,Chen Y,et al. Genome-wide analysis and identification of HAK potassium transporter gene family in maize (Zea mays L.)[J]. Molecular Biology Reports,2012,39(8):8465-8473.
[19] He C,Cui K,Duan A,et al. Genome-wide and molecular evolution analysis of the poplar Kt/HAK/KUP potassium transporter gene family[J]. Ecology and Evolution,2012,2(8):1996-2004.
[20] 杨中敏,王 艳. 钾离子转运载体KUP/HAK/KT家族功能的研究进展[J]. 生物技术,2014(3):100-103.
Abstract:In order to study response of the potassium concentration on the expression ofKUP6 andKUP7 potassium transporter gene,hydroponic potato seedlings was conducted.The RNA of potato was isolated and checked, the first chain of the cDNA was synthesized by the Reverse Transcriptional Kit, and gene transcription on seedlings was detected by Real-time fluorescence quantitative PCR technique and the content of potassium in potato seedlings was detected.The content of potassium in potato seedlings was detected at 10, 20 and 30 days after potato seedling planting. The results showed that when potassium concentration was 1.00 mmol/L,the expression level ofKUP6 andKUP7 was the highest. When potassium concentration was lower than 0.10 mmol/L,the expression was low,and the expression level of potassium decreased when potassium concentration was 10 mmol/L. It indicates that higher and lower potassium concentration is not conducive to the expression ofKUP6 andKUP7 genes. Potassium content in roots, stems and leaves showed that potassium concentration reached its absorption saturation at 1.00 mmol/L for root. The higher potassium concentration in hydroponics, the higher potassium content in root, stem and leaf. The difference of potassium content in stem and leaf was decreased when lower potassium concentration in hydroponics and increased when higher concentration.
Key words:Potato;Potassium transporter;qPCR;KUP6;KUP7
收稿日期:2017-12-26
基金项目:内蒙古自然科学基金项目(2017MS0351);内蒙古硕士研究生科研创新资助项目(S20171012912);国家自然科学基金项目(31760356)
中图分类号:S141.3;Q946
文献标识码:A
文章编号:1000-7091(2018)02-0095-05
doi:10.7668/hbnxb.2018.02.014