
A.重瓣花;B.1~7轮花瓣。A.The double flower;B.1-7 wheel petals.
图1 百合比罗尼卡的重瓣花及花瓣
Fig.1 The double flower pattern and the petals of lily Belonica
摘要:为了深入研究重瓣百合花形成的分子机制,以重瓣百合比罗尼卡为试验材料,从中分离得到1个AGL6基因,其开放阅读框为744 bp,共编码247个氨基酸,蛋白质分子量为28.3 ku。亲水性平均系数为-0.748,等电点为8.23。蛋白结构分析显示,百合AGL6蛋白具有典型的MADS-box结构域、K-box区及2个AGL6基序。系统进化树分析结果显示,百合AGL6编码的蛋白属于AP1/AGL9亚家族AGL6分枝的单子叶植物类群,与同为单子叶植物的风信子亲缘关系最近,相似度达到78%,说明克隆得到的基因即为AGL6的同源基因,将其命名为LiAGL6。亚细胞定位表明,LiAGL6在洋葱表皮细胞的细胞核中表达,具备转录因子的基本特征。实时荧光定量PCR结果分析表明,LiAGL6基因在花中表达量最高,在茎、叶中几乎不表达;在整朵花中,LiAGL6在第7轮花瓣中的相对表达量最高,其次依次是第6轮和第3轮,第2轮花瓣中几乎检测不到表达。研究表明,LiAGL6基因可能在百合重瓣花形成方面发挥了调控作用。
关键词:重瓣百合;MADS-box;基因克隆;LiAGL6基因;表达分析
显花植物从营养生长转变为生殖生长是生活史中的一个重要历程,花是显花植物重要的繁殖器官,花的形成和发育受到多个基因的调控。Coen等[1]研究提出了花器官发育的ABC模型,将调控花发育的基因分为A、B、C这3类,在花萼、花瓣、雄蕊及雌蕊的发育过程中发挥着不同的作用。随着研究的进一步深入,人们又发现了调控胚珠发育的D类基因以及对各轮花器官发育均有调控作用的E类基因,因此,ABC模型进一步扩展为ABCDE模型[2]。
MADS-box家族基因广泛分布于动物、植物及真菌中,其编码的蛋白是一类重要的转录调控因子,能调节其他基因的表达,对植物的生长发育具有重要的调控作用[3]。植物的开花过程精密而复杂,受到很多基因的调控,其中,MADS-box基因在植物的花形态建成方面发挥了重要作用。MADS-box基因是一个庞大的基因家族,在长期进化过程中分化为TypeⅠ和TypeⅡ两大类,其中,TypeⅡ基因含有4个不同的结构域,分别为MADS(M)、Intervening(I)、Keratin-like(K)和Carboxyl-terminal(C),因此被称为MIKC基因;而TypeⅠ基因缺少Keratin-like(K)结构域,目前发现的调控植物花发育的相关基因大部分属于MIKC亚家族基因[4-6]。
AGL6(AGAMOUS like 6)亚家族基因是一个古老的遗传冗余基因,属于MIKC家族的AP1/AGL9组,该组由AP1、AGL6/AGL13以及SEP这3个分枝组成,AGL6与SEP互为姊妹系,在300万年以前就已经出现在被子植物与裸子植物的共同祖先中[3,5,7-8]。目前,已经从多种植物中克隆得到AGL6的同源基因,如裸子植物辐射松(Pinus radiata)[9]、挪威云杉(Picea abies)[10]、柳杉(Cryptomeria japonica)[11],被子植物玉米(Zea mays)[12]、水稻(Oryza sativa)[13-14]、拟南芥(Arabidopsis thaliana)[15]、矮牵牛(Petunia hybrida)[16]等。前人研究表明,AGL6基因与花器官发育密切相关,主要表现在调节开花时间、生殖分生组织及花器官的决定性方面[17]。在拟南芥中将AGL6基因过表达或由T-DNA插入使其表达增强后,会导致拟南芥早花现象[18-19];水稻中的AGL6-like基因OsMADS6突变后,水稻会丧失花分生组织属性的决定性,导致小穗的分生组织形成额外的小穗[14,20];玉米中的AGL6-like基因ZAG3突变后,雌花和雄花的表型会发生多样化[21];樊金会等[22]研究表明,风信子中的HoAGL6能够通过促进SOC1、LFY基因的表达调节开花时间,通过激活AG、SEP1基因参与花器官发育,在拟南芥中异位过表达后引起开花提前、植株矮小及器官之间发生同源转化的现象;Melzer等[23-24]研究认为,AGL6/SEP1/SQUA-like转录因子家族是花发育调控网络的中心,其通过相互作用将分生组织和花器官的决定性联合起来,最终发育形成有正常功能的花器官。
百合(Lilium spp.)属于单子叶植物,是百合科百合属观赏花卉,单瓣百合花器官主要由3枚瓣化的萼片、3枚花瓣、6枚雄蕊及1枚雌蕊组成。花的发育是影响百合花品质的生物学基础,目前,市场上百合多以单瓣品种为主,复瓣和重瓣百合品种繁育技术尚不成熟,品种较少,市场认知度不高,因此,开展百合花瓣发育相关基因的研究,对通过生物技术改善百合观赏瓣性,提高百合品种多样性与稳定性,具有重要的意义。本研究以雌雄蕊瓣化的重瓣百合比罗尼卡为试验材料,从中克隆了AGL6基因,并对其蛋白特性和表达特性进行了分析,以期探讨出AGL6基因在百合重瓣花中的表达模式,为进一步揭示E类基因AGL6在花发育方面的作用机制以及通过基因工程改善百合的观赏瓣性提供理论参考。
以重瓣百合比罗尼卡(Belonica)为试验材料,种球购自荷兰,规格为18~20 cm,种植于北京市盛斯通生态科技有限公司南口试验基地,常规栽培管理。比罗尼卡的花器官由外至内共由7轮花瓣组成,雌雄蕊全部瓣化,其中最内侧的第7轮花瓣上偶见残存的花药(图1)。

A.重瓣花;B.1~7轮花瓣。A.The double flower;B.1-7 wheel petals.
图1 百合比罗尼卡的重瓣花及花瓣
Fig.1 The double flower pattern and the petals of lily Belonica
试验所用的RNA提取试剂盒购自天根生化科技(北京)有限公司;DNA片段回收试剂盒、质粒提取试剂盒购自北京百泰克生物技术有限公司;pMD18-T载体、SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)荧光定量试剂盒以及试验中所用的各种常规酶类均购自TaKaRa公司;卡那霉素(Kan)、氨苄青霉素(Amp)购自Sigma公司;大肠杆菌感受态DH5α购自北京全式金生物技术有限公司;扩增引物由上海生工生物技术有限公司合成;DNA测序由北京华大科技有限公司完成。
1.2.1 总RNA提取及AGL6基因的克隆 取比罗尼卡盛花期的花瓣,用液氮速冻并保存于-80 ℃的超低温冰箱中备用,按照RNA提取试剂盒中的说明书提取RNA,并用1%的琼脂糖凝胶电泳检测完整性。利用Reverse Transcriptase M-MLV 进行cDNA第1链的合成,并以其为模板进行PCR扩增。
根据中国农业大学观赏植物栽培生理与生物技术实验室前期从百合中克隆得到的AGL6基因ORF(开放阅读框)序列(未发表)设计1对引物(F1:5′-ATGGGTAGAGGAAGAGTTGAGTTGAAGAG-3′;R1:5′-CTACCATCCCATACTCAAAGAACCCAAACC-3′),以重瓣百合比罗尼卡花瓣的 cDNA为模板,使用高保真PrimeSTAR HS DNA聚合酶进行反应,PCR反应条件:98 ℃ 5 min;98 ℃ 10 s,63 ℃ 15 s,72 ℃ 1 min,35个循环;72 ℃ 延伸10 min。PCR产物用1%的琼脂糖凝胶电泳检测后切胶回收,连接到pMD18-T载体并转化至大肠杆菌DH5α感受态中,Amp抗性培养基过夜培养后,挑取单克隆进行菌落PCR检测,将含有目的基因片段的阳性克隆送北京华大科技有限公司测序,获得比罗尼卡AGL6基因的ORF全长序列。
1.2.2 基因序列分析 将获得的基因ORF序列使用NCBI(http://www.ncbi.nlm.nih.gov/)在线工具进行序列分析;使用ProtParam(http://www.web.expasy.org/protparam)在线工具预测分析百合AGL6蛋白的基本性质;使用NCBI(http://www.ncbi.nlm.nih.gov/)的Blast功能搜索同源基因并进行蛋白的相似性分析;使用DNAMAN 5.0软件对AGL6蛋白进行多重比对分析;使用MEGA 5.0软件进行系统进化树的构建。
1.2.3 亚细胞定位分析 结合pCAMBIA1300载体特点,使用DNAMAN 5.0软件对百合AGL6基因的ORF序列进行酶切位点分析,选用Sal Ⅰ和Spe Ⅰ作为构建融合表达载体的酶切位点,设计特异引物(F2:5′-GTCGACATGGGTAGAGGAAGAGTTG
AG-3′,R2:5′-ACTAGTCTACCATCCCATACTCAAAG-3′)进行PCR扩增。将pCAMBIA1300空载质粒和PCR扩增产物分别进行双酶切,之后将酶切产物纯化并用T4连接酶16 ℃连接过夜,获得重组表达载体。通过基因枪轰击法将构建好的重组表达载体轰击到经过MS培养基预培养24 h的洋葱(Allium cepa)表皮细胞中,24 h后在激光共聚焦显微镜(Nikon Eclipse TE2000-E)下进行观察及拍照,以空载pCAMBIA1300-GFP为对照。
1.2.4 基因表达分析 分别取比罗尼卡盛花期的茎、叶、整朵花瓣及1~7轮不同花瓣用液氮速冻并保存于-80 ℃的超低温冰箱中备用,按照说明书提取RNA,电泳检测完整性,并进行cDNA第1链的合成(方法同1.2.1)。用ABI Step One Plus System PCR仪,以上述材料反转录的cDNA为模板,将百合AGL6基因ORF序列结合3′端UTR序列设计定量特异引物(F3:5′-GGTTCTACTGAAGAAGCTATGCCA
T-3′;R3:5′-CGATCCAATCCGAAATAAAGTTCG-3′),进行重瓣百合AGL6基因的实时荧光定量PCR分析。以18S rRNA为内参(18SF:5′-AGTTGGTGGAGCGA
TTTGTCT-3′,18SR:5′-CCTGTTATTGCCTCAAACTTC
C-3′)进行百合AGL6基因的相对表达水平检测。PCR反应体系为:95 ℃ 3 min;95 ℃ 3 s,58 ℃ 30 s,72 ℃ 20 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,1个循环。每个样品设3个生物学重复,采用2-ΔΔCT法对基因相对表达量进行分析。
将重瓣百合花瓣提取的RNA进行反转录,并以其为模板进行PCR扩增,获得比罗尼卡重瓣百合基因ORF序列744 bp,共编码247个氨基酸(图2)。Blast的结果显示,百合AGL6基因与其他物种的AGL6基因有较高的同源性,因此,将其命名为LiAGL6基因。
ProtParam在线工具预测百合LiAGL6蛋白的分子式为C1216H1956N364O384S15,分子量为28.3 ku,半衰期在大肠杆菌(Escherichia coli)中大于10 h,在酵母菌(Saccharomyces cerevisiae)中大于20 h,亲水性平均系数(GRAVY)为-0.748。对氨基酸组成成分进行分析,结果表明,LiAGL6蛋白肽链负电荷残基(天冬氨酸Asp + 谷氨酸Glu)为30,正电荷残基(精氨酸Arg + 赖氨酸Lys)为32,预测等电点(PI)为8.23(>7),推测LiAGL6蛋白为碱性蛋白。将LiAGL6与拟南芥、番红花(Crocus sativus)、春兰(Cymbidium goeringii)、油棕(Elaeis guineensis)、风信子(Hyacinthus orientalis)及海枣(Phoenix dactylifera)的AGL6氨基酸序列进行同源比对,结果表明,百合LiAGL6蛋白与其他物种的AGL6蛋白一样,在N端1-60个氨基酸残基内含有一个典型的MADS-box结构域,在中间90-155氨基酸残基内含有一个K-domain区,在靠近C端部分含有2个特有的AGL6-Ⅰmotif和AGL6-Ⅱmotif基序(图3)。

图2 百合LiAGL6基因开放阅读框及编码的氨基酸序列
Fig.2 The open reading frame of LiAGL6 and the amino acid sequences encoded by LiAGL6
为确定百合LiAGL6基因的系统发育位置,对其进行了系统进化树分析,结果显示,AP1/AGL9亚家族有3个分枝,分别为SEP分枝、AP1分枝及AGL6分枝,其中AGL6分枝与SEP分枝互为姊妹分枝。AGL6分枝可分为3个类群,分别为裸子植物类群、单子叶植物类群及双子叶植物类群,百合LiAGL6归属于AP1/AGL9亚家族AGL6分枝的单子叶植物类群,与风信子的亲缘关系最近(图4),Blast的结果显示,其相似度达78%,进一步说明百合LiAGL6基因为AGL6的同源基因。

LiAGL6. 百合AGL6;AtAGL6. 拟南芥AGL6(NP_182089.1);CsAGL6. 番红花AGL6(ABK35281.1);CgAGL6. 春兰AGL6(ADI58464.1);EgAGL6. 油棕AGL6(XP_010934013.1);HoAGL6. 风信子AGL6(AAT88088.1);PdAGL6. 海枣AGL6(XP_008797646.1)。
LiAGL6. Peptide sequences of AGL6s from Lily;AtAGL6. Peptide sequences of AGL6s fromArabidopsis thaliana (NP_182089. 1);CsAGL6. Peptide sequences of AGL6s fromCrocus sativus (ABK35281.1);CgAGL6. Peptide sequences of AGL6s fromCymbidium goeringii (ADI58464.1);EgAGL6. Peptide sequences of AGL6s fromElaeis guineensis (XP_010934013.1);HoAGL6. Peptide sequences of AGL6s fromHyacinthus orientalis (AAT88088.1);PdAGL6. Peptide sequences of AGL6s fromPhoenix dactylifera (XP_008797646.1).
图3 百合LiAGL6与其他植物AGL6氨基酸序列同源比对
Fig.3 Homology alignment of the amino acid sequences of LiAGL6 and AGL6 from other plants

▲. 百合LiAGL6。▲. Lily LiAGL6.
图4 LiAGL6蛋白与其他物种AP1/AGL6亚家族蛋白系统进化树分析
Fig.4 Analysis of phylogenetic relationship between LiAGL6 protein and subfamily protein of AP1/AGL6 in other species
利用基因枪将构建好的重组表达载体pCAMBIA1300-GFP-LiAGL6轰击到经过24 h预培养的洋葱表皮细胞中,24 h暗培养后放置于激光共聚焦显微镜下观察,结果表明,空载对照pCAMBIA1300-GFP的绿色荧光分布在整个洋葱表皮细胞中,包括细胞膜、细胞质、细胞核及质体中,而重组表达载体pCAMBIA1300-GFP-LiAGL6的绿色荧光则主要分布在细胞核中(图5),说明百合LiAGL6主要在核内发挥作用,具备转录因子的基本特征。
为了确定LiAGL6基因在百合地上部位不同组织及不同轮数花瓣中的表达差异,分别对重瓣百合的花、茎、叶及1~7轮花瓣中的LiAGL6基因进行了实时荧光定量表达分析,结果表明,在不同的地上组织部位中,LiAGL6基因主要在花中表达,在茎和叶中几乎检测不到表达,差异达显著水平(P<0.05)(图6-A);在第1轮及3~7轮花瓣中能检测到LiAGL6基因的表达,第2轮花瓣中几乎检测不到表达,其中,在第7轮花瓣中的表达量显著高于1~6轮花瓣中的表达量(P<0.05),其次依次为第6轮和第3轮花瓣,第1,4,5三轮花瓣中的表达量基本一致,差异不显著(图6-B)。
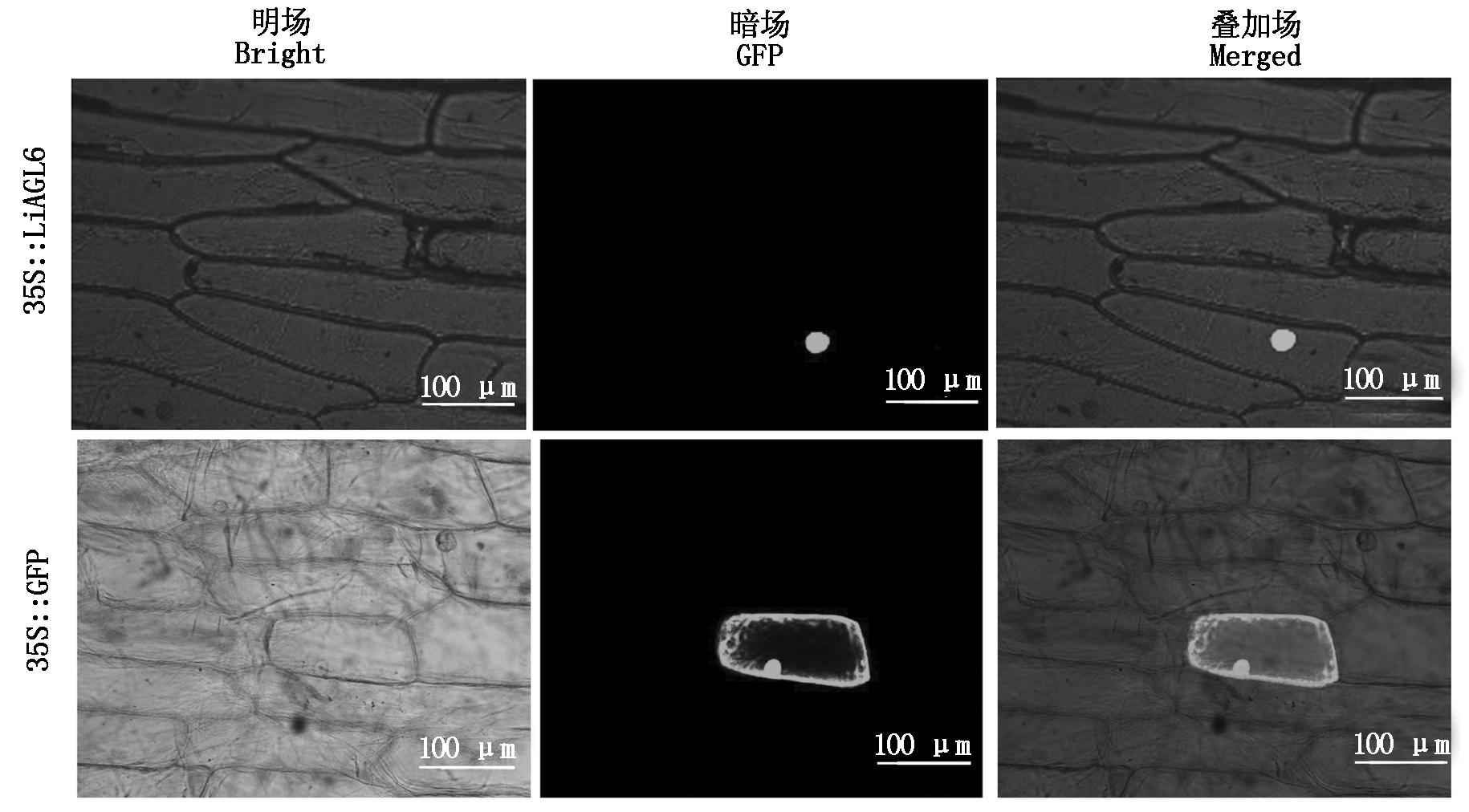
图5 LiAGL6在洋葱表皮中的亚细胞定位
Fig.5 Subcellular localization of LiAGL6 in onion epidermal cells
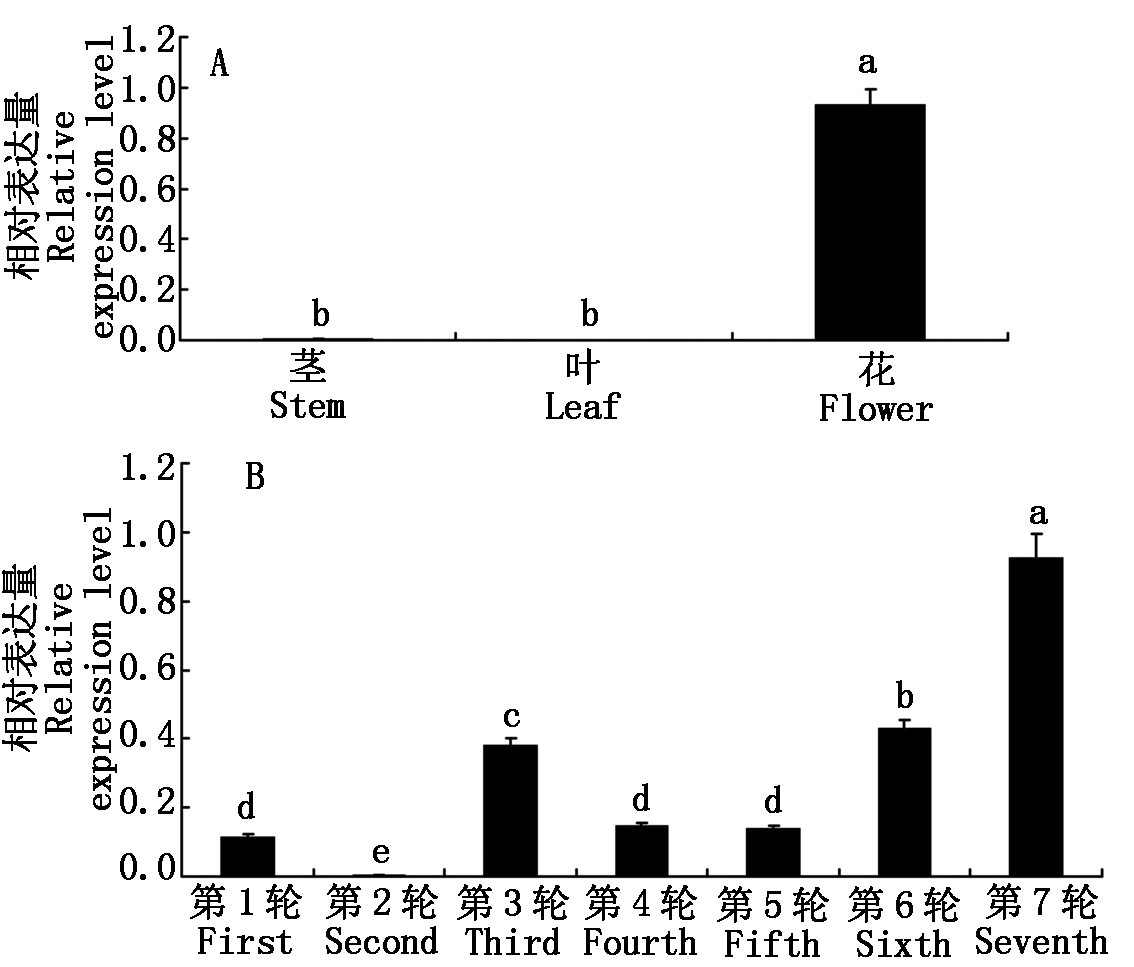
A.LiAGL6在花、茎、叶的表达;B.LiAGL6在不同花瓣中的表达;不同小写字母表示差异显著(P<0.05);相同小写字母表示差异不显著。
A.The expression ofLiAGL6 in flower,stem and leaf;B.The expression ofLiAGL6 in different petals;The different small-letter means significant difference (P<0.05); The same small-letter means no significant difference.
图6 重瓣百合不同组织及不同花瓣中LiAGL6基因的表达分析
Fig.6 LiAGL6 expression in different plant organs and different petals in double lily
MADS-box基因家族成员众多,在拟南芥基因组中,即有107个成员,该家族基因参与了植物多方面的生长发育过程,特别是在生殖生长阶段发挥了重要的调控作用[25-26]。早在20世纪90年代,Coen等[1]即提出了调控花发育的ABC模型来解释植物花发育的分子机理,之后随着拟南芥中D类和E类基因的发现,ABC模型逐渐完善为ABCDE模型[2]。本研究以雌雄蕊均发生瓣化的重瓣百合比罗尼卡为试验材料,从中克隆了1个E类基因AGL6,将其命名为LiAGL6。同源比对结果显示,LiAGL6与其他物种的AGL6具有很高的同源性,除了具有典型的MADS-box结构域、K-domain区外,在靠近C端部分还具有2个特有的AGL6-Ⅰmotif和AGL6-Ⅱ motif的结构特征。系统进化树分析的结果表明,LiAGL6归属于AP1/AGL9亚家族AGL6分枝的单子叶植物群,亚细胞定位的结果也显示该基因编码的蛋白主要在核内发挥作用,符合转录因子的基本特征,这说明本试验克隆得到的LiAGL6基因应该为AGL6的同源基因。
常规单瓣百合的花器官具有6枚花被片、6枚雄蕊和1枚雌蕊,而重瓣百合比罗尼卡缺乏正常的雌雄蕊,仅在第7轮花瓣上偶见残存的花药。对重瓣百合地上组织部位进行LiAGL6基因的表达检测,结果表明,LiAGL6基因在花中的表达量最高,在茎和叶中几乎检测不到表达,该结果与AGL6基因主要在单子叶植物花中表达的模式一致[27],LiAGL6基因可能与其他植物中的AGL6基因功能类似,在花器官的形成和发育过程中发挥了重要功能。但前人研究表明,在核心真双子叶植物中AGL6基因不仅在花器官中有表达,在营养器官中也有表达,如葡萄中的VvAGL6a基因主要在其卷须中表达,VvMADS3基因则在花和卷须中都有表达,说明AGL6基因在百合不同组织部位中的表达模式与核心真双子叶植物存在差异[27]。在重瓣百合1~7轮花瓣中LiAGL6基因在第7轮中的表达量最高,其次依次为第6轮和第3轮花瓣,但在第2轮花瓣中几乎检测不到表达。尽管在绝大多数植物中AGL6基因主要表达部位为花,但不同植物花器官中的表达模式仍存在某些不同,如在矮牵牛中AGL6基因在4轮花器官中均有表达[28],在单子叶植物水稻中AGL6类基因OsMADS6在雄蕊中不表达,但另一个AGL6类基因OsMADS17则在雄蕊中有表达[20]。在观赏植物春兰中也含有CgAGL6-1和CgAGL6-3 2个AGL6基因,其存在部分功能冗余,CgAGL6-1在正常花的萼片、侧瓣、唇瓣及蕊柱中有表达,但CgAGL6-3在侧瓣中几乎不表达[29]。由此推测,可能在比罗尼卡原种单瓣百合的雄蕊中LiAGL6基因也不表达或表达量极低,在百合雄蕊群发生瓣化形成3~6轮花瓣的过程中LiAGL6基因发挥了调控功能,而在第7轮花瓣中LiAGL6基因表达量突然增加,推测第7轮花瓣有可能是雌蕊发生瓣化而来,LiAGL6基因通过增加表达量发挥了调控功能。重瓣百合中的第2轮花瓣中几乎检测不到LiAGL6基因的表达,推测LiAGL6在百合中可能也属于一个功能冗余基因,极有可能存在另外的AGL6同源基因在第2轮花瓣的形成过程中发挥作用,需要进一步试验验证。
本研究以重瓣百合比罗尼卡为试验材料,从中分离得到1个E类花发育相关基因,命名为LiAGL6。 试验结果表明,该基因含有744 bp的核苷酸,编码247个氨基酸,具有典型的MADS-box结构域、K-box区及2个AGL6基序,属于AP1/AGL9亚家族AGL6分枝的单子叶植物类群;亚细胞定位结果显示,LiAGL6蛋白主要在核内发挥作用;荧光定量PCR技术分析表明,LiAGL6基因主要在花中表达,其中,在第7轮花瓣中的表达量最高,推测LiAGL6可能在重瓣百合雌雄蕊瓣化过程中发挥了一定的推动作用。
参考文献:
[1] Coen E S,Meyerowitz E M. The war of the whorls:genetic interactions controlling flower development[J]. Nature,1991,353(6339):31-37.
[2] Theissen G. Development of floral organ identity:stories from the MADS house[J]. Current Opinion in Plant Biology,2001,4(1):75-85.
[3] Dreni L,Zhang D.Flower development:the evolutionary history and functions of the AGL6 subfamily MADS-box genes[J]. Journal of Experimental Botany,2016,67(6):1625-1638.
[4] Jin Y,Wang Y,Zhang D,et al.Floral organ MADS-box genes in Cercidiphyllum japonicum(Cercidiphyllaceae):Implications for systematic evolution and bracts definition[J].PloS One,2017,12 (5):e0178382.
[5] 敬 帆, 罗登攀, 马 婧, 等. 蜡梅CpAGL6基因启动子的克隆及功能初步分析[J]. 园艺学报, 2015, 42(6): 1139-1149.
[6] Cheng Z, Ge W, Li L, et al. Analysis of MADS-Box gene family reveals conservation in floral organ ABCDE model of moso bamboo (Phyllostachys edulis)[J]. Frontiers in Plant Science, 2017, 8: 656.
[7] Yu X, Chen G, Guo X, et al. Silencing SlAGL6, a tomato AGAMOUS-LIKE6 lineage gene, generates fused sepal and green petal[J]. Plant Cell Reports, 2017, 36 (6):1-11.
[8] Shulga O A, Shchennikova A V, Beletsky A V, et al. Transcriptome-wide characterization of the MADS-Box family inPinesap Monotropa hypopitys reveals flowering conservation in Non-photosynthetic Myco-heterotrophs[J]. Journal of Plant Growth Regulation, 2017(11):1-16.
[9] Chen F, Zhang X , Liu X , et al. Evolutionary analysis of MIKCc-Type MADS-Box genes in gymnosperms and angiosperms[J]. Frontiers in Plant Science, 2017, 8: 895.
[10] Carlsbecker A, Sundström J F, Englund M, et al. Molecular control of normal and acrocona mutant seed cone development in norway spruce (Picea abies) and the evolution of conifer ovule-bearing organs[J]. The New Phytologist, 2013, 200(1): 261-275.
[11] Katahata S I, Futamura N, Igasaki T, et al. Functional analysis ofSOC1-like andAGL6-like MADS-box genes of the gymnospermCryptomeria japonica[J]. Tree Genetics & Genomes, 2014, 10 (2): 317-327.
[12] Alter P, Bircheneder S,Zhou L Z, et al. Flowering time-regulated genes in maize include the transcription factor ZmMADS1[J]. Plant physiology, 2016, 172 (1) :389-404.
[13] Duan Y,Xing Z,Diao Z,et al. Characterization of osmads6-5,a null allele,reveals thatOsMADS6 is a critical regulator for early flower development in rice (Oryza sativa L.) [J]. Plant Molecular Biology,2012,80(4/5):429-442.
[14] Li H,Liang W,Jia R,et al. The AGL6-like geneOsMADS6 regulates floral organ and meristem identities in rice[J]. Cell Research,2010,20(3):299-313.
[15] Zhao T, Holmer R, Bruijn S,et al. Phylogenomic synteny network analysis of MADS-Box transcription factor genes reveals Lineage-specific transpositions, ancient tandem duplications, and deep positional conservation[J]. The Plant cell, 2017 , 29 (6) :1278.
[16] Tsuchimoto S,Mayama T,Van Der Krol A,et al. The whorl-specific action of a petunia class B floral homeotic gene[J]. Genes to Cells,2000,5(2):89-99.
[17] 王珍华,胡立霞,钟 丹,等.AGAMOUS like 6亚家族基因研究进展[J]. 西北植物学报,2012,32(7):1480-1487.
[18] Koo S C,Bracko O,Park M S,et al. Control of lateral organ development and flowering time by theArabidopsis thaliana MADS-box GeneAGAMOUS-LIKE6[J]. The Plant Journal,2010,62(5):807-816.
[19] Yoo S K,Wu X,Lee J S,et al.AGAMOUS-LIKE 6 is a floral promoter that negatively regulates theFLC/MAF clade genes and positively regulates FT inArabidopsis[J]. The Plant Journal,2011,65(1):62-76.
[20] Ohmori S,Kimizu M,Sugita M,et al. MosaicFLORAL ORGANS1,anAGL6-like MADS box gene,regulates floral organ identity and meristem fate in rice[J]. The Plant Cell,2009,21(10):3008-3025.
[21] Thompson B E,Bartling L,Whipple C,et al.Bearded-ear encodes a MADS box transcription factor critical for maize floral development[J]. The Plant Cell,2009,21(9):2578-2590.
[22] 樊金会,李文卿,董秀春,等. 风信子AGL6同源基因在拟南芥中异位表达引起提早开花和器官同源转化[J]. 中国科学C辑,2007,37(4):466-478.
[23] Melzer R,Wang Y Q,Theissen G. The naked and the dead:the ABCs of gymnosperm reproduction and the origin of the angiosperm flower[J]. Seminars in Cell & Developmental Biology,2010,21(1):118-128.
[24] 窦艳华. 普通小麦AGL6(AGAMOUS LIKE6)基因功能的初步分析[D]. 杨凌:西北农林科技大学,2015.
[25] Ma J, Yang Y, Luo W, et al. Genome-wide identification and analysis of the MADS-box gene family in bread wheat (Triticum aestivum L.) [J]. PloS One, 2017, 12 (7): e0181443.
[26] Yu X, Duan X, Zhang R, et al. Prevalent exon-Intron structural changes in the APETALA1/FRUITFULL, SEPALLATA, AGAMOUS-LIKE6, and FLOWERING LOCUS CMADS-Box gene subfamilies provide new insights into their evolution[J]. Frontiers in Plant Science, 2016, 7: 598.
[27] 韩萌萌,盛安琪,李海峰. 植物AGAMOUS LIKE 6基因功能的研究进展[J]. 西北农林科技大学学报:自然科学版,2014,42(8):229-234.
[28] Rijpkema A S,Zethof J,Gerats T,et al. The petuniaAGL6 gene has aSEPALLATA-like function in floral patterning[J]. The Plant Journal,2009,60(1):1-9.
[29] 胡月苗,孙崇波,向 林,等. 春兰AGL6-3基因的克隆及实时定量表达分析[J]. 西北植物学报,2016,36(2):225-230.
Abstract:To explore flower development molecular mechanism of the Double lily,theAGL6 homologous gene was cloned from Double lily cv. Belonica. The open reading frame ofLiAGL6 gene was 744 bp,encoded a protein of 247 amino acids. The LiAGL6 protein molecular weight was 28.3 ku,the grand average of hydropathicity was -0.748 and the theoretical pI was 8.23. The protein structure analysis showed that LiAGL6 protein had a typical MADS-box domain,a K-box region and two AGL6 motifs. Phylogenetic tree analysis showed thatLiAGL6 belonged to monocotyledon group,AGL6 branch of the AP1/AGL9 subfamily,and had the highest similarity withHyacinthus orientalis which was also belonged to monocotyledons, the similarity reached 78%. All the results indicatedLiAGL6 was the homologous gene ofAGL6,so named itLiAGL6. Cellular localization assay revealedLiAGL6 expressed in the nucleus of onion epidemical cells, which was the basic characteristics of the transcription factors. The qRT-PCR result showed the highest expression ofLiAGL6 was in flowers while no expression occurred in leaves and stems.LiAGL6 was expressed most in the seventh whorl petals followed by the sixth and third whorl petals,however,there was almost no expression in the second whorl petals. The research showed theLiAGL6 gene might play a regulatory role on formation of Double lily flowers.
Key words:Double lily;MADS-box;Gene cloning;LiAGL6 gene;Expression analysis
收稿日期:2018-01-27
基金项目:国家自然科学基金项目(31471904);安徽省教育厅自然科学研究重点项目(KJ2016A871);安徽省高校质量工程项目(2015jyxm221)
中图分类号:Q78;S644.03
文献标识码:A
文章编号:1000-7091(2018)02-0087-08
doi:10.7668/hbnxb.2018.02.013