猪圆环病毒(Porcine circovirus,PCV)属于圆环病毒科圆环病毒属,为已知最小的动物病毒之一,圆环病毒分为感染鸟类和感染哺乳动物类2种,感染哺乳动物类的即为猪圆环病毒。猪圆环病毒的基因组为单股负链的闭合环状结构,大小为1.7~2.0 kb[1-2]。基因组为双义链,正义链和反义链均可以编码蛋白 [3]。PCV分为2个血清型:Ⅰ型(PCV1)和Ⅱ型(PCV2),其中,PCV1无致病性,而PCV2则是多种猪病的病原体 [4]。目前,已知和PCV2相关的猪病有:猪断奶后衰竭综合征(PMWS)、猪皮炎与肾炎综合征(PDNS)、增生性坏死性肺炎(PNP)、猪呼吸道综合征(PRDC)、繁殖障碍、先天性产颤抖、肠炎等 [5]。PCV2病毒因有存活能力强、传播范围广、易诱发其他疾病共感染的特点而给全球的养猪业造成了严重的危害。
已有报道,PCV2可通过MyD88-NF-κB途径调节IL-4和IL-12的分泌,研究发现,PCV2可通过激活MyD88启动NF-κB信号途径,通过IκBα的磷酸化降解激活NF-κB,促使其入核与DNA结合,调控相关细胞因子的转录和表达 [6-7]。PCV2感染肺巨噬细胞后,TNF-α、IL-8分泌量会下降 [8],且巨噬细胞趋化因子Ⅱ(Macrophage-derived chemotactic factor-Ⅱ,AMCF-Ⅱ)、粒细胞集落刺激因子(Granulocyte colony-stimulating factor,G-CSF)、单核细胞趋化因子(Monocyte chemotactic protein-1,MCP-1)的mRNA表达量均会一定程度下调 [9]。Darwich等 [10]研究表明,PCV2的核酸以及基因组的特殊结构(ODN)可抑制PBMCs中IFN-α、IL-12p40、IL-10和IL-6的表达。综上可知,PCV2对宿主的先天性免疫存在潜在的调控作用,但PCV2对作为介导天然免疫反应重要防线的β干扰素是否也具有调控作用,目前未见报道。
病毒感染细胞后,释放核酸,被胞浆中特异的模式识别受体识别,经过相应配体的结合和下游信号转导,启动干扰素和其他细胞因子基因的转录 [11-12]。TLR9是发现较早的病毒DNA模式识别受体,AIM2、IFI16、DDX41、cGAS是后来逐渐发现的其他胞质DNA感受器 [13-16]。通过模式识别受体对病毒DNA的识别引发级联反应,最终同IFN-β上游的-100~-50 bp处启动子区有顺式作用元件(Positive regulatory domain,PRD)相应的ISRE、NF-κB、AP-1启动子区结合,启动IFN-β [17]。
本研究利用 IFN-β启动子报告基因检测、相对荧光定量等试验方法,探究PCV2调控Ⅰ干扰素通路的作用机制,为该病的防治提供理论依据。
1 材料和方法
1.1 试验材料
试验所有PCV2毒株为天津大学生命科学学院实验室在PK-15细胞上增殖后收集保存,所用PK-15细胞为本实验室冻存。真核细胞表达载体pcDNA3.1、RIG-I-FLAG、IFN-β-Luc、NF-κB-Luc、ISRE-Luc质粒、TBK1表达质粒、IRF3-5D-Flag、仙台病毒(Sendai virus,SEV)由本实验室保存。
1.2 主要试剂
TRIzol LS reagent、DEPC购自Invitrogen公司;TranScript First-Strand cDNA Synthessis SuperMix购自北京全式金生物技术有限公司;分子克隆相关试剂:E.coli DH5α感受态、Fast pfu DNA聚合酶购自全式金公司;限制性内切酶XbaⅠ和BamHⅠ、T4DNA连接酶均为New England Biolabs公司产品;无内毒素质粒大提试剂盒购自Promega公司;细胞培养相关试剂:FBS、PBS、青-链霉素、0.25%胰酶、DMEM 培养基购于Gibco公司;转染试剂Lipofectamine 2000 Reagent购自ThermoFisher 公司。荧光素酶报告检测试剂:D-Luciferase粉末购自Sigma公司;Glycylglycine购自北京索莱宝科技有限公司;鼠抗HA标签单抗、鼠抗β-actin 单抗、兔鼠抗-V5 标签单抗、辣根过氧化物酶标记的抗鼠抗体购自全式金公司。
1.3 试验方法
1.3.1 细胞与病毒增殖 细胞培养于含有10% FBS 和1%青-链霉素的H-DMEM 完全培养基中,置于37 ℃,5% CO2孵箱中培养。PCV2毒株按MOI为0.5感染PK-15细胞及PAM细胞,感染后2,6,12,24,36,48 h分别收集细胞,提取总RNA,相对荧光定量PCR检测PCV2感染不同时间先天性免疫分子的变化。相对荧光定量PCR体系为:总RNA(50 ng)8 μL,2×TS Reaction Mix 10 μL,Oligo(dT) 18 (50 pmol/L) 1 μL,RT Enzyme Mix 1 μL,ddH2O 8.2 μL,反应条件为:95 ℃ 30 s;95 ℃ 10 s,56 ℃退火15 s,72 ℃ 30 s,共进行40个循环。95 ℃持续15 s,60 ℃ 15 s,升温至95 ℃持续20 min,采集扩增产物的解链曲线。相对荧光定量PCR中的Ct值代表模板中目标基因的含量,通过与β-actin进行比较,细胞因子mRNA相对定量PCR结果采用2-ΔΔCt法进行分析。利用Duncan法进行统计学分析(P<0.05时表示差异显著)。
1.3.2 质粒构建、转染及蛋白检测 根据GenBank(DQ910866.1、DQ235696.1、EF514716.2)基因序列设计PCV2 ORF1、ORF2、ORF3基因扩增引物。引物由生工生物工程(上海)股份有限公司合成。使用浓度25 pmol/μL的引物见表1。根据相应基因序列设计引物,将PCV2 ORF1、ORF2、ORF3基因连接到pcDNA3.1真核表达载体上,将一定量的质粒转染HEK293T细胞,转染48 h后收获细胞,加入适量含蛋白酶抑制剂、RIPA裂解液(50 mmol/L Tris-HCl,pH值7.5,150 mmol/L NaCl,1%NP-40)冰浴裂解30 min,裂解液于4 ℃、8 000 r/min离心5 min,收集上清进行 SDS-PAGE,之后将蛋白转膜至硝酸纤维膜上,经5%牛奶封闭30 min,一抗4 ℃孵育过夜,HRP标记二抗室温孵育1 h后,用化学发光显色底物及Chemi Doc TMXRS系统检测。
表1 PCV2基因扩增引物
Tab.1 Amplification primers of different PCV2 protein genes
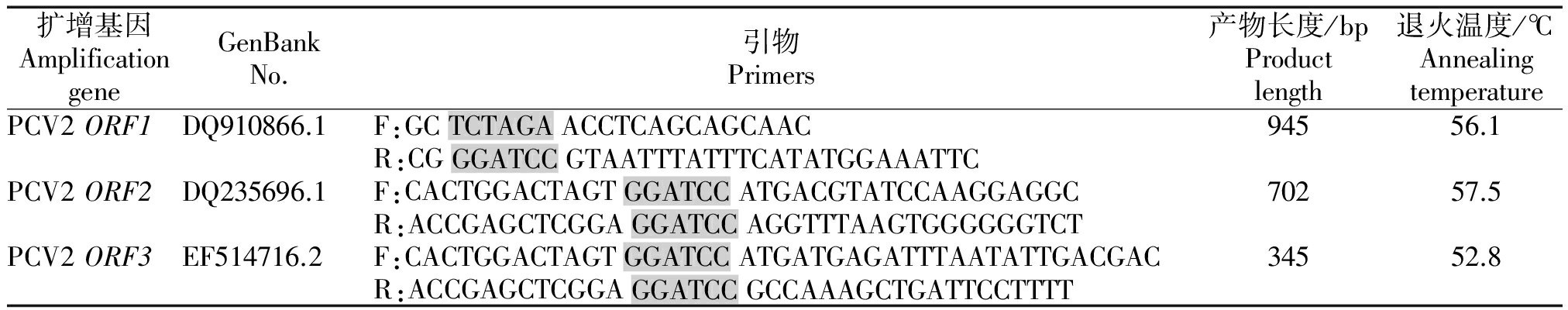
扩增基因AmplificationgeneGenBankNo.引物Primers产物长度/bpProductlength退火温度/℃AnnealingtemperaturePCV2ORF1DQ910866.1F:GCTCTAGAACCTCAGCAGCAAC94556.1R:CGGGATCCGTAATTTATTTCATATGGAAATTCPCV2ORF2DQ235696.1F:CACTGGACTAGTGGATCCATGACGTATCCAAGGAGGC70257.5R:ACCGAGCTCGGAGGATCCAGGTTTAAGTGGGGGGTCTPCV2ORF3EF514716.2F:CACTGGACTAGTGGATCCATGATGAGATTTAATATTGACGAC34552.8R:ACCGAGCTCGGAGGATCCGCCAAAGCTGATTCCTTTT
注:灰色部分为酶切位点。
Note:Enzyme cutting site was showed in gray.
1.3.3 荧光素酶报告检测 将IFN-β启动子荧光素酶的报告质粒 IFN-β-Luc和荧光素酶内参质粒 Laz-luc共转染PK-15细胞,设置不接种(Mock)和接种PCV2(0.5 moi)组,并将PK-15细胞接种SeV作为阳性对照,24 h后检测 IFN-β启动子荧光素酶活性。为了进一步研究PCV2感染是否能抑制Poly(dA∶dT)诱导的IFN-β转录,将 IFN-β启动子荧光素酶的报告质粒IFN-β-Luc和荧光素酶内参质粒Laz-luc共转染PK-15细胞,随后分别设0.00(Mock),1.00,0.10,0.01 moi剂量的PCV2接种组,接种设置为24 h后用Poly(dA:dT)刺激,24 h后检测 IFN-β启动子荧光素酶活性。
为了进一步研究PCV2编码的3个主要蛋白ORF1/ORF2/ORF3哪个对干扰素具有调控作用,使用Lipofectamine 2000将pcDNA3.1-ORF1、pcDNA3.1-ORF2、pcDNA3.1-ORF3各0.5 μg同0.5 μg IFN-β-Luc、NF-κB-Luc、AP-1-Luc及0.5 μg 内参Laz-luc质粒共同转染24孔板中的HEK293T细胞,转染24 h后,加入SEV(20 HA/mL)刺激18 h后收集细胞,进行荧光素酶报告检测。确定了PCV2编码蛋白对干扰素具有调控作用后,进一步将0.5 μg IFN-β-Luc、NF-κB-Luc、AP-1-Luc与0.5 μg 内参Laz-luc质粒同不同剂量的pcDNA3.1-ORFs(0.05,0.10,0.20,0.40 μg)转染细胞,用Poly(dA∶dT)或cGAS质粒作为诱导剂激活干扰素信号通路。
数据平均值和标准误差通过GraphPad Prism 5.01分析处理得到。通过t检验计算P值,P值小于0.05时认为有统计学意义。
2 结果与分析
2.1 pcDNA3.1-ORF1/ORF2/ORF3真核表达的构建
基因扩增产物与目的大小相符,阳性克隆测序正确,表明已成功构建了ORF1/ORF2/ORF3的pcDNA3.1真核表达载体。重组质粒转染细胞裂解产物的相对分子量大小正确,能特异性表达相应大小的ORF1/ORF2/ORF3蛋白(图1)。
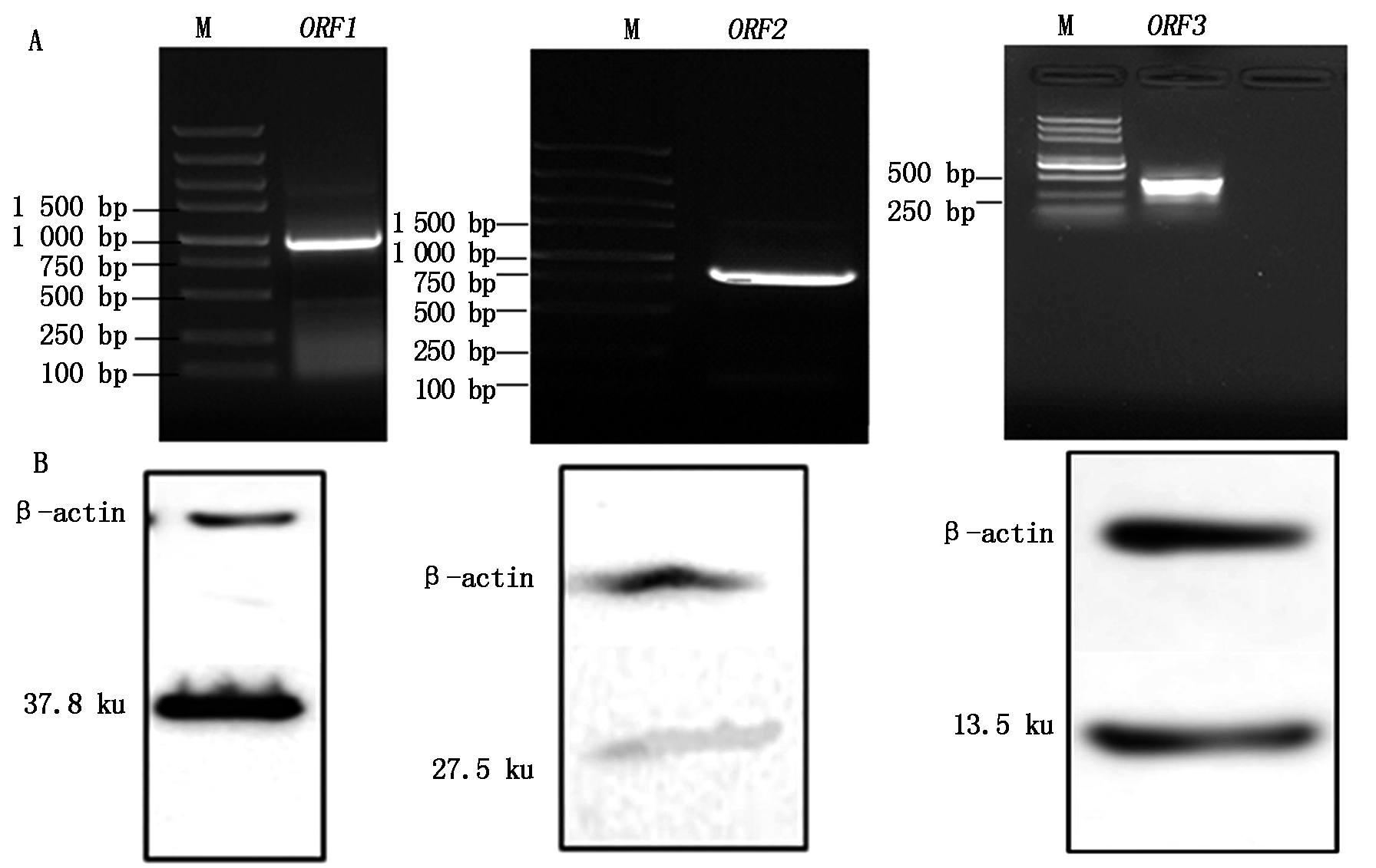
A.ORF1-3基因片段分别为945,702,345 bp;B.ORF1-3表达蛋白分子量分别为37.8,27.5,13.5 ku。A.ORF1-3 PCR products,945,702,345 bp respectively;B.The expression products of PCV2 ORF1-3,37.8,27.5,13.5 ku,respectively.
图1 PCR扩增PCV2 ORF1、ORF2、ORF3基因的产物(A)及其pcDNA3.1-ORF1/ORF2/ORF3转染HEK293T细胞的表达蛋白(B)
Fig. 1 The PCR amplification products of PCV2 ORF1,ORF2 and ORF3 genes (A)and its expression protein in transinfected HEK293T cells (B)
2.2 PCV2体外感染对天然免疫反应的抑制效应
2.2.1 PCV2感染对白细胞介素mRNA的影响 如图2所示,整体上看,IL-1β、IL-6、IL-8、IL-10的转录在病毒感染初期会有一个上升过程,但在感染后期均会受到不同程度的抑制。IL-1β和IL-8是天然免疫应答过程中最重要的调节因子,其参与炎症反应、增强免疫介导的组织损伤;IL-8是一种重要的趋化性细胞因子,趋化和激活中性粒细胞、嗜碱性粒细胞及T细胞进入感染部位。PCV2感染后IL-8在12 h的升高说明病毒成功感染细胞,后期可能与细胞浸润和肉芽肿形成相关;IL-10是一种介导免疫抑制的细胞因子,可以抑制Th1细胞应答、抑制巨噬细胞的抗原提呈功能及其细胞因子的合成,PCV2感染导致IL-10转录的上调和感染猪胸腺的衰竭有关。
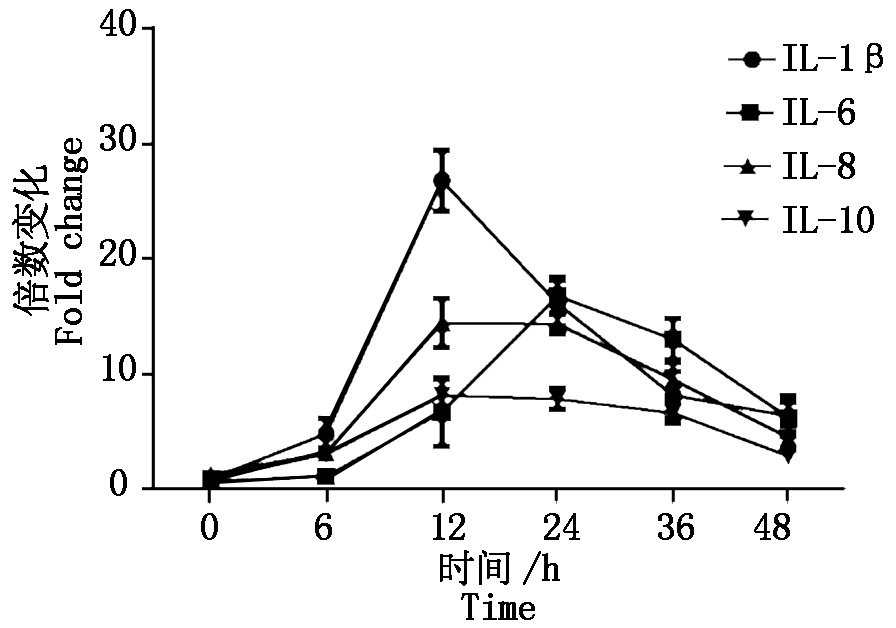
图2 PCV2感染PK-15细胞因子IL-1β、IL-6、IL-8、IL-10转录时相
Fig.2 The transcriptional profiles of cytokines IL-1β,IL-6,IL-8,IL-10 in PCV2 inoculated PK-15 cells
2.2.2 PCV2感染对抗原提呈分子mRNA的影响 如图3所示,PCV2感染后MHCⅠ、MHCⅡ类分子在感染早期的转录水平较高,其中,MHCⅠ的峰值出现在感染后12 h,MHCⅡ则能持续较高水平地表达,在感染24 h后开始下降。抗原提呈细胞后期受到抑制可能和IL-10的高水平表达有关,IL-10的上调会降低MHC类分子的表达,损害抗原提呈细胞的抗原提呈能力。
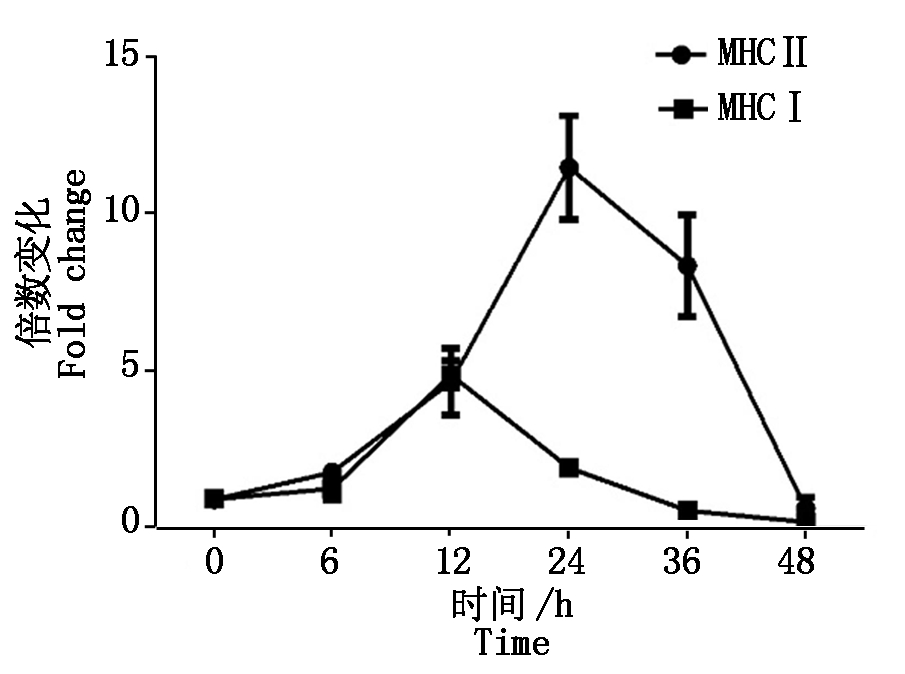
图3 PCV2感染PK-15细胞MHCⅠ,MHC Ⅱ的转录表达
Fig.3 The transcriptional changes of MHCⅠand MHCⅡ in PCV2 infected cells
2.2.3 PCV2感染对模式识别受体TLRs、cGAS的影响 TLR样受体是一种广泛存在的模式识别受体,其中,TLR3、TLR7、TLR9主要负责识别病毒的核酸,我们已经证实,PCV2感染会引起先天性免疫细胞因子IL-1、IL-6、IL-8、IL-12、TNF-α等的变化,这种变化是否和TLR受体相关?PAM细胞感染PCV2后0,6,12,24,48 h各时间点收集细胞,提取总RNA,利用相对荧光定量的方法检测TLR3、TLR7、TLR9的mRNA水平,结果如图4所示。在PCV2感染12 h以内TLRs的转录水平不会有显著的变化,但在感染12 h以后便开始显著升高,其中,TLR7随感染时间变化不明显,TLR9有先上升后下降的趋势,在24 h时达到最大值,随后开始下降(图4)。
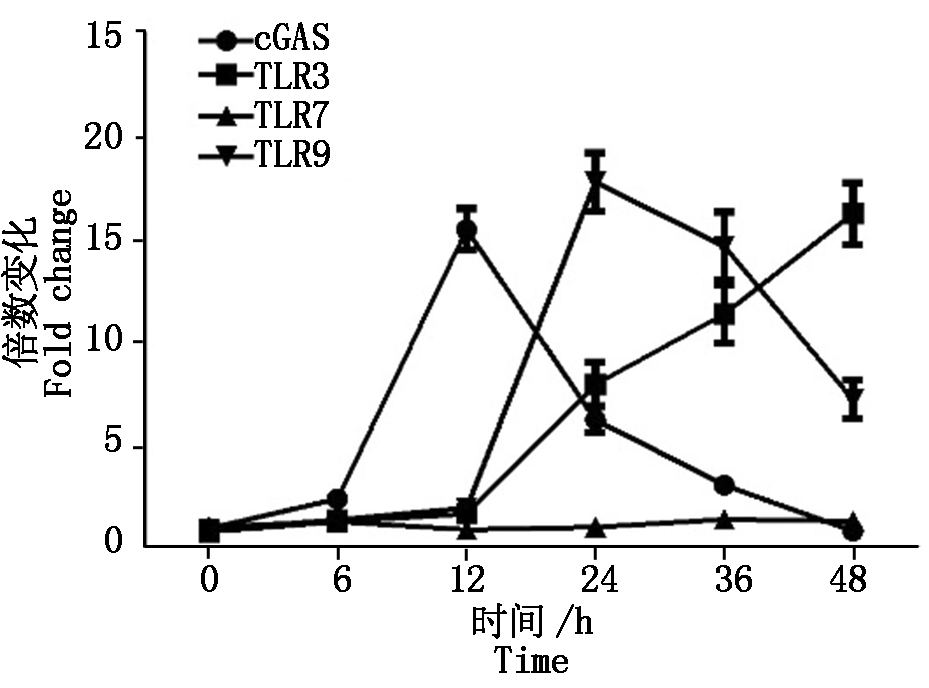
图4 PCV2感染对TLR3/7/9、cGAS转录的影响
Fig.4 The transcription levels of TLR3/7/9 and cGAS in PCV2 inoculated cells
2.2.4 PCV2体外感染对Ⅰ型干扰素及转录因子的影响 Ⅰ型干扰素是机体天然免疫重要的抗病毒蛋白。对PCV2感染后细胞Ⅰ型干扰素IFN-α、IFN-β、IFN-γ的转录水平进行动态分析发现,PCV2感染对IFN-α的影响不明显,但可以下调IFN-β、IFN-γ的mRNA,转录因子NF-κB上调,而IRF3的转录水平被下调(图5)。
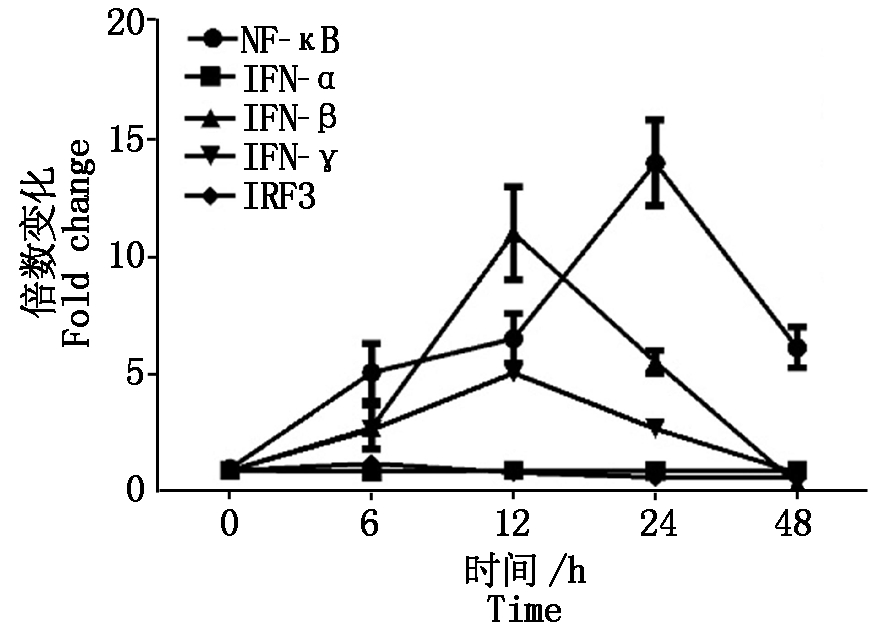
图 5 PCV2感染PK-15细胞后Ⅰ型干扰素及转录因子NF-κB、IRF3转录的变化
Fig.5 The transcription levels changes of type Ⅰ interferon and transcription factor NF-κB and IRF3 in PCV2 inoculated cells
2.2.5 PCV2体外感染PK-15对IFN-β及其启动子的抑制 IFN-β是先天性免疫的第一道防线,采用荧光素酶报告检测系统检测PCV2感染PK-15细胞后IFN-β的表达情况及其启动子的激活情况,分别用DNA模式识别受体相关的配体去激活IFN-β信号通路,然后检测PCV2感染后对IFN-β的影响(图6),结果显示PCV2感染不能激活IFN-β的转录,并且能够抑制Poly(dA∶dT)、cGAS诱导的IFN-β转录,且呈现接种剂量依赖性。
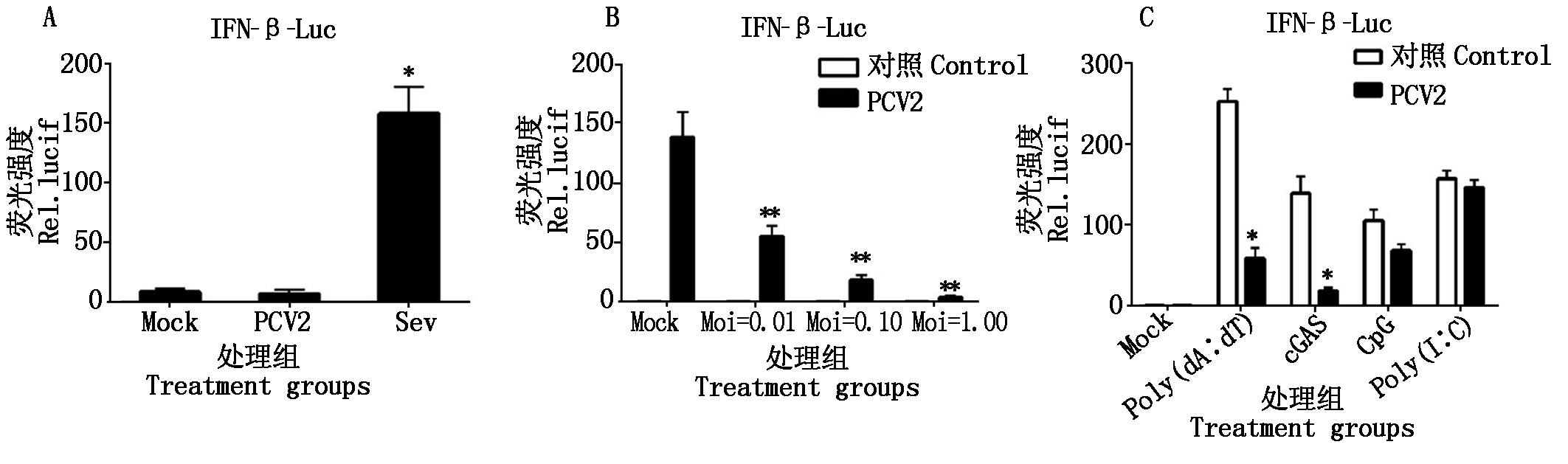
A.与Sev相比;B.PCV2剂量效应;C.不同激活配体处理;*.P<0.05,**.P<0.01。图7-9同。A.Sev stimulated cells;B.Dose-dependent effect of PCV2 treated cells;C.PCV2 blocked Ploy(dA∶dT),cGAS induced activity of IFN-β.*.P<0.05,**.P<0.01.The same as Fig.7-9.
图6 PCV2感染对IFN-β-Luc通路及IFN-β转录的影响
Fig.6 Effect of PCV2 infection on the IFN-β-Luc pathway and the IFN-β transcription level
2.3 PCV2 ORF1、ORF2对IFN-β的调控作用
为了确定PCV2 ORF1、ORF2、ORF3这3个主要蛋白的调控作用,将PCV2表达质粒ORF1、ORF2、ORF3分别同IFN-β-Luc、NF-κB-Luc、IRF3-Luc、AP-1-Luc质粒共转染细胞,24 h后加入Sev作为诱导剂激活IFN-β通路。如图7所示,PCV2感染抑制Poly(dA∶dT)和cGAS诱导的IRF3、NF-κB的活化,但不影响AP-1的活化。ORF1可以通过NF-κB启动子激活IFN-β的表达,ORF2可通过NF-κB和IRF3启动子抑制IFN-β的表达,ORF3则没有明显的作用。
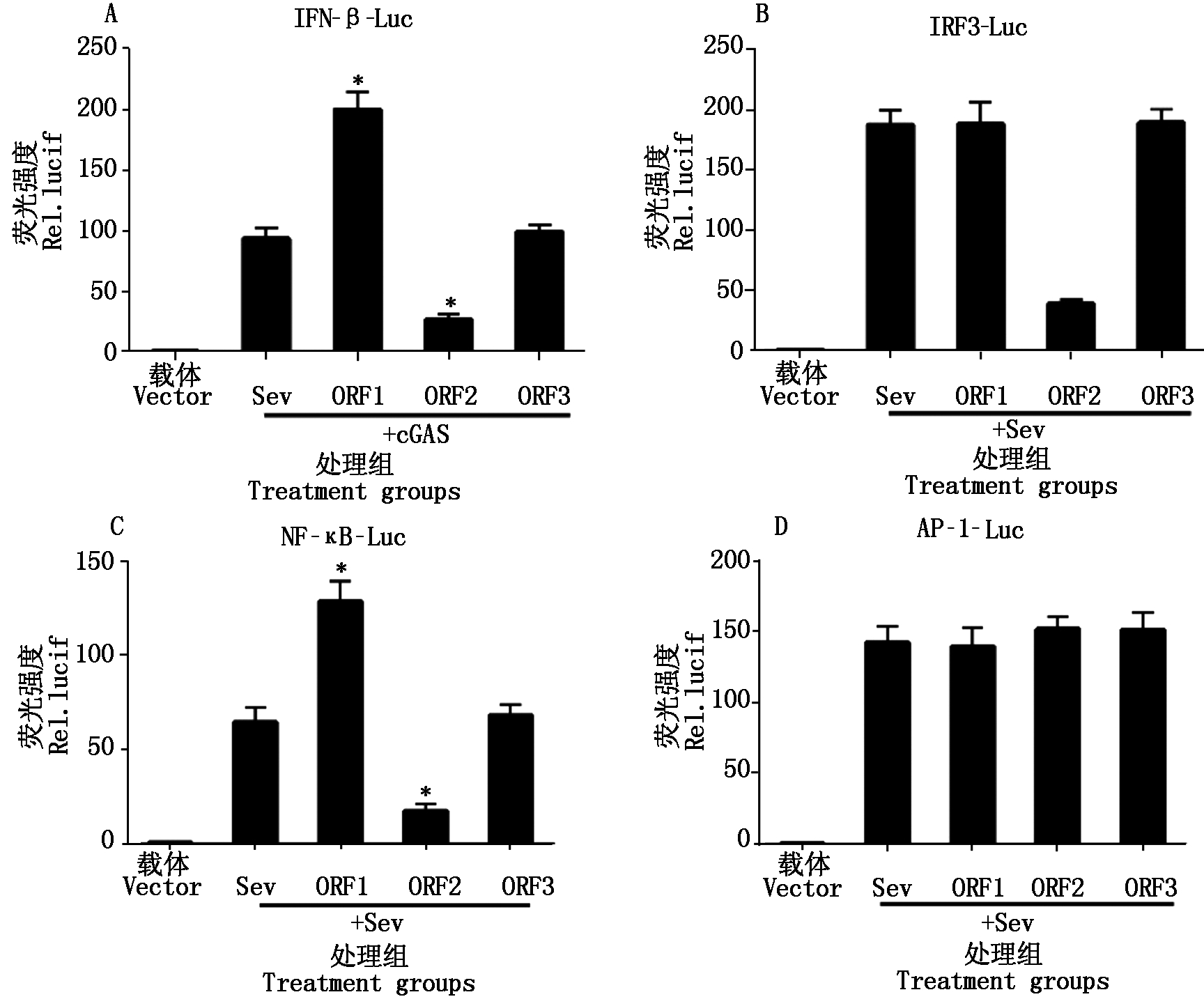
图7 不同PCV2 ORF表达蛋白对干扰素诱导启动子活化的影响
Fig.7 The regulation roles of different PCV2 ORF expression protein in inducing IFN activation
2.4 ORF1 和ORF2通过NF-κB、IRF3对IFN-β的作用
PCV2感染可以抑制Ploy(dA∶dT)、cGAS诱导的IFN-β产生,且呈剂量依赖关系。以cGAS为诱导剂检测过表达ORF1、ORF2时,对IFN-β及其启动子的活性调控的结果如图8所示,ORF1可以通过NF-κB启动子激活IFN-β的表达,并且呈剂量依赖效应;ORF2可以通过NF-κB和IRF3启动子抑制IFN-β的表达,并且呈剂量依赖效应。
水泡性口炎在许多细胞上都有它的受体,因此可以感染多种细胞系,并且已知它是一种对Ⅰ型干扰素敏感的病毒。笔者用表达绿色荧光蛋白标记的水泡性口炎病毒(GFP-VSV)间接判断ORF1、ORF2表达蛋白对细胞干扰素产生的影响,生长状态良好的PK-15细胞,分别转染ORF1、ORF2的表达质粒,转染24 h后,按moi 0.01的浓度接种GFP-VSV。接种后18 h收获细胞,用4%的多聚甲醛固定细胞后,用DAPI染细胞核,荧光倒置显微镜观察视野中GFP-VSV的细胞数量并做统计学分析,结果如图9所示,ORF1转染细胞VSV-GFP病毒增殖明显受到抑制,ORF2转染细胞后VSV-GFP病毒的增殖却显著增强。
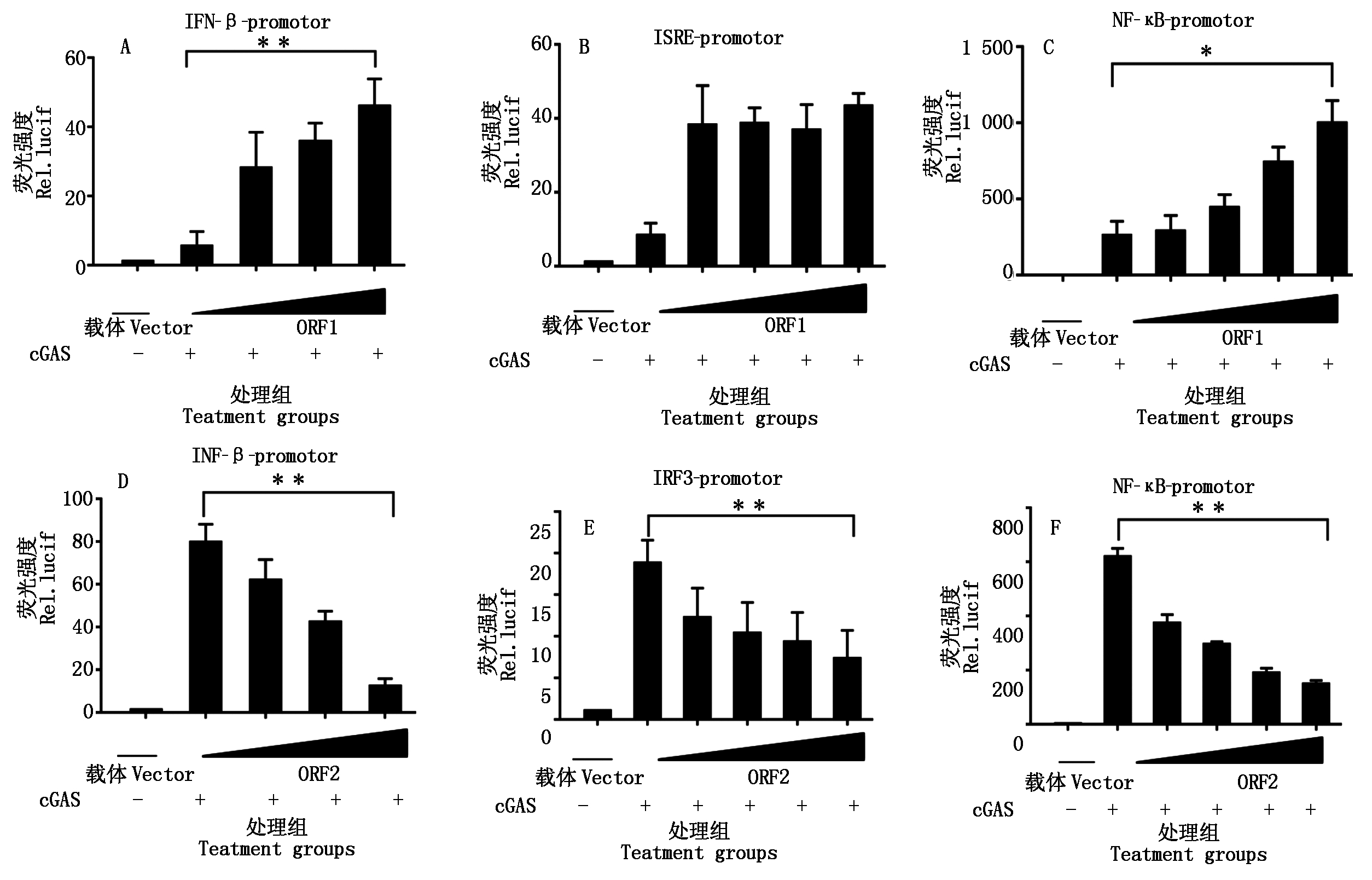
图8 PCV2 ORF1和ORF2影响的干扰素活化途径分析
Fig.8 Effects of over expression of PCV2 ORF1/ORF2 on cGAS-triggered IFN-β promoter activation

A、B.ORF1 转染组;C、D.ORF2 转染组。A,B.ORF1-treated cells;C,D.ORF2-treated cells.
图9 不同PCV2 ORF表达蛋白对GFP-VSV增殖的影响
Fig.9 The effects of different PCV2 ORF expression protein on GFP-VSV multiplication
3 讨论
PCV2感染PK-15细胞检测其对细胞先天性免疫因子的影响,结果发现,NF-кB、IL-6、IL-8细胞因子在病毒感染后其转录水平均较高,而IFN-β、IL-1β、TNF-α、MHC Ⅰ、MHC Ⅱ细胞因子后期受到抑制[18],说明PCV2造成感染细胞的免疫抑制,这也解释了感染PCV2的仔猪通常会伴随着猪繁殖与呼吸综合征病毒(PRRSV)、猪肺炎支原体、细菌性败血症和肺炎等其他疾病,PCV2感染造成机体免疫抑制使得仔猪继发性易感性增加。病毒感染使TLRs转录水平试验中TLR3的转录水平随PCV2感染会升高,可能的原因为细胞的RNA聚合酶Ⅲ以PCV2基因组为模板合成5′-三磷酸双链RNA,它可被TLR3识别,进而通过TRIF途径发挥抗病毒效应,但对TLR7的转录水平没有影响。TLR9识别病毒非甲基化的CpG DNA,通过对PCV2的序列分析发现,PCV2基因中富含若干CpG DNA基序可以激活TLR9,PCV2感染后24,36 h TLR9 mRNA表达量升高,可能与PCV2基因组中CpG的释放内陷进入细胞内有关。
病毒感染机体后,机体的细胞内模式识别受体会识别和提呈病毒的病原相关分子,启动天然免疫,经一系列的信号转导,最终诱导Ⅰ型干扰素等细胞因子的表达,这是很多病毒用来逃逸先天性免疫的主要手段之一[19]。研究发现,仙台病毒(Simaian virus)的V蛋白、埃博拉病毒(Ebola virus)的VP35可以通过抑制IRF3的功能从而抑制干扰素的转录,到达逃逸先天性免疫的目的。丙型肝炎病毒(Hepatitis C virus)NS3/4A既可以抑制IRF3的功能,也可以通过降解MAVS蛋白来抑制先天性免疫;流感病毒的非结构蛋白NS1可以通过和RIG结合而抑制IRF3的功能,从而成功地进行免疫逃逸。HCV的NS5A蛋白通过抑制MyD88、痘病毒(Vaccinia virus)的A52R通过与IRAK2的相互作用抑制TLR介导的Ⅰ型干扰素转录[19-22]。研究发现,PCV2通过IRF3、NF-κB启动子抑制干扰素的产生,但PCV2 ORF1和ORF2在对干扰素的调控方面表现出相反的特性,ORF1通过NF-κB激活干扰素的产生,Meng[23]研究发现,PCV2 复制时激活 NF-κB,细胞用NF-κB抑制剂处理可以减少病毒的复制,说明NF-κB 的活化在协同多种控制免疫反应的细胞基因表达上发挥重要的作用,从而促进病毒的复制。现在还不清楚其具体分子机制。另有研究表明,PCV2基因序列中含有的干扰素刺激应答元件(ISRE)使得PCV2感染早期能够利用干扰素进行病毒复制[24]。这可能为ORF1激活IFN-β提供了一种解释。
IRF-3被上游信号分子激活后磷酸化入核,再与细胞核内的组蛋白乙酰基转移酶结合,改变染色体的构象,然后与干扰素启动子DNA结合,通过这一系列的活化过程来启动干扰素的表达。NF-κB的活化包括IκB降解和P65磷酸化2个过程,IκB降解后释放NF-κB P50/P65异源二聚体,P65磷酸化,最终进入细胞核与细胞核内的组蛋白乙酰基转移酶结合,改变染色体的构象,然后与干扰素启动子DNA结合,启动干扰素的表达[25-26],因此,欲进一步研究ORF1/ORF2调控干扰素的机制,需要研究ORF1/ORF2对IRF3的磷酸化二聚化入核的影响[27-29]。
研究中利用双报告基因检测技术、相对荧光定量等试验方法,发现PCV2抑制Ⅰ型干扰素通路,但其编码的ORF1蛋白通过NF-κB激活IFN-β的产生,ORF2通过NF-кB、IRF3启动子抑制IFN-β的产生,这为认识PCV2免疫抑制机制提供了新依据。
参考文献:
[1] Fauquet C, Fargette D. International committee on taxonomy of viruses and the 3,142 unassigned species[J]. Virol J, 2005, 2(1):64.
[2] Park C, Jeong J, Choi K, et al. Development of porcine circovirus 2 (PCV2) open reading frame 2 DNA vaccine with different adjuvants and comparison with commercial PCV2 subunit vaccine in an experimental challenge[J]. Can J Vet Res, 2017, 81(3):171-177.
[3] Sauvage V, Cheval J, Foulongne V, et al. Identification of the first human gyrovirus, a virus related to Chicken anemia virus[J]. J Virol, 2011, 85(15):7948-7950.
[4] Chae C. A review of porcine circovirus 2-associated syndromes and diseases[J]. Vet J, 2005, 169(3):326-336.
[5] Gu J, Xing G, Lei J, et al. Porcine circovirus type 2 and PCV2-systemic disease-a review[J]. Chinese Journal of Biotechnology,2015, 31(6):880-891.
[6] 张秀娟, 孙 运, 郭 华, 等.PCV2 感染对仔猪肝脏MyD88-NF-κB信号途径的影响[J]. 南京农业大学学报,2013, 36(1):97-102.
[7] 段滇宁, 郭 华, 李晓琳, 等. PCV2通过激活NF-κB信号途径调节体外培养仔猪淋巴细胞IL-4和IL-12的分泌[J]. 南京农业大学学报, 2014, 37(3):93-99.
[8] Koinig H C, Talker S C, Stadler M, et al. PCV2 vaccination induces IFN-gamma/TNF-alpha co-producing T cells with a potential role in protection[J]. Vet Res, 2015, 46(1):1-13.
[9] 周双海, 杨汉春, 郭 鑫, 等. PCV2 感染对猪 MCP-1 和 IL-8mRNA 表达的影响[J]. 中国兽医科学, 2006, 36(6):468-471.
[10] Darwich L, Balasch M, Plana-Duran J, et al. Cytokine profiles of peripheral blood mononuclear cells from pigs with postweaning multisystemic wasting syndrome in response to mitogen, superantigen or recall viral antigens[J]. J Gen Virol, 2003, 84(12):3453-3457.
[11] García-Sastre A, Biron C A. Type 1 interferons and the virus-host relationship: a lesson in detente[J]. Science, 2006, 312:879-882.
[12] Samuel C E. Antiviral actions of interferons[J]. Clin Microbiol Rev, 2001, 14(4):778-809.
[13] Takaoka A, Wang Z, Choi M K, et al. DAI (DLM-1/ZBP1) is a cytosolic DNA sensor and an activator of innate immune response[J]. Nature, 2007, 448:501-505.
[14] Makris S, Paulsen M, Johansson C. Type I interferons as regulators of lung inflammation[J]. Front Immunol, 2017, 8:259-269.
[15] Zhang Z, Yuan B, Bao M, et al. The helicase DDX41 senses intracellular DNA mediated by the adaptor STING in dendritic cells[J]. Nat Immunol, 2011, 12(10):959-965.
[16] Sun L, Wu J, Du F, et al. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway[J]. Science, 2013, 339(6121):786-791.
[17] Dragan A, Carrillo R, Gerasimova T,et al. Assembling the human IFN-β enhanceosome in solution[J]. J Mol Biol, 2008, 384(2):335-348.
[18] Hu Y, He K, Wang X. Role of Chinese herbal medicinal ingredients in secretion of cytokines by PCV2-induced endothelial cells[J]. J Immunotoxicol, 2016, 13(2):141-147.
[19] Bowie A G, Unterholzner L. Viral evasion and subversion of pattern-recognition receptor signalling[J]. Nature Reviews Immunology, 2008, 8(12):911-922.
[20] Sadler A J, Williams B R. Interferon-inducible antiviral effectors[J]. Nature Reviews Immunology, 2008, 8(7):559-568.
[21] Weber F, Kochs G, Haller O. Inverse interference: how viruses fight the interferon system[J]. Viral Immunol, 2004, 17(4):498-515.
[22] Eddicks M, Szikora F, Walhofer N, et al. Occurrence of genotypes of Porcine circovirus(PCV2) in pig farms using different vaccination strategies against PCV2[J]. Tierarztl Prax Ausg G Grosstiere Nutztiere, 2017, 45(2):90-97.
[23] Meng X J. Porcine circovirus type 2 (PCV2): Pathogenesis and interaction with the immune system[J]. Annu Rev Anim Biosci, 2013, 1(1):43-64.
[24] Ramamoorthy S, Opriessnig T, Pal N, et al. Effect of an interferon-stimulated response element (ISRE) mutant of Porcine circovirus type 2 (PCV2) on PCV2-induced pathological lesions in a Porcine reproductive and respiratory syndrome virus(PRRSV) co-infection model[J]. Vet Microbiol, 2011, 147(1):49-58.
[25] Liu P, Li K, Garofalo R P, et al. Respiratory syncytial virus induces RelA release from cytoplasmic 100-kDa NF-κB2 complexes via a novel retinoic acid-inducible gene-I· NF-κB-inducing kinase signaling pathway[J]. J Biol Chem, 2008, 283(34):23169-23178.
[26] Bonizzi G, Karin M. The two NF-κB activation pathways and their role in innate and adaptive immunity[J]. Trends Immunol, 2004, 25(6):280-288.
[27] Honda K, Yanai H, Takaoka A, et al. Regulation of the type I IFN induction: a current view[J]. Int Immunol, 2005, 17(11):1367-1378.
[28] Smith E J, Marié I, Prakash A, et al. IRF3 and IRF7 phosphorylation in virus-infected cells does not require double-stranded RNA-dependent protein kinase R or IκB kinase but is blocked by Vaccinia virus E3L protein[J]. J Biol Chem, 2001, 276(12):8951-8957.
[29] Sun F, Zhang Y B, Liu T K, et al. Fish MITA serves as a mediator for distinct fish IFN gene activation dependent on IRF3 or IRF7[J]. The Journal of Immunology, 2011, 187(5):2531-2539.