细胞分裂素是一类经典的植物激素,参与了许多植物发育过程,在细胞分裂、调控顶端优势、促进芽的分化、叶绿素的合成、延缓开花时间及叶片衰老、促进维管束分化和种子发育等过程中发挥了重要作用[1-9]。近年来,越来越多的证据表明,在植物应对盐、干旱等非生物胁迫的过程中,细胞分裂素也扮演着重要的角色[10-16]。
细胞分裂素的信号是通过由细胞分裂素受体组氨酸激酶(Histidine kinases,HKs)、组氨酸磷酸转运蛋白(Histidine phosphotransfer proteins,HPs)以及反应调节因子(Response regulators,RRs)组成的复杂的双元组分系统(Two component system,TCS)进行传递的[17-18]。细胞分裂素与受体HK胞外域的CHASE(Cyclaseand histidine kinase-associated sensing extracellular)结构域结合,使受体胞内域保守位点His自磷酸化,之后磷酸基团转移到受体接受域保守的Asp位点。接下来,磷酸基团再转移到HP上保守的His位点并促使HP由细胞质进入细胞核。最后,磷酸基团转移到定位于细胞核的转录因子B型RR接受域保守的Asp位点上,从而激活下游基因的转录[19-20]。
组氨酸磷酸转运蛋白在拟南芥中由6个成员组成,其中,AHP1~AHP5含有发挥功能的保守His磷酸化位点,是有功能的组氨酸磷酸转运蛋白[21]。AHP6中保守的His磷酸转化位点被Asp替代,不具备传递磷酸基团的功能[22]。水稻中的组氨酸磷酸转运蛋白家族由5个成员组成:2个OsAHP和3个OsPHP[23-24]。OsAHP1和OsAHP2均具有保守的XHQXKGSSXS序列及其中保守位点的His,该位点在信号转导过程中可以接受来自组氨酸受体激酶的磷酸基团,进而将磷酸基团传递给下游的响应因子。因此,保守位点的His对于OsAHP行使信号传递的功能是必需的。而在OsPHP中该保守位点的His被Gln替代,因而无法进行信号传递,从而被称为假组氨酸磷酸转运蛋白。拟南芥和水稻中的研究结果显示,组氨酸磷酸转运蛋白参与了细胞分裂素信号转导途径,同时也参与了植物对盐和干旱胁迫的应激反应[21,25]。
目前,小麦中已经克隆了3个组氨酸磷酸转运蛋白基因,分别为TaHP1、TaHP2和TaHP3[26],但是并未对其在逆境胁迫下的表达和功能开展研究。本研究克隆了一个新的组氨酸磷酸转运蛋白基因,命名为TaHP4,对其进行了生物信息学分析,并研究了其在小麦不同组织及逆境胁迫下的表达特征,旨在为深入研究和利用该基因奠定基础。
1 材料和方法
1.1 材料及逆境胁迫处理
小麦科农199由河北省农林科学院粮油作物研究所提供。取抽穗期小麦的根、茎、叶和穗,3次重复。取样后迅速置于液氮中冷冻并于-80 ℃超低温冰箱保存备用。
Hoagland营养液水培10 d的小麦幼苗,分别进行干旱(20% PEG-6000)、200 mmol/L NaCl、100 μmol/L ABA和50 μmol/L BA处理,于0,1,3,6,12,24 h取相同部位叶片,3次重复。取样后迅速置于液氮中冷冻并于-80 ℃超低温冰箱保存备用。
1.2 试验方法
1.2.1 植物总RNA的提取及cDAN合成 用TRNzol Reagent(TIANGEN)按试剂说明书提取植物总RNA。以500 ng RNA为模板,按照PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)试剂盒的说明书进行反转录合成cDNA。
1.2.2 小麦TaHP4基因的克隆 利用拟南芥组氨酸磷酸转运蛋白AHP1(At3g21510)、AHP2(At3g29350)、AHP3(At5g39340)、AHP4(At3g16360) 和AHP5(At1g03430)基因序列分别比对小麦EST数据库(http://plants.ensembl.org),得到多个可能的小麦HP基因部分cDNA序列,通过电子克隆拼接得到1个基因的全长cDNA序列,命名为TaHP4。根据序列设计引物,上游引物TaHP4-F:5′-GTCTCATTGCA
GCCATCTCAG-3′,下游引物TaHP4-R:5′-TAGCTGG
TCCCTTAGTTCCCT-3′,由北京英骏生物公司合成。PCR反应使用Premix PrimeSTAR HS(TaKaRa),体系为50 μL:Premix PrimeSTAR HS(2×)25 μL,上下游引物(10 μmol/L)各2.5 μL,小麦cDNA 2 μL,超纯水18 μL。PCR反应条件为:98 ℃ 2 min;98 ℃ 10 s,60 ℃ 10 s,68 ℃ 35 s,32个循环;68 ℃ 7 min。使用1%琼脂糖凝胶对PCR产物进行电泳,切胶回收后连接至pEASY-Blunt Cloning载体(北京全式金生物技术有限公司),转化大肠杆菌DH5α感受态细胞,筛选阳性克隆后测序。
1.2.3 小麦TaHP4基因序列分析 序列的ORF分析、蛋白质翻译、分子量和等电点预测使用OMIGA软件;利用ProSite(http://prosite.expasy.org/)在线分析蛋白的保守结构;利用DNAMAN软件对蛋白序列进行比对和进化树分析。包括以下组氨酸磷酸转运蛋白基因:小麦中的TaHP1 (AY342358)、TaHP2 (BK005644)和TaHP3 (BK005645),拟南芥中的AHP1 (At3g21510)、AHP2 (At3g29350)、AHP3 (At5g3934)、AHP4 (At3g16360)、AHP5(At1g03430)和AHP6(At1g80100),水稻中的OsAHP1(Os08g44350)、OsAHP2 (Os09g39400)、OsPHP1 (Os01g54050)、OsPHP2 (Os05g09410)和OsPHP3(Os05g44570),玉米中的ZmHP1(AB024293)、ZmHP2(AB024292)、ZmHP3(AB089191)和ZmHP4(NM_001153941)。
1.2.4 荧光实时定量PCR 利用Primer Express软件设计目标基因qRT-PCR引物。上游引物TaHP4-QF:5′-TGAAGCAGAAGCTGGAGTCAT-3′,下游引物TaHP4-QR:5′-TGGTCCCTTAGTTCCCTTGG-3′。以小麦TaActin为内参,上游引物TaActin-QF:5′-TGCTATC
CTTCGTTTGGACCTT-3′,下游引物TaActin-QR:5′-AGCGGTTGTTGTGAGGGAGT-3′。用SYBR®Premix Ex TaqⅡ(TaKaRa)试剂盒进行实时荧光定量PCR分析,20 μL 反应体系:SYBR® Premix Ex Taq Ⅱ(2×)10 μL,上下游引物(10 μmol/L)各0.8 μL,cDNA模板(稀释10倍)4 μL,ddH2O 4.4 μL。反应在Bio-Rad Icycler iQ5 Real-time PCR仪上进行,反应条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。每个样品设置3个技术性重复,3个生物学重复。根据扩增曲线确定每个基因和样本相应的Ct值,以TaActin为内参基因,将“0”时间点样本的表达量设为“1”,相对表达量采用2-ΔΔCt方法计算。
2 结果与分析
2.1 TaHP4基因克隆及序列分析
根据拼接的TaHP4基因序列,设计了上下游引物,从小麦幼苗的cDNA中扩增得到了一条长度为563 bp的序列(图1)。测序结果表明,其核苷酸序列与电子克隆的序列一致,包含一个456 bp的ORF,编码151个氨基酸,推测的蛋白分子量为17.71 ku,等电点为9.09。TaHP4具有一个HPt结构域,位于第38-133个氨基酸,其中第79位His为保守的磷酸化组氨酸位点,该位点在信号转导过程中可以接受来自组氨酸受体激酶的磷酸基团,进而将磷酸基团传递给下游的响应因子。
2.2 TaHP4蛋白的同源序列比对和进化树分析
将TaHP4预测的氨基酸序列与来自小麦、拟南芥、水稻和玉米中的18个HP蛋白序列进行同源比对(图2),结果显示,TaHP4与水稻和玉米中不含保守His位点的HP同源性较高,其中与水稻中的OsPHP2同源性最高,达到了88.7%,其次为OsPHP1、ZmHP4和OsPHP3,同源性也达到了62.3%~68.9%;而与拟南芥、水稻和玉米中含保守组氨酸位点的HP同源性较低,仅为36.5%~55.9%;与小麦中已经克隆的3个HP的同源性也只有32.2%~34.2%。以上结果表明,TaHP4是一个新的小麦组氨酸磷酸转运蛋白基因。
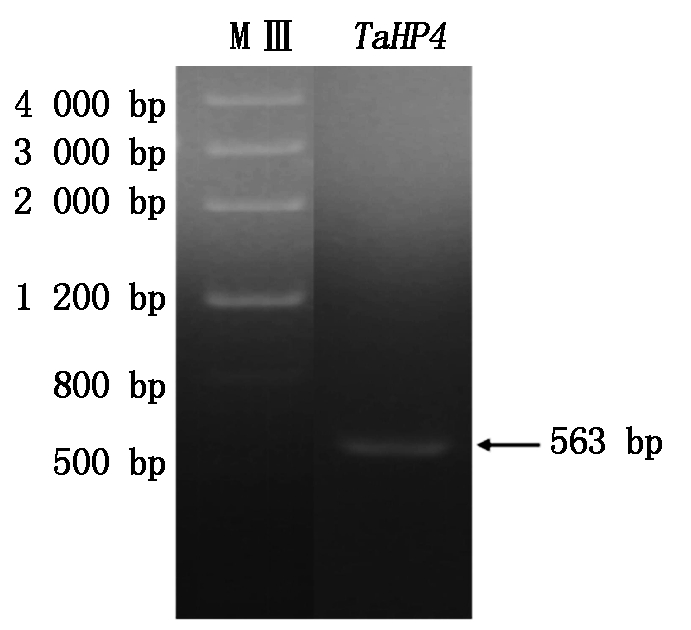
MⅢ. Marker Ⅲ分子量标准;TaHP4. TaHP4基因扩增结果。MⅢ. Marker Ⅲ DNA Marker;TaHP4. Gene amplification of TaHP4.
图1 小麦TaHP4基因的克隆
Fig.1 The cloning of TaHP4 in wheat

图2 小麦TaHP4与其他HP氨基酸序列比对
Fig.2 Multiple amino acid sequences alignment of TaHP4 and other HPs
将TaHP4预测的氨基酸序列与来自小麦、拟南芥、水稻和玉米中的18个HP蛋白序列进行系统进化树分析(图3),结果显示,TaHP4与水稻、玉米和拟南芥中不含保守His位点的OsPHP1、OsPHP2、OsPHP3、ZmHP4、AHP6和含保守His位点的AHP4位于同一个进化分枝,小麦中前期已经克隆的TaHP1、TaHP2、TaHP3与水稻和玉米中的含保守His位点的OsAHP1、OsAHP2、ZmHP1、ZmHP2和ZmHP3位于同一个进化分枝,拟南芥中含保守His位点的AHP1、AHP2、AHP3和AHP5位于同一个进化分枝。
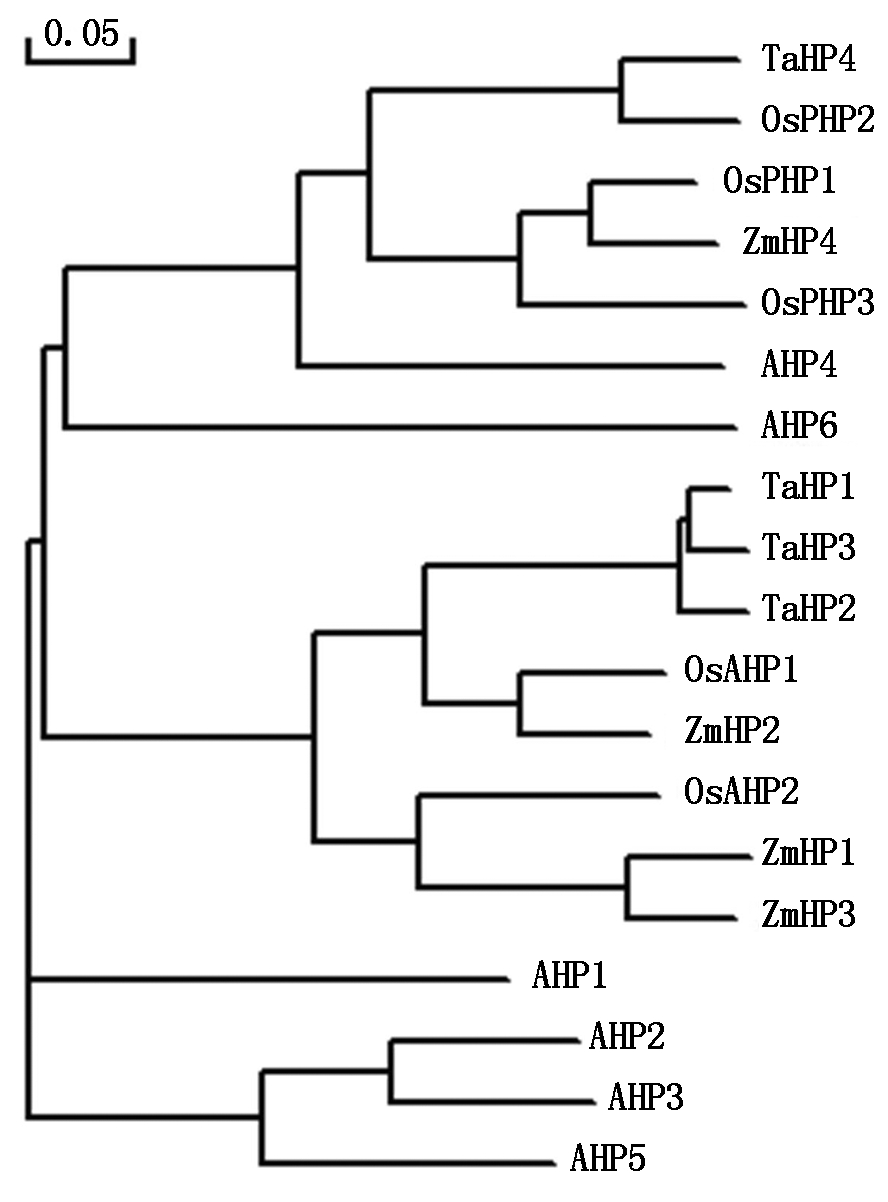
图3 小麦TaHP4与其他HP蛋白的系统进化树分析
Fig.3 Phylogenetic tree of TaHP4 and other HP proteins
2.3 TaHP4基因的表达特性
为了解TaHP4基因在小麦不同组织的表达特性,设计特异引物进行了荧光定量PCR检测。结果显示,TaHP4在根、茎、叶和穗中都有表达,但不同组织的表达水平存在显著差异(图4)。其中,叶中表达量最高,其次是穗和茎,而在根中的表达量最低。
为了进一步了解TaHP4在小麦各种胁迫下的表达特性,对小麦幼苗进行盐、干旱、脱落酸和细胞分裂素处理,并利用基因特异引物进行了荧光定量PCR检测。结果显示,盐(NaCl)和干旱(PEG)胁迫时,TaHP4表达量在1 h就明显降低,3 h达到最低值,之后表达量开始回升,但至处理24 h,表达量仍显著低于处理前水平(图5-A、B)。脱落酸(ABA)处理时,TaHP4表达量在1 h就降低至最低值,之后表达量持续维持在较低水平(图5-C)。细胞分裂素(BA)处理时,TaHP4表达量从1 h开始持续下降,至12 h降至最低水平,24 h仍保持在较低水平(图5-D)。
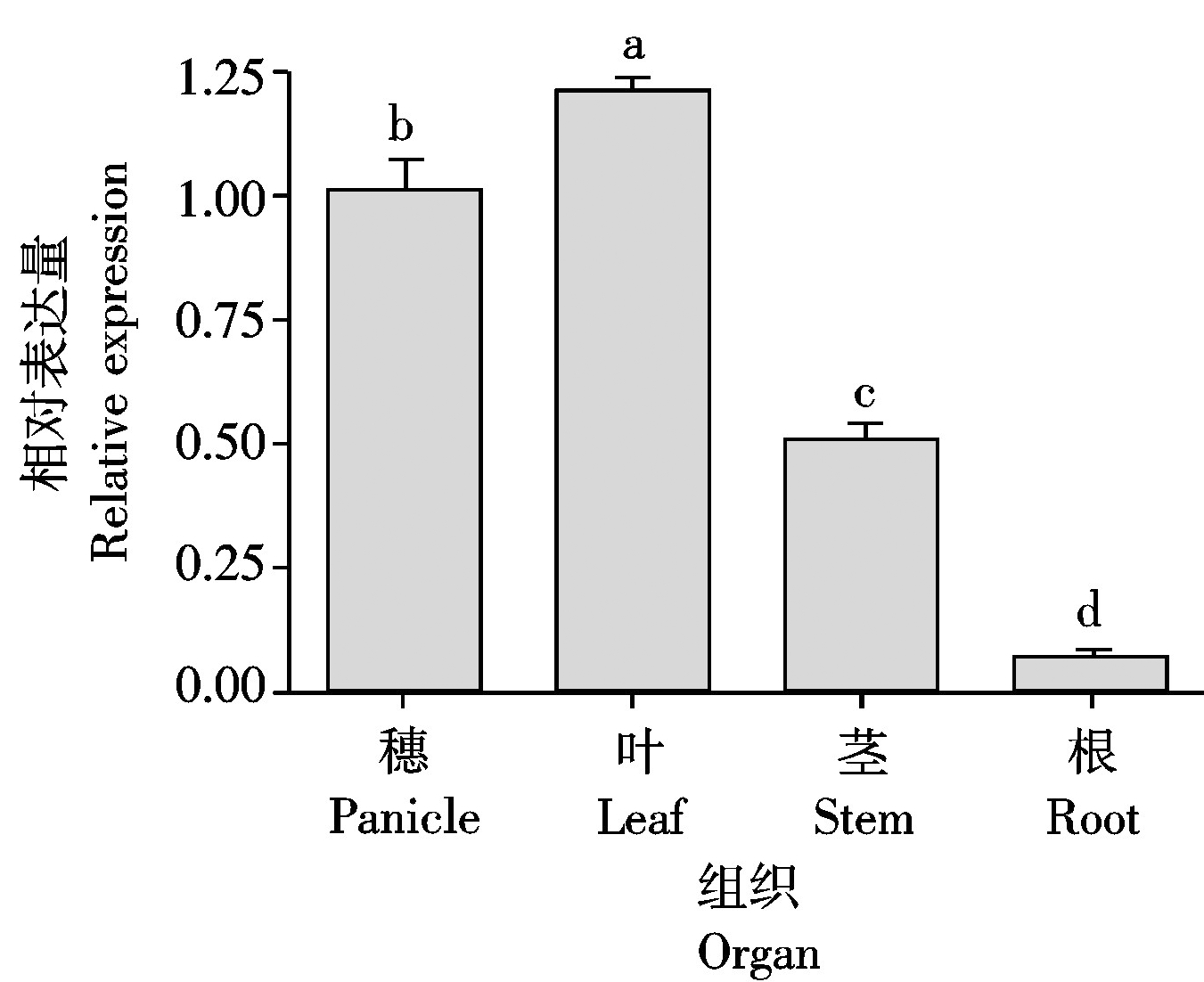
图柱上不同字母表示组织间在0.05水平上差异显著。图5同。Values followed by different letters are significantlydifferent at the 0.05 probability level.The same as Fig.5.
图4 TaHP4在小麦不同组织中的表达分析
Fig.4 Expression analysis of TaHP4 in different tissues of wheat
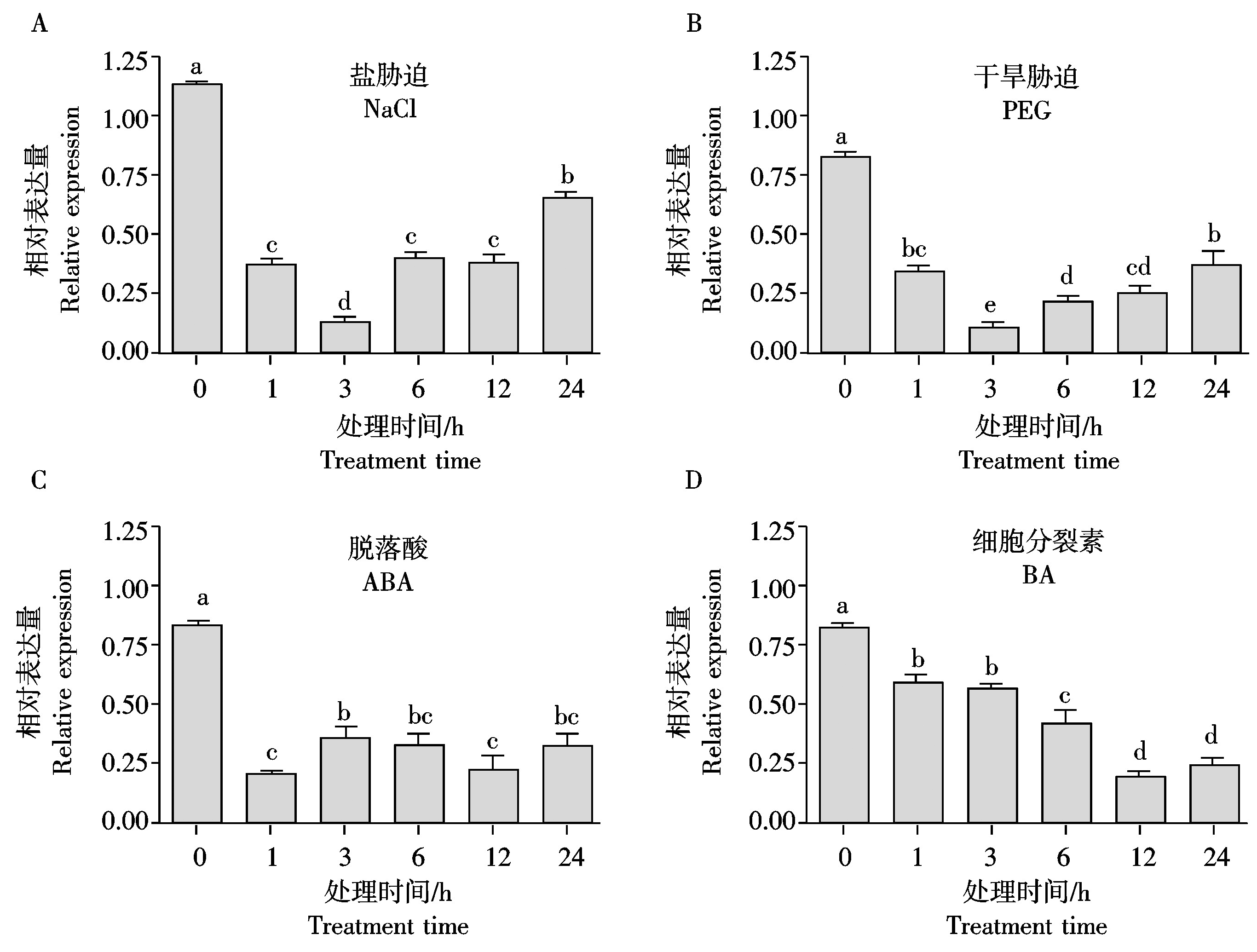
图5 TaHP4在各种胁迫处理下的相对表达量
Fig.5 Relative expression of TaHP4 under various treatments
总之,TaHP4基因的表达受盐、干旱、脱落酸和细胞分裂素抑制表达,可能在小麦抵御非生物胁迫的过程中具有重要作用。
3 讨论与结论
为了克隆小麦细胞分裂素信号转导途径中的组氨酸磷酸转运蛋白基因,并研究其表达特性,本研究通过电子克隆结合RT-PCR的方法,得到一个小麦HP基因TaHP4。生物信息学分析显示,该基因ORF长456 bp,编码的蛋白长度为151个氨基酸,具有一个HPt结构域和一个负责磷酸基团传递的保守的His位点;蛋白序列同源比对分析显示,TaHP4与小麦中已经克隆的3个HP的同源性只有32.2%~34.2%,表明TaHP4是一个新的小麦HP基因。然而,系统进化树分析显示,TaHP4与水稻、玉米和拟南芥中不含保守His位点的OsPHP1、OsPHP2、OsPHP3、ZmHP4、AHP6位于同一个进化分枝,而与小麦中前期已经克隆的TaHP1、TaHP2、TaHP3位于不同的进化分枝,暗示其在小麦细胞分裂素信号转导途径中可能发挥着独特的作用。
不同的组氨酸磷酸转运蛋白基因有不同的组织表达模式。一些HP基因在不同组织组成型表达,如玉米中的ZmHP2[27]。另一些HP基因具有特异的组织表达模式,如拟南芥中的AHP1、AHP2和AHP3基因主要在根中表达,在叶片和茎中的表达量则很低[28];小麦中的TaHP1在地上部的表达量很高,而在根中则几乎不表达[26]。本研究中的TaHP4基因表达模式与TaHP1类似,在叶、穗、茎等地上部表达量较高,而在根中表达量则很低。
拟南芥中的研究表明,细胞分裂素负调控着植物应对盐、干旱等非生物胁迫的过程,降低植物体内细胞分裂素水平或减弱细胞分裂素信号转导通路均能够提高植物对盐、干旱等非生物胁迫的耐受性[29-34]。拟南芥中组氨酸磷酸转运蛋白基因AHP2、 AHP3和AHP5均受盐、干旱和ABA抑制表达,其三重突变体ahp2,3,5对盐和干旱的耐受性也显著高于野生型对照[25]。然而,水稻中组氨酸磷酸转运蛋白在盐和干旱胁迫中却发挥着不同的功能。OsAHP1和OsAHP2受干旱抑制表达,其RNAi植株对干旱的耐受性也显著高于野生型对照;相反,OsAHP1受盐诱导表达,其RNAi植株对盐的耐受性也显著低于野生型对照[35]。本研究中的TaHP4基因与拟南芥中AHP2、AHP3和AHP5类似,受盐、干旱和ABA抑制表达,表明其参与了小麦响应上述3种逆境胁迫的生物学过程,但其具体功能还需要更多分子遗传学的证据。
参考文献:
[1] Mok D W,Mok M C. Cytokinin metabolism and action[J]. Annual Review of Plant Physiology and Plant Molecular Biology,2001,52:89-118.
[2] Mizuno T. Plant response regulators implicated in signal transduction and circadian rhythm[J]. Current Opinion in Plant Biology,2004,7(5):499-505.
[3] Ferreira F J,Kieber J J. Cytokinin signaling[J]. Current Opinion in Plant Biology,2005,8(5):518-525.
[4] Yamburenko M V,Kieber J J,Schaller G E. Dynamic patterns of expression for genes regulating cytokinin metabolism and signaling during rice inflorescence development[J]. PLoS One,2017,12(4):e0176060.
[5] Geng J,Li L Q,Lv Q,et al. TaGW2-6A allelic variation contributes to grain size possibly by regulating the expression of cytokinins and starch-related genes in wheat[J]. Planta,2017,246(6):1153-1163.
[6] Zheng C F,Zhu Y J,Wang C Y,et al. Wheat grain yield increase in response to Pre-Anthesis foliar application of 6-Benzylaminopurine is dependent on floret development[J]. PLoS One,2016,11(6):e0156627.
[7] Wang W Q,Hao Q Q,Tian F X,et al. The stay-green phenotype of wheat mutant tasg1 is associated with altered cytokinin metabolism[J]. Plant Cell Reports,2016,35(3):585-599.
[8] Talla S K,Panigrahy M,Kappara S,et al. Cytokinin delays dark-induced senescence in rice by maintaining the chlorophyll cycle and photosynthetic complexes[J]. Journal of Experimental Botany,2016,67(6):1839-1851.
[9] Lu J,Chang C,Zhang H P,et al. Identification of a novel allele of TaCKX6a02 associated with grain size,filling rate and weight of common wheat[J]. PLoS One,2015,10(12):e0144765.
[10] Havlova M,Dobrev P I,Motyka V,et al. The role of cytokinins in responses to water deficit in tobacco plants over-expressing trans-zeatin O-glucosyltransferase gene under 35S or SAG12 promoters[J]. Plant,Cell & Environment,2008,31(3):341-353.
[11] Ha S,Vankova R,Yamaguchi-Shinozaki K A,et al. Cytokinins:metabolism and function in plant adaptation to environmental stresses[J]. Trends in Plant Science,2012,17(3):172-179.
[12] Verslues P E. ABA and cytokinins:challenge and opportunity for plant stress research[J]. Plant Molecular Biology,2016,91(6):629-640.
[13] Xu Y,Burgess P,Huang B R. Transcriptional regulation of hormone-synthesis and signaling pathways by overexpressing cytokinin-synthesis contributes to improved drought tolerance in creeping bentgrass[J]. Physiologia Plantarum,2017,161(2):235-256.
[14] Vojta P,Kokas F,Husickova A,et al. Whole transcriptome analysis of transgenic barley with altered cytokinin homeostasis and increased tolerance to drought stress[J]. New Biotechnology,2016,33(5,B):676-691.
[15] Li W,Herrera-Estrella L,Tran L S. The Yin-Yang of cytokinin homeostasis and drought acclimation/adaptation[J]. Trends in Plant Science,2016,21(7):548-550.
[16] Avalbaev A,Yuldashev R,Fedorova K,et al. Exogenous methyl jasmonate regulates cytokinin content by modulating cytokinin oxidase activity in wheat seedlings under salinity[J]. Journal of Plant Physiology,2016,191:101-110.
[17] Hwang I,Sheen J. Two-component circuitry in Arabidopsis cytokinin signal transduction[J]. Nature,2001,413(6854):383-389.
[18] Hutchison C E,Kieber J J. Cytokinin signaling in Arabidopsis[J]. The Plant Cell,2002,14(S):47-59.
[19] Heyl A,Schmulling T. Cytokinin signal perception and transduction[J]. Current Opinion in Plant Biology,2003,6(5):480-488.
[20] Kakimoto T. Perception and signal transduction of cytokinins[J]. Annual Review of Plant Biology,2003,54:605-627.
[21] Hutchison C E,Li J,Argueso C,et al. The Arabidopsis histidine phosphotransfer proteins are redundant positive regulators of cytokinin signaling[J]. The Plant Cell,2006,18(11):3073-3087.
[22] Mahonen A P,Bishopp A,Higuchi M,et al. Cytokinin signaling and its inhibitor AHP6 regulate cell fate during vascular development[J]. Science,2006,311(5757):94-98.
[23] Du L M,Jiao F C,Chu J,et al. The two-component signal system in rice (Oryza sativa L.):A genome-wide study of cytokinin signal perception and transduction[J]. Genomics,2007,89(6):697-707.
[24] Schaller G E,Doi K,Hwang I,et al. Nomenclature for two-component signaling elements of rice[J]. Plant Physiology,2007,143(2):555-557.
[25] Nishiyama R,Watanabe Y,Leyva-Gonzalez M A,et al. Arabidopsis AHP2,AHP3,and AHP5 histidine phosphotransfer proteins function as redundant negative regulators of drought stress response[J]. Proceedings of the National Academy of Sciences of the United States of America,2013,110(12):4840-4845.
[26] Ma Q H,Tian B. Characterization of a wheat histidine-containing phosphotransfer protein (HP) that is regulated by cytokinin-mediated inhibition of leaf senescence[J]. Plant Science,2005,168(6):1507-1514.
[27] Sakakibara H,Hayakawa A,Deji A,et al. His-Asp phosphotransfer possibly involved in the nitrogen signal transduction mediated by cytokinin in maize:molecular cloning of cDNAs for two-component regulatory factors and demonstration of phosphotransfer activity in vitro[J]. Plant Molecular Biology,1999,41(4):563-573.
[28] Miyata S,Urao T,Yamaguchi-Shinozaki K,et al. Characterization of genes for two-component phosphorelay mediators with a single HPt domain in Arabidopsis thaliana[J]. FEBS Letters,1998,437(1/2):11-14.
[29] Nguyen K H,Chien V H,Nishiyama R,et al. Arabidopsis type B cytokinin response regulators ARR1,ARR10,and ARR12 negatively regulate plant responses to drought[J]. Proceedings of the National Academy of Sciences of the United States of America,2016,113(11):3090-3095.
[30] Nishiyama R,Watanabe Y,Fujita Y,et al. Analysis of cytokinin mutants and regulation of cytokinin metabolic genes reveals important regulatory roles of cytokinins in drought,salt and abscisic acid responses,and abscisic acid biosynthesis[J]. The Plant Cell,2011,23(6):2169-2183.
[31] Tran L S,Urao T,Qin F,et al. Functional analysis of AHK1/ATHK1 and cytokinin receptor histidine kinases in response to abscisic acid,drought,and salt stress in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(51):20623-20628.
[32] Kang Y N,Cho C,Kim N Y,et al. Cytokinin receptor-dependent and receptor-independent pathways in the dehydration response of Arabidopsis thaliana[J]. Journal of Plant Physiology,2012,169(14):1382-1391.
[33] Pospisilova H,Jiskrova E,Vojta P,et al. Transgenic barley overexpressing a cytokinin dehydrogenase gene shows greater tolerance to drought stress[J]. New Biotechnology,2016,33(5,B):692-705.
[34] Kumar M N,Verslues P E. Stress physiology functions of the Arabidopsis histidine kinase cytokinin receptors[J]. Physiologia Plantarum,2015,154(3):369-380.
[35] Sun L J,Zhang Q,Wu J X,et al. Two rice authentic histidine phosphotransfer proteins,OsAHP1 and OsAHP2,mediate cytokinin signaling and stress responses in rice[J]. Plant Physiology,2014,165(1):335-345.