抗菌肽是生物体内一种具有抗菌活性的小分子物质,最早发现的抗菌肽是天蚕素,由瑞典科学家Baman等[1]于1972年从惜古比天蚕(Hyatophora cecropin)中发现。研究发现,抗菌肽对细菌、病毒、真菌和原虫也都具有抑制杀伤作用[2-3]。目前,在家蚕(Bombyx mori,Bm)中已有40余种抗菌肽基因被发现[4],通过比对序列的相似性,将其分为7个家族:Cecropin、Attacin、Moricin、Gloverin、Lebocin、Enbocin及Defensin家族[5],孙伟等[6]将家蚕抗菌肽类型分为3类:富含甘氨酸或脯氨酸类抗菌肽、两亲性具有α-螺旋结构的线性抗菌肽和富含半胱氨酸类抗菌肽。Yang等[7]通过抑菌活性检测发现,BmCecropinB6、BmCecropinD和Bmmoricin具有极强广谱的抗菌性,能够杀灭大多数的革兰氏阳性和革兰氏阴性细菌及真菌,预示这些家蚕抗菌肽具有广泛的应用前景。
自诱导蛋白质表达系统(Auto-induction protein expression system)由Studier[8]于2005年提出,该系统利用乳糖培养基替代IPTG(异丙基-β-D-硫代吡喃半乳糖苷)表达外源蛋白[9-10],具有毒性低、表达量高等特点。本研究在此基础上对BmCecropin、BmCecropinB6、BmCecropinD和Bmmoricin 这4种家蚕的抗菌肽基因进行RT-PCR扩增,构建了pET32a-BmCecropin、pET32a-BmCecropinB6、pET32a-BmCecropin和pET32a-Bmmoricin原核表达载体,并采用自诱导表达系统表达上述4种家蚕抗菌肽重组蛋白,对表达的重组蛋白进行Ni-NTA亲和纯化和超滤纯化,旨在为家蚕抗菌肽进一步的抑菌活性测定和应用家蚕抗菌肽奠定基础。
1 材料和方法
1.1 试验材料
家蚕(青松×皓月)由蒙自家蚕养殖户提供。质粒小量提取试剂盒、DNA胶回收试剂盒为Axygen公司产品, RNAiso Plus购自宝生物工程(大连)有限公司,T4 DNA连接酶、限制性核酸内切酶均购自Fermentas公司,DL2000 DNA Marker、RT-PCR试剂盒购自生工生物工程(上海)股份有限公司,高分子量预染蛋白Marker购自Thermo Scientific公司。
50×M:称取17.75 g Na2HPO4,17 g KH2PO4,13.4 g NH4Cl,3.55 g Na2SO4,加水溶解,调节pH值至6.7,定容至100 mL,在1.034×105 Pa高压下蒸汽灭菌20 min,4 ℃保存。
50×5052:称取25 g甘油,2.5 g葡萄糖,10 g乳糖定容至100 mL,高压灭菌后4 ℃保存。
1000×微量金属:称取0.222 g CaCl2,0.198 g MnCl2,0.288 g ZnSO4,0.047 NiCl2,0.048 4 g NaMoO4,0.012 g H3BO3,加水定容至50 mL,高压灭菌后4 ℃保存。
0.1 mol/L MgSO4:称取2.465 g MgSO4·7H2O加水定容至100 mL,高压灭菌后4 ℃保存。
1% ZY:称取1 g胰蛋白胨,0.5 g酵母提取物加水定容至50 mL,高压灭菌后4 ℃保存。
ZYM-5052:量取2 mL 50×M ,2 mL 50×5052,2 mL 0.1 mol/L MgSO4,20 μL 1000×微量金属,50 mL 1% ZY,加灭菌水定容至100 mL。
1.2 引物设计
根据GenBank公布的BmCecropin(XM_004926048)、BmCecropinB6(S60579)、BmCecropinD(NM_001043368.2)、Bmmoricin(AB006915)的mRNA序列,应用Primer Primer 5.0引物设计软件设计4对特异性引物如下:BmCecropin引物:F:5 ′-AATGGATCCATGAATTTCGCAAAGATCCTAT-3 ′,R:5′-AATAAGCTTTCATTTTCCTATAGCTTTAGCC-3′;BmCecropinB6引物:F:5′-CATGCCATGGTTAGGTGGAAGATCTTCAAG-3′,R:5′-GACCCTCGAGTCAGATAGCTTTAGCCGAACCAAGG-3′;BmCecropinD引物:F:5′-CAGTCCATGGGCAACTTCTTCAAGGATC-3′,R:5′-CCGCTCGAGTCATTGTCCGAGAGCTTTTGCTTTTG-3′;Bmmoripin引物:F:5′-CATGCCATGGCAAAAATACCTATCAAGGCCATTAAGACTGTAGGAAAGGCAGTCGGTA-3′,R:5′-CCGCTCGAGTCAATGCTTTCTTTTCTTCGGTTTCAAGAAATTGAAAACATC-3′。
下划线部分为限制性内切酶识别位点,引物由生工生物工程(上海)股份有限公司合成。
1.3 总RNA提取及RT-PCR扩增
取五龄七天家蚕中肠组织,应用RNAiso Plus提取总RNA,方法参考《分子克隆实验指南》[11]。应用宝生物工程(大连)有限公司的PrimeScriptTMOne Step RT-PCR Kit,分别加入合成4种抗菌肽基因的特异性引物,RT-PCR扩增出4种抗菌肽基因,2%琼脂糖凝胶电泳检测扩增结果。
1.4 表达载体的连接、转化及鉴定
DNA凝胶回收试剂盒回收PCR扩增产物,用NcoⅠ/XhoⅠ分别双酶切BmCecropinB6、BmCecropinD、Bmmoricin基因和pET32a载体,用BamHⅠ/Hind Ⅲ分别双酶切BmCecropin基因和pET32a载体,构建pET32a-BmCecropinD、pET32a-BmCecropinB6、pET32a-BmCecropin和pET32a-Bmmoricin原核表达载体,连接,转化,酶切鉴定,PCR鉴定等参考《分子克隆实验指南》[11]。
1.5 重组蛋白的自IPTG诱导表达
构建的重组质粒转化BL21感受态细胞,加入终浓度为0.1 mmol/L的IPTG诱导表达重组蛋白,分别收集诱导0~6 h菌液,SDS-PAGE电泳检测重组蛋白表达情况。
1.6 重组蛋白的自诱导表达
按照Studier[8]的方法进行自诱导表达研究。挑取含有重组质粒的单菌落,接种到4 mL含有100 μg/mL Amp的LB培养基中,37 ℃ 、220 r/min培养过夜,再按1% 的接种量接种到10 mL含有100 μg/mL Amp的ZYM-5052 培养基中,37 ℃ 、220 r/min培养18 h,收集菌液,与IPTG诱导的菌液进行SDS-PAGE电泳分析,比较二者重组蛋白表达产率的差异。
1.7 重组蛋白的纯化
应用GE公司的GE healthcare Ni-NTA亲和层析试剂盒纯化重组蛋白,并用10 ku超滤管进行超滤浓缩,BCA蛋白定量试剂盒测定重组蛋白浓度,真空冷冻干燥得到重组抗菌肽粉末。
2 结果与分析
2.1 家蚕抗菌肽基因的RT-PCR扩增
以五龄七天(5L7D)时期家蚕的中肠组织总RNA为模板,通过RT-PCR技术扩增家蚕BmCecropin、BmCecropinB6、BmCecropinD、Bmmoricin 这4条抗菌肽基因,结果显示,4条抗菌肽基因大小约为198,108,105,129 bp,与预期结果一致(图1)。
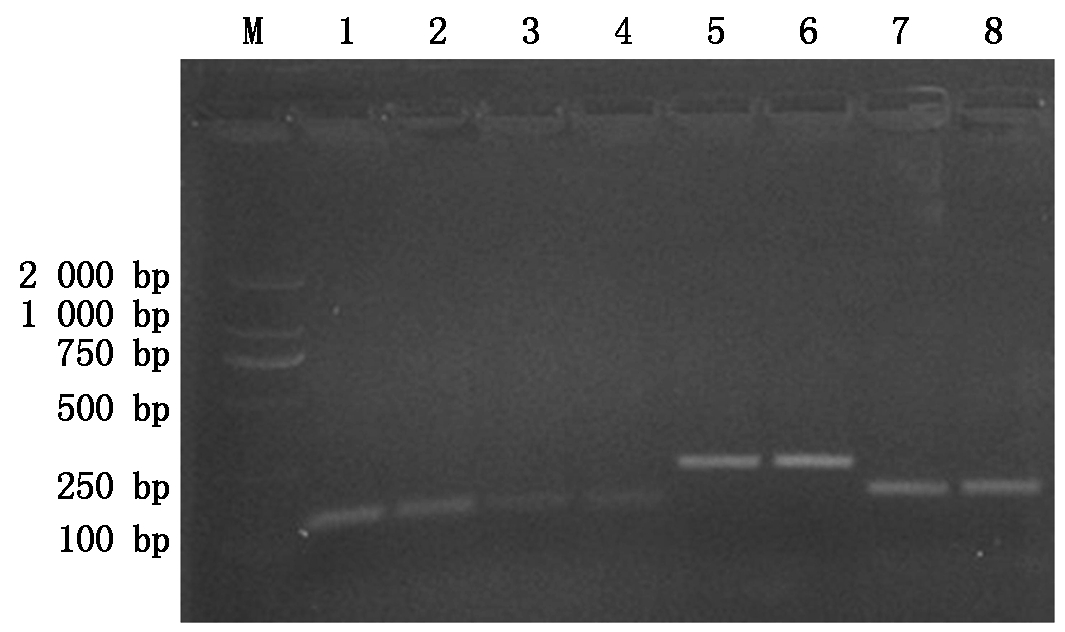
M.DL2000 Marker;1,2.BmCecropinD的RT-PCR扩增结果;3,4.BmCecropinB6的RT-PCR扩增结果;5,6.BmCecropin的RT-PCR扩增结果;7,8.Bmmoricin的RT-PCR扩增结果。
M.DL2000 DNA Marker;1,2.The RT-PCR amplification of BmCecropinD;3,4.The RT-PCR amplification of BmCecropinB6;5,6.The RT-PCR amplification of BmCecropin;7,8.The RT-PCR amplification of Bmmoricin.
图1 家蚕抗菌肽基因的RT-PCR扩增
Fig.1 The RT-PCR amplification of antibacterial peptide genes from silkworm
2.2 重组表达载体的构建
分别将4种抗菌肽基因与pET32a原核表达载体连接,构建pET32a-BmCecropin、pET32a-BmCecropinB6、pET32a-BmCecropinD和pET32a-Bmmoricin原核表达载体,阳性重组质粒分别经PCR鉴定,鉴定结果如图2,3所示。
2.3 抗菌肽的自诱导表达
4种抗菌肽经自诱导表达后,SDS-PAGE检测显示,BmCecropin、BmCecropinB6、BmCecropinD、Bmmoricin重组蛋白表达。结果表明,BmCecropin、BmCecropinB6、BmCecropinD、Bmmoricin经自诱导后均有高效表达,表达的4种抗菌肽重组蛋白大小分别为24,21,20,22 ku,自诱导表达产率明显高于IPTG诱导组(图4-7)。
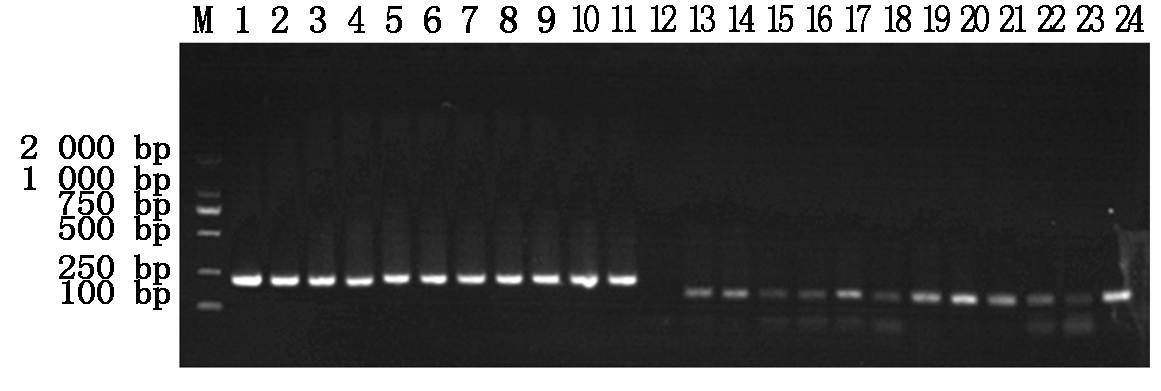
M.DL2000 DNA Marker;1~11.pET32a-BmCecropin重组质粒的PCR鉴定;13~24.pET32a-Bmmoricin重组质粒的PCR鉴定。
M.DL2000 DNA Marker;1-11.The PCR identification of recombinant plasmids pET32a-BmCecropin;13-24.The PCR identification of recombinant plasmids pET32a-Bmmoricin
图2 pET32a-BmCecropin和pET32a-Bmmoricin重组质粒的PCR鉴定
Fig.2 The PCR identification of recombinant plasmids pET32a-BmCecropin and pET32a-Bmmoricin
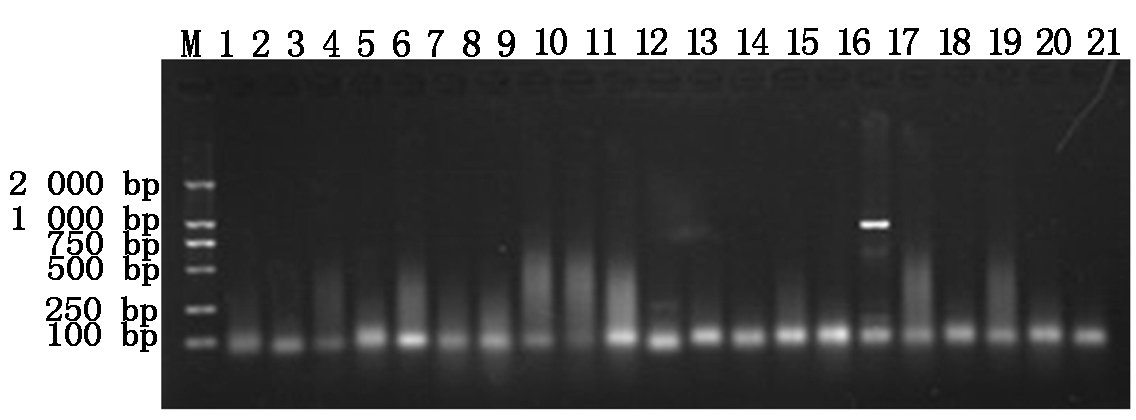
M.DL2000 DNA Marker;1~11.pET32a-BmCecropinB6重组质粒的PCR鉴定;12~21.pET32a-BmCecropinD重组质粒的PCR鉴定。
M.DL2000 DNA Marker;1-11.The PCR identification of recombinant plasmids pET32a-BmCecropinB6;12-21.The PCR identification of recombinant plasmids pET32a-BmCecropinD.
图3 pET32a-BmCecropinB6和pET32a-BmCecropinD重组质粒的PCR鉴定
Fig.3 The PCR identification of recombinant plasmids pET32a-BmCecropin B6 and pET32a-BmCecropinD
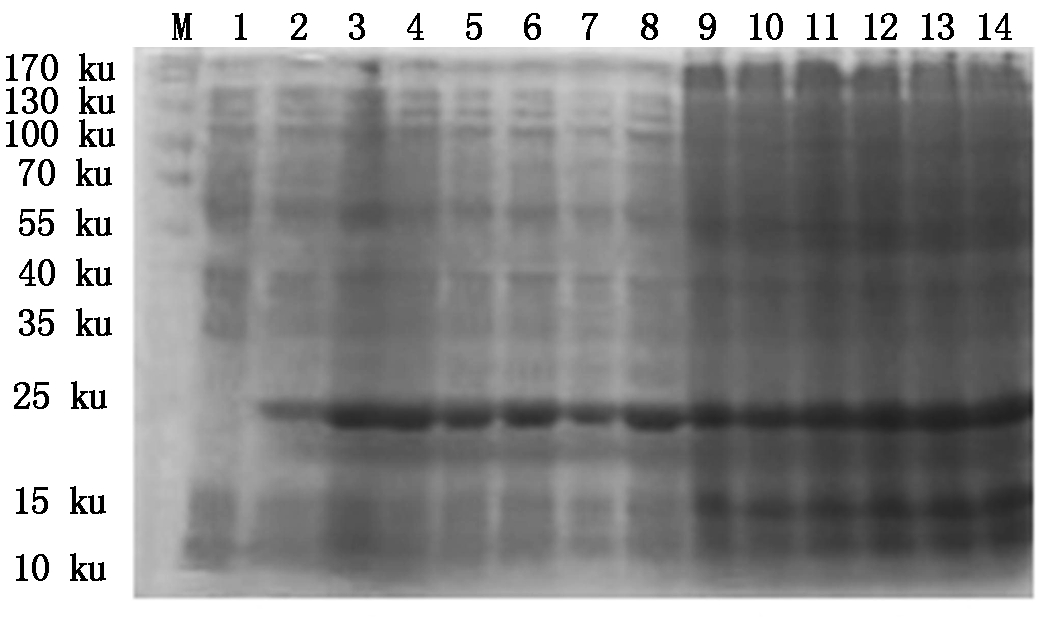
M.Protein Marker;1.含pET32a空质粒的菌液;2~8.IPTG分别诱导0,1,2,3,4,5,6 h重组菌株;9~14.自诱导12,14,16,18,20,22 h重组菌株。图5~7同。
M.Protein Marker;1.The bacteria include pET32a empty plasmid;2-8.Recombinant bacterium induced for 0,1,2,3,4,5 and 6 hours by IPTG,respectively;9-14.BmCecropin expression by auto-induction for 12,14,16,18,20,22 hours.The same as Fig.5-7.
图4 SDS-PAGE检测BmCecropin抗菌肽的表达
Fig.4 The expressing detecting of BmCecropin by SDS-PAGE
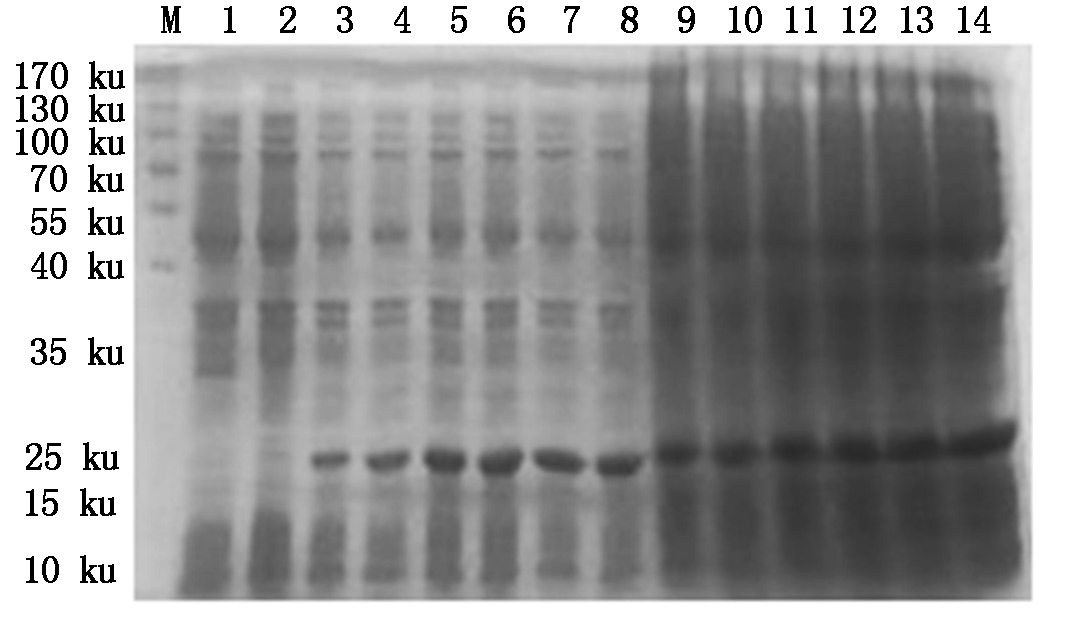
图5 SDS-PAGE检测BmCecropinB6抗菌肽的表达
Fig.5 The expressing detecting of BmCecropinB6 by SDS-PAGE
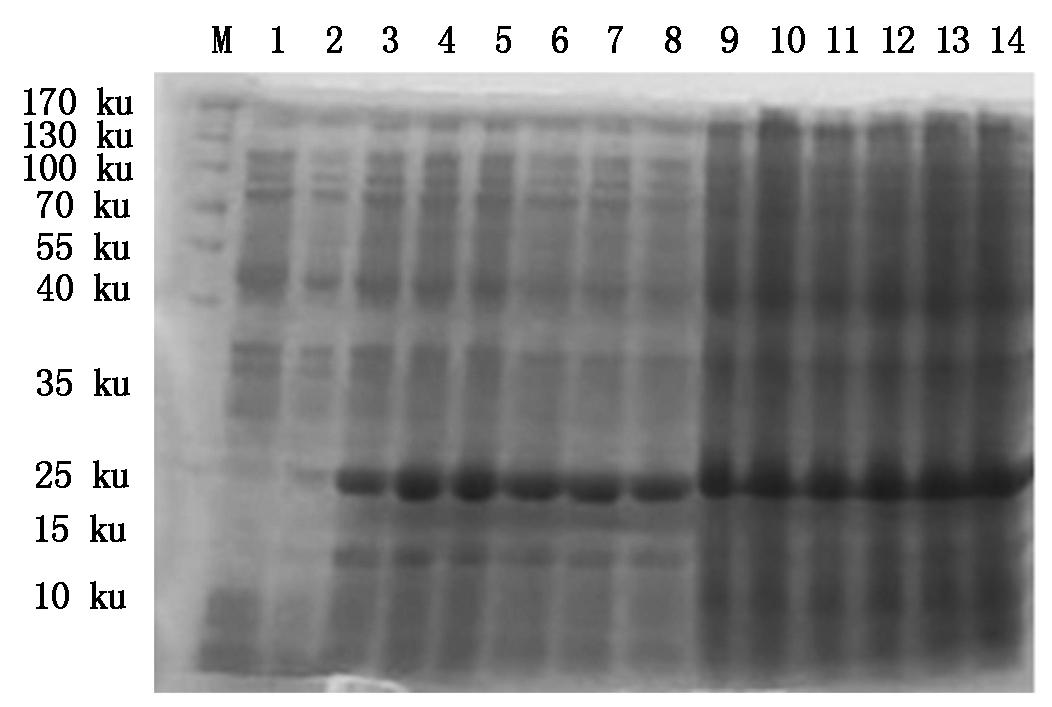
图6 SDS-PAGE检测BmCecropinD抗菌肽的表达
Fig.6 The expressing detecting of BmCecropinD by SDS-PAGE
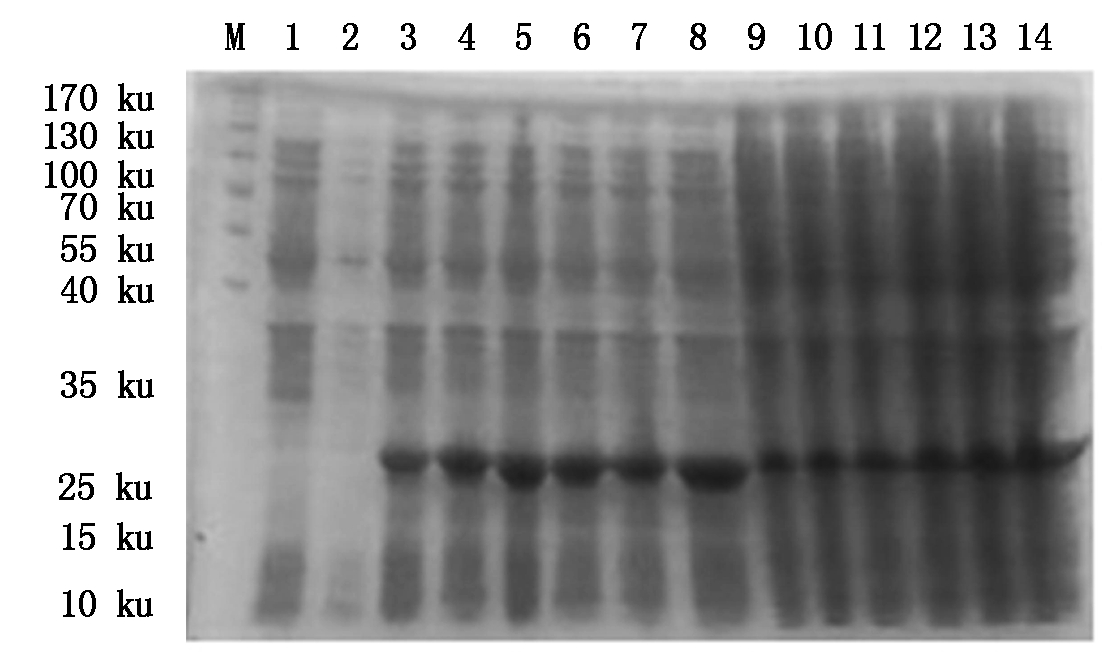
图7 SDS-PAGE检测Bmmoricin抗菌肽表达产率
Fig.7 The expressing detecting of Bmmoricin by SDS-PAGE
2.4 抗菌肽的纯化
分别对pET32a-BmCecropin、pET32a-BmCecropinB6、pET32a-BmCecropinD和pET32a-Bmmoricin重组蛋白进行Ni-NTA亲和纯化,Sephadex G-10柱分子筛凝胶脱盐和30 ku的超滤管进行超滤浓缩,然后真空干燥。结果如图8-11所示。结果表明,已获得比较纯的浓缩BmCecropin、BmCecropinB6、BmCecropinD、Bmmoricin重组抗菌肽样品,可以下一步用作抑菌活性研究。
3 讨论
昆虫抗菌肽具有分子量小、热稳定、水溶性好、无免疫原、广谱抗菌等特点,可以抑杀细菌、真菌、病毒及原虫,而且对多种癌细胞及动物实体瘤有明显的杀伤作用而不破坏高等动物的正常细胞。到目前为止,已从绝大多数生物如水稻[12]、人[13-15]、蜜蜂[16]、蛇[17]、蜈蚣[18]、蚯蚓[19]中获得上千种抗菌肽,在多种昆虫中分离或鉴定出超过200种抗菌肽。BmCecropin、BmCecropinB6、BmCecropinD和Bmmoricin 这4种抗菌肽是家蚕体内抑菌活性最强的抗菌肽,能抑制大肠杆菌、沙门氏菌、葡萄球菌、链球菌、枯草芽孢杆菌、蜡样芽孢杆菌、酵母菌、青霉菌、放线菌、毛霉菌、曲霉菌等常见细菌和真菌的生长,显示其在防腐剂、化妆品和饲料添加剂等方面有广泛的应用前景[7]。本研究通过RT-PCR技术从家蚕中场组织中扩增上述4种家蚕抗菌肽基因,构建原核表达载体,通过自诱导表达系统表达4种抗菌肽重组蛋白,Ni-NTA亲和纯化重组蛋白,为4种家蚕抗菌肽的应用奠定基础。
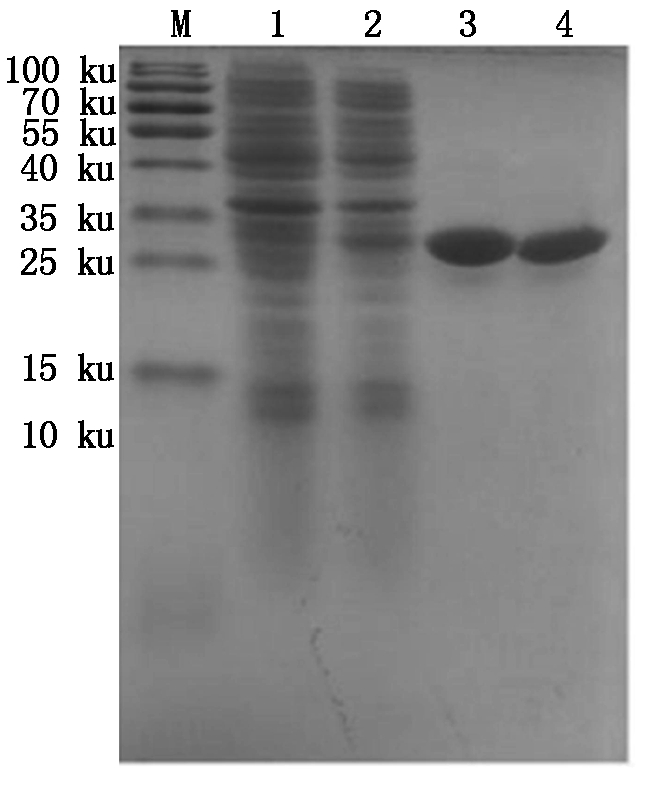
M.Protein Marker;1.空质粒菌液;2.IPTG诱导5 h重组菌株;3~4.30 ku超滤浓缩后的BmCecropin重组抗菌肽。
M.Protein Marker;1.The bacteria include pET32a empty plasmid;2.Recombinant bacterium induced for 5 hours by IPTG;3-4.Recombinant antibacterial peptide BmCecropin by 30 ku ultrafiltrations.
图8 30 ku超滤管超滤浓缩后的BmCecropin重组抗菌肽纯品
Fig.8 The purified recombinant antibacterial peptide BmCecropin by 30 ku ultrafiltrations
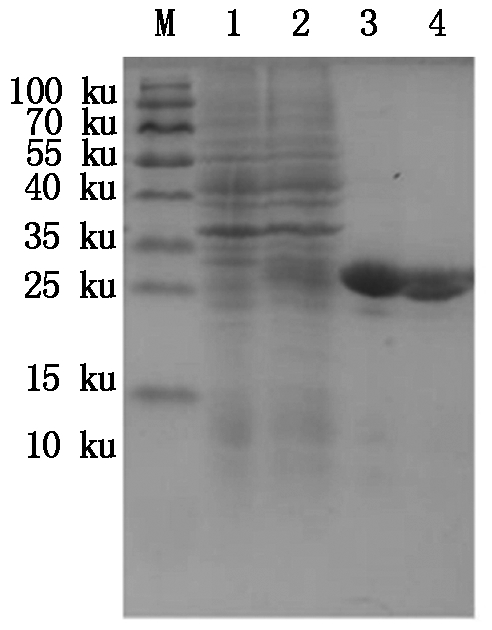
M.Protein Marker;1.空质粒菌液;2.IPTG诱导5 h重组菌株;3~4.30 ku超滤浓缩后的BmCecropinB6重组抗菌肽。
M.Protein Marker;1.The bacteria include pET32a empty plasmid;2.Recombinant bacterium induced for 5 hours by IPTG;3-4.Recombinant antibacterial peptide BmCecropinB6 by 30 ku ultrafiltrations.
图9 30 ku超滤管超滤浓缩后的BmCecropinB6重组抗菌肽纯品
Fig.9 The purified recombinant antibacterial peptide BmCecropinB6 by 30 ku ultrafiltrations
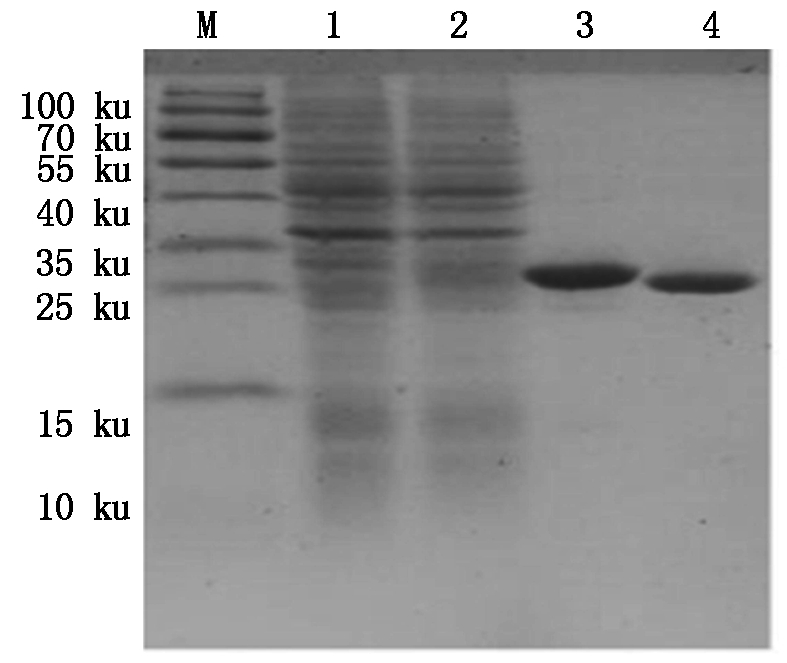
M.Protein Marker;1.空质粒菌液;2.IPTG诱导5 h重组菌株;3~4.30 ku超滤浓缩后的BmCecropinD重组抗菌肽。
M.Protein Marker;1.The bacteria include pET32a empty plasmid;2.Recombinant bacterium induced for 5 hours by IPTG;3-4.Recombinant antibacterial peptide BmCecropinD by 30 ku ultrafiltrations.
图10 30 ku超滤管超滤浓缩后的BmCecropinD重组抗菌肽纯品
Fig.10 The purified recombinant antibacterial peptide BmCecropinD by 30 ku ultrafiltrations
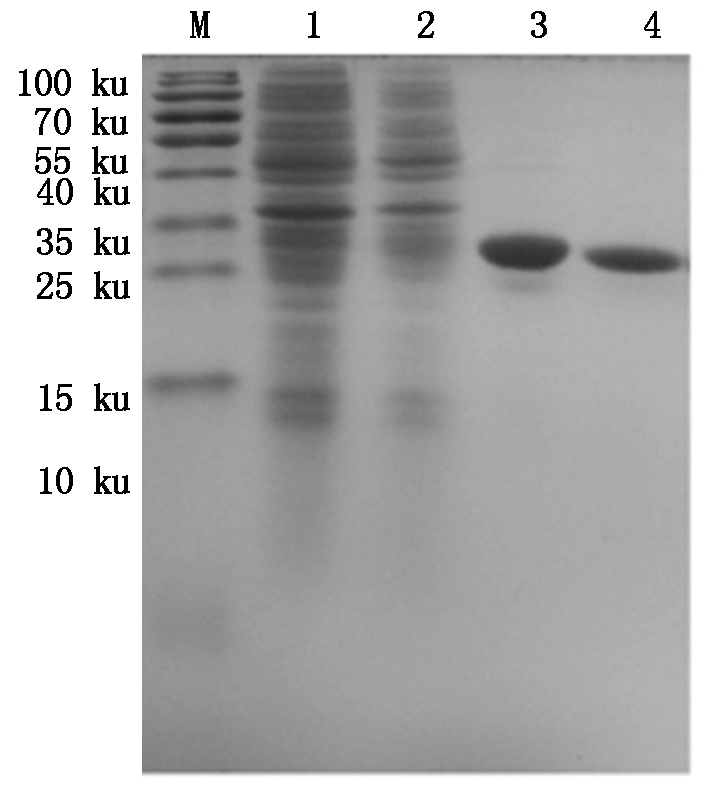
M.Protein Marker;1.空质粒菌液;2.IPTG诱导5 h重组菌株;3~4.30 ku超滤浓缩后的Bmmoricin重组抗菌肽。
M.Protein Marker;1.The bacteria include pET32a empty plasmid;2.Recombinant bacterium induced for 5 hours by IPTG;3-4.Recombinant antibacterial peptide Bmmoricin by 30 ku ultrafiltrations.
图11 30 ku超滤管超滤浓缩后的Bmmoricin重组抗菌肽纯品
Fig.11 The purified recombinant antibacterial peptide Bmmoricin by 30 ku ultrafiltrations
自诱导表达系统于2005年由Studier发现,该系统通过乳糖培养基替代IPTG,当培养基中葡萄糖耗尽后,乳糖才被利用,目的蛋白开始表达[20-23]。自诱导表达系统的优点是毒性低,外源蛋白表达量高。从本研究结果可以看出,通过自诱导表达系统表达的4种抗菌肽重组蛋白表达量明显高于IPTG诱导组。与天然来源和化学合成生产抗菌肽相比,大肠杆菌融合表达的独特优势使其成为大规模生产抗菌肽最具成本效益的方式,硫氧还蛋白是融合表达生产抗菌肽使用最多的载体蛋白,在适宜条件下可以获得大量的可溶性融合蛋白,分子量小、高度的溶解性等优良性能使其特别适用于抗菌肽的生产[24-25]。pET载体系统被证明是一种能高效表达可溶性重组蛋白的载体蛋白,其具有高度的特异性和稳定性。在外源基因的原核表达中具有广泛的应用价值[26-27]。本研究结果为后续家蚕抗菌肽的进一步应用奠定了基础。
参考文献:
[1] Baman H G, Nilsson I, Rasmuson B. Inducible antibactercial denfense system in Drosophila[J]. Nature,1972,237:232-235.
[2] Lakshmaiah N J, Chen J Y. Antimicrobial peptides: Possible anti-infective agents[J]. Peptides, 2015, 72(10): 88-94.
[3] Sancho-Vaello E, Zeth K. Antimicrobial peptides: has their time arrived?[J]. Future Microbiol, 2015, 10(7):1103-1106.
[4] Ezzati-Tabrizi R, Farrokhi N, Talaei-Hassanloui R, et al. Insect inducible antimicrobial peptides and their applications[J]. Curr Protein Pept Sci, 2013, 14(8):698-710.
[5] Cheng T, Zhao P, Liu C, et al. Structures, regulatory regions, and inductive expression patterns of antimicrobial peptide gens in the silkworm Bombyx mori[J]. Genomies, 2006, 87(3): 356-365.
[6] 孙 伟,沈以红,向仲杯,等.家蚕抗菌肽基因研究进展[J].蚕业科学,2009,35(1):196-203.
[7] Yang W,Cheng T,Ye M,et al.Functional divergence among silkworm antimicrobial peptide paralogs by the activities of recombinant proteins and the induced expression profiles[J].PLoS One,2011,6(3):e18109.
[8] Studier F W.Protein production by auto-induction in high density shaking cultures[J].Protein Expression and Purification,2005,41(1):207-234.
[9] Studier F W. Stable expression clones and auto-induction for protein production in E.coli[J]. Methods Mol Biol, 2014, 1091:17-32.
[10] EL-Baky N A, Linjawi M H, Redwan E M. Auto-induction expression of human consensus interferon-alpha in Escherichia coli[J]. BMC Biotechnol, 2015,15:14.
[11] J 萨姆布鲁克,拉塞尔.分子克隆实验指南[M].4版.黄培堂,等译.北京:科学出版社,2016.
[12] Taniguchi M,Ochiai A,Takahashi K,et al.Antimicrobial activity against Porphyromonas gingivalis and mechanism of action of the cationic octadecapeptide AmyI-1-18 and its amino acid-substituted analogs[J].Journal of Bioscience and Bioengineering,2016,122(6):652-659.
[13] Potturu M,Prabhakaran P A,Neetu O N,et al.Cathelicidin expression and role in oral health and diseases:A short review[J].Tropical Journal of Medical Research,2017,17(2):69-75.
[14] Benergossi J,Calixto G,Fonseca-Santos B,et al.Highlights in peptide nanoparticle carriers intended to oral diseases[J].Current Topics in Medicinal Chemistry,2015,15(4):345-355.
[15] Borovaya A,Dombrowski Y,Zwicker S,et al.Isotretinoin therapy changes the expression of antimicrobial peptides in acne vulgaris[J].Archives of Dermatological Research,2014,306(8):689-700.
[16] 王志涛,王俊刚,申 红.昆虫抗菌肽研究进展[J].新疆农垦科技,2015,6:36-38.
[17] 郝思怡,姚远航,郭土敬,等.金环蛇抗菌肽在毕赤酵母中的组成型表达[J].生物技术,2015,25(2):124-127.
[18] Yang S,Yang F,Wei N,et al.A pain-inducing centipede toxin targets the heat activation machinery of nociceptor TRPV1[J].Nature Communications,2015,6(3):8297.
[19] 李 娟,吴永胜,杨 雪. 蚯蚓抗菌肽研究进展[J]. 安徽农业科学, 2016,44(3): 62-63.
[20] 张彦明,刘美辰, 孙雨萱. 金黄色葡萄球菌蛋白A在大肠杆菌中的自诱导表达以及单克隆抗体的制备[J]. 粮食科技与经济, 2016, 41(4): 31-35.
[21] 王 昭,王 席,杨 威, 等. 金属硫蛋白基因MT1A在大肠杆菌中的自诱导表达条件优化及其抗镉性[J]. 河南农业科学, 2016, 45(4): 66-70.
[22] 彭 冬,杨 威 王 昭, 等. GST-SUMO-MT 融合蛋白在大肠杆菌中的自诱导表达[J]. 生物技术通报, 2016, 32(2): 219-224.
[23] 陈 可,代 娟,甘春扬, 等. 通过自诱导方法对乙型肝炎病毒聚合酶TP区进行可溶性表达及鉴定[J]. 中国生物制品学杂志, 2017, 30(1):25-33.
[24] 章玉萍,牛晓利,曹玉桥,等.家蚕抗菌肽Cecropin D基因的原核表达,纯化及抑菌活性测定[J].中国蚕业,2012,32(4):20-23.
[25] 张学敏,金莉莉,王 铮,等.抗菌肽在大肠杆菌中的融合表达[J].生物工程学报,2014,30(8):1172-1181.
[26] Li Y.Recombinant production of antimicrobial peptides in Escherichia coli:a review[J].Protein Expression and Purification,2011,80(2):260-267.
[27] Aleinein R A,Hamoud R,Schäfer H,et al.Molecular cloning and expression of ranalexin,a bioactive antimicrobial peptide from Rana catesbeiana in Escherichia coli and assessments of its biological activities[J].Applied Microbiology and Biotechnology,2013,97(8):3535-3543.