机体免疫器官的发育状况直接反映出机体的免疫应答水平,家禽免疫器官(法氏囊、脾脏、胸腺等)的重量发育是评价家禽免疫力影响的重要指标[1]。脾脏作为重要的淋巴器官,也是机体最大的外周免疫器官,是产生致敏淋巴细胞和抗体的场所之一,同时具有造血、滤血、清除衰老细胞和微生物等功能。法氏囊是禽类特有的免疫器官,在70~80日龄时体积最大,以后逐渐消退,性成熟时消失。鸭胸腺有6~7叶,分布于颈静脉,多叶排列,成年后萎缩退化。家禽免疫器官发育不良,或者其他原因导致免疫抑制,家禽免疫抑制会增强机体对病毒、细菌以及寄生虫的易感性,对各种接种疫苗的反应能力下降,造成养殖业的巨大损失[2-3]。
TLRs是一类胚系编码的模式识别受体,通过识别病原微生物特有的分子,从而识别入侵的微生物,在机体固有免疫中发挥重要作用[4-7]。目前,在小鼠中发现的TLRs有12种,人类有10种[8]。家禽TLRs研究进展落后,禽类TLRs的研究基本集中于鸡上,鸭种中的研究仅近几年有增长趋势。禽类中,在鸡中发现的有10种,分别为TLR1La、TLR1Lb、TLR2A、TLR2B、TLR3、TLR4、TLR5、TLR7、TLR15、TLR21[9-10],在鸭中发现的为9种,包括TLR1A、TLR1B、TLR2A、TLR2B[11]、TLR3、TLR4、TLR5、TLR7、TLR15[12],未发现TLR21。其中TLR1、TLR2、TLR4、TLR5主要识别细菌[13],TLR3和TLR7主要识别病毒,TLR15和TLR21既可识别病毒又可识别细菌[14]。Muzio等[15]对TLRs在人类白细胞中表达的研究发现,TLR1能在包括单核细胞、多形核细胞、T、B淋巴细胞及NK细胞等多种细胞中表达,TLR2、TLR4、TLR5只在髓源性细胞(如单核巨噬细胞)上表达,而TLR3只特异性表达于树突状细胞(Dendritic cells,DC)。在对抗外来物质入侵的过程中,天然免疫发挥的作用显得尤为重要,被看作是机体的第一道防线,TLRs是其中重要一员;不同的TLRs,在不同组织部位的表达,可能发挥不同的功能,但其在发育进程中,在水禽中枢器官和外周免疫器官中的表达分析目前仍无研究报道,本研究对高邮鸭免疫器官发育进行测量,分析TLRs mRNA在高邮鸭免疫器官发育进程中的表达模式,可以为TLRs在鸭先天免疫和抗感染中的作用研究奠定基础。
1 材料和方法
1.1 主要试剂及仪器
2×PCR mix、PCR产物回收试剂盒、DNA纯化试剂盒、TRNzol-A+总RNA提取试剂、Quant cDNA 第一链合成试剂盒、SYBR Green SuperRealPreMix试剂盒购自天根生物科技(北京)有限公司,DNA Marker DL2000购自TaKaRa生物有限公司,琼脂糖和DEPC购自Promega生物有限公司。
组织匀浆机为瑞士Kinematica PT1200E,高速冷冻离心机为Eppendorf 5417R,生物分光光度计为Eppendorf AG 22331Hamburg,PCR仪为Eppendorf mastercycler,紫外分光光度计为Pharmacia GeneQuant Ⅱ,凝胶成像系统为Tanon 3500R产品,荧光定量分析采用Stratagene公司的Mx3000P型PCR仪。
1.2 试验动物
120只雏鸭(购自江苏高邮鸭集团)国家标准正常饲养至1,2,4,6,8周龄,在不同周龄随机选取24个个体(公母各半),个体称重后解剖,采集免疫器官:脾脏、胸腺、法氏囊,剔除脂肪准确称量,记录绝对质量(湿重量)后,立即放入-80 ℃保存待用。
1.3 引物设计
参考GenBank收录的鸭TLRs mRNA基因序列,采用Primer Premier 5.0软件设计特异性引物,引物序列见表1。
表1 PCR用引物
Tab.1 Primers used for the PCR

引物名Primers基因序列号AccessionNo.引物序列(5'-3')Sequence扩增长度/bpLengthTLR1-FNM_001310424.1TGATGGGATGAGCACTTCAG123TLR1-RAGCATCAGAGCCGTTGTCTTTLR2-FNM_001310348CCGCAACAGGATAAAGCAC201TLR2-RCTGGAGCGAAACAAGGTGATLR4-FJN048668.1CCATCCATTTGTCTGCCTCT116TLR4-RCCTGTTCCTTTGCTCTTTCCTLR5-FKF316966.1TTGTGCTTTGAGGAACGAGA123TLR5-RCCACCCATCTTTGAGAAACTGβ-actin-FNM_001310421.1TGAGAGTAGCCCCTGAGGAGCAC198β-actin-RTAACACCATCACCAGACTCCATCAC
1.4 RNA的提取,反转录
将采集的组织样品分别称取30 mg左右,置于含1 mL TRNzol的2 mL离心管中,用小剪刀剪碎,组织匀浆机匀浆,按照TRNzol-A+试剂说明书提取总RNA,总RNA置于-80 ℃保存备用。根据FastKing RT kit(with gDNase)(KR116) 第一链cDNA合成试剂盒说明书进行反转录,反转录分两步进行,第一步先去除gDNA,反应体系为:5×gDNA Buffer 2 μL,总RNA 1 μg,加水补足到10 μL,混匀后简短离心,置于42 ℃,孵育3 min,置于冰上放置。第二步即反转录,反应体系为:10×King RT Buffer 2 μL,FastKing RT Enzyme Mix 1 μL,FQ-RT Primer Mix 2 μL,Rnase-Free ddH2O 补足至10 μL,然后将此混合液加入到gDNA去除步骤的反应液中,充分混匀,42 ℃孵育15 min;95 ℃孵育3 min后放于冰上,-20 ℃保存备用。
1.5 基因TLRs及β-actin mRNA扩增及测序
PCR反应体系总体积为25 μL,其中2×PCR mix 12.5 μL,上下游引物各1 μL,cDNA产物1 μL, ddH2O 补足至25 μL。PCR反应程序为:95 ℃变性5 min;95 ℃变性30 s,60 ℃复性30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。扩增后的产物用2%琼脂糖凝胶电泳进行检测。检测为单一条带并在相应的片段区间内PCR产物进行凝胶回收和纯化后送上海生工生物科技有限公司测序。测序结果用在线BlastN软件与相应的基因序列进行比对。
1.6 高邮鸭TLRs mRNA及β-actin荧光定量PCR扩增
将采集的样品进行RNA提取和反转录后获得cDNA,每个样品吸取1 μL制成mix样品,然后将mix样品进行2倍梯度稀释制成标准样品,以此为模板荧光定量PCR扩增相应的鸭TLRs和β-actin基因,获得标准曲线。反应体系为:SYBR Premix(2×)10 μL,上下游引物(10 μmol/L) 0.8 μL,50×ROX 0.4 μL,cDNA模板2 μL,ddH2O补足至20 μL。实时荧光定量PCR反应程序:95 ℃变性5 min;95 ℃变性25 s,60 ℃复性25 s,72 ℃延伸25 s,40个循环;95 ℃变性30 s,60 ℃复性30 s,95 ℃延伸30 s,收集溶解曲线。
1.7 数据分析
荧光定量试验结果采用相对比较2-ΔΔCt法分析,首先计算出各样品目的基因与内参基因的Ct差值(ΔCt=ΔCt目的基因-ΔCt内参基因),分别选取表达量最低的组织为对照,以其他组织Ct差值减去对照Ct差值,即为ΔΔCt,即ΔΔCt=(ΔCt目的基因-ΔCt内参基因)试验组-(ΔCt目的基因-ΔCt内参基因)对照组。数据采用SPSS 20.0软件进行独立样本t检验,结果以“平均值±标准差”表示。
2 结果与分析
2.1 高邮鸭体重和免疫器官的发育及其相关性分析
高邮鸭体重发育和品种志中该品种性能观测记录值相当,不同周龄间的体重变化表现出显著差异,说明本试验群体在试验周期内表现为正常饲养状态。胸腺发育在前4周育雏期内,有缓慢增重表现,但未表现出显著差异,随后发育明显,6周龄,8周龄时展示出显著的增重变化(P<0.05);脾脏发育在1周龄和2周龄时表现出显著差异(P<0.05),本次测定结果发现脾脏在2周龄和4周龄之间增重缓慢,6周龄和8周龄之间增重也未有显著性差异。脾脏增重和法氏囊的增重结果在8周龄内表现一致,详细结果见表2。
表2 高邮鸭8周龄内体重和免疫器官发育变化
Tab.2 Development changes of body weight and immune tissues in Gaoyou duck g
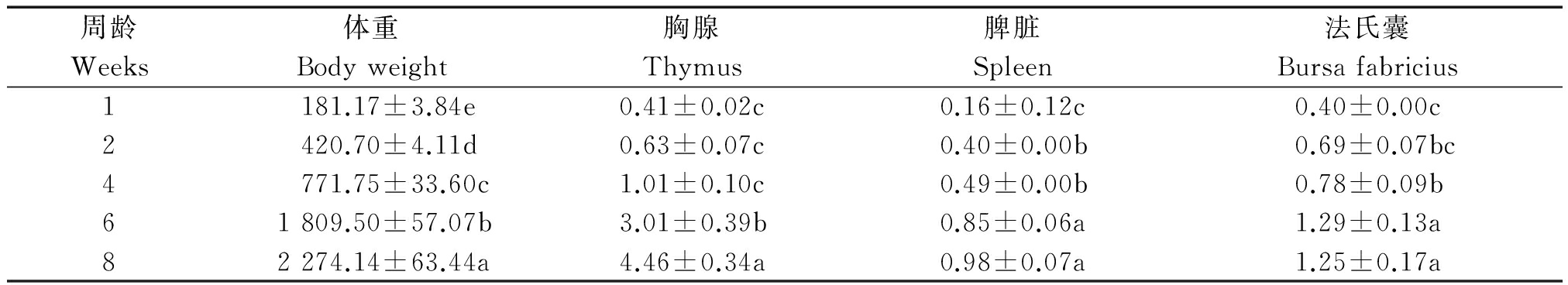
周龄Weeks体重Bodyweight胸腺Thymus脾脏Spleen法氏囊Bursafabricius1181.17±3.84e0.41±0.02c0.16±0.12c0.40±0.00c2420.70±4.11d0.63±0.07c0.40±0.00b0.69±0.07bc4771.75±33.60c1.01±0.10c0.49±0.00b0.78±0.09b61809.50±57.07b3.01±0.39b0.85±0.06a1.29±0.13a82274.14±63.44a4.46±0.34a0.98±0.07a1.25±0.17a
注:不同小写字母表示显著水平差异(P<0.05)。表4同。
Note: Different lowercases indicate significant difference in P<0.05 level. The same as Tab.4.
体重和各免疫脏器重相关性结果发现,体重和免疫器官重相关性较高,和脾脏、胸腺的相关系数为0.92,和法氏囊的相关性最小,为0.76;免疫器官发育之间的相关性较小,脾脏与法氏囊和胸腺发育的相关指数分别为0.71,0.89,法氏囊和胸腺重发育的相关指数最小,为0.64。详细结果见表3。
2.2 鸭TLRs基因片段的PCR扩增,实时荧光定量PCR产物特异性,标准曲线绘制
对所提取的组织总RNA进行反转录和PCR扩增,分别得到与预期大小相符的单一扩增条带,将所扩增的鸭TLRs基因片段纯化后测序,BlastN比对相应的目的基因,证实为对应的TLR1/2/4/5基因。
表3 高邮鸭体重和免疫器官重的发育相关系分析
Tab.3 Correlation of body weight and immune tissue weights in Gaoyou duck
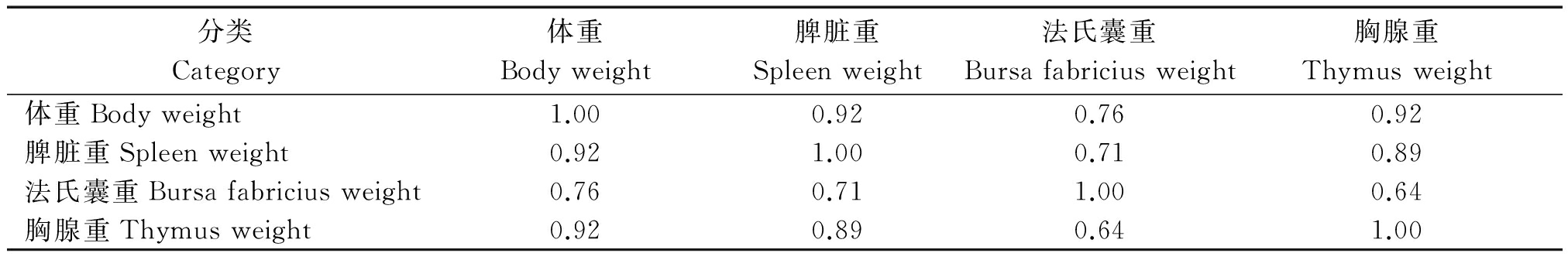
分类Category体重Bodyweight脾脏重Spleenweight法氏囊重Bursafabriciusweight胸腺重Thymusweight体重Bodyweight1.000.920.760.92脾脏重Spleenweight0.921.000.710.89法氏囊重Bursafabriciusweight0.760.711.000.64胸腺重Thymusweight0.920.890.641.00
经溶解曲线分析,高邮鸭TLR1/2/4/5和内参基因β-actin的溶解曲线均呈单峰,无引物二聚体或其他杂峰。TLR1/2/4/5和β-actin的溶解温度分别为81.0,88.0,85.0,82.5,87.5 ℃。
以梯度稀释后的样品为模板进行鸭TLR1/2/4/5和内参基因β-actin荧光定量PCR,获得相应的标准曲线见图1,各基因的扩增效率(Eff)分别为104.6%,102.8%,101.4%,105.0%和104.6%,相关系数(Rsq)分别为0.992,0.987,1.000,1.000和0.994。
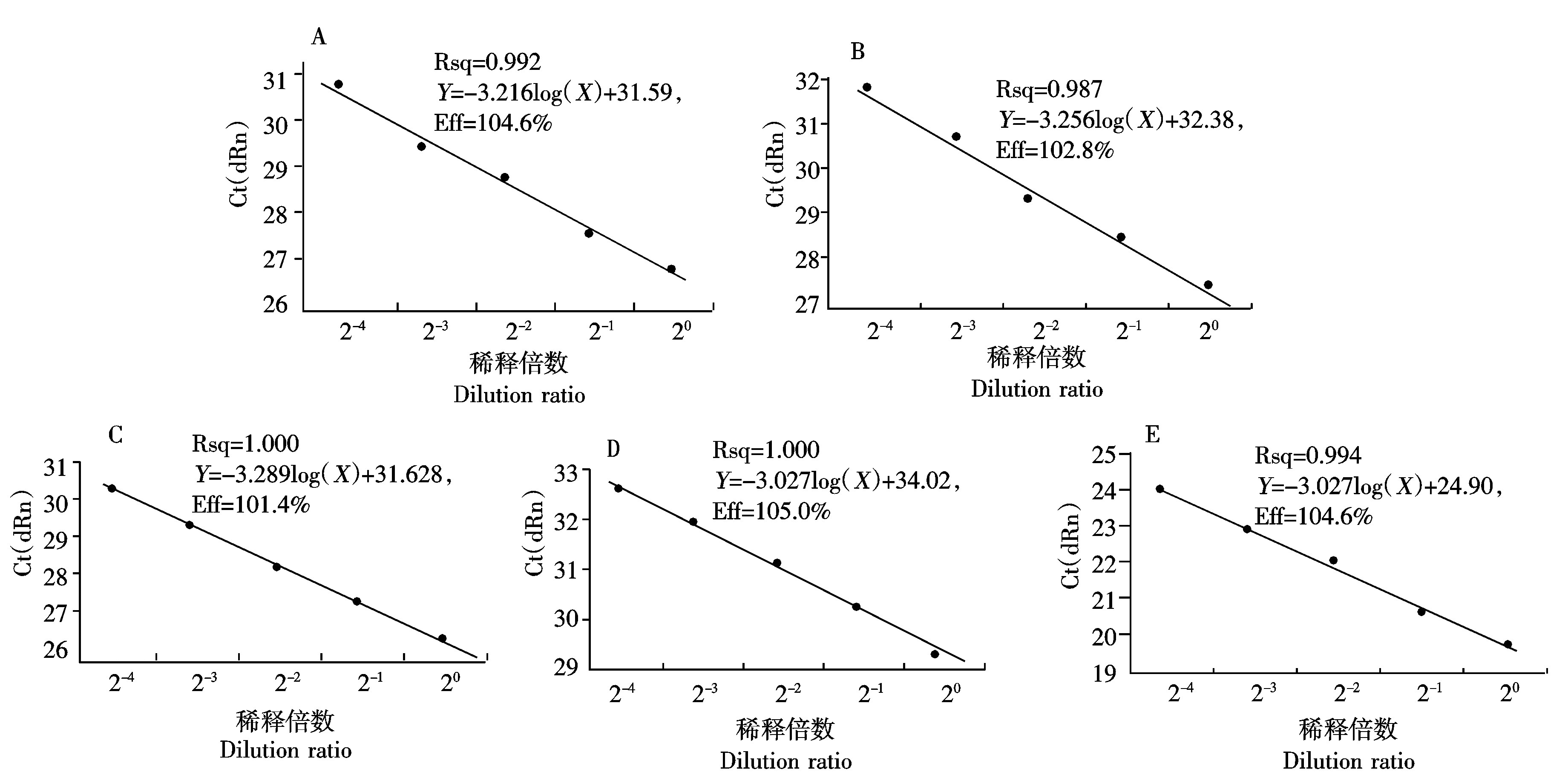
A. TLR1; B.TLR2; C. TLR4; D. TLR5; E.β-actin。
图1 鸭TLRs和β-actin的扩增曲线
Fig.1 Amplification curve of duck TLRs and β-actin
2.3 高邮鸭TLRs基因在不同发育时期免疫组织中的相对表达量
在本研究测定的范围内,胸腺中TLR1/2/4/5在1周龄时的表达量较高,TLR1/4在1周龄时的表达量显著高于其他周龄(P<0.05);TLR1/2/4在2,4,6,8周龄时表达差异不显著;TLR5在2周龄时表达量最低,显著低于1周龄和8周龄(P<0.05)。脾脏组织中各基因的表达变化如表4所示,TLR1/2/5在8周龄时的表达量显著高于其他周龄(P<0.05),2周龄时表达量最低;TLR4在1,2周龄时表达量较高,1周龄时表达量显著高于4,6,8周龄表达量(P<0.05)。法氏囊中各基因表达结果显示TLR1/5在8周龄时表达水平相对较高,TLR4在1周龄时,表达水平较高,显著高于其在4,6,8周龄时的表达水平(P<0.05)。
表4 高邮鸭不同发育时期TLRs在免疫组织中的相对表达量
Tab.4 The relative expression level of TLRs during different development periods in Gaoyou duck
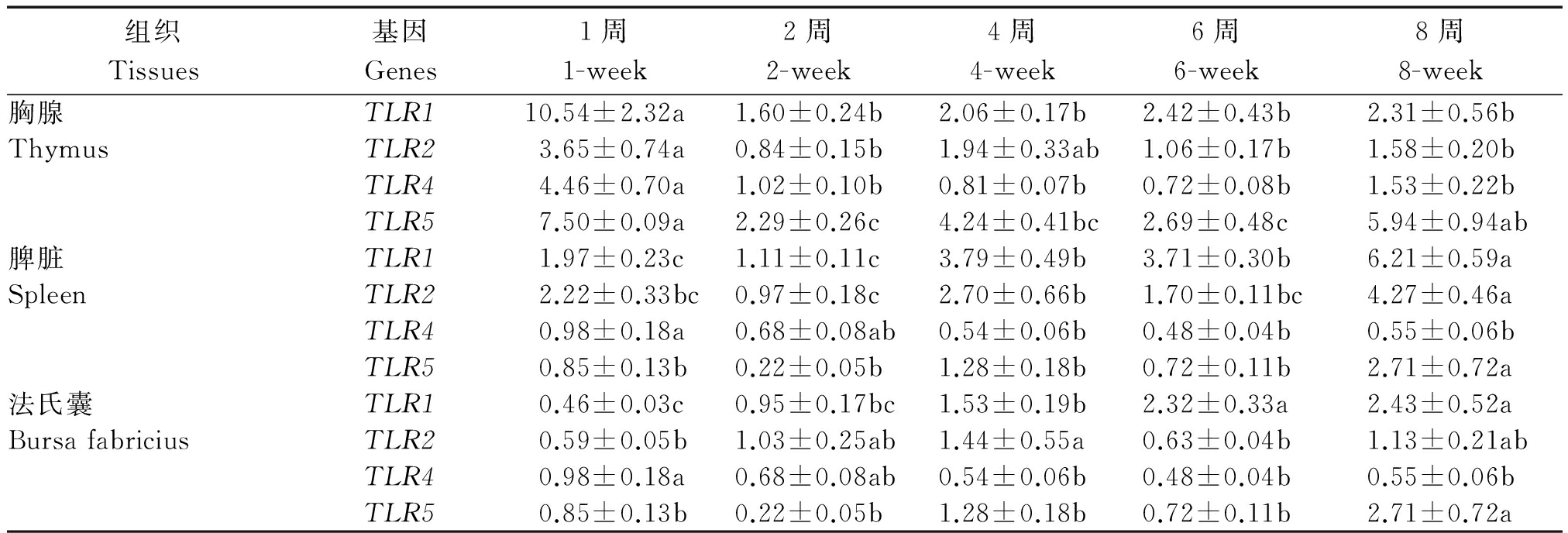
组织Tissues基因Genes1周1-week2周2-week4周4-week6周6-week8周8-week胸腺TLR110.54±2.32a1.60±0.24b2.06±0.17b2.42±0.43b2.31±0.56bThymusTLR23.65±0.74a0.84±0.15b1.94±0.33ab1.06±0.17b1.58±0.20bTLR44.46±0.70a1.02±0.10b0.81±0.07b0.72±0.08b1.53±0.22bTLR57.50±0.09a2.29±0.26c4.24±0.41bc2.69±0.48c5.94±0.94ab脾脏TLR11.97±0.23c1.11±0.11c3.79±0.49b3.71±0.30b6.21±0.59aSpleenTLR22.22±0.33bc0.97±0.18c2.70±0.66b1.70±0.11bc4.27±0.46aTLR40.98±0.18a0.68±0.08ab0.54±0.06b0.48±0.04b0.55±0.06bTLR50.85±0.13b0.22±0.05b1.28±0.18b0.72±0.11b2.71±0.72a法氏囊TLR10.46±0.03c0.95±0.17bc1.53±0.19b2.32±0.33a2.43±0.52aBursafabriciusTLR20.59±0.05b1.03±0.25ab1.44±0.55a0.63±0.04b1.13±0.21abTLR40.98±0.18a0.68±0.08ab0.54±0.06b0.48±0.04b0.55±0.06bTLR50.85±0.13b0.22±0.05b1.28±0.18b0.72±0.11b2.71±0.72a
2.4 体重和免疫器官重与基因表达水平相关性分析
免疫器官重量发育和对应器官中TLR1/2/4/5基因的表达量相关系数较低,除法氏囊中TLR1表达量与体重、法氏囊重相关系数分别为0.78,0.56;脾脏TLR1的表达量与体重、脾脏重变化的相关系数分别为0.75,0.73,TLR5的表达量与体重的相关系数为0.53;其他对应的相关系数值均小于0.50。具体结果如表5所示。
不同免疫器官内TLR1/2/4/5基因表达水平的相关性分析结果发现(表6),不同免疫组织中TLR1/2/5基因表达量之间表现为正相关。法氏囊中各基因的表达量两两之间的相关系数较小;在脾脏组织中,TLR1的表达量和TLR2以及TLR5表达量相关系数值较高,分别为:0.74,0.73,TLR2和TLR5表达量之间的相关系数为0.58;在胸腺组织中,不同TLRs基因表达量的两两相关系数值相对较高,不同TLRs基因两两之间的相关系数值均大于0.50,最高值为0.89。
表5 高邮鸭体重和免疫器官重与TLR1/2/4/5相关性分析
Tab.5 The correlation analysis of expression level TLR1/2/4/5 and body weight, immune tissue weights in Gaoyou duck

组织Tissues体重Bodyweight免疫器官重Immunetissueweight法氏囊TLR10.780.56BursaTLR20.120.11fabriciusTLR4-0.28-0.06TLR50.270.37脾脏TLR10.750.73SpleenTLR20.480.38TLR4-0.36-0.44TLR50.530.40胸腺TLR1-0.39-0.27ThymusTLR2-0.33-0.27TLR4-0.43-0.41TLR50.120.20
表6 高邮鸭不同免疫器官内各基因表达水平的相关性分析
Tab.6 The correlation analysis of expression levels in different TLRs in Gaoyou duck
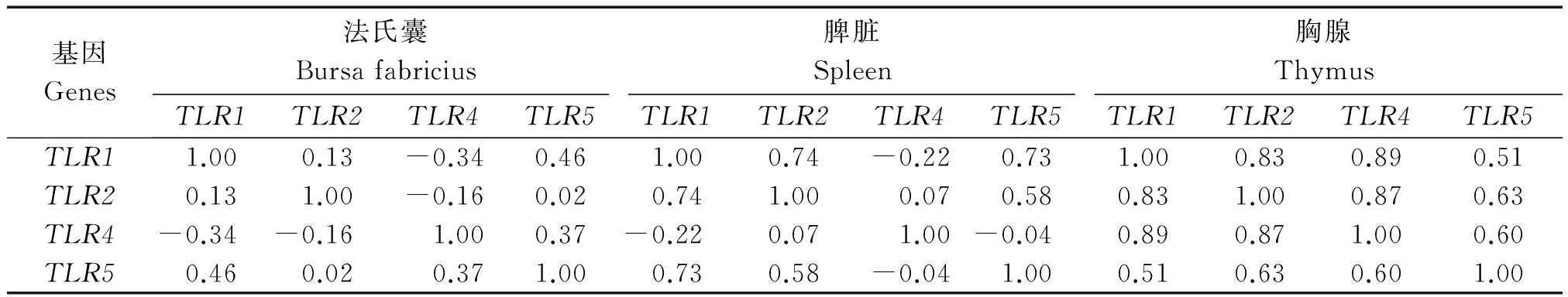
基因Genes法氏囊Bursafabricius脾脏Spleen胸腺ThymusTLR1TLR2TLR4TLR5TLR1TLR2TLR4TLR5TLR1TLR2TLR4TLR5TLR11.000.13-0.340.461.000.74-0.220.731.000.830.890.51TLR20.131.00-0.160.020.741.000.070.580.831.000.870.63TLR4-0.34-0.161.000.37-0.220.071.00-0.040.890.871.000.60TLR50.460.020.371.000.730.58-0.041.000.510.630.601.00
3 讨论
本试验过程中,饲养群体体重发育和品种志中记录数据一致,说明本饲养群体状态良好,可以进行发育性各项指标测定。胸腺和法氏囊均表现为性成熟后重量开始下降,体积逐渐缩小,到成年时仅剩下痕迹,或完全消失。胸腺、法氏囊退化发生的时间与物种、性别及饲养方式等有关。法氏囊作为中枢免疫器官,不仅是B细胞及抗体生成的主要场所,也是大量影响其发育、功能形成及与免疫功能发育关键基因的聚集地,在机体免疫系统中扮演着重要角色。本研究中免疫器官发育状态的数据测定和相关性分析检测,为高邮鸭生长发育状态提供基础数据。
反转录实时荧光定量PCR(RT-qPCR)方法具有特异性强、敏感性高、自动化程度高等特点,目前广泛用于基因表达的研究。本试验采用该方法进行TLR1/2/4/5基因在高邮鸭发育过程中免疫器官的表达水平分析[12]。包括β-actin在内的5个基因其扩增产物溶解温度均呈现单一特异性单峰,说明本试验中设计的引物特异性较强,可以用于定量测定。Comparative Delta-delta Ct法相对定量结果分析要求,目的基因和看家基因的扩增效率相似,越接近100%越好[16],水禽课题组利用上述方法建立多个鸭相关基因表达模式的检测[17-18]。TLR1/2/4/5基因与β-actin的扩增效率在101.4%~105.0%,均接近100%,且TLR1/2/4/5基因与β-actin的荧光定量PCR反应相关系数在0.987~1.000,说明本试验中建立的荧光定量PCR方法稳定可靠。因此,可以用此方法进行4种基因的相对定量结果分析。
关于TLRs基因在组织中的表达已有较多研究报道,例如,鸡上的研究结果表明,雏鸡TLR1、TLR2、TLR4、TLR5在脾脏、法氏囊、胸腺和各段肠道组织中均有转录,但不同脏器组织中的表达水平不一[13]。采用荧光定量PCR法对牦牛TLR2和TLR4在不同组织中的研究表明,TLR2和TLR4在所有组织中均有表达,TLR2在小肠中表达量最高,而TLR4在乳腺中表达量最高[19]。在蒙古马中的研究表明,TLR1、TLR2、TLR4、和TLR6 4种TLRs在心脏、肝脏、脾脏、肺脏、肾脏、胃、十二指肠、空肠、盲肠和骨髓中均有转录[20]。上述研究表明,在不同物种中各TLRs在不同组织中表达水平不一。但在物种发育进程中的表达水平变化报道则相对较少。本研究结果表明,鸭TLR1、TLR2、TLR4、TLR5在发育中的免疫脏器中均有表达,表达模式不同。
脾脏和法氏囊中TLR1表达在8周龄时表达量最高,在前4周内表达量则相对较低,但在胸腺中则是在1周龄时表达量最高,其他周龄点表达水平则差异不显著。TLR2在法氏囊中表达水平较胸腺和脾脏中表达水平稍低,且在不同周龄中表达水平差异不显著。 在胸腺和脾脏中分别是在1周龄和8周龄时表达量显著高于其他周龄,总的来说在不同组织中的表达水平不一。而TLR4均表现为在1周龄时表达水平较高。TLR5在不同脏器中则表现为不同表达趋势,胸腺中1周龄时表达量最高,而在脾脏和法氏囊中则是8周龄时表达量最高。上述这些非规律性表达变化对宿主免疫水平的影响如何,是后期研究的重点。
相关性分析结果表明,上述基因的表达和体重以及免疫器官重的相关性不大,比较而言,脾脏中各基因的表达水平相关性系数稍高,最高为TLR2和TLR4表达水平相关系数为0.89。上述结果是否意味着脾脏中这些基因的网路功能更强。脾脏作为重要免疫器官,TLRs是在高邮鸭或者其他鸭品种中作为天然免疫的重要组成部分,在抗感染过程中起着重要作用。
参考文献:
[1] 张 敏,黄藏宇,孙艳发,等.日粮维生素E水平对肉鸡生长性能和免疫器官发育的影响[J].湖北农业科学, 2016, 55(4): 961-963, 979.
[2] 马利芳,崔玉娟,段宝敏,等. 2014-2015年我国水禽主要流行性疾病病原的初步调查[J].中国家禽, 2016, 38(4): 68-70.
[3] 鄢 涛,赖贻奎,张庆生,等.吉安市家禽产业发展现状、存在的问题及建议[J].江西畜牧兽医杂志, 2016(6): 14-15.
[4] 方 强.家禽Toll样受体基因的克隆、序列分析及不同品种鸡抗沙门菌感染天然免疫应答研究[D]. 扬州:扬州大学,2012.
[5] 应诗家, 戴子淳, 郭佳佳, 等.鹅输卵管TLR家族基因差异表达的研究[J]. 江苏农业学报, 2015, 31(6):1395-1399.
[6] 沙素梅. Toll样受体5与黏附侵袭性大肠杆菌LF82在炎症性肠病发病中的作用研究[D].西安:第四军医大学, 2014.
[7] Zhang P, Zhang N, Liu L, et al. Polymorphisms of toll-like receptors 2 and 9 and severity and prognosis of bacterial meningitis in Chinese children[J]. Scientific Reports, 2017, 7: 42796.
[8] O’Neill L A, Golenbock D, Bowie A G.The history of toll-like receptors-redefining innate immunity[J].Nat Rev Immunol,2013, 13(6):453-460.
[9] Brownlie R, Allan B. Avian toll-like receptors[J]. Cell and Tissue Research, 2011, 343(1): 121-130.
[10] Cheng Y, Sun Y, Wang H, et al. Cloning, expression and functional analysis of the duck Toll-like receptor 5 (TLR5) gene[J]. Journal of Veterinary Science, 2015, 16(1): 37-46.
[11] Huang Y, Temperley N D, Ren L, et al. Molecular evolution of the vertebrate TLR1 gene family-a complex history of gene duplication, gene conversion, positive selection and co-evolution[J]. BMC Evolutionary Biology, 2011, 11: 149.
[12] Li R, Li N, Zhang J, et al. Expression of Immune-Related genes of ducks infected with avian pathogenic escherichia coli (APEC) [J]. Frontiers in Microbiology, 2016, 7: 637.
[13] 周作勇,聂 奎,宋振辉,等.雏鸡不同组织TLR1,TLR2,TLR4,TLR5,TLR15 mRNA转录水平相对定量研究[J].畜牧兽医学报, 2010, 41(11): 1453-1459.
[14] Chen S, Cheng A, Wang M. Innate sensing of viruses by pattern recognition receptors in birds[J]. Veterinary Research, 2013, 44: 82.
[15] Muzio M, Polentarutti N, Bosisio D, et al. Toll-like receptor family and signalling pathway[J]. Biochemical Society Transactions, 2000, 28(5): 563-566.
[16] Pfaffl M W. A new mathematical model for relative quantification in Real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29(9): e45.
[17] Zhu C, Gi G, Tao Z, et al. Development of skeletal muscle and expression of myogenic regulatory factors during embryonic development in Jinding ducks (Anas platyrhynchos domestica) [J]. Poultry Science, 2014, 93(5): 1211-1216.
[18] Li H, Zhu C, Tao Z, et al. MyoD and Myf6 gene expression patterns in skeletal muscle during embryonic and posthatch development in the domestic duck (Anas platyrhynchos domestica)[J]. Journal of Animal Breeding and Genetics, 2014, 131(3): 194-201.
[19] 林宝山,兰道亮,黄 偲,等.牦牛TLR2和TLR4基因mRNA在不同组织中的表达分布研究[J].中国预防兽医学报, 2014, 36(11): 901-903.
[20] 赵一萍,黄金龙,白东义,等.蒙古马不同组织器官TLR1、TLR2、TLR4和TLR6 mRNA转录水平研究[J].中国兽医学报, 2012, 32(10): 1542-1546.