掌叶半夏即虎掌,又名独角莲,隶属天南星科半夏属,是我国传统的中药材,主要分布在河北和长江流域及西南各地。其主要药效成分是掌叶半夏凝集素,是一种从掌叶半夏块茎中分离出的植物蛋白[1-2]。掌叶半夏凝集素属于单子叶甘露糖凝集素,能够专一地结合甘露糖,具有抑菌、杀虫、凝血、抗肿瘤等生理作用[3-6]。近年来,研究掌叶半夏蛋白对多种害虫尤其是对同翅目类害虫的致死作用和掌叶半夏蛋白基因的抗虫性,已成为抗虫植物基因工程研究的热点[7-8]。依托经作所生物技术中心建立的掌叶半夏凝集素基因文库,筛选到了3个具有典型结构域的凝集素家族基因,可能与植物对蚜虫的抗性相关。因此,本研究克隆了这3个掌叶半夏凝集素家族基因,并构建其原核表达载体pET-28b(+)-PPAs,并在大肠杆菌表达系E.coli BL21(DE3)中实现特异性表达,为进一步研究掌叶半夏凝集素家族蛋白的功能奠定了基础。
1 材料和方法
1.1 材料与试剂
掌叶半夏采自河北省农林科学院药用植物研究中心中药材种质资源圃,表达载体pET-28b(+)、表达菌株E.coli BL21(DE3) 由河北省农林科学院经济作物研究所实验室保存,克隆载体为pEASY-T。
限制性内切酶Xho Ⅰ、Nde Ⅰ均购自美国Fermentas公司;IPTG、卡那霉素(Kanamycin)、蛋白胨(Tryptone)、酵母提取物(Yeast extract)为上海生工产品;胶回收试剂盒、克隆载体pEASY-T及大肠杆菌感受态细胞均购自北京公司。
1.2 试验方法
1.2.1 掌叶半夏基因组DNA的提取 利用CTAB法,从掌叶半夏幼嫩的叶片中提取掌叶半夏基因组DNA。
1.2.2 引物设计及序列扩增 参照基因文库设计特异性扩增引物(表1)。PCR 法特异扩增基因序列,反应条件为:94 ℃ 1 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,30 个循环;72 ℃ 10 min。PCR 产物进行琼脂糖凝胶电泳并纯化,连接到pEASY-T载体,经 PCR 鉴定后将阳性克隆送华大公司测序。
表1 引物
Tab.1 Primer

引物Primer序列Sequence15上游Upstream5'-AACATATGGCCTCCAAGCTCCTC-3'15下游Downstream5'-ATCTCGAGCTAGCAGGGCCGTAGATGACG-3'324上游Upstream5'-AACATATGGCCTCCAAGCTCCTC-3'324下游Downstream5'-ATCTCGAGCTACGCCGCAGCAATGGA-3'533上游Upstream5'-AACATATGGCCTCCAAGCTCCTC-3'533下游Downstream5'-ATCTCGAGCTACGCCGCAGCAATGGA-3'
1.2.3 克隆基因的生物信息学分析 利用网上数据库(http://www.ncbi.nlm.nih.gov/)进行Blast分析。使用SignalP-3.1信号肽预测工具(http://www.cbs.dtu.dk/services/SignalP/)分析基因的信号肽。利用TMHMM(http://www.cbs.dtu.dk/services/SignalP/)对基因编码的蛋白进行跨膜域预测[9-10]。使用DNAman进行几种植物蛋白质的同源性分析,采用生物软件Mega 4.1和Clustal W2对不同植物凝集素氨基酸序列进行系统分析物中蛋白的聚类分析,并生成系统进化树。
1.2.4 PPA基因原核表达载体的构建 将pET-28b(+)和pEASY-PPA分别用Xho Ⅰ和Nde Ⅰ进行双酶切,1%琼脂糖凝胶电泳检测,切胶回收,回收产物进行连接,转化至克隆菌株DH5α感受态中,挑取长出的菌落,进行菌液PCR鉴定,将检测出目的条带的菌液提取质粒进行酶切鉴定,经过鉴定正确的重组质粒转化至大肠杆菌 BL21(DE3)感受态细胞中。
1.2.5 重组质粒pET-28b(+)-PPA在大肠杆菌中的诱导表达 将已成功转化pET-28b(+)-PPA重组质粒的菌株以及转化pET-28b(+) 的表达菌株挑取单克隆菌落接种到5 mL LB(100 mg/L Kan) 液体培养基中,37 ℃,200 r/min振荡培养12 h,各取0.5 mL接种到50 mL LB(100 mg/L Kan) 培养基中扩大培养,待OD600为0.6时,分别诱导0,3,6,9,12 h。诱导完成后取菌液,10 000 r/min,4 ℃离心5 min弃上清液沉淀加入1 mL PBS吹吸混匀后,超声波破碎9 s休息,5 s工作,工作次数50次。将菌液5 000 r/min,4 ℃离心5 min。吸取上清至新的1.5 mL EP管中,沉淀加入100 μL PBS缓冲液,吹吸混匀置-20 ℃。分别取上清和沉淀各50 μL,加入50 μL SDS上样缓冲液,吹吸混匀。沸水浴10 min,4 ℃保存,待各组均处理完毕,统一点样进行SDS-PAGE(5%积层胶,15%分离胶)。凝胶用考马斯亮蓝R-250染色1.5 h,脱色至条带清晰。
2 结果与分析
2.1 掌叶半夏凝集素家族成员基因CDS序列的扩增及生物信息学分析
2.1.1 掌叶半夏凝集素家族成员基因CDS序列的扩增 通过对河北省农林科学院经济作物研究所生物技术研究中心前期所构建掌叶半夏凝集素cDNA文库分析,设计引物,提取掌叶半夏总RNA,并利用RT-PCR扩增获得3个掌叶半夏凝集素家族基因PPA15、PPA324、PPA533(图1)。
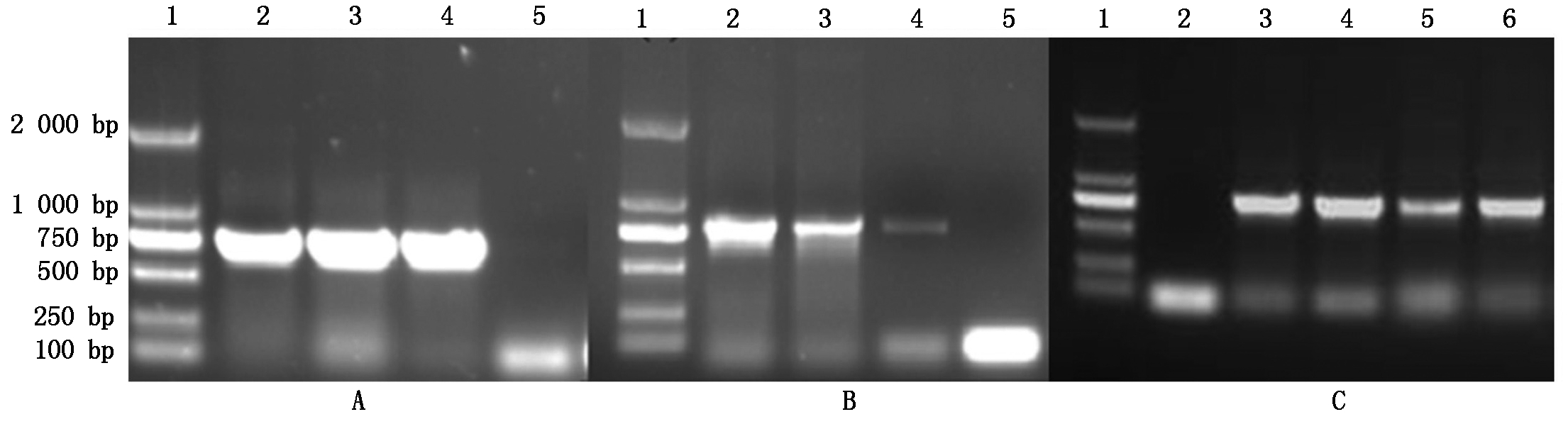
A:1.Marker DM2000;2~4.PPA15扩增片段;5.双蒸水。B:1.Marker DM2000;2~4.PPA324扩增片段;5.双蒸水。C:1.Marker DM2000;2.双蒸水;3~6.PPA533扩增片段。
A:1.Marker DM2000;2-4.PPA15 sequence;5.ddH2O. B:1.Marker DM2000;2-4.PPA324 sequence;5.ddH2O. C:1.Marker DM2000;2.ddH2O;3-6.PPA533 sequence.
图1 掌叶半夏凝集素家族基因克隆
Fig.1 The gene of Pinellia pedatisecta cloning
2.1.2 掌叶半夏凝集素家族成员基因生物信息学分析 PPA15基因全长729 bp,编码一个由243个氨基酸构成的多肽,理论分子量为27 ku;信号肽由N端25个氨基酸残基组成,具有典型的跨膜结构域,推测定位于胞内膜结构(图2-A、B);具有单子叶甘露糖结合位点QDNVY和血球型凝集素结构域(图2-C)。
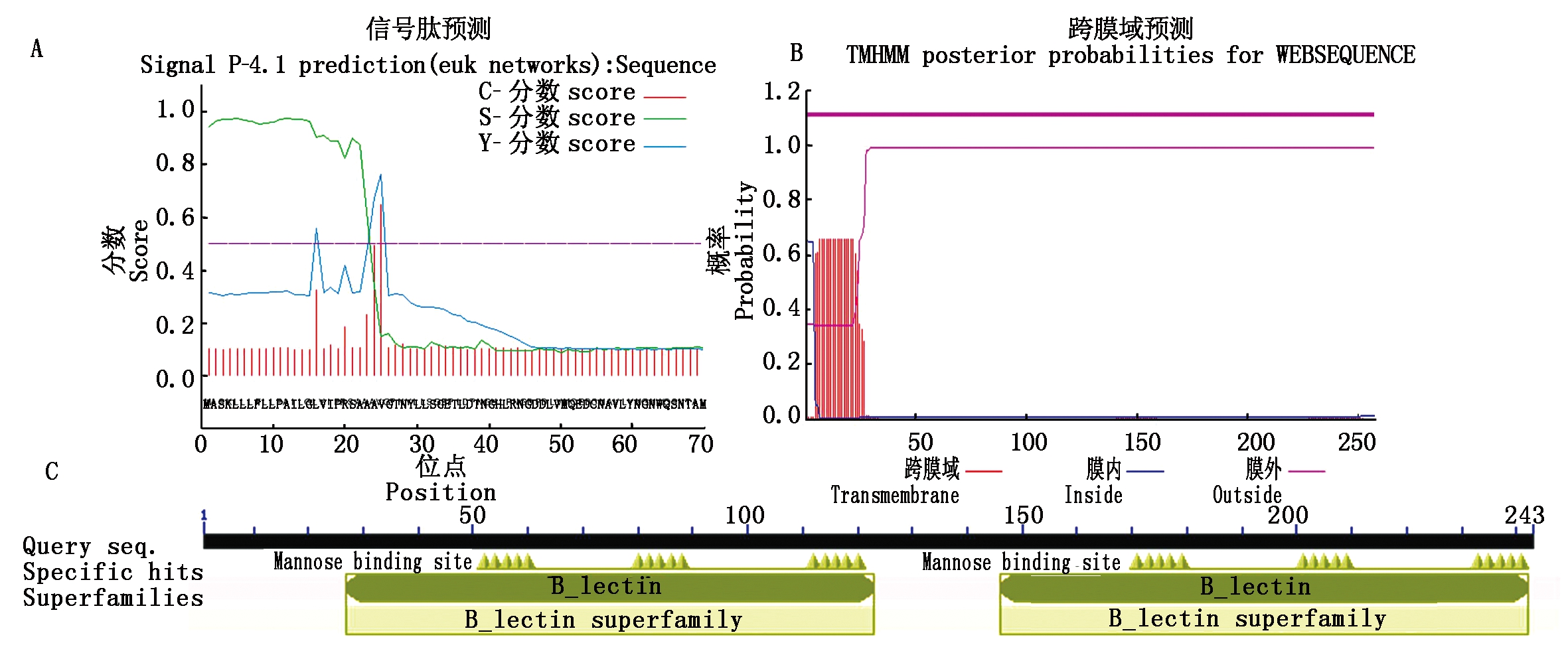
A.信号肽分析;B.跨膜结构域分析;C.基因结构域分析。图3-4同。
A .The analysis of signal peptide; B.The analysis of transmembrane domain; C.The analysis of genetic domain.The same as Fig.3-4.
图2 PPA15生物信息学分析
Fig.2 The bioinformatics analysis of PPA15
PPA324基因全长774 bp,编码一个由258个氨基酸构成的多肽,理论分子量为28 ku;信号肽由N端25个氨基酸残基组成,具有典型的跨膜结构域,推测定位于胞内膜结构(图3-A、B);具有单子叶甘露糖结合位点QDNVY和血球型凝集素结构域(图3-C)。
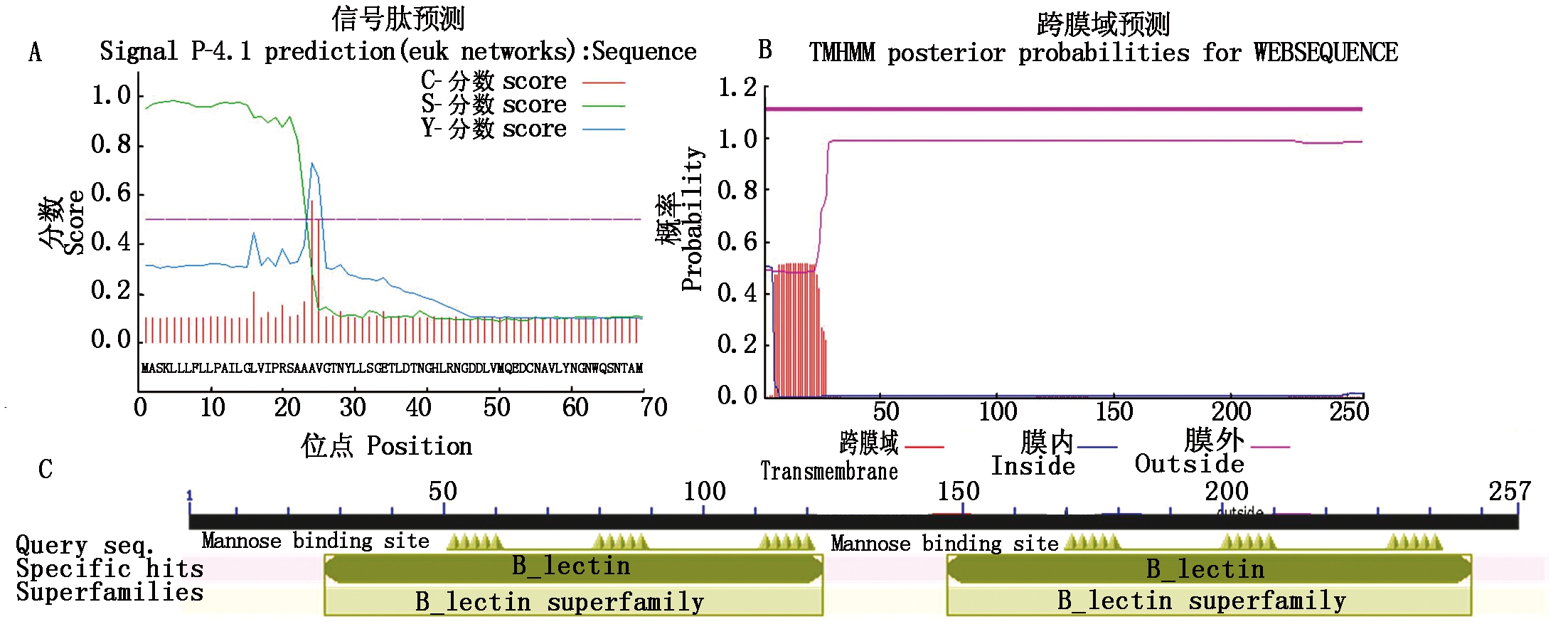
图3 PPA324生物信息学分析
Fig.3 The bioinformatics analysis of PPA324
PPA533基因全长777 bp,编码一个由259个氨基酸构成的多肽,理论分子量为28 ku;信号肽由N端25个氨基酸残基组成,具有典型的跨膜结构域,推测定位于胞内膜结构(图4-A、B);具有单子叶甘露糖结合位点QDNVY和血球型凝集素结构域(图4-C)。

图4 PPA533生物信息学分析
Fig.4 The bioinformatics analysis of PPA533
2.1.3 掌叶半夏凝集素家族成员基因同源聚类分析 本研究利用DNA分析软件将得到的序列与GenBank中的序列进行比对,发现具有高度相似性,序列相似度高达89.35%,且具有一致的保守结构位点。
蛋白聚类分析显示,PPA15、PPA324与滴水珠凝集素聚成一类,再与三叶半夏、掌叶半夏等凝集素聚成一类;PPA533与异叶天南星凝集素聚成一类(图5)。
将所测序序列与GenBank中已报道的掌叶半夏序列进行同源性比较,结果显示,PPA15与报道的掌叶半夏凝集素基因(PPA,KF154981.1)相似性为92%,编码的氨基酸序列相似性为82%;PPA324与报道的掌叶半夏凝集素基因(PPA,KF154981.1)相似性为93%,编码的氨基酸序列相似性为88%; PPA324与报道的掌叶半夏凝集素基因(PPA,KF154981.1)相似性为91%,编码的氨基酸序列相似性为83%。与三叶半夏凝集素基因(PTA,AY4518540)滴水珠凝集素基因(PCA,EF090419)、花南星凝集素基因(ALA,AY557617)、犁头尖凝集素基因(TDA,EF194099)、异叶天南星基因(AHA,AY338965)、东北南星凝集素基因(AAA,EU409835)、芋头凝集素基因(CEA,EF541132)和雪花莲外源凝集素基因(GNA,AF413083)的同源性为84%~89%。可见,单子叶凝集素基因在进化过程中是高度保守的,它们具有重要的生物学功能。
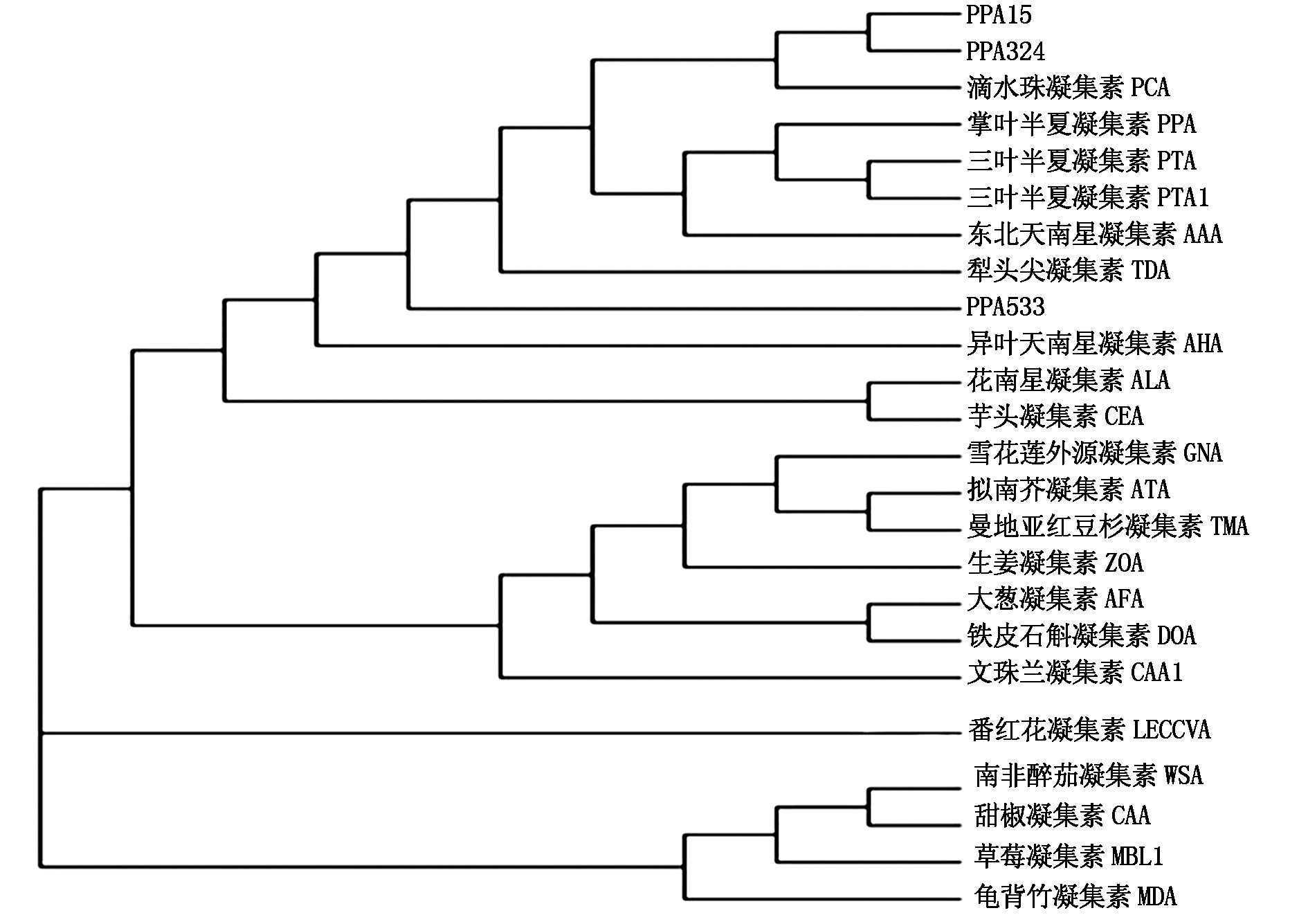
图5 掌叶半夏凝集素与其他植物凝集素氨基酸序列构建的系统分类树
Fig.5 The systematic classification tree of PPA and other plant lectin amino acid sequence
2.2 融合蛋白原核表达载体构建及诱导表达
将pET-28b(+)和pEASY-PPA分别用Xho Ⅰ和Nde Ⅰ进行双酶切,回收产物进行连接,转化至克隆菌株DH5α中。经菌液PCR和双酶切鉴定,将阳性重组质粒转化至转化表达菌株BL21(DE3)中。用IPTG诱导表达菌株,选取0,3,6,9 h菌液,经超声波破碎后提取上清和沉淀分别进行SDS-PAGE检测(图6),结果显示,在28.0 ku附近,可见明显的蛋白片段,与预期一致,融合蛋白成功表达,可提取用于后续研究。
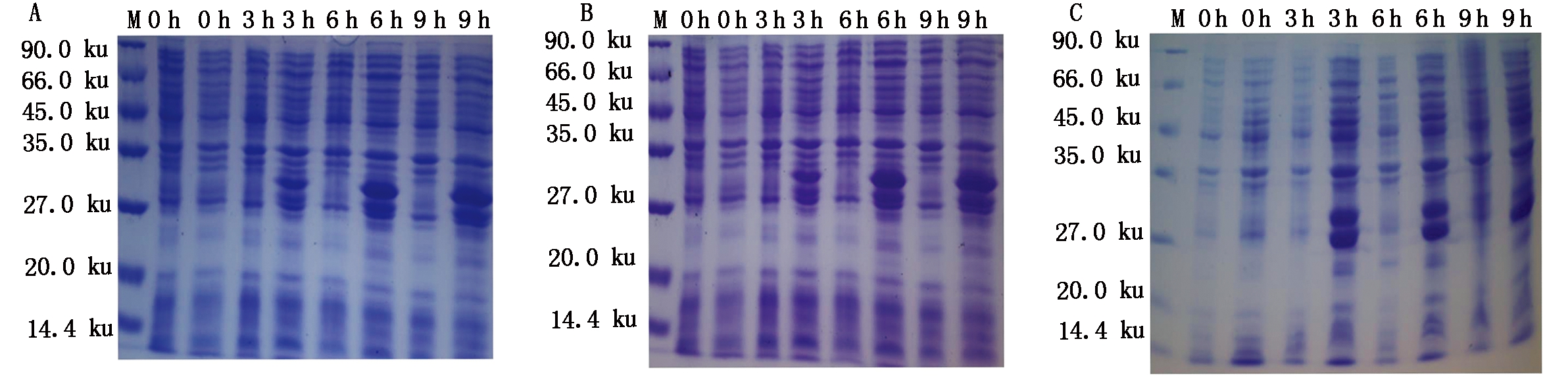
A.融合蛋白pET-28b(+)-PPA15与空载体对照在诱导0,3,6,9 h后表达;B.融合蛋白pET-28b(+)-PPA324
与空载体对照在诱导0,3,6,9 h后表达;C.融合蛋白pET-28b(+)-PPA533与空载体对照在诱导0,3,6,9 h后表达。
A.The expression of pET-28b(+)-PPA15 and pET-28b(+) at inducing 0,3,6,9 h; B.The expression of pET-28b(+)-PPA324 and pET-28b(+) at inducing 0,3,6,9 h; C.The expression of pET-28b(+)-PPA533 and pET-28b(+) at inducing 0,3,6,9 h.
图6 融合蛋白在不同时段的原核表达
Fig.6 The prokaryotic expression of recombinant protein at different time periods
3 讨论
目前,对半夏凝集素基因的研究主要分为两方面:原核表达蛋白和转基因植株研究。Yao等[11-12]首次克隆了PTA基因,并且成功地得到相应的氨基酸序列。吴志明等[13]克隆并将PTA转化烟草,结果获得转基因烟草对蚜虫的平均抑制率达到77.02%。
将雪花莲凝集素基因(GNAs)、中国水仙凝集素基因(NTLs)、半夏凝集素基因(pta)分别转化小麦进行田间以及室内的抗虫性鉴定比较。结果显示,sGNA与sNTL以及pta基因可以作为培育高抗虫性小麦的较好选择[14]。
将PPA2转化并经Western Blot鉴定后进行抗蚜性分析,结果表示,不同表达量的转基因烟草都具有明显的抗蚜性[15]。而Wu等[16]将掌叶半夏PPAb基因转入烟草,转基因烟草对蚜虫的平均抑制率达到了90.28%。
通过生物信息学分析发现,这几个凝集素成员都具有典型的甘露糖结合位点QDNVY,属单子叶甘露糖凝集素,并且都具有血球型凝集素结构域。与先前已经报道的抗性基因在生物信息学上极其相似。Blast比对结果显示,它与已报道的PPA、PTA、PCA、ALA、TDA、AHA、AAA等具有较高的相似性[17],其中与三叶半夏相似性最高,采用生物软件Mega 4.1和Clustal W2对不同植物凝集素氨基酸序列进行系统分析,这从分子进化上证实了掌叶半夏隶属于天南星科半夏属植物,同时也为下一步获得抗虫植株或其他制剂提供了材料和方法基础。
已有研究表明,单子叶植物甘露糖凝集素如雪莲花凝集素(GNA)和大蒜凝集素(Allium sativum leaf agglutinin,ASAL)在蚜虫肠道中均有共同的结合位点[18-20]。此外,由于凝集素成员之间存在抗蚜虫差异,可能从中筛选得到更加高抗蚜活性的凝集素家族成员,丰富凝集素抗蚜基因库;研究不同成员之间是否存在协同效应等。因此,有必要克隆筛选更多的甘露糖凝集素家族成员,获得更多的序列和抗蚜特性的数据,为深入研究和筛选更高杀虫活性的凝集素成员提供基础。
本研究发现,尽管凝集素家族同源性很高,但通过诱导表达发现在相同的时间、相同浓度的IPTG诱导下,融合蛋白的表达量各不相同。此外,氨基酸序列的差异会不会导致蛋白功能的不同还需要进一步的研究。
本研究应用的pET-28b(+)表达是带有载体His标签的融合表达系统,其利用T7启动子高效表达目的融合蛋白。而融合蛋白中的His标签不会影响蛋白的活性,便于纯化。诱导表达后的蛋白通常以2种形式存在:可溶性蛋白和包涵体蛋白。可溶性蛋白存于菌液上清液中,纯化起来比较容易;而包涵体蛋白存于菌体中,纯化较难,而且易使蛋白变性。本试验通过多次诱导,探索不同的诱导条件,终于得到可溶性蛋白,这为以后纯化蛋白、研究该蛋白的性质及功能提供了基础。
参考文献:
[1] 蔡茜茜,李巧玲,刘舒云,等.植物凝集素研究进展[J].食品科学技术学报,2013,31(6):51-57.
[2] 赵 欢,彭正松.半夏属植物凝集素的研究进展[J].天然产物研究与开发,2014,26(9):1531-1537,1487.
[3] 赵 欢,彭正松,雷 杨,等.半夏凝集素基因的克隆、生物信息学分析及其蛋白的亚细胞定位[J].中草药,2014,45(13):1914-1919.
[4] 孙 佳,邵荣花,高卫真.半夏中的活性成分生物碱及其蛋白基因研究[J].中国中医基础医学杂志,2014(12):1699-1701.
[5] Zhou W,Huang Y,Xu S,et al.Prokaryotic expression and bioactivity analysis of N-terminus domain of Pinellia ternate agglutinin using alkaline phosphatase signal peptide[J].Protein Expression and Purification,2013,78(1):84-91.
[6] Zhou W,Gao Y Y,Xu S,et al.Purification of a mannose biding lectin Pinellia ternate agglutinin and its induction of apoptosis in Bel-7404cells[J].Protein Expression and Purification,2014,93(1):11-17.
[7] 马 琛,徐 涛.植物凝集素抗虫性研究[J].现代园艺,2017(5):31-32.
[8] Lin J,Zhou X,Gao S,et al.cDNA cloning and expression analysis of a mannose-binding lectin from Pinellia pedatisecta[J].Journal of Biosciences,2007,32(2):241-249.
[9] 张正英.半夏凝集素基因的克隆与氨基酸序列初步分析[J].中草药,2012,43(9):1818-1823.
[10] 赵 欢.掌叶半夏凝集素基因的克隆及亚细胞定位分析[J].华北农学报,2017,32(2):32-37.
[11] Yao J H,Sun X F,Tang K X.Molecular cloning of lectin gene from Pinellia ternate[J].Journal of Fudan University:Natural Science,2001,40(4):461-464.
[12] Yao J H,Zhao X Y,Liao Z H,et al.Cloning and molecular characterization of a novel lectin gene from Pinelliate ternata[J].Cell Research,2003,13(4):301-308.
[13] 吴志明,董文琦,党志红,等.半夏凝集素基因克隆及其对桃蚜的抗性研究[J].南京农业大学学报,2010,33(2):45-50.
[14] 段晓亮.三种植物凝集素基因在转基因小麦中的表达及其抗蚜效果分析[D].北京:中国农业大学,2013.
[15] 刘 玎,陈 劲,刘 志,等.掌叶半夏凝集素基因 PPA2抗蚜功能分析[J].生物技术通报,2016,32(10):180-187.
[16] Wu Z M,Yan H B,Pan W L,et al.Transform of an ectopically expressed bulb lectin gene from Pinellia pedatisecta into tobacco plants conferring resistance to aphids[J].Australian Journal of Crop Science,2012,6(5):904-911.
[17] Liu L L,Yang Z J,Wei S H,et al.ISSR and SRAP markers in the genetic relationship analysis among Pinellia in China[J].J Med Plants Res,2012,6(19):3596-3602.
[18] Hamshou M,Smagghe G,Shahidi-Noghabi S,et al.Insecticidal properties of Sclerotinia sclerotiorum agglutinin and its interaction with insect tissues and cells[J].Insect Biochemistry and Molecular Biology,2010,40(12):883-900.
[19] Upadhyay S K,Mishra M,Singh H,et al.Interaction of Allium sativum leaf agglutinim with midgut brush border membrance vesicles proteins and its stability in Helicoverpa armigera[J].Proteomics,2010,10(24):4431-4440.
[20] Hakim R S,Baldwin K,Smagghe G.Regulation of midgut growth,development,and metamorphosis[J].Annu Rev Entomol,2010,55:593-608.