基因启动子是一段特殊的DNA序列,能与RNA聚合酶结合主导基因的起始转录位置[1],根据转录方式不同,启动子主要包括3种类型,分别为组成型启动子、组织特异型启动子和诱导型启动子[2-3]。转录调控和翻译调控是真核生物基因表达的主要调控途径,转录因子和位于启动子区域的顺式作用元件间的相互作用完成基因转录水平的调控[4],转录因子能够与位于启动子区域的顺式调控元件特异结合,从而实现基因的表达调控,促进作物适应环境条件的变化[5]。生物信息学是近年来发展起来的一门学科,与互联网结合进行发展,促进了基因序列数据发掘的前进步伐,很多分析和预测工具、网站被开发出来,为科研提供了便利[6]。利用预测工具对启动子进行分析,能够预测位于启动子上的顺式调控元件[7]。
核糖体失活蛋白(Ribosome inactivating proteins,RIPs)是主要存在于植物体内具有多种生物学活性的毒蛋白,核糖体功能失活致使蛋白质生物合成受到抑制主要是由于RIPs作用于28S rRNA实现的,截至目前,国内外研究团队从苦瓜果实和种子中分离到多种RIPs,主要包括α-苦瓜素、β-苦瓜素和MAP30 (Momordica anti-HIV protein of 30 kDa,MAP30)等。其中苦瓜MAP30蛋白是药理作用最强的Ⅰ型RIPs[8]。具有显著的抗肿瘤、抗病毒等药理活性[9-15]。
目前,有关MAP30的研究主要集中在重组表达和药理活性分析方面,林育泉等[16]选用大肠杆菌表达系统表达的重组MAP30蛋白对肿瘤细胞株具有明显的抑制作用。樊剑鸣等[17]在毕赤酵母中表达的苦瓜蛋白MAP30能够诱发胃腺癌细胞MCG803的凋亡。樊剑鸣等[18]研究表明,重组的苦瓜MAP30蛋白在体外能抑制大肠LoVo细胞生长,并能诱导其凋亡。朱振洪等[19]研究发现,MAP30基因在毕赤酵母中的表达产物具有抑制肿瘤细胞的活性。韩晓红等[20]研究表明,重组表达MAP30蛋白可以诱导人食管癌细胞株EC-1.71凋亡。邱华丽等[21]研究结果证实,重组表达MAP30蛋白体外可诱导人乳腺癌细胞凋亡。有关苦瓜MAP30基因启动子及单倍型的研究鲜有报道。因此,该研究拟克隆MAP30基因的上游启动子序列,利用生物信息学分析方法分析该启动子潜在的顺式作用元件;分析不同苦瓜种质资源MAP30基因启动子序列SNPs和InDels分布情况,鉴定单倍型,分析不同单倍型之间在顺式作用元件上的差别以及共同点,为进一步阐明MAP30基因的表达调控机制奠定基础。
1 材料和方法
1.1 试验材料
供试苦瓜材料共30份,来源于苦瓜初级核心种质库[22],其中3份来自日本,3份来自中国广东,1份来自中国江西,5份来自中国海南,3份来自泰国,2份来自中国云南,1份来自中国湖南,4份来自中国广西,2份来自中国福建,3份来自斯里兰卡,3份来自印度(表1)。试验于2016年9月初在中国热带农业科学院热带作物品种资源研究所试验基地进行,将供试苦瓜种子用50 ℃温水处理30 min,常温浸种12 h后,播种于营养钵中,按照常规方法管理。待苦瓜长至三叶一心时,摘取叶片贮于-20 ℃冰箱备用。
表1 供试苦瓜材料
Tab.1 The test materials of bitter gourd
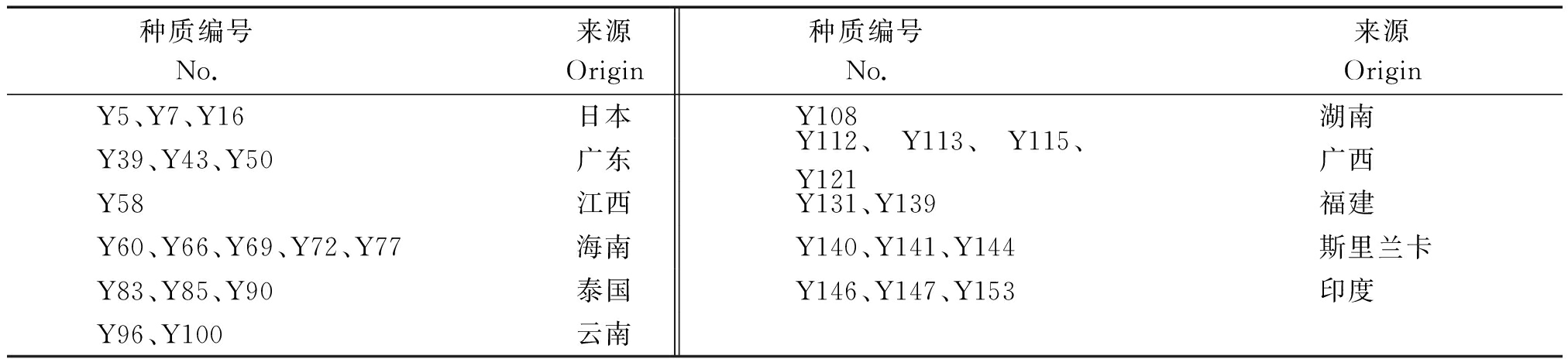
种质编号 No. 来源Origin种质编号 No. 来源OriginY5、Y7、Y16日本Y108湖南Y39、Y43、Y50广东Y112、Y113、Y115、Y121广西Y58江西Y131、Y139福建Y60、Y66、Y69、Y72、Y77海南Y140、Y141、Y144斯里兰卡Y83、Y85、Y90泰国Y146、Y147、Y153印度Y96、Y100云南
1.2 试验方法
1.2.1 基因组DNA提取 采用改良的CTAB法[23]提取待测苦瓜材料的基因组DNA。
1.2.2 MAP30启动子序列分离 根据GenBank MAP30编码序列S79450比对苦瓜基因组序列[24],该编码序列对应于Scaffold_175,为了获得MAP30启动子序列,从MAP30基因起始密码子下游200 bp内利用软件Primer 5.0设计引物(表2),获取起始密码子上游1.5 kb左右的序列。以苦瓜材料Y5基因组DNA为模板进行PCR扩增,采用离心柱型琼脂糖凝胶DNA回收试剂盒(Omega Gel Extraction Kit,美国)回收目的条带,将目的条带连接到北京全式金生物技术有限公司pEASY-T5载体上,转化感受态细胞Trans1-T1,筛选出阳性克隆,委托广州英韦创津生物科技有限公司测序。
PCR反应体系为20 μL,其中包括12 μL Premix TaqTM(宝生物工程有限公司),1 μmol/L引物,150 ng模板DNA。扩增步骤为94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,35个循环;72 ℃终延伸10 min;PCR反应扩增产物10 ℃保存。20 μL扩增产物与3 μL上样缓冲液、2 μL UltraPower DNA染料混合经1.5%琼脂糖凝胶于110 V电泳30 min,显色进行带型统计。
表2 扩增MAP30启动子区域引物序列
Tab.2 The primers used for amplifying MAP30 promoter
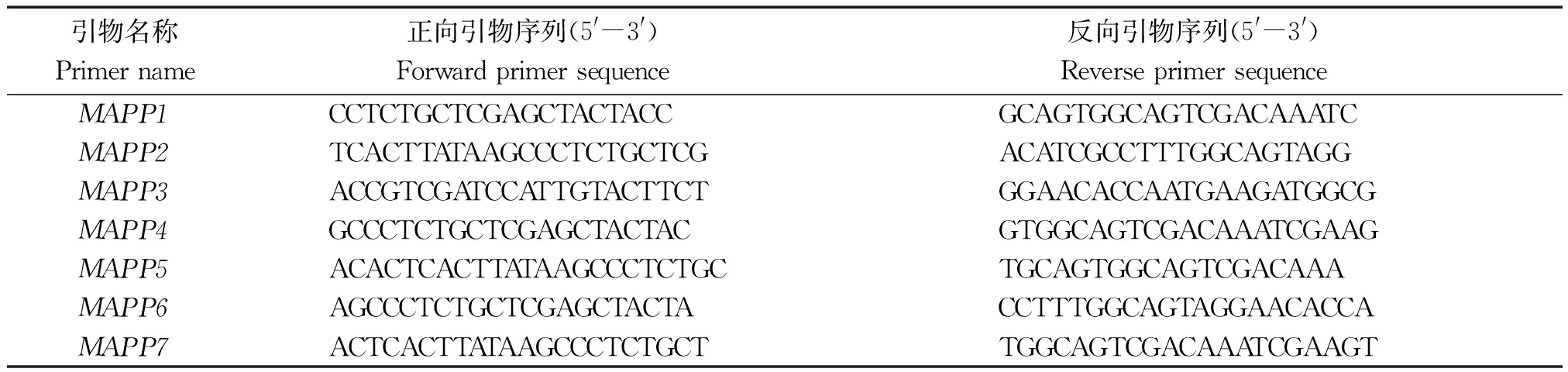
引物名称Primername正向引物序列(5'-3')Forwardprimersequence反向引物序列(5'-3')ReverseprimersequenceMAPP1CCTCTGCTCGAGCTACTACCGCAGTGGCAGTCGACAAATCMAPP2TCACTTATAAGCCCTCTGCTCGACATCGCCTTTGGCAGTAGGMAPP3ACCGTCGATCCATTGTACTTCTGGAACACCAATGAAGATGGCGMAPP4GCCCTCTGCTCGAGCTACTACGTGGCAGTCGACAAATCGAAGMAPP5ACACTCACTTATAAGCCCTCTGCTGCAGTGGCAGTCGACAAAMAPP6AGCCCTCTGCTCGAGCTACTACCTTTGGCAGTAGGAACACCAMAPP7ACTCACTTATAAGCCCTCTGCTTGGCAGTCGACAAATCGAAGT
1.2.3 MAP30启动子序列分析 利用在线软件FGENESH预测MAP30基因转录起始位点。利用在线分析工具P1antCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测MAP30启动子区域顺式作用调控元件[25]。
1.2.4 MAP30启动子单倍型分析 采用BioEdit软件对不同苦瓜种质MAP30启动子序列进行多序列比对,分析MAP30启动子区域SNPs和InDels分布情况,分析MAP30启动子单倍型及调控元件差异。
2 结果与分析
2.1 MAP30基因启动子片段克隆
为了获得MAP30启动子序列,从MAP30基因起始密码子下游200 bp内利用软件Primer 5.0设计引物,获取起始密码子上游1.5 kb左右的序列,共设计7对引物。以苦瓜种质Y5叶片基因组DNA为模板,进行PCR扩增,其中引物MAPP1扩增条带单一,目的片段为1 600 bp左右,与预期片段大小吻合,回收特异片段、连接、转化、测序,获得1 682 bp的序列,经与MAP30编码序列比对发现,起始密码子(ATG)位于1 582 bp处,且起始密码子下游编码序列完全与MAP30编码序列相匹配,证明所克隆序列为MAP30基因上游启动子序列。MAP30基因转录起始位点(TSS)利用FGENESH软件进行预测,预测结果表明,TSS位于MAP30起始密码子上游52 bp处,位于目的片段1 530 bp位点(C)。选取转录起始位点上游1 500 bp序列进行启动子顺式作用元件分析(图1)。
2.2 MAP30基因启动子序列分析
MAP30基因启动子序列经P1antCARE软件分析,结果表明,多个顺式作用调控元件存在于MAP30基因启动子区域(图1、表3)。其中1 461(-39)~1 464 bp(-36)位置含有1个TATA-box,即RNA聚合酶结合位点,能够保证转录起始的准确性。调控转录起始频率的CAAT-box元件位于1 419(-81)~1 422 bp(-78)位置,综合以上分析结果表明,MAP30核心启动子区域位于TSS上游-39~-81区域。另外,发现多个光响应元件,28个元件中与光响应相关的有10个,占35.7%。如AT1-motif、Box 4、Box Ⅰ、Box Ⅱ、CATT-motif、G-Box、GAG-motif、GATA-motif、GT1-motif、TCT-motif等。植物激素响应元件,如脱落酸响应元件ABRE、乙烯响应元件ERE。特异表达元件,如CCGTCC-box、Skn-1_motif;防御与生物、非生物胁迫响应相关的元件,如TC-rich repeats、TCA-element、HSE、MBS、ARE、GC-motif。昼夜节律调控响应元件,如circadian。预测结果表明,该启动子可能参与光、厌氧、逆境胁迫、脱落酸、水杨酸和乙烯等诱导,同时它还可能参与胚乳高效表达及昼夜节律调控。


图1 MAP30启动子序列
Fig.1 The promoter sequence of MAP30 in bitter gourd
2.3 MAP30基因启动子单倍型分析
以MAPP1为引物,以其余29份苦瓜种质基因组DNA为模板进行扩增,回收目的片段进行测序,以MAP30(Y5)启动子序列为参考序列进行比对,结果如图2所示,共发现37个SNPs位点和6个InDels,SNPs位点分别是100位点的A/G,342位点的T/C、363位点的T/A、387位点的G/C、409位点的C/A、584位点的A/G、610位点的C/T、783位点的G/T、788位点的G/T、807位点的G/C、812位点的T/A、820位点的T/C、833位点的A/C、867,868,869位点的GAA/TCG,872位点的A/G、875位点的G/A、881位点的A/G、930位点的G/A、947位点的T/C、1022位点的G/A、1062位点的A/G、1075位点的G/C、1087位点的T/G、1111位点的T/A、1125位点的G/T、1128位点的A/G、1189位点的A/G、1200位点的A/C、1207位点的G/A、1237位点的C/T、1244位点的G/T、1368位点的G/A、1383位点的G/A、1402位点的C/T、1437位点的C/G。6个InDels位点分别是951-952位点的--/GT、1238-1240位点的AAG/---、1273位点的T/-、1285-1287位点的AAA/---、1305位点的A/-、1372位点的-/G。(图2)。通过SNPs分组发现,30份苦瓜种质资源MAP30基因启动子共存在3种单倍型。Y5、Y7、Y16、Y39、Y58、Y60、Y66、Y77、Y83、Y96、Y100、Y112、Y121属于第1组,Y43、Y50、Y90、Y108、Y113、Y115、Y140、Y141、Y144属于第2组,Y69、Y72、Y85、Y131、Y139、Y146、Y147、Y153属于第3组。结合顺式调控元件的位置,其中5个SNPs(342位点的T/C、584位点的A/G、783位点的G/T、872位点的A/G、1087位点的T/G)位于顺式调控元件内部,涉及的顺式调控元件分别为MBSI、ABRE、ARE、5UTR Py-rich stretch、GAG-motif、TC-rich repeats,SNP导致转录因子结合位点发生改变,可能对MAP30基因的表达调控有重要作用。
表3 MAP30启动子区域顺式作用调控元件
Tab.3 The cis-acting regulation elements in MAP30 promoter region
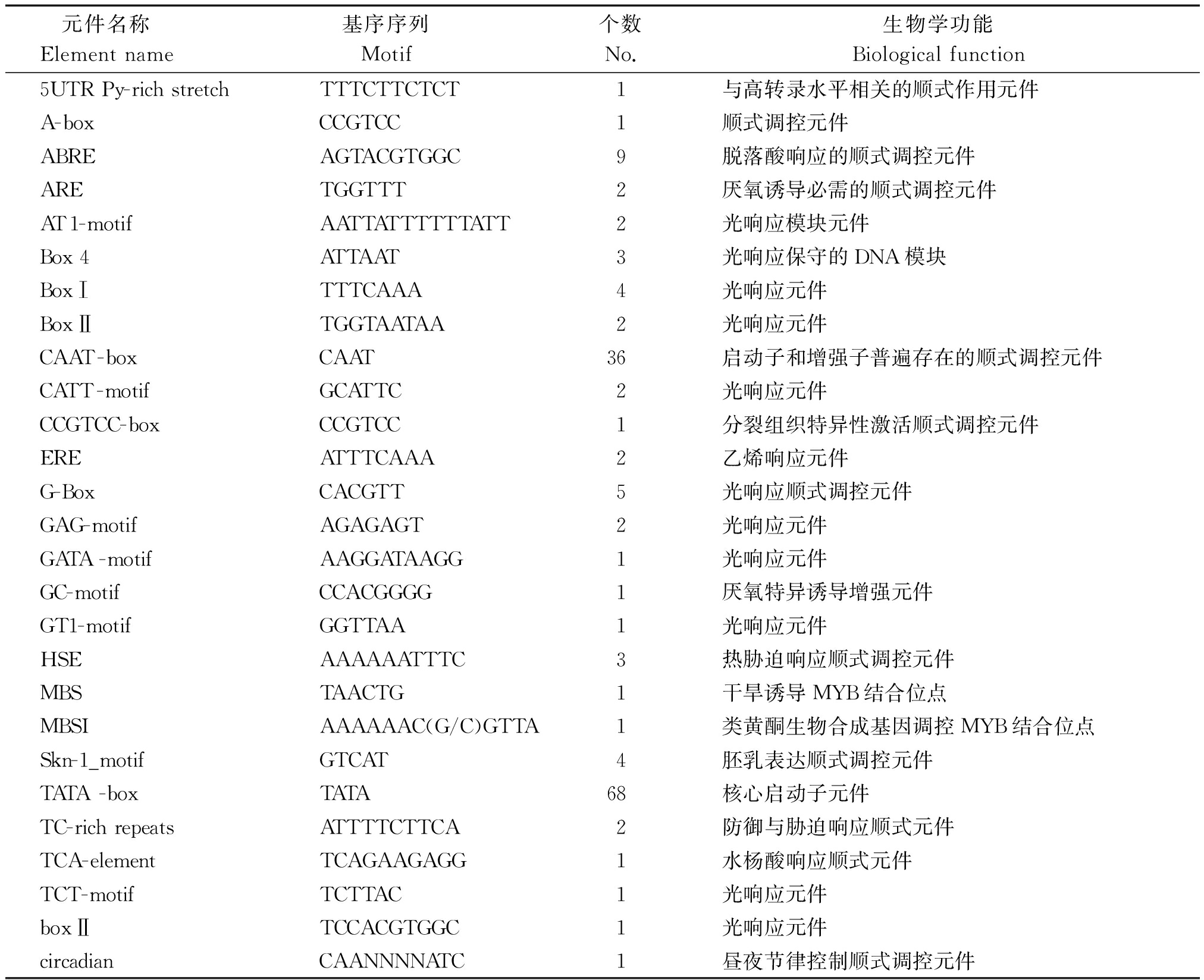
元件名称 Elementname 基序序列 Motif 个数No.生物学功能Biologicalfunction5UTRPy-richstretchTTTCTTCTCT1与高转录水平相关的顺式作用元件A-boxCCGTCC1顺式调控元件ABREAGTACGTGGC9脱落酸响应的顺式调控元件ARETGGTTT2厌氧诱导必需的顺式调控元件AT1-motifAATTATTTTTTATT2光响应模块元件Box4ATTAAT3光响应保守的DNA模块BoxⅠTTTCAAA4光响应元件BoxⅡTGGTAATAA2光响应元件CAAT-boxCAAT36启动子和增强子普遍存在的顺式调控元件CATT-motifGCATTC2光响应元件CCGTCC-boxCCGTCC1分裂组织特异性激活顺式调控元件EREATTTCAAA2乙烯响应元件G-BoxCACGTT5光响应顺式调控元件GAG-motifAGAGAGT2光响应元件GATA-motifAAGGATAAGG1光响应元件GC-motifCCACGGGG1厌氧特异诱导增强元件GT1-motifGGTTAA1光响应元件HSEAAAAAATTTC3热胁迫响应顺式调控元件MBSTAACTG1干旱诱导MYB结合位点MBSIAAAAAAC(G/C)GTTA1类黄酮生物合成基因调控MYB结合位点Skn-1_motifGTCAT4胚乳表达顺式调控元件TATA-boxTATA68核心启动子元件TC-richrepeatsATTTTCTTCA2防御与胁迫响应顺式元件TCA-elementTCAGAAGAGG1水杨酸响应顺式元件TCT-motifTCTTAC1光响应元件boxⅡTCCACGTGGC1光响应元件circadianCAANNNNATC1昼夜节律控制顺式调控元件
3 讨论
启动子作为精确调控基因表达的重要元件[26],位于结构基因5′端上游,能够活化RNA聚合酶,使之与模板DNA准确结合,另外启动子区含有一系列顺式作用元件[27],决定转录起始方向和效率,控制基因表达的起始时间、空间和表达程度[28]。
MAP30是从苦瓜果实和种子中分离纯化得到的一种单链I型核糖体失活蛋白[29],具有抗肿瘤[20]、抗菌[30]、抗病毒[31]等多种生物学活性。为了分析MAP30基因启动子特征特性,本研究从MAP30基因起始密码子下游200 bp内设计引物,获取1 682 bp的序列,经与MAP30编码序列比对发现,起始密码子(ATG)位于1 582 bp处,且起始密码子下游编码序列完全与MAP30编码序列相匹配,证明所克隆序列为MAP30基因上游启动子序列。选取MAP30基因转录起始位点上游1 500 bp的序列作为启动子序列进行了研究,对启动子进行了结构预测,分析结果表明,MAP30启动子序列不但含有植物启动子所具有的基本顺式调控元件CAAT-box和TATA-box等,还含有其他多个与光、激素、防御胁迫等相关的顺式作用调控元件。MAP30启动子尤其与光响应密切相关,28个元件中与光响应相关的有10个,占35.7%,进而推测光在MAP30基因表达过程中具有重要作用。另外,启动子序列含有逆境胁迫、厌氧及水杨酸响应元件,推测该基因具有抵抗不利条件,参与植物早期的过敏反应并在植物的抗病过程中发挥重要作用,这与前期MAP30蛋白生物活性研究结果一致[32]。MAP30启动子含有与胚乳表达相关的元件,推测MAP30在种子中高效表达,这与以往研究一致,以往研究主要从苦瓜种子中提取MAP30蛋白[33-34]。另外还预测到水杨酸响应元件,该结果表明,MAP30启动子可能并不完全属于组织或器官型启动子,还有可能是诱导型启动子。


图2 MAP30启动子序列SNPs和InDels分布情况
Fig.2 The SNPs and InDels distribution of MAP30 promoter in bitter gourd germplasm
本研究以30份苦瓜种质为材料,分析了MAP30启动子区域SNPs和InDels分布情况,共发现37个SNPs位点和6个InDels,通过SNPs和InDels分组发现,30份苦瓜种质资源共存在3种单倍型。结合MAP30启动子区域顺式调控元件预测结果来看,5个SNPs位于顺式调控元件区域,SNPs导致转录因子结合位点发生改变,可能对MAP30基因的表达调控有重要作用。在下一步的研究计划中,将开展不同单倍型与MAP30表达水平的相关性分析。
参考文献:
[1] 周丽英,卜璐璐,杨春雷,等.西瓜果实AGPL1基因启动子的序列分析[J].亚热带植物科学,2016,45(2):122-126.
[2] 聂丽娜,夏兰琴,徐兆师,等.植物基因启动子的克隆及其功能研究进展[J].植物遗传资源学报,2008,9(3):385-391.
[3] 成晓静,田 甜,周丽英,等.甜瓜黄瓜素基因启动子的序列及元件分析[J].分子植物育种,2016,14(9):2268-2273.
[4] Valerie R,Michael K,Peter O.Transcriptional regulation of gene expression in C.elegans[J].WormBook the Online Review of C Elegans Biology,2013,4(5):1-34.
[5] Lee T I,Young R A.Transcriptional regulation and its misregulation in disease[J].Cell,2013,152(6):1237-1251.
[6] 陈 铭.后基因组时代的生物信息学[J].生物信息学,2004,2(2):29-34.
[7] 刘玉瑛,张江丽.几个真核生物启动子计算机预测数据库资源概述[J].湖南农业科学,2007(4):70-71,74.
[8] 栾 杰,陈秀玲,侯莉华,等.MAP30基因转化烟草的研究[J].东北农业大学学报,2012,43(7):109-112.
[9] Fang E F,Zhang C Z,Zhang L,et al.Trichosanthin inhibits breast cancer cell proliferation in both cell lines and nude mice by promotion of apoptosis[J].Plos One,2012,7(9)e41592.
[10] Sun Y, Sun F, Li J, et al. Mono-PEGylation of Alpha-MMC and MAP30 from Momordica charantia L.: production, identification and anti-tumor activity [J]. Molecules, 2016, 21(11): e1457.
[11] Moghadam A, Niazi A, Afsharifar A, et al. Expression of a recombinant Anti-HIV and anti-tumor protein, MAP30, in Nicotiana tobacum hairy roots: A pH-Stable and Thermophilic Antimicrobial Protein [J]. PLoS One, 2016, 11(7):e0159653.
[12] Qian S, Sun L, Li J, et al. MAP30 inhibits autophagy through enhancing acetyltransferase p300 and induces apoptosis in acute myeloid leukemia cells [J]. Oncol Rep, 2016, 35(6):3705-3713.
[13] Caizhen G, Yan G, Ronron C, et al. Zirconium phosphatidylcholine-based nanocapsules as an in vivo degradable drug delivery system of MAP30, a momordica anti-HIV protein [J]. Int J Pharm, 2015, 483(1-2):188-199.
[14] Rothan H A, Bahrani H, Mohamed Z, et al. Fusion of protegrin-1 and plectasin to MAP30 shows significant inhibition activity against Dengue virus replication [J]. PLoS One, 2014, 9(4):e94561.
[15] Meng Y, Liu S, Li J, et al. Preparation of an antitumor and antivirus agent: chemical modification of α-MMC and MAP30 from Momordica Charantia L. with covalent conjugation of polyethyelene glycol [J]. Int J Nanomedicine, 2012, 7(1):3133-3142.
[16] 林育泉,周 鹏,曾召绵.苦瓜MAP30蛋白基因克隆、表达及其抗肿瘤活性研究[J].中国生物工程杂志,2005,25(5):60-66.
[17] 樊剑鸣,朱 沙,罗 俊,等.苦瓜蛋白MAP30在毕赤酵母中的表达及其诱发胃腺癌细胞MCG803凋亡的研究[J].现代预防医学,2009,36(10):1932-1934.
[18] 樊剑鸣,张晓峰,张 巧,等.重组苦瓜MAP30蛋白对大肠癌LoVo细胞凋亡的影响[J].郑州大学学报:医学版,2009,44(1):116-119.
[19] 朱振洪,杨威威,葛立军,等.MAP30全长基因的克隆及在巴斯德毕赤酵母中的高效表达研究[J].中国医药生物技术,2010,5(2):110-116.
[20] 韩晓红,邵世和,薛延军,等.重组苦瓜叶蛋白MAP30诱导人食管癌细胞株EC-1.71凋亡的实验研究[J].临床检验杂志,2011,29(5):354-357.
[21] 邱华丽,穰 杰,丁学知,等.苦瓜MAP30蛋白的原核表达及其生物活性研究[J].中国生物工程杂志,2014,34(6):40-46.
[22] 刘子记,牛 玉,朱 婕,等.苦瓜核心种质资源构建方法的比较[J].华南农业大学学报,2017,38(1):31-37.
[23] 刘子记,牛 玉,杨 衍.热研一号油绿苦瓜种子纯度的SSR鉴定[J].热带作物学报,2013,34(11):2179-2182.
[24] Urasaki N,Takagi H,Natsume S,et al.Draft genome sequence of bitter gourd (Momordica charantia),a vegetable and medicinal plant in tropical and subtropical regions[J].DNA Research:an International Journal for Rapid Publication of Reports on Genes and Genomes,2017,24(1):51-58.
[25] Lescot M,Déhais P,Moreau Y,et al.A database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J].Nucleic Acids Research,2002,30(1):325-327.
[26] 魏桂民,张金文,王 蒂,等.马铃薯sgt2基因启动子的克隆与活性分析[J].甘肃农业大学学报,2014,53(1):41-47.
[27] 朱玉贤,李 毅.现代分子生物学[M].2版,北京:高等教育出版社,2007.
[28] 李永梅,冯玉杰,曹新文,等.能源橡胶草GGPPS基因启动子的克隆及瞬时表达研究[J].草业学报,2016,25(12):180-187.
[29] Lee-Huang S,Huang P L,Nara P L,et al.MAP30:a new inhibitor of HIV-1 infection and replication[J].FEBS Letters,1990,272(1/2):12-18.
[30] 王美娜,潘 娟,王 楠,等.苦瓜蛋白MAP30的抗菌作用及PTD-MAP30跨克氏原螯虾肠膜功能的研究[J].生物学通报,2015,50(10):43-45.
[31] 王临旭,孙永涛,杨为松,等.植物蛋白MAP30体外抗HIV-1的实验研究[J].解放军医学杂志,2003,28(10):894-896.
[32] 樊剑鸣,许 君,张 巧,等.苦瓜核糖体失活蛋白MAP30基因的表达及特性分析[J].郑州大学学报:医学版,2008,43(6):1142-1146.
[33] Arazi T,Lee Huang P,Lin Huang P,et al.Production of antiviral and antitumor proteins[J].Biochem Biophys Res Commun,2002,292(2):441-448.
[34] Mock J W,Ng T B,Wong R N,et al.Demonstration of ribonuclease activity in the plant ribosome-inactivating proteins alpha- and beta-momorcharins[J].Life Sci,1996,59(22):1853-1859.