小麦是我国的主粮作物之一,常年遭受病原菌的侵染,其中,由小麦条锈菌(Puccinia striiformis f.sp.tritici)引起的条锈病属世界性禾谷类病害,是危害小麦生产的重要病害之一[1-3]。小麦感染条锈病后各项生理机能失常,导致小麦生长发育受阻,严重威胁着小麦的产量和品质[4],2002年全国条锈病大暴发曾导致小麦减产14亿kg[5],造成重大经济损失。因此,广泛发掘抗病基因、选育抗病品种对减少小麦产量损失尤为迫切[6]。
彭提卡偃麦草(Th.ponticum,2n=10x=70,StStEeEbEx)是禾本科小麦族中的多年生草本植物,具有抗病、抗旱、优质、耐盐碱等诸多优异性状,是小麦遗传改良的重要外源基因库[7]。在20世纪70年代,李振声[8]最先利用长穗偃麦草与普通小麦杂交,从后代中选育出小偃7430等一系列八倍体小偃麦材料,以及小偃6号等小麦品种,其中,小偃6号对条锈菌的抗性保持了20年之久,在我国小麦抗病育种中具有重要意义。此外,从长穗偃麦草中还分离鉴定出抗条锈病基因YrTP1、YrTP2以及具有正式命名的Yr69,分别被定位于小麦2BS、7BL和2AS上[9-10]。
CH7056是作物遗传与分子改良山西省重点实验室从20世纪90年代开始,利用小偃7430与感病普通小麦品种杂交回交后选育出的抗病品系之一。在四川成都多年的鉴定结果表明,CH7056对当地流行的条锈菌种条中32、条中33以及高毒性小种v26均表现为免疫;而且利用细胞学技术在CH7056中鉴定不到外源染色体片段,能最大程度地减少连锁累赘,具有较高的育种应用价值。
本研究利用芯片技术和常规分子标记技术对CH7056的遗传群体进行成株期抗性分析,旨在明确其携带抗病基因的数目和位置,并通过开发偃麦草特异标记鉴定其抗病性来源。
1 材料和方法
1.1 供试材料
抗性鉴定材料为小麦CH7056/SY95-71重组自交系(F7和F8,共112家系)及其亲本,用于抗性来源分析的材料为八倍体长穗偃麦草和小偃7430,均由作物遗传与分子改良山西省重点实验室提供。供试菌种为条锈菌混合菌种CYR32+33+v26,由四川省农业科学院作物科学研究所杨恩年研究员提供。
1.2 试验方法
1.2.1 材料种植及抗性鉴定 试验材料于2013,2014年种植于四川成都。播种行长2 m,宽20 cm,每行种植15粒。每隔5行设置1行小麦感病对照品种铭贤169,每行的行首和行尾各种植1孔诱发材料SY95-71。RILs群体按单株种植。在小麦拔节期对诱发材料接种混合菌种,接种14 d后,待感病对照充分发病时,按叶部病害0~4级法对群体和亲本材料进行鉴定[11]。
1.2.2 抗病位点分析 在三叶期从亲本以及每个RILs F8单株上剪取叶片,采用CTAB法提取总DNA[12]。从中分别选择2013,2014年鉴定结果均表现为抗病(0或0;级)和感病(4级)的10个F8单株的DNA等量混合,构建抗感池。将亲本以及抗感池DNA寄往澳大利亚Diversity Arrays Technology公司(DArT®,http://www.diversityarrays.com/)进行芯片扫描,该芯片包含27 166个具有基因组位置信息的DArT标记。根据多态性DArT标记分布位置初步确定抗病位点。
1.2.3 外源特异标记开发 利用中间偃麦草(StEeEb)相关同源群的标记序列检索本研究中抗病位点所在的小麦基因组序列[13],对获得的小麦scaffold序列诊断SSR位点并开发相应分子标记,随后利用彭提卡偃麦草(StStEeEbEx)、八倍体小偃7430(ABD+StEeEbEx)和普通小麦(ABD)材料从中筛选出能鉴定出外源片段的特异SSR标记,用来分析CH7056中是否携带有来自于其外源亲本长穗偃麦草的序列片段。
1.2.4 基因定位 利用聚丙烯酰胺凝胶电泳技术和银染法,筛选抗病位点所在染色体上的公共SSR标记 (GrainGenes,http://wheat.pw.usda.gov/)以及新开发的物种特异SSR标记,将得到的多态性SSR标记扩增RIL F8群体定位抗病基因,利用JoinMap v4.0软件构建遗传图谱。
2 结果与分析
2.1 群体抗性遗传分析
抗病鉴定结果显示(表1),CH7056对混合条锈菌种免疫(IT=0),SY95-71则表现为重度感病(IT=4),RILs家系中抗感单株比例在2013年和2014年间均接近1∶1,符合显性单基因遗传的孟德尔分离模型,由此推断,CH7056中携带有1个显性的抗条锈病基因,暂命名为YrCH7056。
表1 小麦CH7056/SY95-71 RIL群体及其亲本对混合条锈小种CYR32+33+v26成株期的抗性
Tab.1 Adult plant resistance to mixed Pst pathotypes CYR32+33+v26 of CH7056/SY95-71 RIL population and its parents
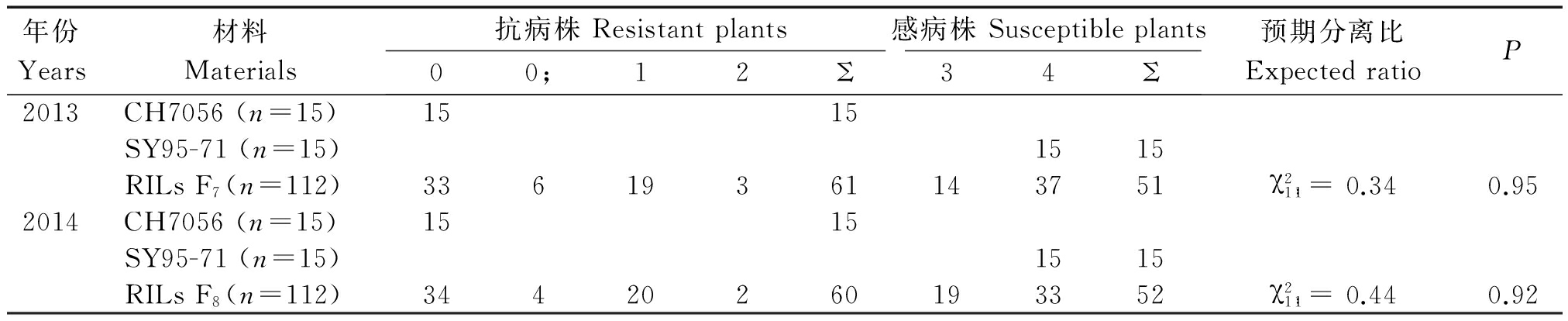
年份Years材料Materials抗病株Resistantplants感病株Susceptibleplants00;12Σ34Σ预期分离比ExpectedratioP2013CH7056(n=15)1515SY95-71(n=15)1515RILsF7(n=112)33619361143751χ21∶1=0.340.952014CH7056(n=15)1515SY95-71(n=15)1515RILsF8(n=112)34420260193352χ21∶1=0.440.92
2.2 抗病位点确定
芯片扫描结果显示(图1),共有1 565个DArT位点在亲本及抗、感池间具有多态性,多态性比率为5.8%。其中,有629个位点分布于1B基因组上,占全部多态性位点的40.2%;有322个(51.2%)集中位于1B基因组的260 000 000~450 000 000区段(图2-A)。由此初步推测,YrCH7056可能位于小麦1B染色体上。
2.3 抗病基因定位及抗性来源分析
利用中间偃麦草第一同源群的标记序列比对小麦1B基因组,获得包含SSR位点的659条小麦scaffolds,据此开发出246对SSR标记,并从中筛选出72对可鉴定外源序列片段的SSR标记(表2)。
利用72对偃麦草特异SSR标记以及小麦1B染色体上的129对常规SSR标记[14],对CH7056、SY95-71和抗感池进行扩增,筛选出6条多态性SSR标记,依次为gwm11、barc137、1BL-3848555、barc240、barc181和barc256,最终将YrCH7056定位在小麦1BL染色体上(图2-b),侧翼标记为1BL-3848555-1.1cM- YrCH7056-2.5cM-barc240(图3)。
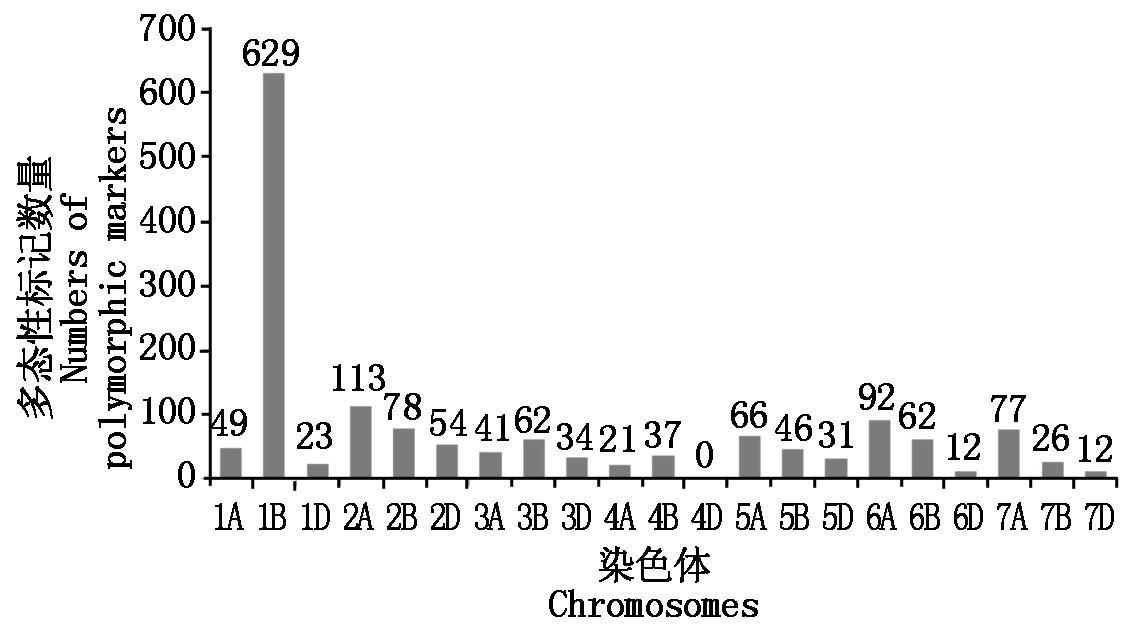
图1 多态性DArT标记在染色体上的分布
Fig.1 Chromosome distribution of polymorphic DArT markers
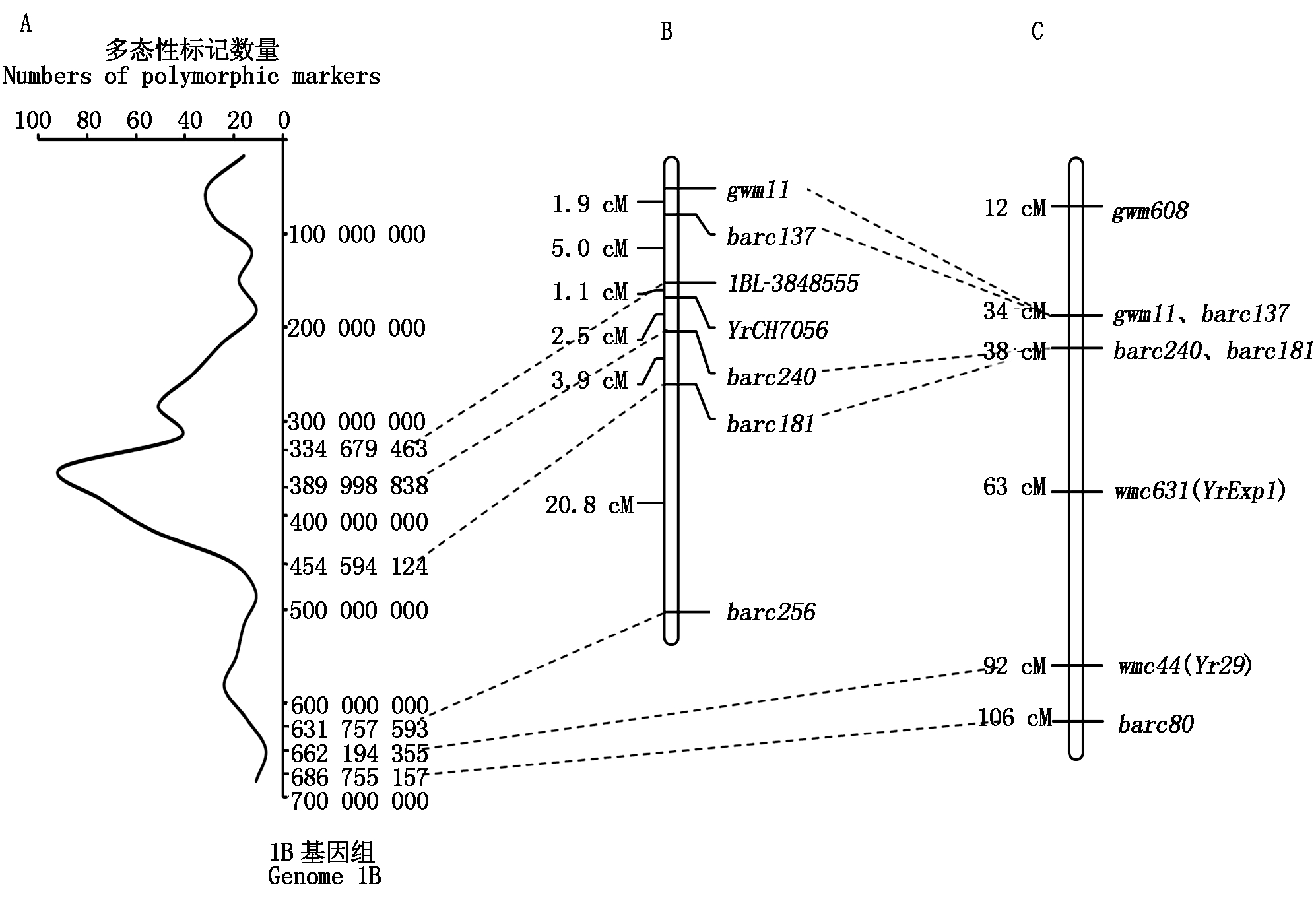
A.多态性DArT标记在1B基因组的分布;B.YrCH7056遗传图谱;C.1B遗传图谱[12]。
A.Distribution of polymorphic DArT markers in 1B genome;B.YrCH7056 genetic map;C.1B genetic map[12].
图2 YrCH7056定位图谱
Fig.2 Mapping of YrCH7056
表2 基于小麦基因组序列的偃麦草特异SSR标记开发
Tab.2 Development of Thinopyron-specific SSR markers based on wheat genomic sequences
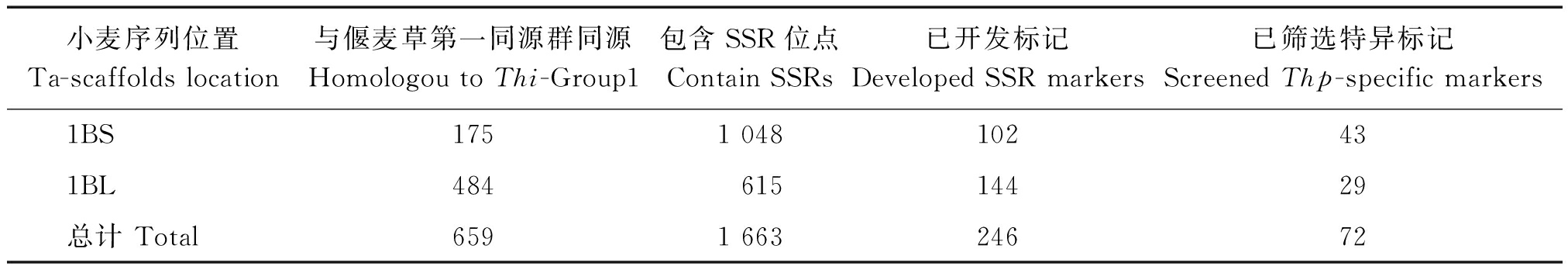
小麦序列位置Ta-scaffoldslocation与偃麦草第一同源群同源HomologoutoThi-Group1包含SSR位点ContainSSRs已开发标记DevelopedSSRmarkers已筛选特异标记ScreenedThp-specificmarkers1BS1751048102431BL48461514429总计Total659166324672
其中,物种特异SSR标记1BL-3848555在CH7056中的扩增条带与在彭提卡偃麦草和小偃7 430中的条带一致,并且该标记与YrCH7056连锁,表明YrCH7056很可能来自于其外源亲本彭提卡偃麦草(图3)。

图3 YrCH7056侧翼SSR标记1BL-3848555 (A)和barc240 (B)的扩增图谱
Fig.3 Amplification profiles of 1BL-3848555 (A) and barc240 (B),the flanking SSR markers of YrCH7056
3 讨论与结论
3.1 抗性基因来源
彭提卡偃麦草是小麦抗性改良的优异近缘种,迄今为止,已从彭提卡偃麦草向普通小麦中导入了抗条锈(Yr)[10]、抗叶锈(Lr)[15]和抗秆锈(Sr)[16]等多种抗锈病基因。CH7056即是由彭提卡偃麦草-小麦八倍体材料小偃7430与普通小麦品种杂交回交后选育出的渗入系,对当前流行条锈菌种表现出优异且持久的成株期抗性,而且利用细胞学技术在CH7056中检测不到外源染色体信号,表明其可能很少存在连锁累赘[17],具有较高的育种价值。为了证实CH7056中抗条锈病基因的来源,本研究开发了一批能鉴定出偃麦草特异片段的SSR标记,其中,1BL-3848555在彭提卡偃麦草、小偃7430和CH7056中扩增出了一致的条带,并且该标记与YrCH7056紧密连锁。初步推断,YrCH7056来自于彭提卡偃麦草。
利用72对偃麦草特异SSR标记以及小麦1B染色体上的129对常规SSR标记[14],对CH7056、SY95-71和抗感池进行扩增,筛选出6条多态性SSR标记,最终将YrCH7056定位在小麦1BL染色体上,侧翼标记为1BL3848555-1.1cM- YrCH7056-2.5cM-barc240。
3.2 YrCH7056不同于其他已知抗性基因
本研究最终筛选出6个SSR标记,将YrCH7056定位在小麦1BL染色体上,与来自彭提卡偃麦草的YrTP1(2BS)、YrTP2[9](7BL)和Yr69[10](2AS)位于不同的染色体。此外,小麦1BL染色体上目前已定位的抗条锈病基因有Yr3a-c[18]、Yr21[19]、Yr29[20]和YrExp1[21],其中,Yr3a-c、Yr21均为苗期抗病基因,并且抗性来源于普通小麦,与YrCH7056不是同一基因。而Yr29和YrExp1虽然也表现为成株期抗性,但都来源于普通小麦,并且二者的紧密连锁标记wmc44(Yr29)和wmc631(YrExp1)与YrCH7056的遗传距离较远,不在同一位点。因此推断,YrCH7056可能是一个新的抗条锈病基因。
3.3 YrCH7056的育种潜力和价值
偃麦草具有诸多小麦缺乏的优良基因及性状,是小麦遗传改良的优质资源[22]。挖掘、鉴定、利用新的有效抗条锈病基因,可丰富小麦抗病资源,为培育持久小麦抗病新品种提供物质储备。本研究的YrCH7056可用于小麦条锈病成株抗性改良分子育种,而与其连锁的分子标记,为基因图位克隆及分子标记辅助育种奠定基础。小麦抗条锈菌具有高度变异性,抗原单一的抗病品种易失去抗性,该基因可与其他有效的抗条锈病基因结合起来,通过杂交、回交、复交等技术应用于聚合育种,延长其用于控制小麦条锈病危害的时间[23-25]。
参考文献:
[1] 曹华宁. 小麦条锈菌热激蛋白hsp70的克隆与热胁迫下的表达分析[D]. 北京:中国农业科学院,2014.
[2] 王步云. 小麦条锈菌中国鉴别寄主尤皮Ⅱ号抗条锈病基因的精细定位[D]. 北京:中国农业科学院,2014.
[3] 王 乐,张晓军,郭慧娟,等.抗条锈病小偃麦渗入系的HMW-GS组成分析[J].山西农业科学,2013,41(10):1027-1030.
[4] 侯丽媛,乔麟轶,张晓军,等.抗条锈病基因YrCH5026的遗传分析及分子定位[J].华北农学报,2015,30(5):7-15.
[5] 詹海仙. 小偃麦衍生品系鉴定及白粉病和条锈病抗病基因定位[D]. 西安:电子科技大学,2015.
[6] 李 欣,畅志坚,詹海仙,等. 小麦抗条锈病基因来源及染色体定位的研究进展[J]. 中国农学通报, 2015,31(5):92-95.
[7] Li H J,Wang X M.Thinopyrum ponticum and Th.intermedium:the promising source of resistance to fungal and viral diseases of wheat[J].J Genet Genomics,2009,36(9):557-565.
[8] 李振声.小麦远缘杂交新品种——小偃6号[J].山西农业科学,1986(5):30.
[9] 殷学贵,尚勋武,庞斌双,等.1A-3中抗条锈新基因YrTp1和YrTp2的分子标记定位分析[J].中国农业科学,2006,39(1):10-17.
[10] Hou L Y,Jia J Q,Zhang X J,et al. Molecular mapping of the stripe rust resistance gene Yr69 on wheat chromosome 2AS[J].Plant Dis,2016,100(8):1717-1724.
[11] 李 欣,张晓军,张丛卓,等.兼抗白粉、条锈病小偃麦渗入系CH7124抗性遗传及细胞学鉴定[J].植物遗传资源学报,2012,13(4):577-588.
[12] Petya S, Marieta T, Tzveta G, et al. A Modified CTAB method for DNA extraction from soybean and meat products[J]. Biotechnol & Biotechnol Eq, 2013, 27(3): 3803-3810.
[13] Kantarski T,Larson S,Zhang X,et al.Development of the first consensus genetic map of intermediate wheatgrass (Thinopyrum intermedium) using genotyping-by-sequencing[J].Theor Appl Genet,2016,130(1):1-14.
[14] Somers D J,Isaac P,Edwards K.A high-density microsatellite consensus map for bread wheat (Triticum aestivum L.)[J].Theor Appl Genet,2004,109(6):1105-1114.
[15] 刘 成,闫红飞,宫文萍,等.小麦叶锈病新抗源筛选[J].植物遗传资源学报,2013,14(5):936-944.
[16] 尹 静,王广金,张宏纪,等.小麦秆锈抗性遗传及抗性基因研究进展[J].植物遗传资源学报,2007,8(1):106-112.
[17] Qi L,Friebe B,Zhang P,et al.Homoeologous recombination,chromosome engineering and crop improvement[J].Chromosome Res,2007,15:3-19.
[18] Chen X M,Line R F.Inheritance of stripe rust resistance in wheat cultivars postulated to have resistance genes at Yr3 and Yr4 loci[J].Phytopathology,1993,83(4):382-388.
[19] Pahalawatta V,Chen X M.Genetic analysis and molecular mapping of wheat genes conferring resistance to the wheat stripe rust and barley stripe rust pathogens[J].Phytopathology,2005,95(4):427-432.
[20] William M,Singh R P,Huerta-Espino J,et al.Molecular marker mapping of leaf rust resistance gene Lr46 and its association with stripe rust resistance gene Yr29 in wheat[J].Phytopathology,2003,93(2):153-159.
[21] Lin F,Chen X M.Molecular mapping of genes for race-specific overall resistance to stripe rust in wheat cultivar express[J].Theor Appl Genet,2008,116(6):797-806.
[22] 孙善澄.小麦与偃麦草远缘杂交的研究[J].华北农学报,1987,11(2):7-12.
[23] 康振生,王晓杰,赵 杰,等. 小麦条锈菌致病性及其变异研究进展[J].中国农业科学,2015,48(17):3439-3453.
[24] 张小娟. 小麦抗条锈病基因Yr26的精细作图[J].西安:西北农林科技大学,2013.
[25] 鲁秀梅,张 宁,陈劲枫,等. 作物基因聚合育种的研究进展[J].分子植物育种,2017,15(4):1445-1454.