叶绿素是绿色植物进行光合作用的必需物质,其含量高低是反映绿色植物叶片光合作用能力的重要指标[1],且叶绿素含量与作物的氮含量、种植密度等也密切相关,已有许多相关报道[2-4]。
油菜是世界第二大油料作物,也是我国最大的自产油料作物[5],通过降低饱和脂肪酸含量,增加不饱和脂肪酸含量进而改变菜油脂肪酸组成是油菜育种的重要目标之一,如“双低油菜”和高油酸油菜等[6-7],受到众多育种家的关注。不饱和脂肪酸是构成叶绿体膜骨架的主要成分,是光合作用所必需的[8],其中亚油酸与亚麻酸是人体必需脂肪酸,有较好的营养保健作用[9-10]。fad2编码ω-6型不饱和脂肪酸去饱和酶,是控制油酸向亚油酸转化的关键基因,直接决定了种子中储存多不饱和脂肪酸的含量与比例[11];fad3编码ω-3型不饱和脂肪酸去饱和酶,是亚麻酸合成的关键基因[12]。对这2个基因进行分析,有助于从分子方面促进油菜脂肪酸组成改良研究的发展。
本研究分析了不同肥密条件下,甘蓝型油菜不同生育期的叶绿素含量及fad2、fad3基因表达情况,并探讨了叶绿素含量与fad2、fad3基因表达量之间的关系,以期发现不同栽培方式对叶绿素含量及基因表达的影响,为通过栽培方式改良油菜品质提供参考。
1 材料和方法
1.1 试验材料
甘蓝型油菜420,国家油料改良中心湖南分中心提供。
1.2 试验处理
试验于2016年10月-2017年4月在湖南农业大学浏阳基地进行。分别设氮(N)、硼(B)及种植密度各3个梯度,具体表示方法如表1,以正常肥密条件(A2B2C2)为对照,随机区组排列,共27个小区,每个小区面积10 m2,3个重复。所有小区施有效磷肥90 kg/hm2,有效钾肥165 kg/hm2做基肥,一次施入。其他农事操作均按当地管理措施操作。
表1 不同字符表示的肥密条件
Tab.1 Fat and density conditions represented by different characters
氮肥/(kg/hm2)N硼肥/(kg/hm2)B种植密度/(万株/hm2)Plantdensity90(A1)3.75(C1)34.5(B1)180(A2)7.50(C2)49.5(B2)270(A3)11.25(C3)64.5(B3)
1.3 样品制备
每个小区分别取幼苗期(2016年11月12日)、五-六叶期(2016年12月11日) 和蕾薹期( 2017年1月10 日) 嫩叶5片(每株1片),盛花期(2017年2月18日) 各材料取5株自交套袋的花,授粉后 20~35 d种子及角果皮(2017年3月25日) 用以提取RNA。另取各时期倒数第3片叶5片(每株1片),角果期取角果皮,用以叶绿素含量测定。以上材料各自混合,保存于-80 ℃备用。
1.3.1 叶绿素含量测定 取上述叶绿素含量测定所需材料,通过研磨法提取叶绿素,并用721型分光光度计(上海菁华科技仪器有限公司)测定吸光度。
1.3.2 RNA 提取取 上述RNA 提取材料,按照TransGene Biotech 公司的TransZol Up Plus RNA Kit试剂盒说明书提取总RNA,用琼脂糖凝胶电泳检测RNA无明显降解,Nanodrop 2000 微量紫外分光光度计(Thermo) 检测 RNA浓度与纯度良好,于-80 ℃保存备用。
1.3.3 定量PCR Premier 6.0设计fad2和fad3引物(表2),并用Oligo 7.0进行检测,由上海生工技术公司合成。用上述检测合格的RNA按照TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒说明书进行反转录。以刘芳等[13]所设PCR 反应程序对引物进行检测,使用CFX96TM Real-Time System(BIORAD,USA),按照TransScript Tip Green qPCR SuperMix试剂盒说明书,采用两步法进行qPCR反应。内参基因选用UBC9,基因表达情况采用Pfaffl[14]的方法进行评价。试验重复3次,取平均值。
表2 定量PCR引物及内参基因序列
Tab.2 Sequences of primer and reference gene used for quantitative real-time PCR validation of gene expression

基因名称Genename基因IDGeneID序列(5'-3')Sequencefad2AF243045F:TTCCACTCCTTCCTCCTCGTCR:TTGCCGTACCACTTGATGTCTGfad3AT2G29980F:GATGATGTAAGGAACACCGTR:ACTTGCTGGTCCATAATGTTGUBC9AT4G27960F:TCCATCCGACAGCCCTTACTCTR:ACACTTTGGTCCTAAAAGCCACC
1.4 统计分析
测得的数据以SPSS 20.0处理,并用 Excel 2010作图。
2 结果与分析
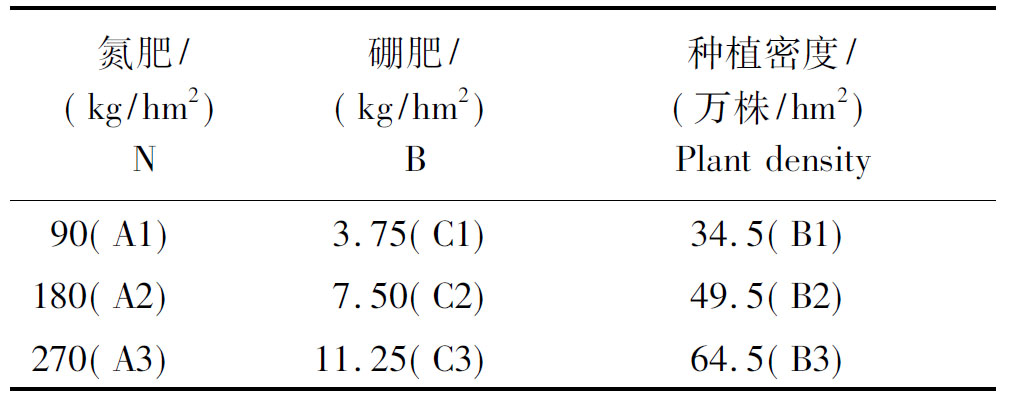
2.1 不同时期叶绿素含量变化
按1.3.1方法对油菜各个时期的叶绿素含量进行测定,结果如图1。在A2B1C2、A3B1C2 与A2B1C3处理叶绿素含量整个生育期均高于对照;反之,在A1B3C1与A1B3C3的处理则远低于对照。总体而言,整个生育期叶绿素的变化规律是相同的,即在相同N及B用量条件下,随着种植密度的增加,叶绿素含量逐渐降低,在相同种植密度及B用量条件下,随着N素的增加,叶绿素含量先升高后降低;相同种植密度及N肥条件下,随着B用量的增加,叶绿素含量亦先升高后降低;随着生育期的推进,叶绿素含量不断增加,这与胡戎朔 [6]的研究是一致的。此外,不同处理间差异随着生育期推进越来越大,可能是油菜生长前期植株幼小,光合作用较弱,随着植株生长,总叶片数、绿叶数增多,光合指数升高而导致 [15]。
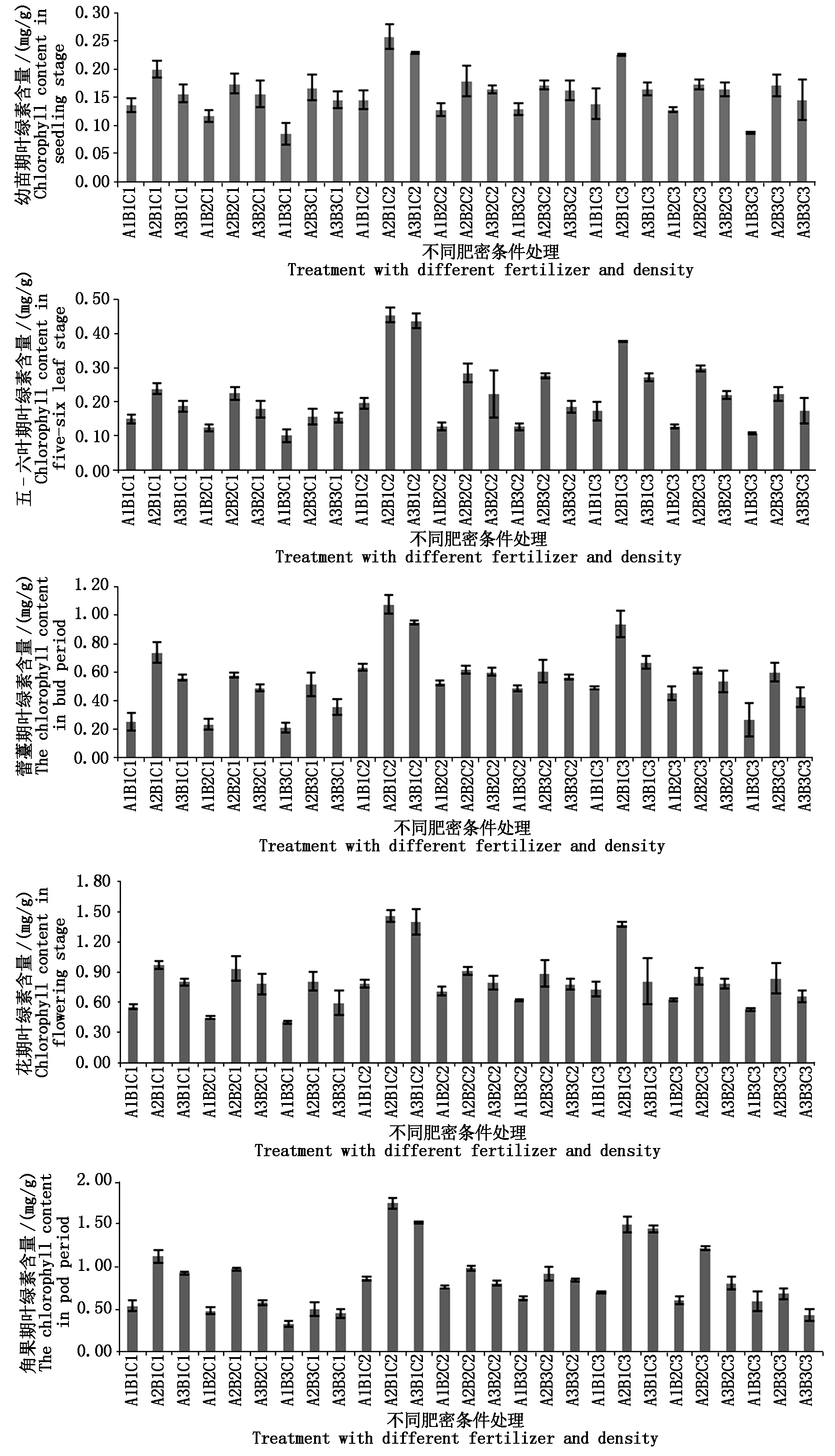
图1 不同时期不同处理下叶绿素含量差异
Fig.1 Difference of chlorophyll content under different treatments in different periods
2.2 营养生长期fad2、fad3表达差异
2.2.1 幼苗期基因表达差异 对幼苗期叶片中fad2、fad3的表达量进行分析,结果如图2。fad2的表达量仅在A2B1C2处理远高于对照,是对照的1.51倍,fad3的表达量则在A2B1C2、A2B1C3及A3B1C2处理,均高于对照,分别是对照的1.65,1.54,1.36倍。
fad2的表达量在A1B3C1处理下表达量最低,仅是对照的0.13倍,其次是A1B2C1与A1B3C3,分别是对照的0.18,0.23倍。fad3的表达量同fad2类似,在3个处理下,分别是对照的 0.12,0.21,0.18倍。另外,在A1B1C1处理,fad2、fad3的表达量也仅有对照的0.31,0.35倍。总体而言,在幼苗期,大部分肥密条件下都抑制两者的表达。
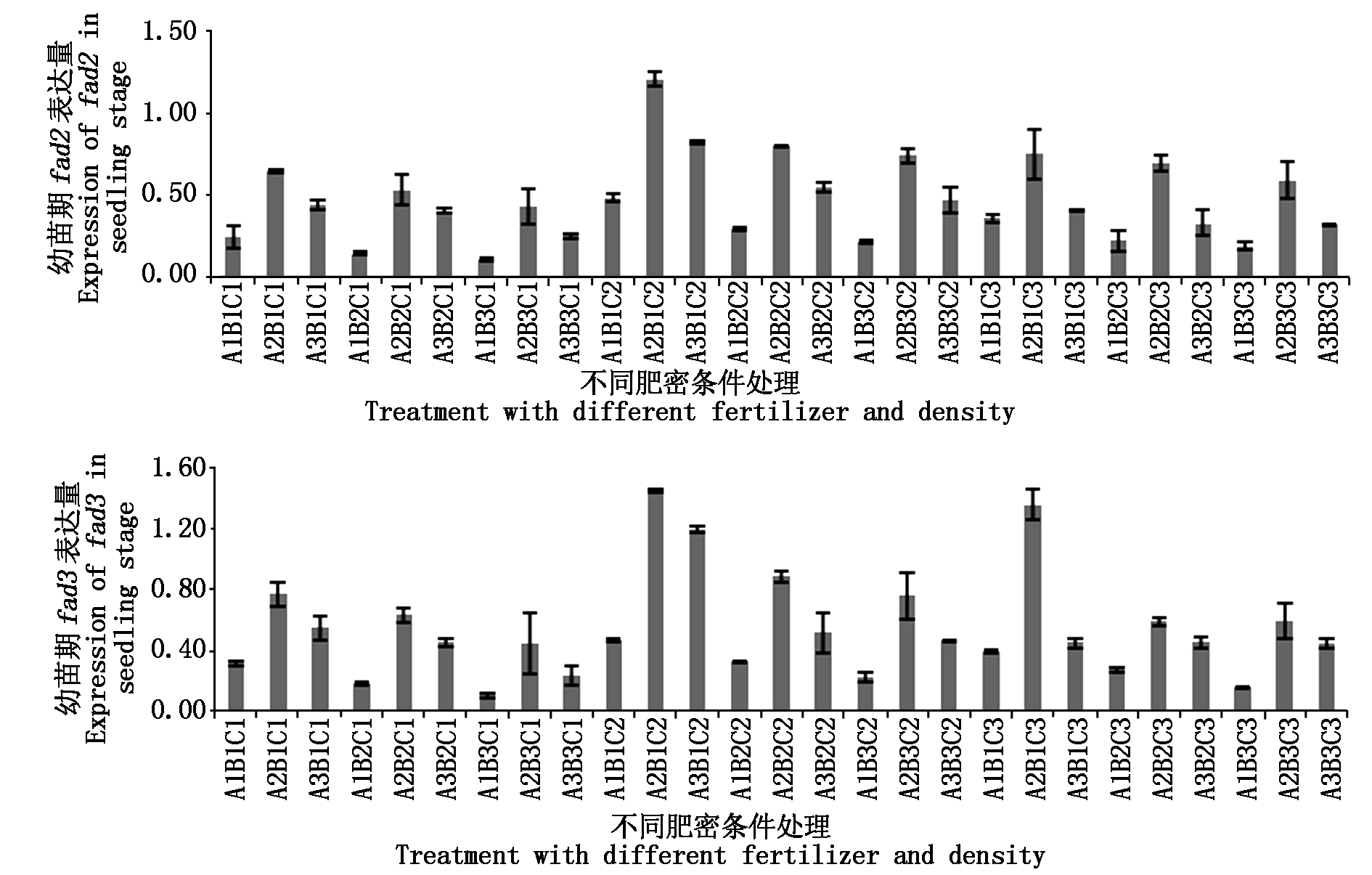
图2 fad2、fad3基因在幼苗期表达差异
Fig.2 Differentially expressed of fad2 and fad3 in seedling stage
2.2.2 五-六叶期基因表达差异 对五-六叶期叶片中fad2、fad3的表达量进行分析,结果如图3。fad2在A2B1C2(1.86倍)、A3B1C2(1.57倍)与A2B1C3(1.51倍)处理时高于对照;fad3则在A2B1C2、A3B1C2与A2B1C3处理高于对照,分别是对照的1.51,1.50,1.31倍。
反之,fad2在A1B3C1(0.38倍)、A1B2C1(0.39倍)、A1B1C1(0.40倍)与A1B3C3(0.40倍)处理时远低于对照;fad3同之,分别是对照的0.15,0.19,0.23倍。此时期基因整体表达量大于幼苗期,可能是随着生育期的推进,油菜各生命活动加强所致[16]。
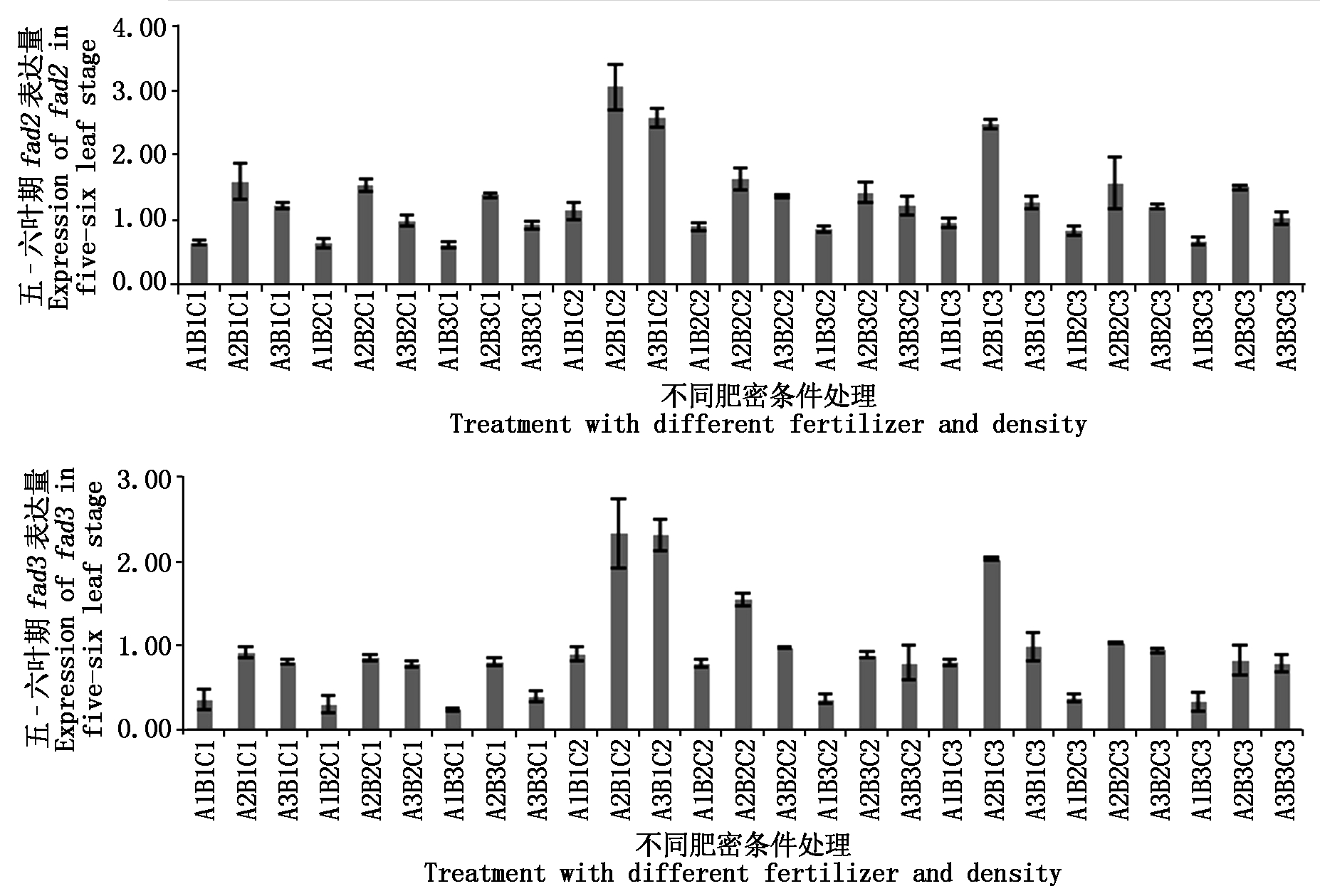
图3 fad2、fad3基因在五-六叶期表达差异
Fig.3 Differentially expressed of fad2 and fad3 in five-six leaf stage
2.2.3 蕾薹期基因表达差异 对蕾薹期叶片中fad2、fad3的表达量进行分析,结果如图4。与对照相比,fad2表达量在A2B1C2(1.61倍)、A3B1C2(1.50倍)与A2B1C3(1.50倍)时高于对照,fad3同之,分别是对照的1.92,1.51,1.71倍。
反之,fad2表达量在A1B1C1(0.46倍)、A1B2C1(0.38倍)、A1B3C1(0.35倍)、A3B3C1(0.27倍)及A1B3C3(0.23倍)处理下远低于对照。fad3在这几种处理下表达量也较低,分别是对照的0.57,0.45,0.42,0.42,0.47倍。此时期是由营养生长期进入生殖生长期的关键期,是油菜吸收氮等元素最多的时期(http://www.chinabaike.com/z/nong/sc/968921.html),而fad2、fad3基因的表达量比五-六叶期有所增加但增幅不大,此外,在整个营养生长期,在氮、硼含量均最低(A1C1)条件下,无论密度(B)怎么变化,基因表达量均小于对照,可推测在氮、硼含量低时,密度对基因表达量的影响并不明显。

图4 fad2、fad3基因在蕾薹期表达差异
Fig.4 Differentially expressed of fad2 and fad3 in the bud period
2.3 生殖生长期fad2、fad3表达差异
2.3.1 花期基因表达差异 对花瓣中fad2、fad3的表达量进行分析,结果如图5。fad2在A2B1C2处理表达量最高,是对照的1.60倍,其次是A3B1C2,是对照的1.53倍;fad3同之,分别是对照的1.63,1.57倍。
fad2表达量在A1B3C1处理下表达量最低,是对照的0.36倍,其次是在A1B2C1(0.39倍)、A3B1C1(0.45倍)与A1B3C3(0.48倍)处理下亦远低于对照。fad3同样在A1B3C1处理表达量最低,是对照的0.43倍,其次在A3B3C1(0.46)、A3B3C3(0.48倍)处理表达量也较低。此时期比之营养生长期,fad2、fad3的表达量有明显提高,但除了上述几个处理与对照有较大差异之外,其他处理与对照间均无明显差异。
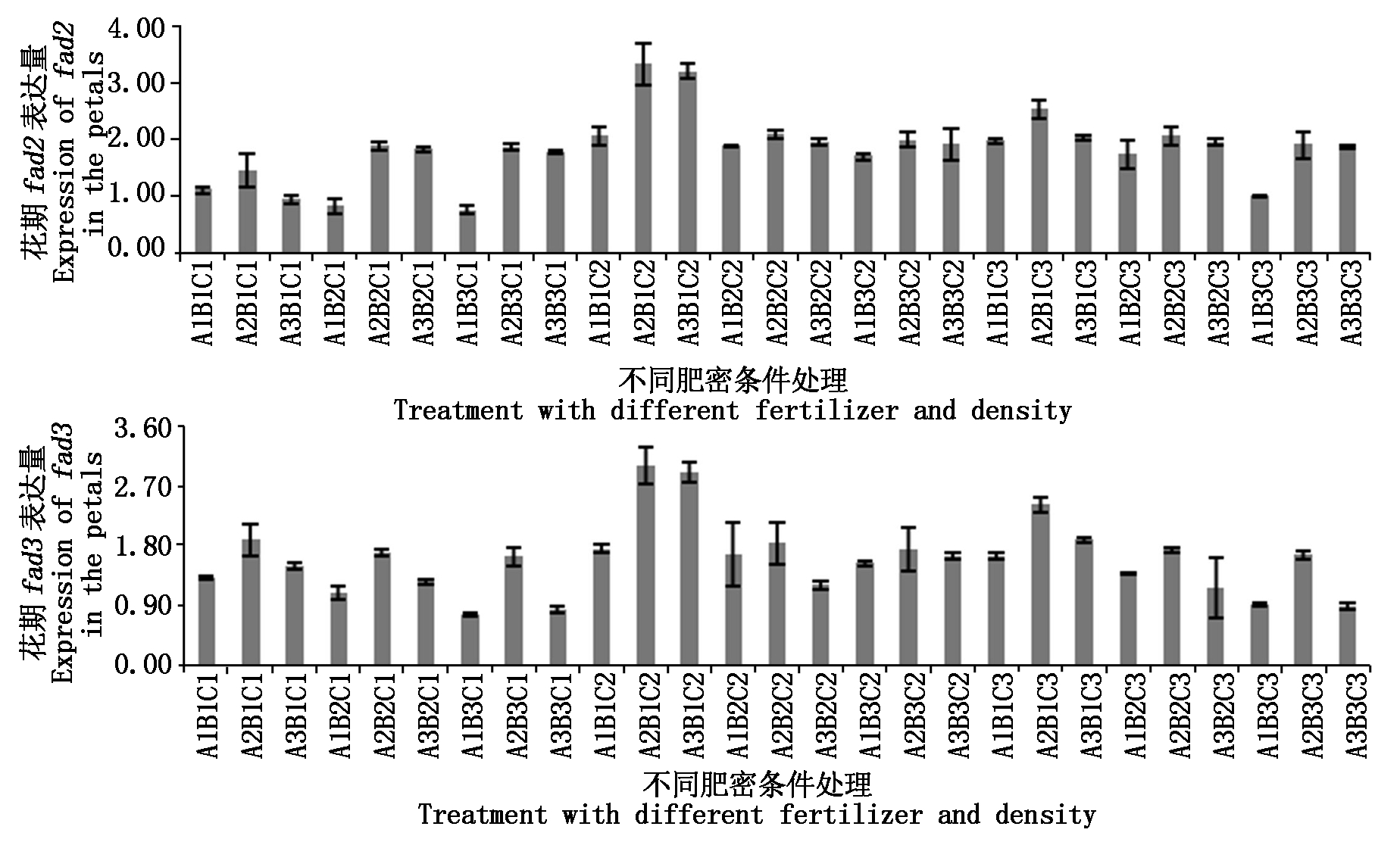
图5 fad2、fad3基因在花瓣中的表达差异
Fig.5 Differentially expressed of fad2 and fad3 in the petals
2.3.2 授粉后20-35 d种子基因表达差异 对授粉后20~35 d种子中fad2、fad3的表达量进行分析,结果如图6。fad2在A2B1C2条件下有最大表达量,是对照的1.94倍,其次是在A2B1C3、 A3B1C3、A3B1C2条件下,分别是对照的1.60,1.54,1.50倍;fad3则仅在A2B1C2、A2B1C3处理远高于对照,分别是对照的1.55,1.52倍。
反之,fad2在A1B3C1(0.35倍)、A1B2C2(0.43倍)、A1B3C3(0.44倍)条件下均低于对照,fad3在A1B3C3条件下表达量最低,是对照的0.16倍,其次是A1B3C2、A1B2C1、A1B2C3处理,表达量分别是对照的0.19,0.27,0.29倍。此时期两基因的表达量均达整个生育期的最大值,推测与角果期是脂肪酸积累的关键期有关[17]。
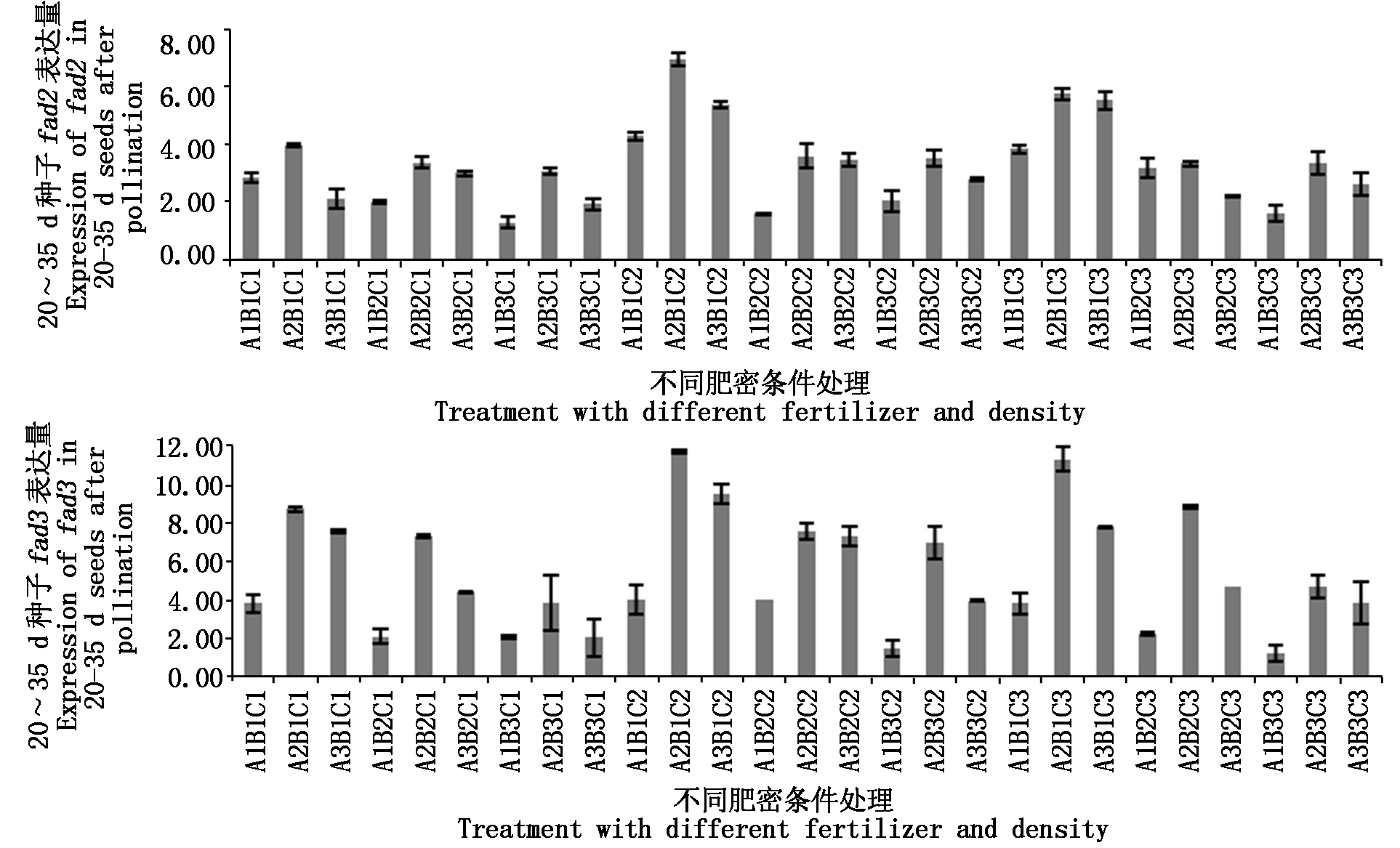
图6 fad2、fad3基因在授粉后20~35 d种子中的表达差异
Fig.6 Differentially expressed of fad2 and fad3 in 20-35 d seeds after pollination
2.3.3 角果皮中基因表达差异 对角果皮中fad2、fad3的表达量进行分析,结果如图7。fad2在A2B1C2处理表达量最高,是对照的1.80倍,其次是在A2B1C3处理,表达量是对照的1.50倍,fad3亦在A2B1C2处理表达量最高,是对照的1.85倍,其次在A3B1C2(1.56倍)、A2B1C3(1.51倍)处理表达量也较高。
反之,fad2表达量在A1B3C1(0.32倍)条件下表达量最低,其次是A1B3C3(0.35倍)、A1B2C3(0.42倍)、A3B3C1(0.47倍)处理均低于对照。fad3则在这几种处理下也远低于对照,分别是对照的0.17,0.24,0.39,0.32倍,除此之外,fad3在A1B2C1处理下表达量也较低,仅为对照的0.21倍。与20~35 d的种子相比,角果皮中fad2、fad3的表达量明显较低,推测此时角果皮作为油分积累的“源”向种子“库”中转移,角果皮的油分积累与种子呈相反趋势,从基因层面验证了傅寿仲等[18]的研究。
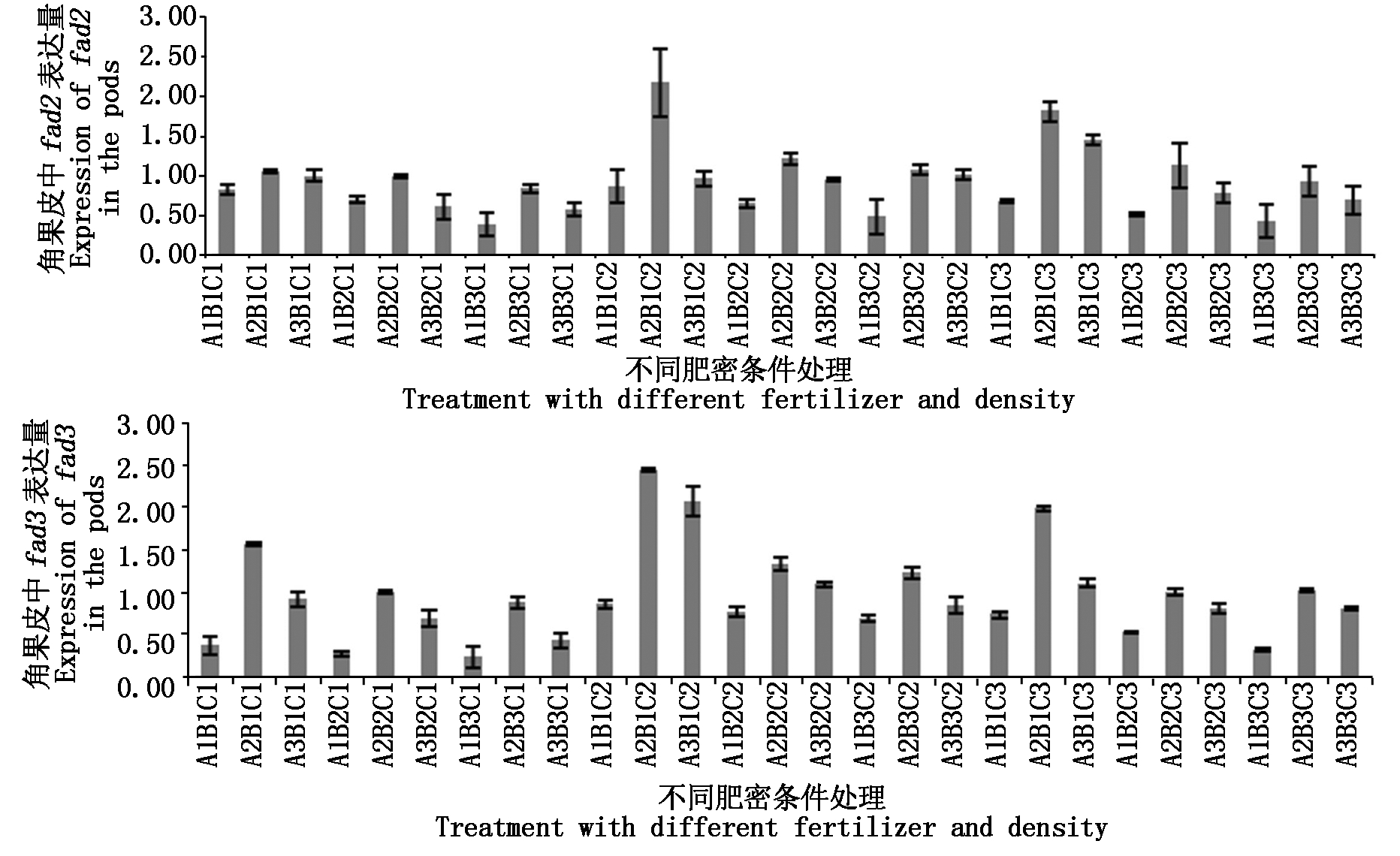
图7 fad2、fad3基因在角果皮中的表达差异
Fig.7 Differentially expressed of fad2 and fad3 in the pods
总体而言,生殖生长期的基因表达量高于营养生长期,特别是角果期。生殖生长期是油菜进行脂肪酸积累的关键期,有效的肥料、种植密度条件可以促进脂肪酸的积累,本研究在A2B1C2与 A2B1C3处理fad2、fad3基因均有较高表达量,可能有助于亚油酸与亚麻酸的合成。而在A1B3C1、A3B3C1及A1B3C3处理下fad2、fad3均有较低表达量,可能有助于其他类脂肪酸(如油酸等)的积累,推动油菜籽品质的提高。
2.4 不同时期叶绿素含量与基因表达量之间的关系
不同时期叶绿素含量与fad2、fad3表达量之间的关系如表3。在整个生育期,叶绿素含量与fad2、fad3之间表现出相同的变化规律,即随着N、B肥的增加而先增加后减少,随着密度的增加而减少。Broun等[8]证实不饱和脂肪酸参与构成叶绿体膜骨架叶绿素含量变化,本试验中,通过线性拟合分析两者间的相关性,发现基因表达量与叶绿素含量拟合度较高,呈正相关关系。
表3 叶绿素含量与基因表达量之间的相关性分析
Tab.3 Correlation analysis between chlorophyll content and gene expression in different periods
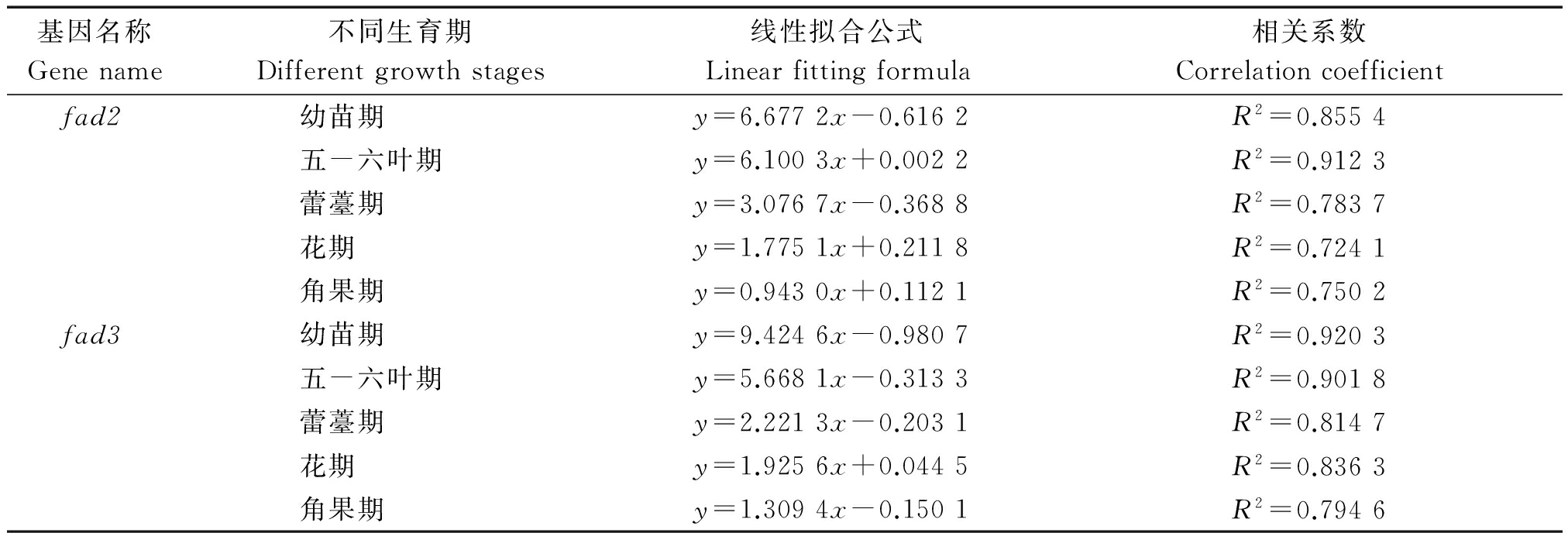
基因名称Genename不同生育期Differentgrowthstages线性拟合公式Linearfittingformula相关系数Correlationcoefficientfad2幼苗期y=6.6772x-0.6162R2=0.8554五-六叶期y=6.1003x+0.0022R2=0.9123蕾薹期y=3.0767x-0.3688R2=0.7837花期y=1.7751x+0.2118R2=0.7241角果期y=0.9430x+0.1121R2=0.7502fad3幼苗期y=9.4246x-0.9807R2=0.9203五-六叶期y=5.6681x-0.3133R2=0.9018蕾薹期y=2.2213x-0.2031R2=0.8147花期y=1.9256x+0.0445R2=0.8363角果期y=1.3094x-0.1501R2=0.7946
3 结论与讨论
3.1 结论
通过对营养生长期与生殖生长期fad2、fad3基因表达量的测定,发现fad2、fad3在A2B1C2与 A2B1C3处理下均有较高表达量,而在A1B3C1、A3B3C1及A1B3C3处理下均有较低表达量。总体而言,增加氮、硼肥在一定程度上可促进叶绿素含量以及fad2、fad3表达量的增加,过多则抑制,而增加种植密度则会抑制叶绿素含量以及fad2、fad3表达量。另一方面,fad2、fad3表达量变化规律同叶绿素含量变化规律相同,呈正相关关系。
3.2 讨论
施肥量及种植密度对农作物各个方面均有较大的影响,本研究发现在不同肥密条件处理下,fad2、fad3的表达量有较大差异,尤其是在生殖生长期。李志玉等[19]对双低油菜新品种中油杂8号施用氮磷硼肥表明,施用氮磷硼肥的作用主要是促进油菜后期的生长发育;杨美等[20]以甘蓝型双低油菜华双4号为材料,通过盆栽试验证明硼肥过高或过低对油菜品质都有影响;曾宇等[21]证明肥密相互协调作用是获得产量品质俱佳的关键,且种植密度对油酸、亚油酸等的含量影响不大,本试验则从基因层面验证了这一研究。
亚油酸、亚麻酸无论对作物本身还是对人体而言,都有不可或缺的作用,但含量过高会引发机体脂质代谢紊乱,从而引起一系列病症,如脂肪肝等[22-23]。且亚油酸极易被氧化,作为食用油时不耐高温,易腐坏[24],故而对油脂品质有一定影响。本研究中,在A1B3C1、A3B3C1及A1B3C3处理下fad2、fad3均有较低表达量,可能有助于其他类脂肪酸(如油酸等)的积累,从而提高油菜籽品质,有待进一步研究。
参考文献:
[1] Ptushenko V V, Ptushenko O S, Tikhonov A N. Chlorophyll fluorescence induction, chlorophyll content, and chromaticity characteristics of leaves as indicators of photosynthetic apparatus senescence in arboreous plants[J]. Biochemistry-Moscow, 2014, 79(3): 260-272.
[2] 刘桃菊,胡雯君,张笑东.水稻冠层高光谱特征变量与叶片叶绿素含量的相关性研究[J].激光生物学报, 2015,24(5): 428-435.
[3] 曾 宇.不同施肥量,种植密度对油菜生长及产量的影响[D].武汉:华中农业大学, 2011.
[4] 唐金花.不同氮磷钾施用量对双季稻田早熟油菜产量和养分吸收的影响[D].长沙:湖南农业大学, 2013.
[5] 张永霞,赵 锋,张红玲.中国油菜产业发展现状、问题及对策分析[J].世界农业, 2015(4): 96-99.
[6] 胡戎朔.播种期及氮磷配比对双低油菜产质量及饲用品质的影响[D].呼和浩特:内蒙古农业大学, 2016.
[7] 李 斌,肖 楠,张振乾,等.不同栽培方式对高油酸油菜的影响[J].湖南农业科学, 2017(4): 32-35.
[8] Broun P, Gettner S, Somerville C. Genetic engineering of Plant lipids[J]. Annu RevNutr, 1999, 19(1):197-21.
[9] Nagano Y, Matsuno R, Sasaki Y, et al. Sequence and transcriptional analysis of the gene cluster trnQ-zPfA-psal-0RF231-petA in pea chloroplasts[J]. Current Genetics, 1991(20): 431-436.
[10] Bergé J-P, Barnathan G. Fatty acids from lipids of marine organisms: molecular biodiversity, roles as biomarkers, biologically active compounds, and economical aspects[J]. In Marine Biotechnology I, 2005, 96: 49-125.
[11] Peng Q, Hu Y, Wei R, et al. Simultaneous silencing of FAD2 and FAE1 genes affects both oleic acid and erucic acid contents in Brassica napus seeds[J]. Plant Cell Reports, 2010,29(4):317-325.
[12] 曹福亮,王欢利,郁万文,等.高等植物脂肪酸去饱和酶及编码基因研究进展[J].南京林业大学学报:自然科学版, 2012, 36(2): 125-132.
[13] 刘 芳,刘睿洋,彭 烨,等.甘蓝型油菜BnFAD2-C1基因全长序列的克隆,表达及转录调控元件分析[J].作物学报, 2015, 41(11): 1663-1670.
[14] Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29(9): e45.
[15] 韩 梅.播期,密度对直播油菜生长发育品质的影响[D].重庆:西南大学, 2016.
[16] 王必庆,王国槐.早熟油菜生理生化特性研究进展[J].作物研究, 2011, 25(3): 269-271.
[17] 高建芹,浦惠明,戚存扣,等.高含油量油菜种子和果皮油份积累及主要脂肪酸的动态变化[J].中国油料作物学报, 2009, 31(2): 173-179.
[18] 傅寿仲,张洁夫,戚存扣,等.甘蓝型油菜高含油量种质选育研究[J].中国油料作物学报, 2008, 30(3): 279-283.
[19] 李志玉,胡 琼,廖 星,等.优质油菜中油杂8号施用氮磷硼肥的产量和品质效应[J].中国油料作物学报, 2005, 27(4): 59-63.
[20] 杨 美,石 磊,徐芳森,等.不同硼水平对双低油菜华双4号产量和品质的影响[J].植物营养与肥料学报, 2008, 14(6): 1118-1122.
[21] 曾 宇,雷雅丽,李 京,等.氮,磷,钾用量与种植密度对油菜产量和品质的影响[J].植物营养与肥料学报, 2012, 18(1): 146-153.
[22] 胡 燕,陈忠杰.不饱和脂肪酸与人体健康关系探讨[J].肉类研究, 2011, 25(1): 17-20.
[23] 廖灵旋,于 昊,黄建忠.多不饱和脂肪酸合成途径研究进展[J].微生物学杂志, 2014, 34(3): 80-85.
[24] 胥 莉.亚油酸氧化产物的体外活性和促炎作用[D].杨凌:西北农林科技大学, 2013.