油菜种皮有黄、黄褐、红褐、褐、黑等颜色,有研究表明,在相同的遗传背景下,黄籽油菜与黑籽油菜比较具有含油量和蛋白含量高[1]、纤维素和多酚含量低、油清澈透明[2]、氮磷钾利用率高[3]、生物柴油制作成本低等优点[4],因此,黄籽育种被认为是提高油菜产油量的重要途径之一。按形态和特征分类,我国栽培的油菜可分为白菜型油菜(B.rapa,AA)、甘蓝型油菜(B.napus,AACC)、芥菜型油菜(B.juncea,AABB)。其中,白菜型油菜和芥菜型油菜种质资源中存在天然黄籽材料,甘蓝型油菜黄籽来自芥菜型油菜或甘蓝型油菜等其他类型。20世纪70年代以来,各国研究者开展了黄籽油菜的遗传育种研究,但同时在三大类型油菜中的研究尚未见报道。
拟南芥和油菜同属十字花科,因此,拟南芥的研究结果可为油菜研究提供参考。有研究表明,拟南芥中引起种皮颜色变化的原因是编码类黄酮生物合成途径中的一些酶和蛋白质的基因发生突变,导致植物体内合成不同的类黄酮终产物或使类黄酮的积累量发生改变最终引起种皮颜色变化[5]。类黄酮生物合成途径在拟南芥中已得到深入研究,其中,查尔酮异构酶(CHI)是第一个被认识的类黄酮生物合成相关酶,同时也是类黄酮生物合成早期阶段的一个关键酶,它催化查尔酮生成柚皮素,柚皮素可作为底物进入其他不同黄酮类化合物的合成代谢支路[6]。目前,CHI基因已从豌豆[7]、大麦和水稻[8]、花生[9-10] 、胡芦巴[11]等多种植物中克隆,而在三大类型油菜中的克隆尚未见报道。
本研究利用同源克隆的方法在白菜型油菜、甘蓝型油菜、芥菜型油菜的黄、褐籽材料中克隆CHI基因序列,分析该基因在不同类型油菜中关键单核苷酸多态性(SNP)位点,探讨CHI基因与种皮颜色的关系,旨在为研究油菜黄籽机制提供参考。同时分析CHI基因在三大类型油菜中的进化关系,探讨三大类型油菜基因组间亲缘关系。
1 材料和方法
1.1 试验材料
试验选用白菜型油菜黄、褐籽高代品系各2个,甘蓝型油菜黄、褐籽高代品系各3个,芥菜型油菜黄、褐籽高代品系各3个,各材料的详细信息见表1。2014年9月种植于西北农林科技大学试验田,四-五叶期时取幼嫩叶片速冻于液氮中,然后-80 ℃保存。
1.2 试验方法
1.2.1 CHI基因cDNA序列的克隆 利用TRIzol法提取叶片总RNA,1%琼脂糖凝胶电泳检测RNA的完整性,Thermo NanoDrop 2000超微量分光光度计检测RNA的浓度和质量,-80 ℃保存。取2 μg RNA,利用天根TIANScript cDNA 第一链合成试剂盒进行反转录合成cDNA。根据拟南芥CHI基因的序列信息,利用Primer Premier 5.0设计引物,上游引物为CHI-F:5′-AAACATAAAGCACTAAAATCCCAAGAAAAA-3′,下游引物为CHI-R:5′-CAACTGTCCGTCACCGTTACCCACC-3′,引物由上海生工合成。以三大类型油菜幼嫩叶片的cDNA为模板进行CHI基因扩增,反应体系为cDNA 1.0 μL,5× Phusion GC Buffer 2.0 μL,10 mmol/L dNTPs 0.2 μL,Phusion DNA Polymerase 0.1 μL,上下游引物各0.5 μL,ddH2O 5.7 μL。PCR反应程序为:95 ℃预变性5 min;95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸75 s,35个循环;72 ℃再延伸5 min。通过1%琼脂糖凝胶电泳检测PCR产物,对扩增所得目的片段进行胶回收,将纯化产物连接到pMD18-T载体上,转化大肠杆菌感受态细胞中,涂在氨苄青霉素(Amp)的LB平板上进行培养,挑取10个单克隆进行菌落PCR检测,选择5个阳性克隆送往Invitrogen公司测序。
表1 供试材料名称及来源
Tab.1 The name and source of test materials
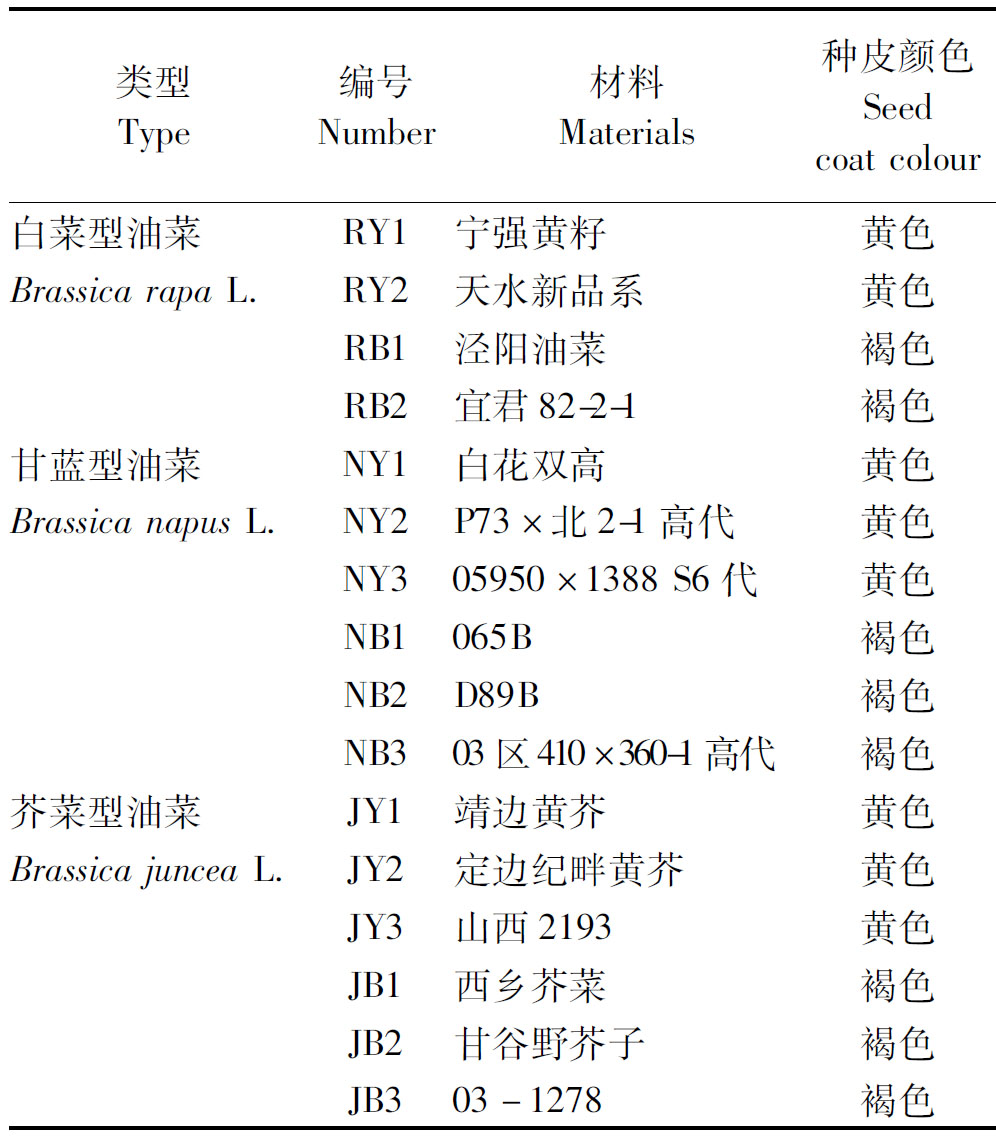
类型Type编号Number材料Materials种皮颜色Seedcoatcolour白菜型油菜RY1宁强黄籽黄色BrassicarapaL.RY2天水新品系黄色RB1泾阳油菜褐色RB2宜君82-2-1褐色甘蓝型油菜NY1白花双高黄色BrassicanapusL.NY2P73×北2-1高代黄色NY305950×1388S6代黄色NB1065B褐色NB2D89B褐色NB303区410×360-1高代褐色芥菜型油菜JY1靖边黄芥黄色BrassicajunceaL.JY2定边纪畔黄芥黄色JY3山西2193黄色JB1西乡芥菜褐色JB2甘谷野芥子褐色JB303-1278褐色
1.2.2 CHI基因序列分析 利用NCBI的ORF Finder在线工具(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)寻找CHI基因的最大开放阅读框,将克隆得到的CHI基因的cDNA序列用DNAMAN软件翻译成氨基酸序列,利用 DNAMAN软件进行序列的多重比对。
1.2.3 油菜CHI与其他物种CHI进化分析 利用MEGA 5.2软件对不同物种的CHI蛋白质序列进行多序列比对,使用邻接法(Neighbor-Joining,NJ)建树,生成系统进化树。
2 结果与分析
2.1 三大类型油菜CHI基因cDNA序列的克隆
以16份三大类油菜的cDNA为模板,扩增出CHI的完整CDS序列(图1),将其回收转化大肠杆菌测序。测序结果显示,白菜型油菜材料RY1、RY2、RB1、RB2中均克隆到1条序列,分别命名为RY1、RY2、RB1、RB2;甘蓝型油菜材料NY1、NY2、NY3、NB1、NB2、NB3中均得到2条序列,分别命名为NY1-1、NY1-2、NY2-1、NY2-2、NY3-1、NY3-2、NB1-1、NB1-2、NB2-1、NB2-2、NB3-1、NB3-2;芥菜型油菜材料JY1、JB1、JB2、JB3中均克隆获得1条序列, JY2和JY3中克隆获得2条序列,分别命名为JY1、JB1、JB2、JB3、JY2-1、JY2-2、JY3-1、JY3-2。通过NCBI的ORF Finder在线工具(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找开放阅读框,结果发现,该基因在大部分材料中ORF长度为756 bp,编码251个氨基酸,但在部分芥菜型油菜材料中得到的序列:JY1、JY2-2、JY3-2、JB1、JB2、JB3第703-705位有3个单核苷酸插入,导致ORF长度为759 bp,编码252个氨基酸(表2)。
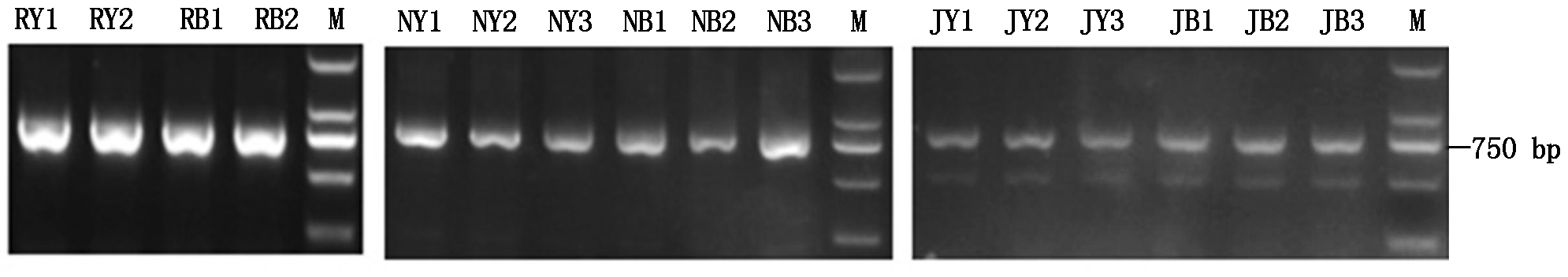
图1 CHI基因的PCR产物
Fig.1 The product of PCR amplification of CHI
表2 各材料CHI基因ORF长度及编码氨基酸长度
Tab.2 The length of ORF and amino acid of CHI
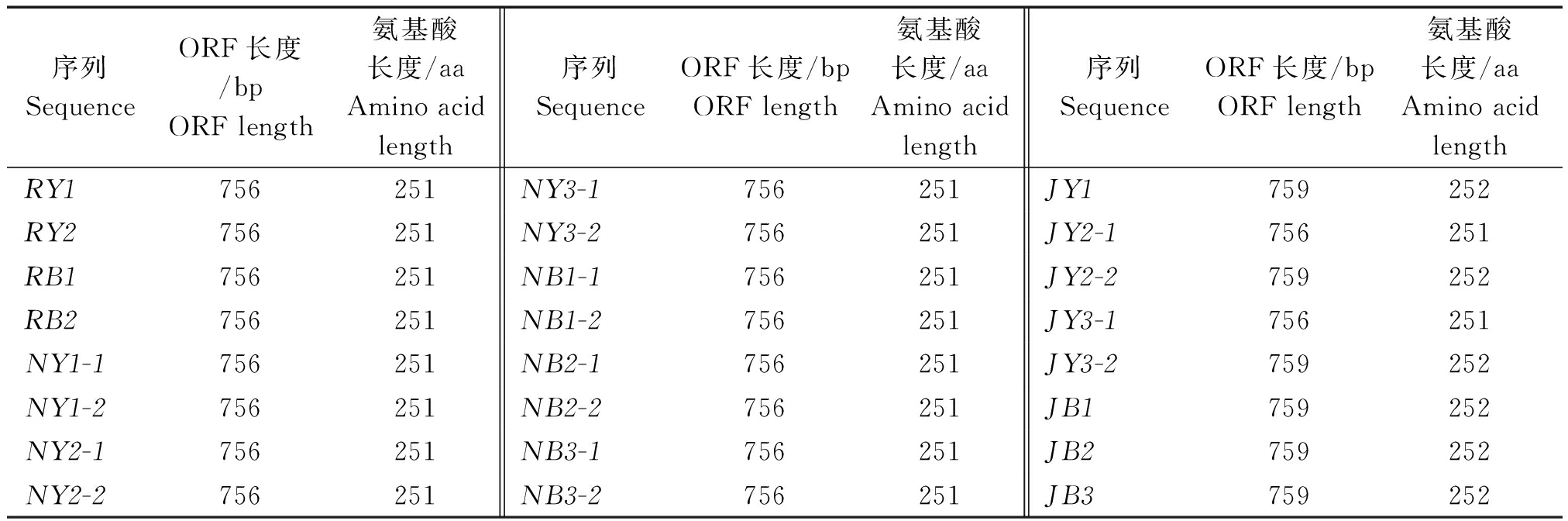
序列SequenceORF长度/bpORFlength氨基酸长度/aaAminoacidlength序列SequenceORF长度/bpORFlength氨基酸长度/aaAminoacidlength序列SequenceORF长度/bpORFlength氨基酸长度/aaAminoacidlengthRY1756251NY3-1756251JY1759252RY2756251NY3-2756251JY2-1756251RB1756251NB1-1756251JY2-2759252RB2756251NB1-2756251JY3-1756251NY1-1756251NB2-1756251JY3-2759252NY1-2756251NB2-2756251JB1759252NY2-1756251NB3-1756251JB2759252NY2-2756251NB3-2756251JB3759252
2.2 三大类型油菜CHI基因保守结构域预测
将本研究克隆得到的24条三大类型油菜的CHI序列利用DNAMAN软件翻译成氨基酸序列,通过CCD在线工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行功能结构域分析,结果发现,它们都含有保守的查尔酮催化结构域(10-230),属于查尔酮异构酶催化活性保守位点的氨基酸分别为Thr55、Tyr113、Asn120和Ser197。
2.3 三大类型黄褐籽油菜CHI基因片段SNP分析
将获得的CHI基因全长ORF序列用DNAMAN翻译为氨基酸序列,利用DNAMAN软件对序列进行同源比对,该基因在三大类型油菜中核苷酸序列同源性为96.41%,氨基酸序列同源性为96.73%。其中,该基因在白菜型油菜材料中同源性最高(核苷酸序列同源性为99.80%,氨基酸序列同源性为99.60%),甘蓝型油菜材料次之(核苷酸序列同源性为98.71%,氨基酸序列同源性为98.67%),芥菜型油菜材料中最低(核苷酸序列同源性为97.89%,氨基酸序列同源性为97.72%)。
利用DNAMAN软件对试验所得序列进行SNP位点分析及比对,查找单核苷酸及氨基酸的差异位点。分析结果如表3,4所示:在本试验所用三大类型油菜材料中,存在90个单核苷酸差异位点,其中33个位点导致氨基酸的差异。
白菜型油菜材料,存在5个单核苷酸差异位点,有3个位点差异导致氨基酸的变化,变化的氨基酸位点分别是第68(P/T)、226(V/I)、247(K/Q)位;甘蓝型油菜材料,存在24个碱基差异位点,有9个位点导致氨基酸的变化,变化的氨基酸位点分别是第25(P/S)、32(S/F)、68(P/T)、151(T/K)、163(S/A)、164(P/S)、165(E/K)、184(A/V)、241(N/D)位;芥菜型油菜材料,存在78个SNP位点,其中有14个位点的变化导致氨基酸的变化,氨基酸变化位点分别为第49(H/Q)、64(A/P)、66(A/S)、68(P/T)、141(K/E)、160(F/L)、180(K/E)、184(A/V)、203(K/N)、218(S/A)、222(K/N)、223(E/S)、228(K/E)、243(S/P)位。在部分芥菜型油菜材料中得到的序列,JY1、JY2-2、JY3-2、JB1、JB2、JB3第703-705位核苷酸插入AAT,导致第235位氨基酸位点插入天冬酰胺。三大类型油菜中第202(C/A)位核苷酸处存在差异,导致第68位氨基酸的突变,其中在褐籽材料中氨基酸为脯氨酸(P),在黄籽材料中为苏氨酸(T)。该氨基酸差异位点位于保守结构域内,因此,笔者推测该位点是该基因在三大类型油菜中种皮色突变的一个关键位点。
表3 三大类型油菜CHI基因单核苷酸变异位点
Tab.3 Variation sites of single nucleotides of CHI gene

编号Number4254577375788795102105144147153156168177186190196202210228234244249264282285RB1GTTCGTACCTTAGTCATCTCCTGTGCATRB2GTTCGCACCTTAGTCATCTCCTGTGCATRY1GTTCGCACCTTAGTCATCTACTGTGCATRY2GTTCGCACCTTAGTCATCTACTGTGCATNB1GTTCGCACCTCAACCAACTCCTGTGCACNB2GTTCGCACCTT/CAG/AC/TCAA/TCTCCTGTGCATNB3GTTCGCACCTT/CAG/AC/TCAA/TCTA/CCTGTGCAC/TNY1GTTCGCACCTT/CAG/AC/TCAA/TCTA/CCTGTGCAC/TNY2GTTT/CGCC/AC/TCTT/CAG/AC/TCAA/TCTA/CCTGTGCAC/TNY3GTTT/CGCC/ACCTT/CAG/ACCAA/TCTA/CCTGTGCAC/TJB1CACCCAACTCCCACGTAGGCTCCCATGTJB2CACCCAACTCCCACGTAGGCTCCCATGTJB3CACCCAACTCCCACGTAGGCTCCCATGTJY1CACCCAACTCCCACGTAGGCTCCCATGTJY2CA/TC/TCCA/CACC/TC/TC/TC/AA/GC/TG/CT/AA/TG/CG/TA/CT/CC/TC/GC/TA/GT/CG/ATJY3CACCCAACTCCCACGTAGGCTCCCATGT编号Number297300303306321330336339345390408421425426429435444448452468471474480487490493495504RB1ACCAGGAAAGGGGGCAGGCTCCCTCGATRB2ACCAGGAAGGGGGGCAGGCTCCCTCGATRY1ACCAGGAAGGGGGGCAGGCTCCCTCGATRY2ACCAGGAAGGGGGGCAGGCTCCCTCGATNB1ACCAGGAAAGGGGATAAGCA/TCCCT/GC/TG/AATNB2ACCAGGAAGGGGGG/AC/TAG/AGCA/TCCCT/GC/TG/AATNB3ACCAGGAAG/AGGGGG/AC/TAG/AGCA/TCCCT/GC/TG/AATNY1ACCAGGAAG/AGGGGG/AC/TAG/AGCA/TCCCT/GC/TG/AATNY2ACCAGGAAG/AGGGGG/AC/TAG/AGA/CA/TCCCT/GC/TG/AATNY3ACCAGGAAG/AGGGGG/AC/TAG/AGA/CA/TCCCT/GC/TG/AATJB1GTTGAAGGATAAAGTGGCCTGTTTCACCJB2GTTGAAGGATAAAGTGGCCTGTTTCACCJB3GTTGAAGGATAAAGTGGCCTGTTTCACCJY1GTTGAAGGATAAAGTGGCCTGTTTCACCJY2G/AT/CT/CG/AA/GA/GG/AG/AG/AT/GG/AG/AG/AGC/TG/AGC/GCTG/CT/CT/CTCG/AC/AC/TJY3GTTGAAGGG/AT/GG/AG/AG/AGC/TG/AGC/GCTG/CG/CG/CTCG/AC/AC/T编号Number508512525531538543551552555558561564567600609615637652666-670676682703-705711721732739741-742RB1GCTCGGTGTTACGTCGGGTAGTGGG…GGCAACRB2GCTCGGTGTTACGTCGGGTAGTGAG…GGCCACRY1GCTCGGTGTTACGTCGGGTAGTGAG…GGCAACRY2GCTCGGTGTTACGTCGGGTAGTGAG…GGCCACNB1GCTCGGT/CGG/TC/TAC/TGTCGGGTAGTGGG…GAAAACNB2GCTCGGT/CGG/TC/TAC/TGTCGGGTAGTGGG…GA/GA/CAACNB3GCTCGGT/CGG/TC/TAC/TGTCGGGTAGTGGG…GA/GA/CAACNY1GCTCGGT/CGG/TC/TAC/TGTCGGGTAGTGGG…GA/GA/CAACNY2GCTCGGT/CGG/TC/TAC/TGTCGGGTAGTGGG…GA/GA/CAACNY3GCTCGGT/CGG/TC/TAC/TGTCGGGTAGTGGG…GA/GA/CAACJB1ACCTACCCACGTAAGGCTGGAGAGAAATTGTAGTJB2AGCTACCCACGTAAGACTGGAGAGAAATTGCAGTJB3ACCTACCCACGTAAGGCTGGAGAGAAATTGTAGTJY1ACCTACCCACGTAAGGCTGGAGAGAAATTGTAGTJY2A/GCC/TC/TA/GC/GT/CC/GA/TC/TG/AC/TA/GA/TC/GGG/CG/TGGAGA/TAGTGG/AG/AAAT/…T/GGT/CAGT/ACJY3A/GCC/TC/TA/GC/GT/CC/GA/TC/TG/AC/TA/GA/TC/GGG/CG/TGGAGA/TAGTGG/AG/AAAT/…T/GGT/CAGT/AC
表4 三大类型油菜CHI基因片段氨基酸差异位点
Tab.4 Variation sites of amino acids in the fragments of CHI gene

编号Number253249646668141-142150-151158160163-165170-171180184203213218222-224226228235237241-243247RB1PSQPSPERETIFSPEVAEVNVANSDVE-EDLPKRB2PSQPSPERETIFSPEVAEVNVANSDIE-EDLPQRY1PSQPSTERETIFSPEVAEVNVANSDIE-EDLPKRY2PSQPSTERETIFSPEVAEVNVANSDIE-EDLPQNB1PSQPSPERETIFSPE/ASKVAEV/ANVANSDVE-ENLPKNB2PSQPSPERETIFSPE/ASKVAEV/ANVANSDVE-EDLP/NLPKNB3PSQPST/PERETIFSPE/ASKVAEV/ANVANSDVE-EDLP/NLPKNY1PSQPST/PERETIFSPE/ASKVAEV/ANVANSDVE-EDLP/NLPKNY2P/SF/SQPST/PERET/EKIFSPE/ASKVAEV/ANVANSDVE-EDLP/NLPKNY3P/SSQPST/PERET/EKIFSPE/ASKVAEV/ANVANSDVE-EDLP/NLPKJB1PSHAAPKKQTIFSPNIAKAKLSKENVKNEDVSKJB2PSHAAPKKQTIFSPNIGKAKLSKENVKNEDVSKJB3PSHAAPKKQTIFSPNIAKAKLSKENVKNEDVSKJY1PSHAAPKKQTIFSPNIAKAKLSKENVKNEDVSKJY2PSH/QA/PA/ST/PER/KKQT/ETIFSPN/SPEIA/VAK/EV/AK/NL/VS/AKEN/NSDV/IE/KN/-E/DDVS/DLPKJY3PSHAAPER/KKQT/ETI/MF/LSPN/SPEIA/VAK/EV/AK/NL/VS/AKEN/NSDV/IE/KN/-E/DDVS/DLPK/N
2.4 三大类型油菜CHI基因进化分析
为了进一步分析油菜CHI蛋白与其他物种相关蛋白的进化关系,通过NCBI的BlastP比对查找相似度较高的其他物种的CHI蛋白,选定苹果(Malus hybrid cultivar,ACP30360.1)、沙梨(Pyrus pyrifolia,ADP09377.1)、萝卜(Raphanus sativus,AAB87071.1)、樱桃(Prunus avium,AJO67964.1)、拟南芥(Arabidopsis thaliana,OAP11712.1)5个物种的CHI蛋白。利用MEGA 5.2邻接法将这些蛋白序列构建无根系统进化树,结果发现,CHI蛋白的进化呈现出物种特异性,三大类型油菜中CHI蛋白的进化关系较近,白菜型油菜与甘蓝型油菜进化距离相比于芥菜型油菜更近,多数芥菜型油菜的CHI蛋白聚为一个分支(除JY2-1、JY3-1)。推测CHI基因在白菜型油菜和甘蓝型油菜中亲缘关系较近。与其他物种相比,油菜CHI基因与萝卜和拟南芥亲缘关系较近(图2)。
3 结论与讨论
3.1 CHI基因拷贝数分析
芥菜型油菜(AABB)和甘蓝型油菜(AACC)是异源四倍体,分别含有A与B、A与C基因组,从比较基因组学角度分析,芸薹属二倍体物种来自于一个六倍体的祖先,基因组大约是拟南芥的3倍,四倍体物种基因组约是拟南芥的6倍[12]。细胞遗传学研究表明,甘蓝型油菜是由二倍体基本种白菜和甘蓝天然杂交并加倍而成的异源四倍体物种。根据“三倍化”假说推测白菜和甘蓝中分别有3个CHI基因拷贝,甘蓝型油菜和芥菜型油菜中有6个CHI基因拷贝。每个同源基因至少应有2个拷贝[13]。刘忠松等[14]利用电子克隆技术和BAC文库筛选相结合对芥菜型油菜CHI基因进行BAC文库筛选,获得CHI基因5个拷贝。严明理等[15]根据拟南芥利用同源克隆法在芥菜型油菜中得到CHI基因的2个拷贝。许本波等[16]通过Southern杂交技术发现6个CHI基因成员。但本研究中,基于同源克隆法,在芥菜型油菜中有部分材料只获得一条CHI基因序列,还需要进一步研究。
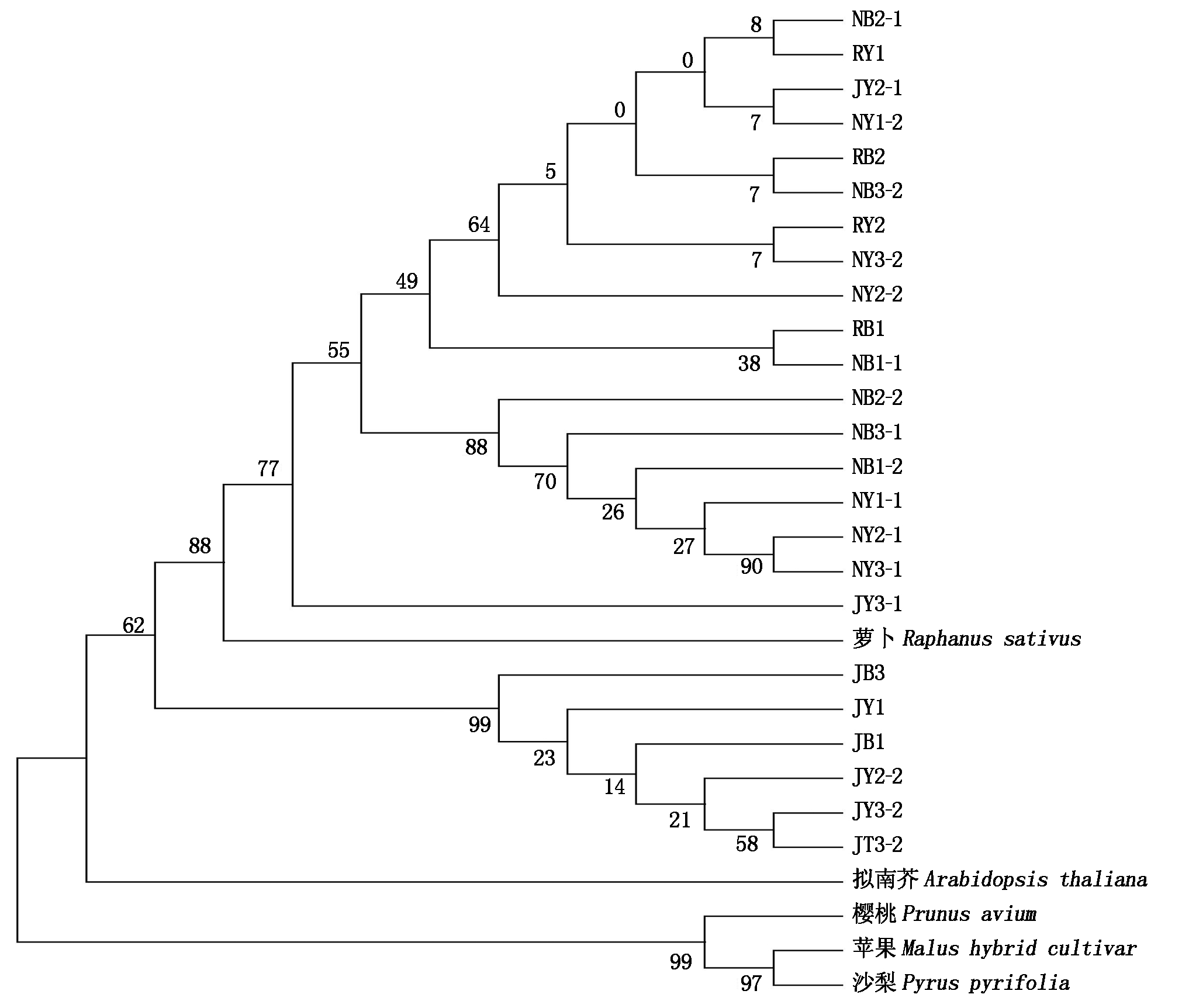
图2 CHI蛋白系统进化树分析
Fig.2 Phylogenetic analysis of CHI protein
3.2 三大类型黄褐籽油菜CHI基因的序列分析及其进化分析
本研究在甘蓝型油菜材料中各克隆到2条序列,ORF长度为756 bp,编码251个氨基酸,这与许本波等[16] 、曲存民等[17]研究结果一致。序列分析发现,有多个导致氨基酸变化的SNP位点,特别是2个拷贝之间SNP位点差异明显,进一步分析发现,其中有一个拷贝与白菜型油菜一致,可能来自A基因组,另一个拷贝可能来自C基因组。芥菜型油菜材料中JY2、JY3均克隆到2条序列,其他材料均克隆到一条CHI序列,与甘蓝型油菜类似,推测一个拷贝来自于A基因组,另一个拷贝来自于B基因组。
本研究推测第202(C/A)位核苷酸的突变,导致第68位氨基酸(P/T)的差异可能是导致油菜种皮颜色变化的主要原因,其功能有待于进一步研究。该研究获得的黄籽油菜与褐籽油菜SNP位点有助于开发油菜特异基因芯片。
本研究通过构建系统发育树发现,CHI基因在白菜型油菜与甘蓝型油菜中亲缘关系较近。尽管本研究未获得CHI基因的所有拷贝序列,但一定程度上反映出不同类型油菜中CHI基因的亲缘关系。与前人研究结果一致,Song[18]、Warwick[19]等研究表明,A、C基因组较接近,A、B基因组间同源性较低;Zhu等[20]分析基因组中同工酶标记以及rDNA的分布,得到了同样的结论。李宗芸等[21]通过原位杂交实验,证实了B基因组与A、C基因组相比分化较大,而A、C间分化较小。
参考文献:
[1] 刘 于,王伏林,刘仁虎.甘蓝型油菜黄籽突变对含油量和蛋白质含量的影响[J].浙江大学学报:农业与生命科学版,2017,43(1): 37-44.
[2] Marles M A,Gruber M Y,Scoles G J,et al.Pigmentation in the developing seed coat and seedling leaves of Brassica carinata is controlled at the dihydroflavonol reductase locus[J].Phytochemistry,2003,62(5): 663-672.
[3] 刘秀秀,鲁剑巍,王 寅,等.氮磷钾肥施用对油菜产量及养分吸收利用的影响[J].中国油料作物学报,2014,36(4): 483-488.
[4] Sensoz S,Angin D,Yorgun S.Influence of particle size on the pyrolysis of rapeseed(Brassica napus L.)fuel properties of bio-oil[J].Biomass and Bioenergy,2000,19(4): 271-279.
[5] Figueiredo D D,Batista R A,Roszak P J,et al.Auxin production in the endosperm drives seed coat development in Arabidopsis[J].Life,2016,5: e20542.
[6] Tohge T,De Souza L P,Fernie A R.Current understanding of the pathways of flavonoid biosynthesis in model and crop plants[J].Journal of Experimental Botany,2017,68(15): 4013-4028.
[7] Andrew J,Davies E.A cDNA encoding chalcone isomerase from aged pea epicotyls [J].Plant Physiology,1994,104(4): 1465-1466.
[8] Druka A,Kudrna D,Rostoks N,et al.Chalcone isomerase gene from rice (Oryza sativa) and barley (Hordeum vulgare): physical,genetic and mutation mapping[J].Gene,2003,302(1/2): 171-178.
[9] Wang X J,Zhang Y,Han X,et al.Clong and expression analysis of peanut (Arachis hypogaea L.)CHI gene [J].Research Gate,2012,112: 1442-1453.
[10] Liu Y,Zhao S,Wang J,et al.Molecular cloning,expression,and evolution analysis of type Ⅱ CHI gene from peanut (Arachis hypogaea L.) [J].Development Genes and Evolution,2015,225(1): 1-10.
[11] Qin J C,Zhu L,Gao M J,et al.Cloning and functional characterization of a chalcone isomerase from Trigonella foenum-graecum L.[J].Planta Medica,2011,77(7): 765-770.
[12] Lysak M A,Berr A,Pecinka A,et al.Mechanisms of chromosome number reduction in Arabidopsis thaliana and related Brassicaceae species[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(13): 5224-5229.
[13] Seo M S,Jin M,Chun J H,et al.Functional analysis of three BrMYB28 transcription factors controlling the biosynthesis of glucosinolates in Brassica rapa[J].Plant Molecular Biology,2016,90(4/5): 503-516.
[14] 刘忠松,孙东红,刘显军,等.油菜原花色素合成途径基因的克隆及进展[J].湖南农业大学学报:自然科学版,2012,38(4): 354-359.
[15] 严明理,刘忠松,官春云,等.芥菜型油菜类黄酮合成相关基因的克隆和序列分析[J].中国农业科学,2007,40(12): 2688-2695.
[16] 许本波,谢伶俐,李加纳,等.甘蓝型油菜BnCHI-1基因的克隆和表达特征分析[J].中国油料作物学报,2016,38(2): 142-149.
[17] 曲存民,卢 坤,刘水燕,等.黄黑籽甘蓝型油菜类黄酮途径基因SNP位点检测分析[J].作物学报,2014(11): 1914-1924.
[18] Song K M,Osborn T C,Williams P H.Brassica taxonomy based on nuclear restriction fragmenth length polymorphisms(RFLPs) [J].Theoretical and Applied Genetics,1988,75(4): 593-600.
[19] Warwick S L,Black L D.Molecular systematics of Brassica and allied genera (Subtribe Brassicinae,Brassiceae) Chloroplast genome and cytodemed Ongruence [J].Theoretical and Applied Genetics,1991,82:81-92.
[20] Zhu B,Tu Y,Zeng P,et al.Extraction of the constituent subgenomes of the natural allopolyploid rapeseed (Brassica napus L.) [J].Genetics,2016,204(3): 1015-1027.
[21] 李宗芸,栗茂腾,黄荣桂,等.基因组原位杂交辨别芸薹属异源四倍体AA、BB、CC基因组研究[J].中国油料作物学报,2002,24(1): 10-14.