随着全球气候变暖,特别是在炎热夏季,髙温使动物机体产生大量的自由基和ROS,严重影响动物(包括冷血动物)生存[1]。在哺乳动物各种生理功能中,生殖功能最易受热应激损伤[2]。当恒温动物生存环境温度超出适宜温度的上限,就会受热应激影响[3],从而影响胚胎的生存[4]。输卵管是早期胚胎发育的重要场所,而早期胚胎对氧化应激损伤比较敏感[5]。还有研究表明,输卵管液与卵裂有密切关系,受精卵在培养液中的发育要比在输卵管内发育迟缓,并且出现早胚发育阻滞[6]。因此,输卵管组织及其腔内环境对早期胚胎健康发育起重要的作用。
黄芩苷分子式为 C21H18O11,是从唇形科植物黄芩的干燥根中提取的一种黄酮类化合物,是黄芩的主要有效成分之一,具有多种药理作用,如解热、抗凋亡、抗氧化作用[7-8],还可抑制黄嘌呤氧化酶活性,清除自由基、超氧阴离子等,对多种因素引起的细胞损伤都有一定的保护作用。然而,目前还未发现有关黄芩苷对热应激时输卵管组织细胞保护作用的报道。因此,本试验根据黄芩苷的药理作用,以热应激小鼠为试验模型,观察热应激条件下黄芩苷是否可以减少输卵管组织细胞氧化损伤,并探究其潜在的机理。
1 材料和方法
1.1 试验材料
1.1.1 试验动物 将性成熟、体重在 25~35 g(6~7 周龄)的雌性昆明小白鼠饲养在恒温(22 ℃)、控光(12 h光/12 h黑)的普通级动物房内,自由摄取食物和水。
1.1.2 药物与试剂 黄芩苷购自中药固体制剂制造技术国家工程研究中心;GOT、SOD、MDA、CAT和GSH-Px生化检测试剂盒购于南京建成公司;Nrf2、Keap1、HO-1和NQO1抗体及β-actin均购自美国 Proteintech Group 公司;Apaf-1和Caspase-9抗体购自北京中杉金桥生物技术有限公司。
1.2 试验方法
1.2.1 试验动物分组 试验前将小鼠分组为对照(Ⅰ)组、Bai(Ⅱ)组、热应激(Ⅲ)组和热应激加Bai(Ⅳ)组。Ⅰ组和Ⅱ组小鼠腹腔注射生理盐水,Ⅲ组和Ⅳ组小鼠腹腔注射黄芩苷(50 mg/kg),连续注射7 d,第8天热应激(41 ℃)2 h。
1.2.2 黄芩苷最佳浓度筛选 将小鼠分为对照组、热应激组、黄芩苷组(25,50,100,150 mg/kg),对照组与热应激组腹腔注射生理盐水,黄芩苷组分别注射不同浓度药物,连续注射7 d,第8 天对热应激组和黄芩苷组进行热应激(41 ℃)2 h。最后对各组小鼠眼球采血后离心取血清,通过谷草转氨酶(GOT)试剂盒,测定血清中GOT含量。
1.2.3 输卵管组织学检查 将中性甲醛固定的输卵管组织进行梯度酒精脱水,二甲苯处理后做石蜡包埋切片,切片后用HE染色,用光学显微镜进行组织学观察。
1.2.4 输卵管组织中氧化标志物测定 用试剂盒检测输卵管中MDA、SOD、GSH-Px和CAT含量或活性。将输卵管组织在-80 ℃预冷的研钵中,加入液氮研磨,并按m∶V=1∶19加入生理盐水混匀,用普通离心机以3 000 r/min离心10~15 min,取上清装入EP 管中标记待用,按照相应试剂盒操作说明分别检测 MDA 含量及 SOD、GSH-Px 和 CAT 活性。
1.2.5 Nrf2/Keap1信号通路相关蛋白的检测 用 Western Blot 检测Nrf2、Keap1、HO-1和NQO1蛋白表达 ,将在-80 ℃冰箱保存的输卵管组织取出置于液氮内暂时保存,于研钵内研至粉末状后加入组织裂解液,用普通离心机以14 000 r/min离心5 min,取上清提取总蛋白,用Western Blot法[9]检测。
1.2.6 凋亡相关因子的检测 首先将石蜡包埋的输卵管组织切片,用二甲苯脱蜡,再用SABC法进行免疫组化检测,其步骤按SABC试剂盒操作说明书进行。阴性对照组用PBS代替一抗。对于染色后的切片,在光学显微镜下观察,细胞胞浆和胞核出现棕黄色颗粒为阳性。
1.2.7 统计方法 采用GraphPad Prism软件做统计学处理,各组数据进行多重比较,均数间进行t检验,P<0.05有统计学意义。应用Image J软件扫描蛋白灰度值,GraphPad Prism软件进行数据的分析处理,ANOVA法进行组间差异性比较,P<0.05为差异有统计学意义。
2 结果与分析
2.1 黄芩苷浓度对血清GOT酶的影响
如表1所示,热应激引起小鼠血清GOT活力升高并差异极显著(P<0.01);添加不同浓度的黄芩苷均能降低血清GOT活力,与热应激相比差异极显著(P<0.01);随黄芩苷浓度增加,血清GOT活力呈现下降趋势,黄芩苷浓度高于50 mg/kg时,血清GOT活力变化不明显,差异不显著(P>0.05)。
表1 不同浓度黄芩苷对热应激小鼠血清GOT的影响
Tab.1 Effects of different concentrations of baicalin on serum GOT in heat stressed mice U/L

组别Group血清GOT活力SerumGOTactivity对照Control23.32±2.464A热应激Heatstress74.09±4.642B25mg/kg55.81±8.191Ca50mg/kg44.16±7.658CDb100mg/kg42.63±6.703D150mg/kg38.80±5.254D
注:同列数据不同大写字母表示差异极显著 (P<0.01);不同小写字母表示差异显著(P<0.05)。
Note:Different capital letters show significant differences(P<0.01);and different lowercase letters have significant differences(P<0.05).
2.2 输卵管组织病理学变化
对照组和黄芩苷组小鼠输卵管组织的上皮单层柱状细胞排列规则,纤毛正常(图1,Ⅰ组和Ⅱ组)。热应激组细胞空泡化明显(图1,Ⅲ组a),细胞体积变小(图1,Ⅲ组b),组织间隙增大(图1,Ⅲ组c),核浓染,上皮单层柱状细胞排列不规则,绒毛脱落(图1,Ⅲ组d)。热应激加黄芩苷组有较大改善,空泡化减少(图1,Ⅳ组a),纤毛脱落减少(图1,Ⅳ组b)。

Ⅰ组.对照组;Ⅱ组.Bai组;Ⅲ组.热应激组;Ⅳ组.热应激加Bai组。
Ⅰ.Control group;Ⅱ.Baicalin group;Ⅲ.Heat group;Ⅳ.Heat+Baicalin group.
图1 输卵管组织病理学观察结果(×400)
Fig.1 Histopathological observation of oviductal tissue in four groups of mouse
2.3 组织中氧化指标的变化
试剂盒检测结果(图2)显示,与对照组相比,热应激组小鼠输卵管组织中MDA含量显著(P<0.05)升高,CAT(P<0.01)和GSH-Px(P<0.05)活力显著降低,此外,SOD活力也有所降低(P>0.05);与热应激组相比,热应激加黄芩苷组MDA含量显著(P<0.05)降低,而CAT、GSH-Px和SOD活力则显著(P<0.05)升高。
2.4 Nrf2和Keap1的表达
Western Blot检测结果(图3)显示,与对照组相比,热应激组Nrf2与Keap1表达量都显著(P<0.05)升高;而与热应激组相比,热应激加黄芩苷组Nrf2与Keap1表达量均显著(P<0.05)降低。
2.5 Ⅱ相解毒酶的表达
Western Blot检测结果(图4)显示,与对照组相比,热应激组HO-1表达量显著(P<0.05)升高,NQO1表达量有所升高,但差异不显著(P>0.05);与热应激组相比,热应激加黄芩苷组HO-1和NQO1表达量降低,差异也不显著(P>0.05)。
2.6 Apaf-1和Caspase-9蛋白表达
如图5,6所示,组织学检查发现,Apaf-1(图5)和Caspase-9(图6)主要在输卵管内膜上皮细胞胞浆和胞核中表达,阳性细胞呈棕黄色(图5,6箭头所指)。黄芩苷组有Apaf-1和Caspase-9蛋白染色,但表达稀疏且染色较浅(图5,6,Ⅱ组箭头所指)。小鼠受热应激后,输卵管内膜上皮细胞Apaf-1和Caspase-9表达明显增强,分布集中且染色较深(图5,6,Ⅲ组箭头所指)。而注射黄芩苷后,Apaf-1和Caspase-9表达明显低于单独热应激组,染色较浅且分布稀疏(图5,6,Ⅳ组箭头所指)。
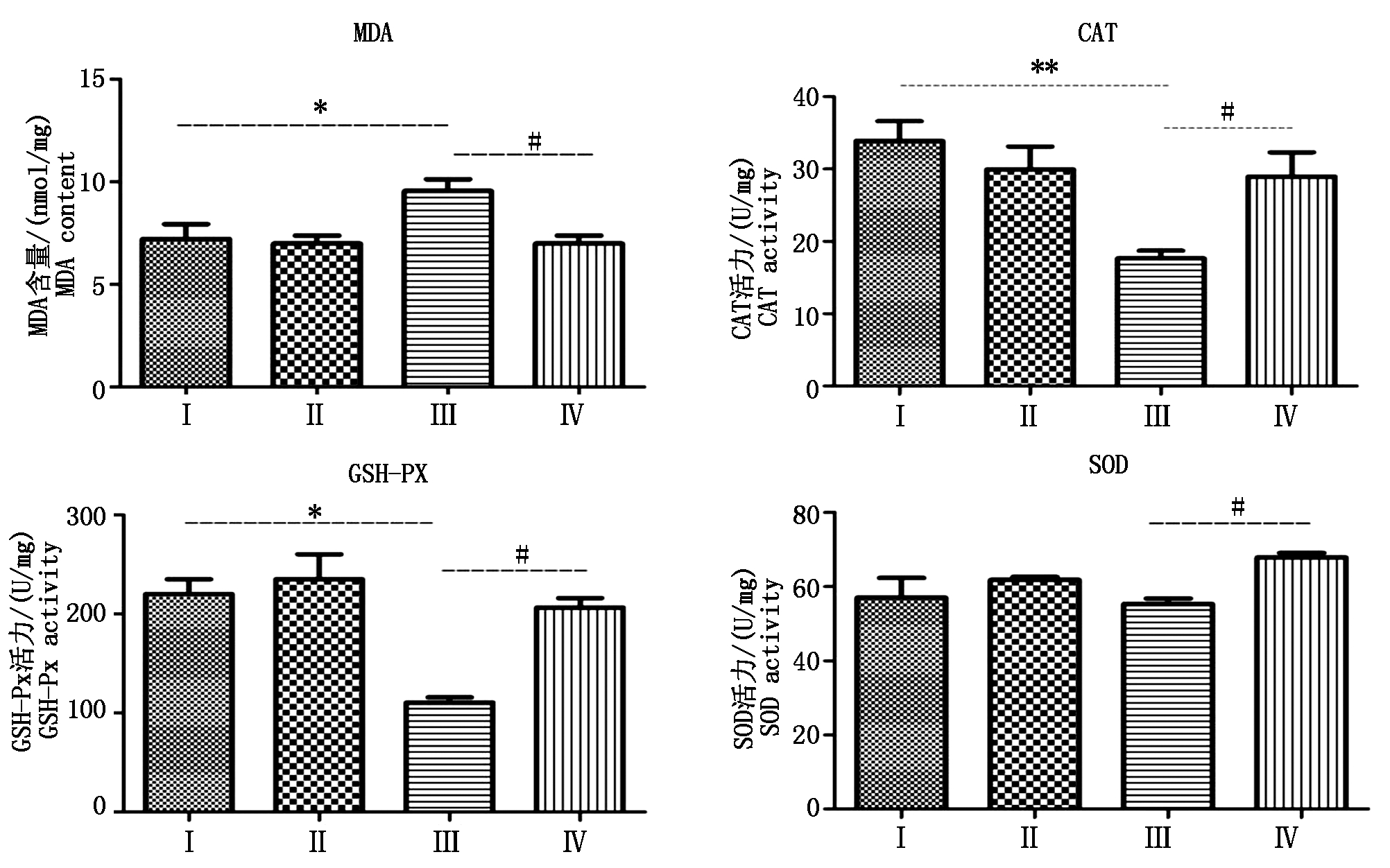
*.与对照组相比差异显著(P<0.05);**.与对照组相比差异极显著(P<0.01);#.与热应激组相比差异显著P<0.05;##.与热应激组相比差异极显著(P<0.01)。图3-4同。
*.Significant difference(P<0.05) compared with the control group;**.Very significant difference(P<0.01)compared with the control group;#.Significant difference(P<0.05) compared with the heat stress group;##.Very significant difference(P<0.01)compared with the heat stress group.The same as Fig.3-4.
图2 四组受试小鼠输卵管组织中MDA含量及CAT、SOD和GSH-PX活力
Fig.2 MDA content and CAT, SOD and GSH-PX activities the oviduct tissue of the four group of mouse
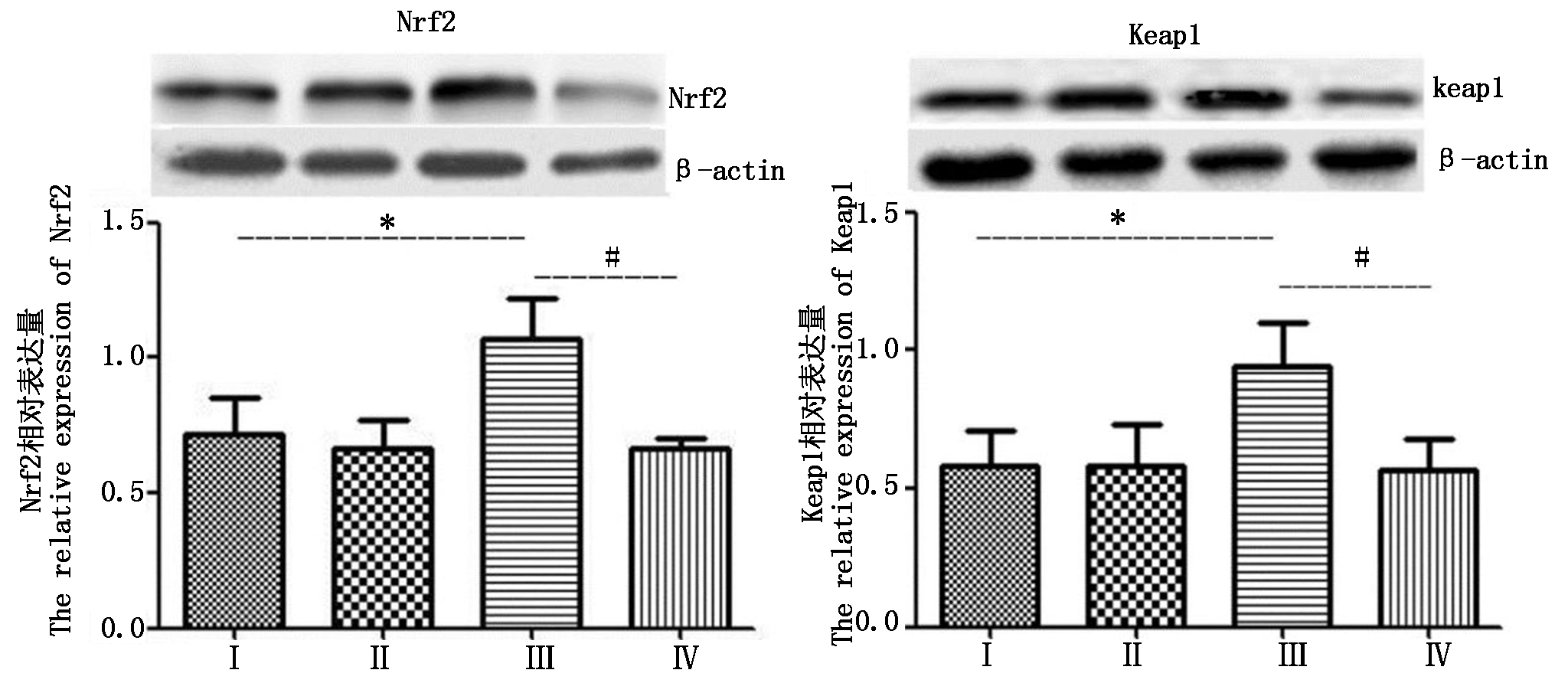
图3 四组小鼠输卵管组织中Nrf2和Keap1表达量
Fig.3 Expressions of Nrf2 and Keap1 in the oviduct tissue of the four group of mouse
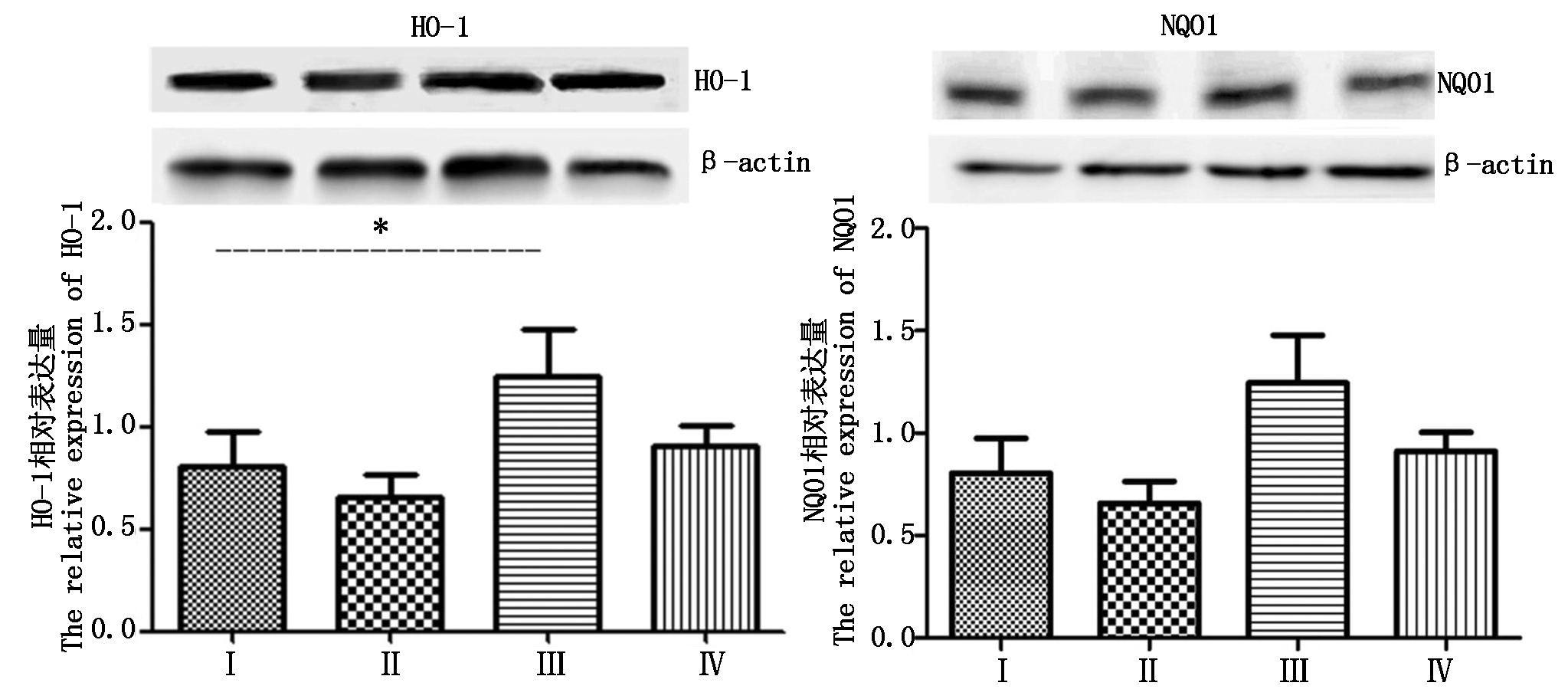
图4 四组小鼠输卵管组织HO-1和NQO1表达量
Fig.4 Expressions of HO-1 and NQO1 in the oviduct tissue of the four group of mouse
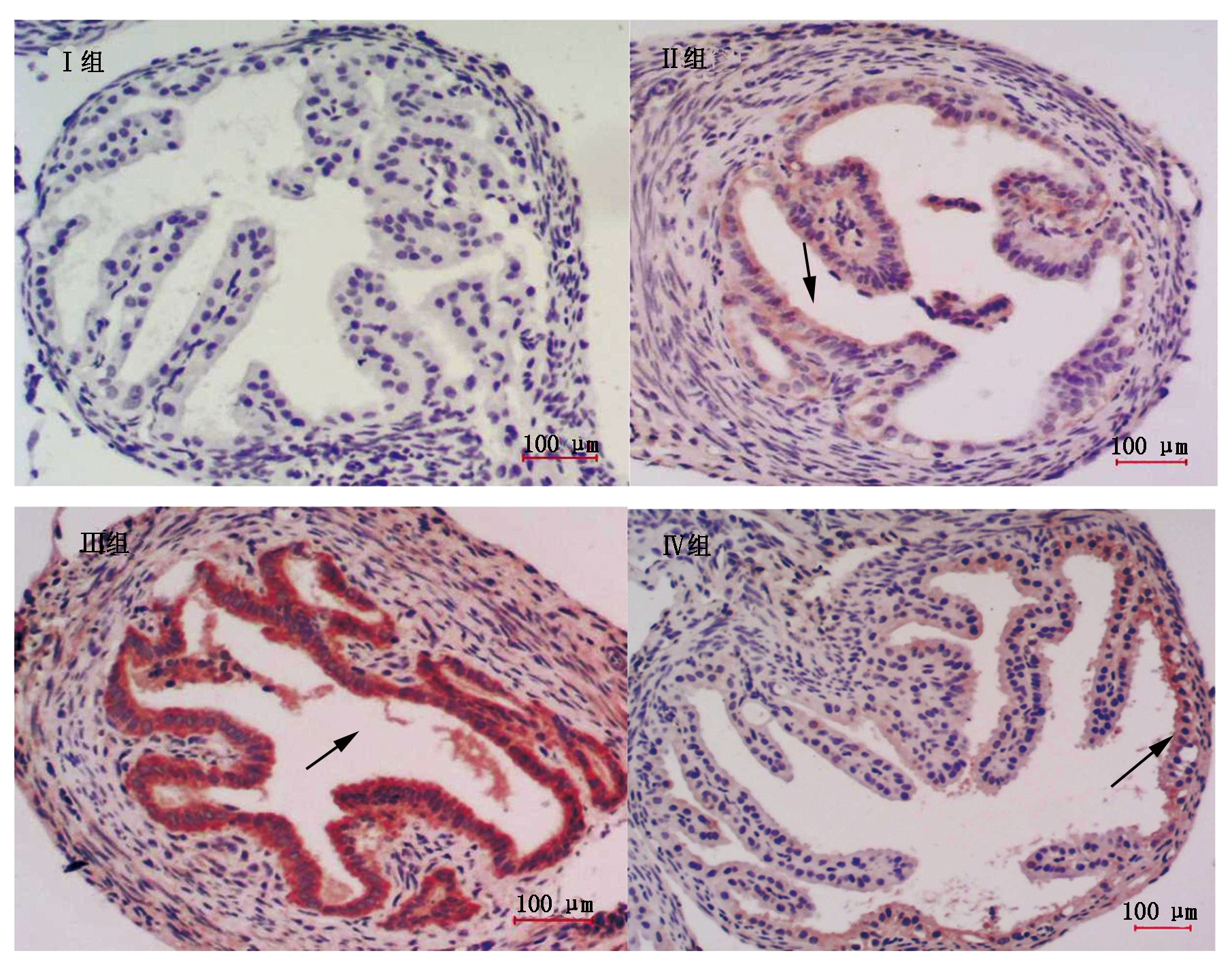
图5 四组小鼠输卵管组织 Apaf-1 蛋白表达(×100)
Fig.5 Expressions of Apaf-1 protein in the oviduct tissue of the four group of mouse

图6 四组小鼠输卵管组织 Caspase-9 蛋白表达(×100)
Fig.6 Expressions of Caspase-9 protein in the oviduct tissue of the four group of mouse
3 讨论
热应激能引起血清中GOT的活力迅速升高[10],因此,可通过血清GOT活力评价黄芩苷对小鼠热应激的保护作用,对黄芩苷药物做初步筛选。试验中,当黄芩苷浓度高于50 mg/kg时,血清GOT活力变化不明显,药效不显著,因此,本研究选择50 mg/kg的药物剂量。热应激状态下,细胞能量分解大于合成,从而为ROS大量生成提供条件。当氧化程度超出氧化物清除能力时,氧化系统和抗氧化系统动态失衡,从而增加组织细胞损伤和凋亡[3]。MDA是脂质过氧化产物,由 ROS 攻击细胞生物膜上的多不饱和脂肪酸并使其破坏而形成。MDA的显著性升高提示机体氧平衡失调[11]。SOD、CAT和GSH-Px对机体多余的ROS有清除作用[12]。本试验发现,热应激后小鼠输卵管组织发生损伤,其中包括氧化损伤,具体反应在组织中MDA含量升高的同时,抗氧化酶活力降低,组织结构损伤和细胞凋亡增加。
热应激可作为细胞内信号分子,激活多条信号通路,调控细胞对氧化应激的反应[13]。最近几年研究发现,机体内源性抗氧化信号通路Keap1-Nrf2/ARE能抵抗氧化应激反应[14],被认为是机体内最重要的内源性抗氧化信号通路。本试验中,热应激时输卵管组织中Nrf2和Keap1表达升高,并且Nrf2介导了抗氧化酶(SOD、GSH-Px和CAT)和Ⅱ相解毒酶(HO-1和NQO1)表达,说明热应激激活了Keap1-Nrf2/ARE通路。Nrf2是氧化应激和外源性有毒物质的感受器,参与细胞抗氧化应激和防御外源性有毒物质[15]。在正常生理条件下,通过Keap1与肌动蛋白细胞骨架结合,被锚定在胞浆内,并通过蛋白酶体依赖性途径和泛素化途径被降解,半衰期约10~40 min[16]。而在氧化状态下,亲电子物质与 Keap1的半胱氨酸残基反应,导致Keap1与Nrf2解离[17],Nrf2转位到核内介导Ⅱ相解毒酶以及抗氧化酶的转录,起到保护细胞和组织的作用[18]。因此,根据本试验结果我们认为,热应激激活了输卵管组织Keap1-Nrf2/ARE抗氧化通路,介导了抗氧化酶和Ⅱ相解毒酶的表达,从而对组织起到一定的保护作用。
本试验发现,黄芩苷增强了抗氧化酶和Ⅱ相解毒酶表达,降低输卵管组织氧化损伤,并且降低了Apaf-1和Caspase-9表达,在一定程度上抑制了细胞凋亡。前人研究也发现,黄芩苷可诱导Nrf2入核[19],从而发挥抗凋亡和抗氧化的作用[7-8]。随着组织氧化还原平衡恢复,Keap1进入细胞核内,与Nrf2一起出核并使Nrf2在胞浆内持续被蛋白体酶降解,Nrf2恢复至正常水平[20]。研究还发现,黄芩素能激活 Nrf2 并发挥抗凋亡作用,其机理是黄芩素通过Keap1-Nrf2/ARE途径促进Nrf2 核转位,降低肝细胞内活性氧的水平,从而减轻细胞氧化应激损伤,减少细胞凋亡[21]。Apaf-1 和 Caspase-9 作为线粒体凋亡途径中的关键蛋白酶,在细胞凋亡过程中发挥重要作用。结果发现,黄芩苷降低了输卵管组织中Apaf-1和Caspase-9的表达,从而减少细胞凋亡,因为,在细胞启动凋亡程序后,Apaf-1和Pro-Caspase-9结合后可促使 Pro-Caspase-9自身活化并激活其下游的一系列 Caspase 成员,从而诱导细胞凋亡[22]。
综上所述, 热应激引起小鼠输卵管组织氧化损伤,激活Keap1-Nrf2/ARE抗氧化信号通路。黄芩苷可增加Nrf2表达,提高抗氧化酶和解毒酶活性,抑制凋亡相关蛋白Apaf-1和Caspase-9表达,从而减少热应激状态下小鼠输卵管组织氧化损伤。然而,热应激对输卵管所造成的损伤是否会影响,以及黄芩苷可否提高热应激时早期胚胎存活率还需进一步深入研究。
参考文献:
[1] Stecyk J A, Couturier C S, Fagernes C E, et al. Quantification of heat shock protein mRNA expression in warm and cold anoxic turtles (Trachemys scripta) using an external RNA control for normalization[J]. Comparative Biochemistry and Physiology. Part D, Genomics & Proteomics, 2012, 7(1): 59-72.
[2] Hansen P J. Genetic variation in resistance of the preimplantation bovine embryo to heat shock[J]. Reproduction Fertility and Development, 2014, 27(1): 22-30.
[3] Tegethoff V, Hartung J. Animal housing climatic quality in various harmful conditions in broiler production to avoid heat stress in summer[J]. Deutsche Tierarztliche Wochenschrift, 1996, 103(3): 87-91.
[4] Hansen P J. Cellular and molecular basis of therapies to ameliorate effects of heat stress on embryonic development in cattle[J]. Animal Reproduction, 2013, 10(3):322-333.
[5] Gupta S, Agarwal A, Banerjee J, et al. The role of ox-idative stress in spontaneous abortion and recurrent preg-nancy loss:a systematic review[J]. Obstetrical & Gynecological Survey, 2007, 629(5): 335-347.
[6] Qian Y, Shi W Q, Ding J T, et al. Effects of type and state of co-culture cells on in-vitro development of porcine oocytes matured and fertilized in vitro[J]. Journal of Assisted Reproduction and Genetics, 2005, 22(6): 233-238.
[7] 孙先枝,程建波,卜登攀,等.黄芩苷的生物学功能和黄芩及其提取物在畜禽生产中的应用研究进展[J].动物营养学报, 2013(7): 1459-1464.
[8] 孙春玲,国晓瞳,赵 园,等.黄芩苷对热应激条件下猪近端肾小管(LLC-PK1)细胞凋亡率及B细胞淋巴瘤-2基因(Bcl-2)和Bcl-2相关X蛋白基因(Bax)表达的影响[J].农业生物技术学报, 2014,22(12):1553-1560.
[9] 关翠雯,金 晶,李 佳,等.丹参酮ⅡA激活Nrf2/ARE通路保护雷公藤甲素所致急性肝损伤[J].药学学报, 2013(9): 1397-1402.
[10] Corsi M M, Fulgenzi A, Gaja G, et al. Effect of acute and chronic inflammation on plasma growth hormone levels in rats[J]. Drugs Under Experimental and Clinical Research, 1997, 23(3/4): 117-122.
[11] Valls-Belles V, Torres Mdel C, Boix L.Alpha-Tocopherol, MDA-HNE and 8-OHd G levels in liver and heart mitochondria of adriamycin-treated rats fed with alcohol-free beer[J]. Toxicology,2008,249(213):97-101.
[12] Lu X T, Yu C. Enantiomer-specific profenofos-induced cytotoxicity and DNA damage mediated by oxidative stress in rat adrenal pheochromocytoma (PC12) cells[J]. Journal of Applied Toxicology,2014,34(2): 166-175.
[13] 国晓瞳,张 倩,于 枫,等.黄芩苷对热应激犊牛睾丸支持细胞胶质细胞源性神经生长因子(GDNF)和干细胞因子(SCF)表达的影响[J].农业生物技术学报, 2015(4): 441-449.
[14] Yang X, Yao W, Shi H, et al. Paeoniflorin protects Schwann cells against high glucose induced oxidative injury by activating Nrf2/ARE pathway and inhibiting apoptosis[J]. Journal of Ethnopharmacology, 2016, 185: 361-369.
[15] Meng H X, Guo J H, Wang H F, et al. Erythropoietin activates Keap1-Nrf2/ARE pathway in rat brain after ischemia[J]. International Journal of Neuroscience, 2014, 124(5): 362-368.
[16] Tong K I, Katoh Y, Kusunoki H, et al. Keap1 recruits Neh2 through binding to ETGE and DLG motifs: characterization of the two-site molecular recognition model[J]. Molecular and Cellular Biology, 2006, 26(8): 2887-2900.
[17] Wakabayashi N, Dinkova-Kostova A T, Holtzclaw W D, et al. Protection against electrophile and oxidant stress by induction of the phase 2 response: fate of cysteines of the Keap1 sensor modified by inducers[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(7): 2040-2045.
[18] Li L, Dong H, Song E, et al. Nrf2/ARE pathway activation, HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive o xygen species and PI3K/AKT signaling[J]. Chemico-Biological Interactions, 2014, 209(1): 56-67.
[19] Draheim T, Liessem A, Scheld M, et al. Activation of the astrocytic Nrf2/ARE system ameliorates the formation of demyelinating lesions in a multiple sclerosis animal model[J]. Glia, 2016, 64(12): 2219-2230.
[20] Jiang T, Huang Z, Lin Y, et al. The protective role of Nrf2 in streptozotocin-induced diabetic nephropathy[J]. Diabetes, 2010, 59(4): 850-860.
[21] 庞 纯,蒋 萍,季莉莉.黄芩素激活核转录因子Nrf2拮抗肝毒性的研究[J].中国药理学通报, 2014, 30(4): 546-549.
[22] Anichini A, Mortarini R, Sensi M, et al. APAF-1 signaling in human melanoma[J]. Cancer Letters, 2006, 238(2): 168-179.