植物内生菌(Endophyte) 指某一阶段或全部阶段生活于健康寄主植物的各组织或器官内部的真菌、细菌或放线菌[1-3],且没有引起明显发病症状的微生物,在植物体这一特殊的环境中,内生菌与宿主协同进化,构成植物体内的微生态系统,并对宿主植物体产生有益的生物学作用,增强植物抗逆、抗病原真菌和细菌等能力[2]。相关报道表明,在植物病虫害防治方面应用植物内生菌可有效增强植物的抗病性[4-15]。
禾谷丝核菌(Rhizoctonia cerealis)引起的小麦纹枯病是我国小麦生产上的一种典型土传病害,病菌在小麦不同生育阶段均能造成侵染,形成烂芽、苗枯、烂茎以及枯白穗等症状,严重影响小麦的长势和产量, 近年来,利用植物内生菌进行小麦纹枯病的生物防治已成为研究的重点[16-22]。安徽农业大学植物保护学院小麦病害课题组从健康的药用植物杜仲( Eucommia ulmoides.)茎分离到1 株炭疽菌属(Colletotrichum)内生真菌菌株DZJ07,该菌株对小麦纹枯病菌有较强的拮抗作用,能够在小麦根部进行有效定殖,通过诱导小麦植株苯丙氨酸解氨酶、过氧化物酶等防御酶活性的提高,提高小麦对纹枯病的抗病能力[3], 具有重要的理论研究和生产开发价值。为了进一步研究该菌株的内生性,安徽省作物生物学重点实验室利用绿色荧光蛋白基因(gfp), 采用农杆菌介导转化法,筛选具有拮抗活性的绿色荧光蛋白,标记转化子,研究该转化子在小麦植株中的定殖能力以及对小麦纹枯病的生防效果,为深入研究杜仲拮抗内生菌与小麦的互作提供理论基础。
1 材料和方法
1.1 供试菌株、质粒和培养条件
本试验供试植物病原真菌、内生真菌及质粒的特征及来源见表1。PCR胶回收试剂盒、Taq 酶和大肠杆菌菌株Trans-1 感受态等分子生物学相关试剂均购自宝生物工程(大连)有限公司;根据gfp基因编码区序列设计引物:引物1(gfp-R 5′-CGCACTA
GTGTACAGCTCGTCCAT-3′)和引物2(gfp-F 5′-GGGGGATCCATGGTGAGCAAG-3′),由上海(生工)生物有限公司合成,以gfp1305为模板,以引物1和引物2为上下游引物扩增gfp基因。生化试剂:草胺膦购自德国Dr.Ehrensorfer公司,其他生化试剂均为国产分析纯。
大肠杆菌(Escherichia coli)常规培养采用LB培养基,根癌农杆菌常规培养采用YEB培养基,真菌常规培养采用PDA培养基。试验用抗生素浓度为卡那霉素50 μg/mL、羧苄青霉素50 μg/mL、噻孢霉素300 μg/mL、草胺膦200 μg/mL。
1.2 供试培养基
PDA培养基:削皮马铃薯200 g/L(沸水煮20 min左右过滤出汤汁),葡萄糖20 g/L,琼脂15 g/L;LB 培养基:酵母提取物 5 g/L,胰蛋白胨10 g/L,氯化钠10 g/L,pH值调至7.0;YEB培养基:牛肉浸膏5 g/L,酵母浸膏1 g/L,蛋白胨5 g/L,蔗糖5 g/L,七水硫酸镁 0.9 g/L,pH值调至7.0~7.4;麦粒培养基:将小麦粒放在水里浸泡48 h后,取适量装在组培瓶,放在灭菌锅121 ℃ 60 min灭菌。
IM液体培养基:2.5×基本培养基 80 mL ,葡萄糖 0.36 g,甘油 1 mL,加ddH2O至终体积192 mL,灭菌冷却到50 ℃左右后添加8 mL 1mol/L MES和4 mL 10 mmol/L AS;2.5×基本培养基:KH2PO43.625 g,K2HPO4 5.125 g,MgSO4·7H2O 1.250 g,NaCl 0.375 g,CaCl2·2H2O 0.165 g,FeSO4·7 H2O 0.006 2 g,(NH4)2 SO4 1.250 g,加1 L ddH2O。
固体M-100培养基(1 L):M-100盐溶液62.5 mL,葡萄糖10 g,KNO3 3 g,加ddH2O至1 L,琼脂粉15 g;半固体M-100培养基的琼脂的含量为1%。M-100盐溶液(1 L):M-100微量元素溶液8 mL,KH2PO4 16 g,Na2SO4 4 g,KCl 8 g,MgSO4·7H2O 2 g,CaCl2 1 g,加ddH2O至1 L;M-100微量元素溶液(500 mL):H3BO3 30 mg,MnCl2·4H2O 70 mg,ZnCl2 200 mg,Na2MoO4·2H2O 20 mg,FeCl3·6H2O 50 mg,CuSO4· 5H2O 200 mg,加ddH2O 500 mL。
表1 细菌、真菌和质粒
Tab.1 Bacteria, fungi and plasmids

菌株或质粒Strainorplasmid相关性状Relevantcharacteristics来源Source根癌农杆菌AGL-1Ti质粒上有一段T-DNA,可插入植物基因组中安徽省作物生物学重点实验室保存AgrobacteriumtumefaciensAGL-1杜仲内生炭疽菌DZJ07杜仲内生真菌安徽省作物生物学重点实验室保存EndophyticfungiDZJ07fromEucommiaulmoides(GenBank登录号:JX179251)禾谷丝核菌小麦纹枯病致病菌安徽省作物生物学重点实验室保存RhizoctoniacerealispDHt-bar质粒植物表达载体,具有卡那霉素和草胺膦抗性安徽省作物生物学重点实验室保存PlasmidpDHt-bar绿色荧光蛋白(GFP)广泛应用的活体报告蛋白,在450~490nm安徽省作物生物学重点实验室保存Greenfluorescentprotein(GFP)蓝光波长下发出绿色荧光大肠杆菌Trans-1作为外源基因克隆表达的宿主购自宝生物工程(大连)有限公司EscherichiacoliTrans-1
1.3 绿色荧光蛋白(GFP)表达载体pDHt-bar- gfp的构建
以gfp 1305为模板,以引物1和引物2为上下游引物扩增gfp基因。PCR反应体系为:10×PCR缓冲液 5 μL、dNTP 4 μL、模板1 μL、gfp-R 2 μL、gfp-F 2 μL、Taq DNA聚合酶0.5 μL,加ddH2O至总体积为50 μL,以94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min为反应条件进行扩增。将PCR产物切胶回收,与pDHt-bar质粒分别进行双酶切,对切胶产物分别回收并连接。双酶切体系为:pDHt-bar/gfp 24 μL、10×通用缓冲液3 μL、BamHⅠ 1.5 μL、SpeⅠ 1.5 μL,反应条件为:37 ℃温浴过夜;连接体系为:pDHt-bar 2 μL、gfp 6 μL、10×Buffer 1 μL、T4 DNA 连接酶1 μL,16 ℃连接3 h。将全部连接产物转至大肠杆菌Trans-1,随机挑取单克隆子并进行验证。
1.4 质粒pDHt-bar-gfp转化生防真菌DZJ07及转化基因的表达
1.4.1 质粒pDHt-bar-gfp转入根癌农杆菌的感受态细胞[23] 取0.5 μL pDHt-bar-gfp质粒加入置于冰上的根癌农杆菌感受态细胞中,混匀;液氮速冻后在37 ℃条件下温育5 min,温育完成立即冰浴;加入适量YEB培养基,28 ℃培养3 h,离心收集菌体;去掉上清后用适量液体YEB重悬菌体并均匀涂布在含有抗生素Carb和Kan 的YEB平板上,室温培养。挑取转化子并进行转化子的验证[23],并将其菌液保存于-80 ℃。
1.4.2 根癌农杆菌与生防真菌DZJ07分生孢子孢悬液共培养 培养转入pDHt-bar-gfp质粒的根癌农杆菌并制备生防真菌DZJ07分生孢子孢悬液,将孢子悬液调到1×106 cfu/mL浓度,使其进行共培养[23],操作方法:培养转入pDHt-bar-gfp质粒的根癌农杆菌,离心收集菌体;用适量的IM液体培养基重悬菌体,并将菌液浓度调到OD660为0.15,摇床培养6 h左右;取培养好的根癌农杆菌菌液及制备好的孢悬液各100 μL 充分混合均匀,涂布于IM固体培养基平板,共培养2 d;加入适量含噻孢霉素和草胺膦的半固体M-100培养基培养3~4 d至抗性菌落出现;挑取疑似转化子边缘部分转移到含噻孢霉素和草胺膦的M-100固体培养基上培养3~4 d,挑取抗性菌落(转化子),用试剂盒提取基因组并进行初步PCR验证,取菌丝体在荧光显微镜下进行观察,绿色荧光标记。
1.4.3 转化子荧光观察 将按照1.4.2方法获得的多株转化子以及原始菌株DZJ07分别接种于PDA 固体平板,光照培养箱28 ℃培养7 d后 观察其菌落生长状况;并在Leica DM5000B显微镜(Germany)下, 利用波长为450~ 490 nm 的激发光照射不同转化子及原始菌株的菌丝,观察荧光产生情况。
1.5 荧光转化子的PCR 鉴定
采用植物基因组DNA提取试剂盒(购自天根公司)提取荧光转化子菌丝的DNA进行荧光转化子的PCR鉴定。采用并建立如下的标准PCR扩增程序:94 ℃,5 min; 94 ℃,30 s,60 ℃,30 s,72 ℃,2 min,34 个循环;72 ℃,10 min。用表2标准的PCR反应的扩增体系来完成。
表2 标准的PCR反应扩增体系
Tab.2 Standard PCR reaction amplification system

组分Component加量/μLVolume10×ExTaqBuffer2.5dNTPMixture2EasyTaqDNABlymerase0.5引物1Primer11引物2Primer21模板DNADNAsample1ddH2O12
1.6 转化子的遗传稳定性检测
将转化子接种至不含抗生素的PDA固体平板,28 ℃继代培养10代后,重新转接至含噻孢霉素(300 μg/mL)的PDA固体平板上,观察菌体生长及其荧光产生情况。
1.7 荧光转化子的拮抗活性测定
首先将原始菌株DZJ07、荧光转化子及小麦纹枯病菌菌株分别接种到PDA固体平板上28 ℃培养7 d,备用。各荧光转化子的拮抗活性测定采用平板对峙法[3],同时以单接种病原菌平板为对照,每处理3个重复,置于25 ℃下黑暗恒温培养。培养箱培养4~5 d,观察并记录结果,计算抑菌率。
1.8 荧光转化子在小麦植株中的定殖检测
1.8.1 荧光转化子分生孢子液的准备 荧光转化子接种于PDA培养基平板上,25 ℃下暗培养8 d,收集分生孢子,制备孢子悬浮液,通过血球计数法调整分生孢子悬浮液浓度为1.0×107 cfu/mL。
1.8.2 麦种处理 扬麦158先浸泡于3%的次氯酸钠溶液中消毒10 min,然后取出,将其用无菌水冲洗3~5遍后,置于无菌培养皿中,于25 ℃的恒温培养箱内保湿催芽,待种子露白后,将其在荧光转化子孢子悬浮液中浸泡5 h,取出备用。
1.8.3 小麦种植[3] 小麦采用盆钵(高8 cm,上口径7 cm,下口径5 cm)种植,将荧光转化子的麦粒培养物(筛选获得的具有较佳拮抗活性的荧光转化子接种在麦粒培养基上,放在28 ℃恒温培养箱7 d即为麦粒培养物)与灭菌砂土按1∶5 (m∶V) 的比例混匀,制成菌土装入盆钵中,播种按1.8.2方法催好芽的麦种,并于麦种表面覆盖5 cm左右的菌土。以种植于装有灭菌砂土盆钵中的小麦植株(麦种未经荧光转化子孢子悬浮液浸泡)为阴性对照。每种处理均种植20盆,每盆5粒麦种,置于人工气候培养箱(昼夜温度18 ℃,相对湿度50%,昼夜各12 h)中培养。
1.8.4 荧光转化子在小麦根际的定殖及数量检测[3] 于接种后第9,12,15,18,23,28,34天分别取不同处理组的小麦根系,参照齐永霞等[24-25]方法,利用梯度稀释法,将获得的母液依次稀释至10-3,分别吸取浓度为10-3 溶液100 μL涂布于含噻孢霉素(300 μg/mL)的PDA平板上,置于28 ℃恒温培养箱内培养,每处理设置3个重复,48 h后观察记载菌落数,计算平均每克根际土壤中的含菌量。
1.8.5 荧光转化子在小麦植株的定殖及数量检测[24] 于小麦种植后第9,12,15,18,23,28,34天分别进行小麦植株的取样以及荧光转化子的数量检测。样品经下列方法处理:①根内定殖:小麦根系用流水冲洗干净后,再用灭菌水反复冲洗,彻底去除根际土,根系首先用75%乙醇消毒3 min,后用无菌水冲洗3次。② 茎内定殖:小麦茎用75%乙醇消毒3 min,再用无菌水冲洗。定量称取不同方法处理过的小麦根系、茎组织,于研钵中彻底研磨。研磨液稀释至10-3,吸取10-3 溶液100 μL涂布到已制备好的含噻孢霉素(300 μg/mL)的PDA 平板上。48 h后逐日观察记载,观察并计数平板上的菌落数。
于小麦种植后的第34天,取小麦根、茎组织(每1株苗为一个重复, 3次重复),按照上述方法表面灭菌后,将小麦根、茎组织徒手切片,小心铺展于载玻片上于激发光波段450~490 nm下进行绿色荧光观察(莱卡DM5000B型号为DFC425C)。
1.9 荧光转化子对小麦纹枯病防治效果试验
麦种及小麦种植方法均同1.8.2和1.8.3,试验设5种处理,具体方法参照文献[3],每处理重复20盆,每盆5粒。播种后35 d 调查纹枯病的发病情况,计算病情指数和发病率。5种处理如下所示:
①阴性对照处理:将催过芽的麦粒(麦种未经孢子悬浮液浸泡)播种于装有灭菌砂土的盆钵里。
②小麦纹枯病菌 + 原始菌株DZJ07处理:小麦纹枯病(麦粒培养基培养)、原始菌株与灭菌砂土按1∶1∶5(m∶m∶V)的比例混合均匀,播种催过芽的麦粒(麦种经原始菌株孢子悬浮液(1.0×107 cfu/mL)浸泡)。
③小麦纹枯病菌 + DZJ07荧光转化子处理 小麦纹枯病菌(麦粒培养基培养)、荧光转化子与灭菌砂土按1∶1∶5(m∶m∶V)的比例混合均匀后,播种催过芽的麦粒(麦种经荧光转化子分生孢子悬浮液(1.0×107 cfu/mL)浸泡)。
④小麦纹枯病菌处理 小麦纹枯病菌和灭菌砂土按1∶5(m∶V)混合均匀,播种催过芽的麦粒(麦种未经孢子悬浮液浸泡)。
⑤小麦纹枯病菌+多菌灵处理 小麦纹枯病菌与灭菌砂土按1∶5(m∶V)混合均匀,多菌灵拌种处理的麦粒播种于盆钵中。
2 结果与分析
2.1 绿色荧光蛋白基因(gfp)表达载体pDHt-bar-gfp的构建
以gfp1305为模板,进行PCR扩增,扩增产物(约750 bp)回收并与pDHt-bar质粒分别进行双酶切后进行连接。连接产物转至大肠杆菌Trans-1,随机挑取单克隆子,以gfp-F和gfp-R为上下游引物扩增gfp基因。PCR产物的琼脂糖凝胶电泳结果见图1,显示克隆转化子PCR扩增产物中有750 bp大小的条带产生,初步推断重组质粒pDHt-bar-gfp构建成功。随后,重组质粒pDHt-bar-gfp送往生工生物工程(上海)股份有限公司进行测序,测序结果确认绿色荧光蛋白(gfp)表达载体pDHt-bar-gfp的构建成功。
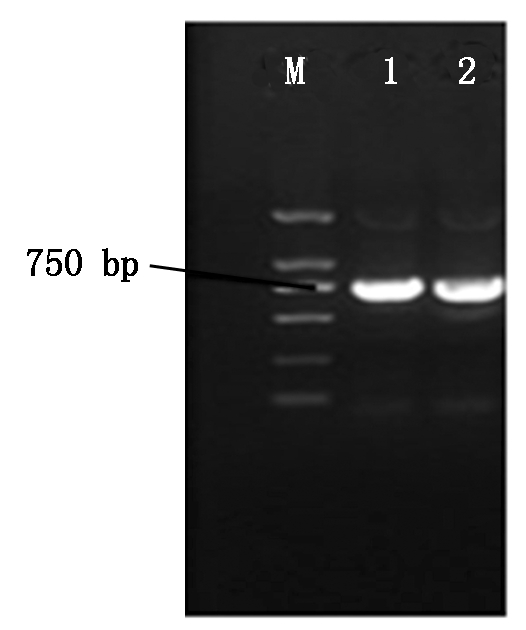
M.DNA Marker(2 000 bp);1,2. gfp基因PCR扩增产物。
M.DNA Marker(2 000 bp);1,2.PCR amplification products of gfp.
图1 gfp基因扩增结果核酸电泳
Fig.1 gfp gene amplification results of nucleic acid electrophoresis
2.2 杜仲内生拮抗菌DZJ07荧光转化子的获得
2.2.1 绿色荧光蛋白基因(gfp)表达载体pDHt-bar-gfp的转化 重组质粒pDHt-bar-gfp转入根癌农杆菌AGL-1,过夜培养挑取单菌落进行PCR验证(图2),图2中显示有750 bp大小的基因条带,验证pDHt-bar-gfp成功转入根癌农杆菌AGL-1。将含有重组质粒pDHt-bar-gfp的根癌农杆菌AGL-1与杜仲内生拮抗菌DZJ07分生孢子液共培养2 d,培养液涂布于M-100固体培养基平板上生长3~4 d,复筛后最终获得7个荧光转化子。参照1.4 的方法提取荧光转化子和原始DZJ07菌株的基因组DNA,并进行PCR 扩增,结果显示7个荧光转化子均扩增出大小约750 bp 的条带,而DZJ07没有任何扩增产物,其中2个转化子DZJ07-1、DZJ07-6的基因组PCR结果如图3所示。选取荧光转化子DZJ07-1 、DZJ07-6的扩增产物进行克隆,比对结果表明序列与gfp基因编码区序列相同,由此可知,外源gfp 基因已整合到基因组DNA中。
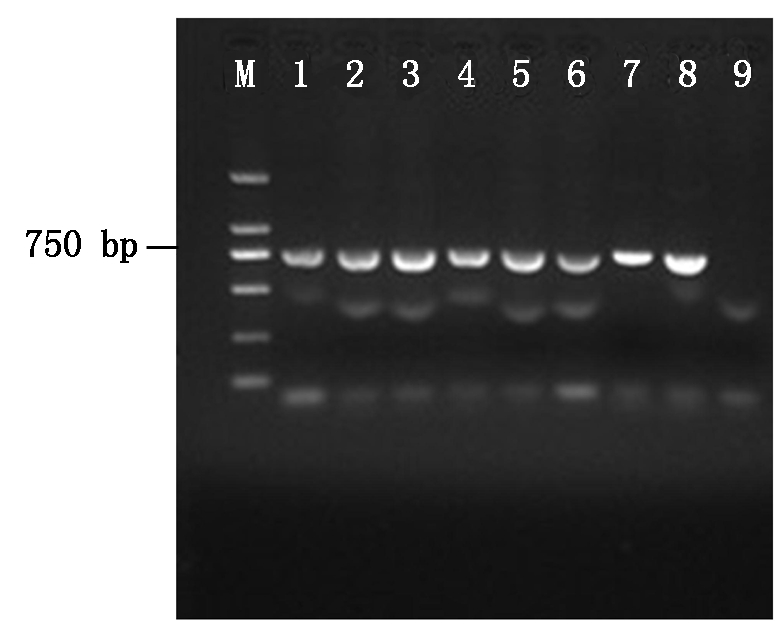
M.DNA Marker(2 000 bp);1~8.pDHt-bar-gfp
农杆菌AGL-1单菌落PCR扩增产物;9.pDHt-bar空质粒对照。
M.DNA Marker(2 000 bp);18.PCR amplification products of pDHt-bar-gfp transformant strains;9.pDHt-bar empty plasmid control.
图2 重组质粒pDHt-bar-gfp转入农杆菌AGL-1的验证核酸电泳
Fig.2 Validation of recombinant plasmid pDHt-bar-gfp into Agrobacterium tumefaciens AGL-1
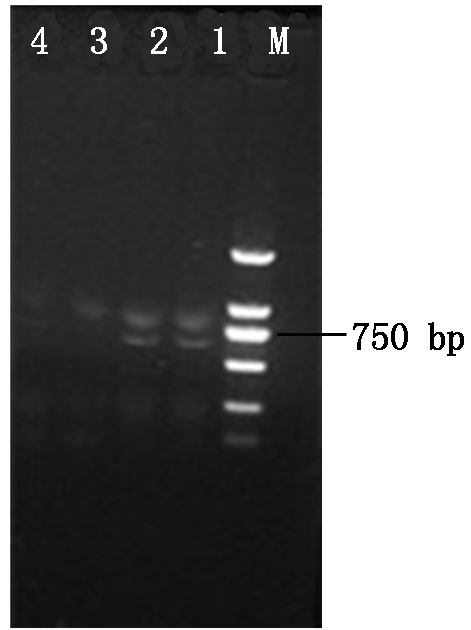
M.DNA Marker (2 000 bp);1~2.转化子DZJ07-1、DZJ07-6基因组PCR扩增产物;3.DZJ07 PCR扩增产物;4.TE水对照。
M.DNA Marker (2 000 bp);1-2.PCR amplification products of transformants DZJ07-1,DZJ07-6 genomic;3.PCR amplification product of DZJ07;4.TE water control.
图3 荧光转化子基因PCR验证电泳图
Fig.3 Genomic DNA PCR confirmation electrophoresis
2.2.2 转化子生长特性研究 转化子于28 ℃培养7 d后,其菌落颜色、生长速度及菌丝和分生孢子形态等均与原始菌株DZJ07一致,可知,外源pDHt-bar质粒的插入对其生长和生物学特性没有影响。荧光观察表明,在激发光波长为450~490 nm的照射下,原始菌株 DZJ07菌丝不产生荧光,而7个抗性转化子均能够产生绿色荧光(图4),分别命名为DZJ07-1~DZJ07-7,结合上述转化子的克隆扩增结果,可知绿色荧光蛋白(GFP)表达载体pDHt-bar-gfp的成功插入引起转化子绿色荧光的产生。
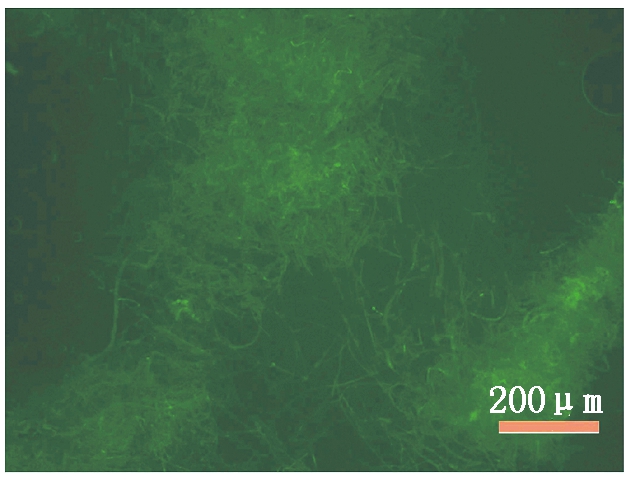
图4 标记GFP的炭疽菌DZJ07菌丝体的荧光图
Fig.4 Fluorescence of Colletotrichum gloeosporioides DZJ07 mycelium labeled with GFP
2.3 荧光转化子的遗传稳定性
参照1.6 的方法, 将所获得的7个荧光转化子DZJ07-1~DZJ07-7分别在不含抗生素噻孢霉素的PDA 固体平板上连续转接10 次后,再接种至含噻孢霉素(300 μg/mL)的PDA固体平板上,各荧光转化子不仅长势正常,且能够稳定的产生绿色荧光,从而表明表达载体pDHt-bar-gfp中的gfp 基因和噻孢霉素抗性基因在转化子中可稳定遗传和表达。
2.4 荧光转化子对小麦纹枯病菌的拮抗活性
荧光转化子DZJ07-1~DZJ07-7对小麦纹枯病菌的拮抗活性检测结果如图5所示,由表3可知,转化子DZJ07-5和DZJ07-6对小麦纹枯病菌的拮抗活性略强于原始菌株DZJ07,抑菌率均在50%以上;DZJZ07-1、DZJ07-2和DZJ07-7的拮抗活性比DZJ07稍弱,抑菌率在43.68%~46.11%;而荧光转化子DZJ07-3和DZJ07-4的抑菌率相对较低,仅在35%左右。因此,在后续试验中,选择荧光转化子DZJ07-6进行小麦植株定殖能力的研究。
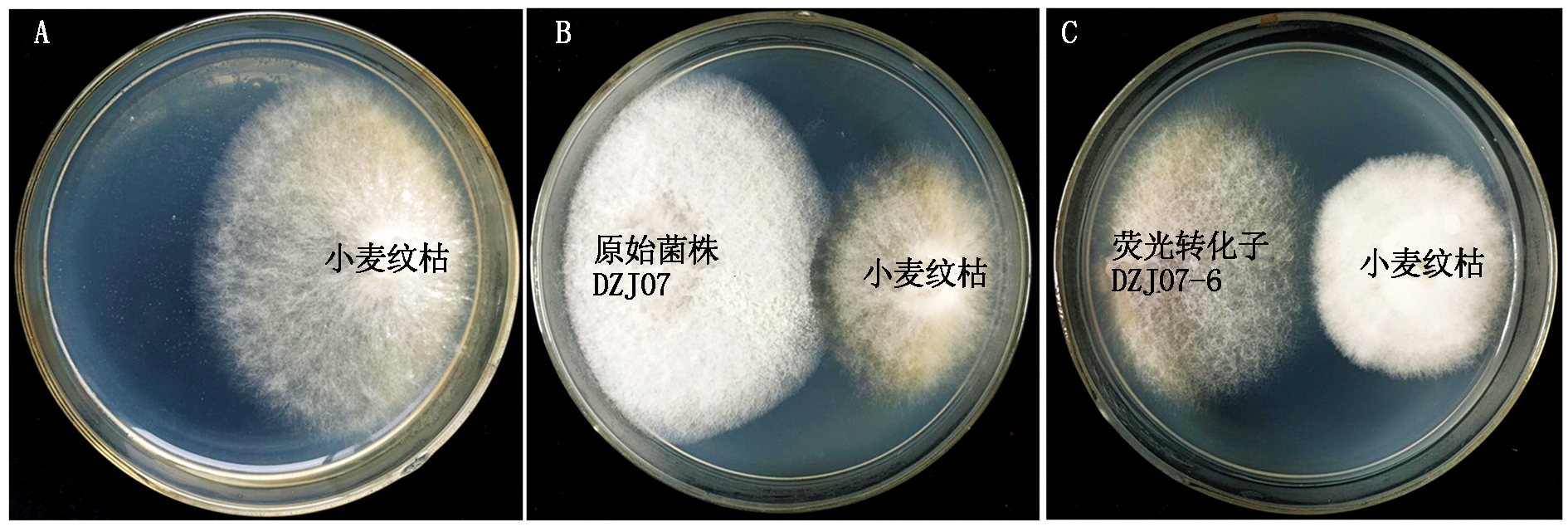
A. 培养4 d的小麦纹枯病菌菌落; B.DZJ07与小麦纹枯病菌对峙培养4 d; C. 荧光转化子DZJ07-6与小麦纹枯病菌对峙培养4 d。
A. The colony characteristics of R. cerealis after 4 days; B. Confront antibiotic culture experiment in DZJ07 and R. cerealis after 4 days;C. Confront antibiotic culture experiment in the transformant strains DZJ07-6 and R. cerealis after 4 days.
图5 荧光转化子DZJ07-6和原始菌株DZJ07与小麦纹枯病菌的对峙培养
Fig.5 Confrontation culture between the transformantstrains DZJ07-6, DZJ07 and Rhizoctonia cerealis
表3 七个荧光转化子对小麦纹枯病菌的抑菌率
Tab.3 The inhibition rate of seven fluorescent transformants against wheat Rhizoctonia cerealis %
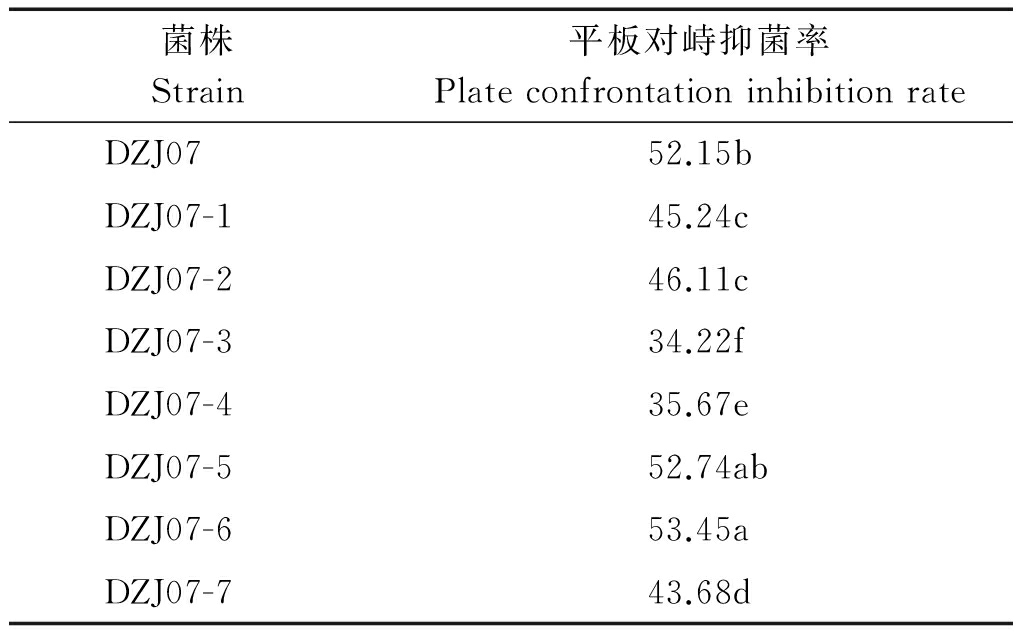
菌株Strain平板对峙抑菌率PlateconfrontationinhibitionrateDZJ0752.15bDZJ07-145.24cDZJ07-246.11cDZJ07-334.22fDZJ07-435.67eDZJ07-552.74abDZJ07-653.45aDZJ07-743.68d
注:不同小写字母表示0.05 水平上差异显著(Duncan多重比较法)。表5同。
Note:Values with different small letters differ significantly at 0.05 level using the Duncan HSD test.The same as Tab.5.
2.5 荧光转化子DZJ07-6在小麦中的定殖情况分析
小麦种植后的不同时间段,对经荧光转化子DZJ07-6处理的小麦根际土壤、根和茎组织进行转化子的分离检测,结果表明(表4),小麦生长的第9天可从根际土壤、根和茎组织中分离检测到转化子DZJ07-6;随着小麦植株的生长,根际土壤中的荧光转化子DZJ07-6数量呈现逐渐下降并趋于平稳的趋势,截至取样的第34天,小麦根际土壤中的DZJ07-6含量保持在2.72×106 cfu/g ;荧光转化子在小麦根、茎内的定殖则均呈现出先下降再上升并趋于平稳的趋势,从第9天的最大值缓慢下降,取样分离的第18,15天,根和茎组织中的荧光转化子数量分别达到最低,分别为0.43×104,0.43×103 cfu/g,随后,根、茎组织中的荧光转化子数量缓慢上升,截至取样的第34天,小麦根、茎内的荧光转化子数量分别为0.62×104,2.26×103 cfu/g。相应的对照处理中,均无DZJ07-6菌株的存在(表4)。荧光显微观察结果如图6所示,大量DZJ07-6可在小麦根表存活并大量繁殖,且生长34 d的小麦植株的根、茎组织中含有大量DZJ07-6的发光菌株,如图6-A、C所示,而在对照的根和叶片横切面中,均未观察到标记菌株(图6-B、D)。
表4 小麦植株的根际土壤、根和茎组织中荧光转化子DZJ07-6的平板分离
Tab.4 Platelet separation of fluorescent transformant DZJ07-6 in rhizosphere soil, root and stem tissue of wheat plants cfu/g
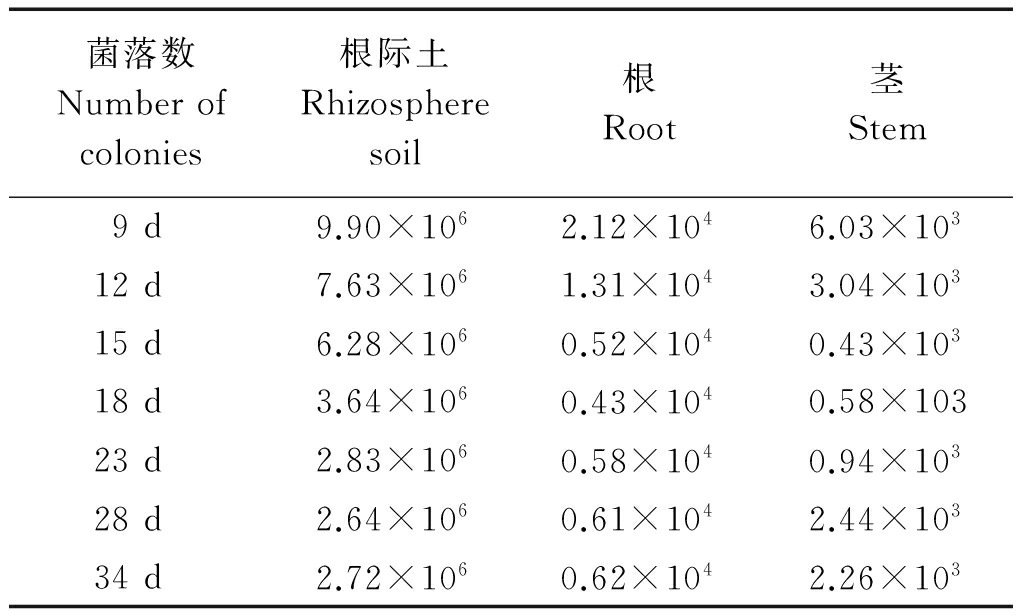
菌落数Numberofcolonies根际土Rhizospheresoil根Root茎Stem9d9.90×1062.12×1046.03×10312d7.63×1061.31×1043.04×10315d6.28×1060.52×1040.43×10318d3.64×1060.43×1040.58×10323d2.83×1060.58×1040.94×10328d2.64×1060.61×1042.44×10334d2.72×1060.62×1042.26×103
注:表中所列数据是3个重复的平均值。表5同。
Note: The data listed in the table is the average of 3 replicates.The same as Tab.5.

A.荧光转化子DZJ07-6的小麦茎组织; B.对照小麦茎组织;C.荧光转化子DZJ07-6的小麦根组织 ;D.对照小麦根组织。
A. Wheat stem tissue of fluorescent transformant DZJ07-6;B. Control wheat stem tissue;C. Wheat root tissue DZJ07-6 of transformant;D. Control wheat root tissue.
图6 GFP标记的炭疽菌DZJ07在小麦根际及茎组织中的定殖
Fig.6 Colonization of GFP-labeled anthrax DZJ07 in wheat rhizosphere and stem
2.6 荧光转化子DZJ07-6对苗期盆栽小麦纹枯病的防效
小麦播种35 d后统计各处理小麦的发病情况,结果见表5:小麦纹枯病菌组的小麦患病严重,病情指数为84.45%;小麦纹枯病菌 + 原始菌株DZJ07处理的小麦与小麦纹枯病菌 + DZJ07荧光转化子组的小麦植株发病情况相似,病情指数分别为10.02%,10.87%,无显著差异,说明荧光转化子DZJ07-6对苗期小麦纹枯病的生防效果没有因绿色荧光蛋白的标记和表达受到明显影响。
3 讨论
gfp标记的方法是研究靶标微生物与植物互作关系的重要手段。现阶段报道的靶标微生物的gfp标记方法多为点击转化法,如杨秀荣等[26]利用点击转化法将含有gfp mut3a基因的质粒转入生防枯草芽孢杆菌B579中获得gfp标记成功的枯草芽孢杆菌B579-gfp并测定其定殖能力;李晓婷等[27]采用点击转化法将含有gfp基因的质粒pTR gfp转入假单胞菌解磷细菌K3中,获得gfp标记成功的菌株K3GFP并测定其解磷能力;黄贵修等[28]采用原生质体转化法将gfp表达载体质粒pPKNTG转入HND5菌株中,获得稳定遗传的荧光转化子。而有关农杆菌介导转化法在生防真菌gfp标记方面的应用则鲜有报道,仅有吴磊等[29]利用农杆菌介导法将红色荧光蛋白基因DsRed转入植物病原菌轮枝镰孢菌株,观察其在玉米自交系B73根部的定殖及生长规律以及Luo等[30]利用农杆菌介导法研究白僵菌代谢产物有丝分裂原活化蛋白激酶作用等方面的报道。本研究通过农杆菌介导转化法,获得了具有拮抗活性的杜仲内生真菌DZJ07绿色荧光标记转化子,且插入的外源gfp基因和噻孢霉素抗性基因可在转化子中稳定遗传和表达。本试验获得的7个荧光转化子中有2个转化子的拮抗活性与原始菌株DZJ07相似,而其余的转化子对小麦纹枯病菌的拮抗活性则显著降低,究其原因可能是外源基因在微生物体内进行特性表达的同时,也会改变转化菌株的代谢途径,增强转化菌株的代谢负荷,当转化菌株和其他微生物共同生长的情况下,会处于不利地位,反映在生理特性上,即是转化子拮抗活性的变化或生长特性等方面的改变。此外,试验中荧光显微镜观察荧光转化子DZJ07-6在小麦植株中的定殖情况,发现其首先侵染玉米根系等组织,并在其中大量增殖,然后沿主根向地上部位茎组织侵染,在玉米茎部组织细胞间隙间扩展,截至取样的第34天,小麦根、茎内的荧光转化子数量分别为0.62×104 ,2.26×103 cfu/g,说明荧光转化子DZJ07-6在小麦植株中有较强的适应性,可以在小麦根、茎等组织中较好地定殖。
表5 五种不同处理的小麦纹枯病的发生情况
Tab.5 Effect of DZJ07 mycelia on morbidity of Rhizoctonia cerealis
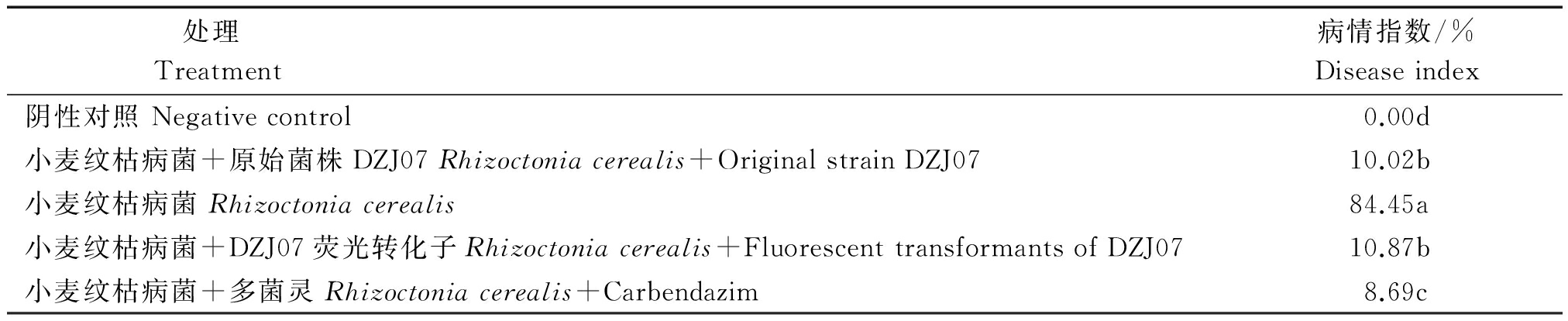
处理Treatment病情指数/%Diseaseindex阴性对照Negativecontrol0.00d小麦纹枯病菌+原始菌株DZJ07Rhizoctoniacerealis+OriginalstrainDZJ0710.02b小麦纹枯病菌Rhizoctoniacerealis84.45a小麦纹枯病菌+DZJ07荧光转化子Rhizoctoniacerealis+FluorescenttransformantsofDZJ0710.87b小麦纹枯病菌+多菌灵Rhizoctoniacerealis+Carbendazim8.69c
植物内生菌及其代谢产物已成为生防研究的热点和重点。内生菌能否在土壤或寄主植物中进行有效定殖,对其生防作用的发挥有着重要的作用。目前,利用gfp标记法可对生防菌在植物体及其根际的定殖、扩展和消长规律进行深入研究。如魏春燕等[8]将固氮菌DX120E进行了绿色荧光蛋白基因标记,并对其在甘蔗植株内的定殖进行了分析;田兆丰等[31]对枯草芽孢杆菌Kct99进行了gfp标记,并对其在甘蓝根部的定殖方式进行了分析,研究了生防枯草芽孢杆菌的抗病机理。本研究利用绿色荧光蛋白gfp 对杜仲拮抗内生真菌DZJ07进行标记,发现外源gfp基因的插入对生防菌的生物学特性以及生防特性无不良影响,DZJ07绿色荧光标记转化子与原始菌株在菌落形态、生长速度、拮抗活性等方面均有较好的相似性,而且质粒的遗传稳定性较好,本试验结果为进一步开展生防菌、病原菌及寄主植物三者之间的互作研究提供了理论基础。此外,生防微生物的防治效果易受环境因素的影响,本研究仅研究了DZJ07荧光转化子对小麦纹枯病的温室防效,而其在其他不同气候条件下如田间环境中是否依然可以在小麦植株中有效定殖,是否还会对小麦纹枯病有较好的防治效果,这些还有待于深入研究。
参考文献:
[1] Stone J K, Bacon C W, White J J. An overview of endophytic microbes:endophytism defined microbial endophytes[M]. New York: Marcel Dekker, 2000: 3-29.
[2] 胡桂萍,郑雪芳,尤民生,等.植物内生菌的研究进展[J].福建农业学报, 2010, 25(2): 226-234.
[3] 丁 婷,孙微微,韩亚惠,等.杜仲内生真菌DZJ07在小麦根际定殖及对根部酶活的影响[J].核农学报, 2015, 29(6): 1149-1157.
[4] Istifadah N, Saleeba J A, Mcgee P A. Isolates of endophytic Chaetomium spp. inhibit the fungal pathogen Pyrenophora tritici-repentis in vitro[J]. Canadian Journal Of Botany-Revue Canadienne De Botanique, 2006, 84(7): 1148-1155.
[5] Dingle J, Mcgee P A. Some endophytic fungi reduce the density of pustules of Puccinia recondite f.sp tritici in wheat[J]. Mycological Research, 2003, 107(3): 310-316.
[6] Istifadah N, Mcgee P A. Endophytic chaetomium globosum reduce development of tan spot in wheat caused by pyrenophora triticirepentis[J]. Australasian Plant Pathology, 2006, 35(4): 411-418.
[7] 徐玲玲,单庆红,郭 斌.植物内生菌研究进展及应用展望[J].安徽农业科学, 2013, 41(13): 5641-5643, 5709.
[8] 魏春燕,邢永秀,莫 遥,等.绿色荧光蛋白基因标记的固氮菌DX120E在甘蔗植株内的定殖[J].作物学报, 2014, 40(6): 1132-1139.
[9] Tian T, Qi X C, Wang Q, et al. Colonization study of GFP-tagged Bacillus strains on wheat surface(in Chinese)[J]. Acta Phytopathologica Sinica, 2004, 34(4): 346-351.
[10] Kong H G, Choi K H, Heo K R, et al. Generation of a constitutive green fluorescent protein expression con-struct to mark biocontrol bacteria using P43 promoter from Bacillus subtilis[J]. Plant Pathology Journal, 2009, 25(2): 136-141.
[11] Peng W, Tan Y J, Huang Y C. Colonization of gfp tagged Paenibacillus polymyxa strain around tomato roots(in Chinese) [J]. Chinese Journal of Biological Control, 2008, 26(3): 307-311.
[12] Hao B Q, Ma L P, Qiao X W. Colonization ability of plant growth promoting Bacillus B96-Ⅱ-gfp labeled with GFP(in Chinese)[J]. Chinese Journal of Eco-Agriculture, 2010, 18(4): 861-865.
[13] Zhang Y, Che J M, Liu P, et al. Colonization of Bacillus cereus ANTI-8098A in tomato plants and its biocontrol characteristics to bacterial wilt disease(in Chinese) [J]. Chinese Journal of Biological Control, 2011, 27(2): 221-227.
[14] Fan X J, Qiu S X, Wu X P, et al. Endophytic Bacillus subtilis strain BS-2 labeled with green fluorescent protein gene(in Chinese) [J]. Chinese Journal of Applied & Environmental Biology, 2007, 13(4): 530-534.
[15] Singh M K, Kushwaha C, Singh R K. Studies on endophytic colonization ability of two upland rice endophytes, Rhizobium sp. and Burkholderia sp., using green fluorescent protein reporter[J]. Curr Microbiol, 2009, 59: 240-243
[16] Han Y P, Chen X L, He Z T, et al. Progress, problem and prospect of wheat sharp eyespot research[J]. Journal of Triteceae Crops, 2001, 21(1): 81-84.
[17] Harman G E. Myths and dogmas of biocontrol: changes in peiceptions derived from research on Trichoderma harzianum T-22[J]. Plant Diseases, 2000, 84(4):377-393.
[18] Howell C R. Mechanisms employed by Trichoderma species in the biological control of plant diseases: the history and evolution of current concepts[J]. Plant Diseases,2002,87(1):4-10.
[19] 石明旺,茹振刚,牛立元,等.不同小麦品种对小麦纹枯病抗性及产量损失测定的研究[J].河南职技师院学报, 2000, 28(1): 15-18.
[20] 王玉正,袁永兰,赵百灵,等.山东省小麦纹枯病危害损失及防治指标研究[J].植物保护学报, 1997, 24(1): 44-48.
[21] 陈健华,张炽昌,徐东方,等.小麦纹枯病的研究进展[J].现代农业科技, 2011(S1):69-70.
[22] Wen C Y, Wang K X, Wang M, et al. Colonization trends of endophytic bacteria EBS05 in wheat and its control effect on wheat sharp eyespot[J]. Acta Phytophylacica Sinica, 2011, 38(6): 481-486.
[23] 林拥军,张启发.农杆菌介导的水稻转基因研究[D].武汉: 华中农业大学, 2001.
[24] 齐永霞,陈方新.球孢白僵菌在玉米根际的定殖及对根际微生物的影响[J].热带作物学报, 2013, 34(5): 962-966.
[25] 古丽君,徐秉良,梁巧兰,等.生防木霉对草坪土壤微生物区系的影响及定殖能力研究[J].草业学报, 2013, 22(3): 321-326.
[26] 杨秀荣,田 涛,孙淑琴,等. GFP 标记生防细菌 B579 及其定殖能力检测[J].植物病理学报, 2013, 43(1): 82-87.
[27] 李晓婷,董彩霞,杨兴明,等.解磷细菌K3的GFP标记及其解磷能力检测[J].土壤,2010, 42(4):548-553.
[28] 黄贵修,时 涛,刘先宝,等.臂形草内生真菌HND5的GFP标记及其抑菌作用[J].中国生物防治, 2010, 26(3): 320-326.
[29] 吴 磊,王晓鸣,徐荣旗,等.利用红色荧光蛋白标记的轮枝镰孢研究病原菌对玉米根系的系统侵染和定殖[J].作物学报, 2011, 37(5): 793-802.
[30] Luo X D, Keyhani N O, Yu X D, et al. The MAP kinase Bbslt2 controls growth, conidiation, cell wall integrity, and virulence in the insect pathogenic fungus Beauveria bassiana[J]. Fungal Genetics and Biology, 2012, 49(7): 544-555.
[31] 田兆丰,刘伟成,董 丹,等.生防枯草芽孢杆菌Kct99的GFP标记及其在甘蓝根部的定殖示踪[J].华北农学报, 2012, 27(6): 53-57.