糖为植物生长和呼吸提供能量,是所有植物生存的基础物质[1],也是决定果实品质的重要因素。在大多数高等植物中,通过光合作用产生的碳水化合物以蔗糖为主,通过韧皮部分配运输到不同的库组织中。在植物组织中,蔗糖可以被直接贮藏,还可以在蔗糖合成酶或者转化酶的作用下转化成己糖[2],也就是葡萄糖和果糖。在植物呼吸代谢过程中,己糖经过己糖激酶(Hexokinase,HK)磷酸化开始进行糖酵解,从而为植物活动提供能量和代谢产物[3-5],因此植物中淀粉的合成和碳元素的循环离不开HK对己糖的磷酸化[6-7]。HK也被称为双功能兼职酶[8],在植物的生长进程中,HK不仅参与糖代谢,而且是己糖传感器[9],在信号网络中起到传感和信号作用,能够感知外界营养、光和激素信号,调控植物的生长[10]。
广义上,植物中的HK包含己糖激酶、果糖激酶和葡萄糖激酶。果糖激酶对果糖有高度的特异性,葡萄糖激酶对葡萄糖具有专一性,而HK可以磷酸化果糖、葡萄糖等一系列己糖[11]。目前已经证实几乎所有生物体中都存在HK,根据对番茄、马铃薯等植物的HK研究发现HK存在同工酶,并且多数植物中都存在1~3个同工酶[12-13]。有研究表明,线粒体的信号转导途径汇聚于线粒体HKⅡ上[14],HKⅡ可以与线粒体膜通透性转化孔(MPTP)上的电压依赖型阴离子通道(VDAC)发生相互作用,HKⅡ从VDAC上脱落诱导VDAC蛋白关闭进而抑制MPTP的开放,从而调控线粒体的通透性[15-16]。
本试验以肥城桃(Prunuspersica(L.)Batsch cv.Feicheng)为试验材料,克隆得到肥城桃果实HKⅡ基因全长并进行了生物信息学分析,并在大肠杆菌中成功表达并且纯化出HKⅡ蛋白,以期对植物HKⅡ蛋白的结构和功能有进一步的了解,从而为揭示HKⅡ在线粒体中的信号转导途径奠定理论基础。
1 材料和方法
1.1 菌株、质粒及试验材料
以肥城桃果实为试验材料,于2015年采摘自山东省肥城市肥城桃基地。选择颜色均匀、大小相似、无机械损伤和无病虫害的七成熟桃果实,采摘后于2 h内运回实验室,0 ℃环境中预冷24 h后将果实切成大小均匀的碎块用液氮冷冻处理,-80 ℃冰箱保存备用。
大肠杆菌菌种E.coli DH5α、E.coli BL21(DE3)为山东农业大学化学与材料科学学院生物化学实验室保存。表达载体pET-30a质粒采购于全式金公司。克隆载体pMD18-T Vector采购于宝生物公司。本研究所用引物(表1)均由华大基因公司合成。
表1 PCR引物序列
Tab.1 PCR primers and sequences

引物名称Nameofprimer序列(5'-3')Sequences(5'-3')HKⅡ-FCTCGCATCCGAAGGCGGCAGCAAGCHKⅡ-RGGCATGAGCCCGTTCTACATAAGCAHKⅡ-SCAAACTTCCGTGTGCTGAGGGTGCHKⅡ-ASGCATGTGCACGTTCTACATATGCTGHKⅡ-NSATCAACTCCCTCCTGGCAGGCAGAGHKⅡ-NASCATCCCCATTGACATACCTACCTCCHKⅡ-1GGTACCATGGGGAAGAAGGCAGTGGTGATTAHKⅡ-2GGATCCGGATTCATCGACTCCAAGGTATTGT
注:GGTACC为KpnⅠ酶切位点;GGATCC为BamHⅠ酶切位点。
Note: GGTACC is KpnⅠrestriction site;GGATCC is BamHⅠrestriction site.
1.2 试验方法
1.2.1 提取肥城桃果实总RNA及合成1st-Strand cDNA 总RNA参考改良CTAB法提取[17],使用购自TaKaRa公司的PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit合成1st-Strand cDNA。
1.2.2 HKⅡ基因中间片段序列的克隆 根据从GenBank中查找的碧桃的HKⅡ基因片段,使用Primer Premier 6.0软件设计HKⅡ-F和HKⅡ-R作为验证引物,以合成的1st-Strand cDNA为模板加入PCR反应体系,将反应后的PCR产物进行1%琼脂糖凝胶电泳,将含有目的条带的凝胶块切块回收,使用Gel Extraction Kit(康为世纪)回收DNA片段。将目的DNA连接pMD18-T载体,通过热激法将构建好的克隆载体转化至感受态细菌DH5α中。通过菌液PCR验证筛选阳性克隆后送至测序公司(北京华大基因)。
1.2.3 HKⅡ基因全长的克隆及生物信息学分析 根据通过测序验证的HKⅡ基因片段,设计RACE引物HKⅡ-S、HKⅡ-AS和巢式引物HKⅡ-NS、HKⅡ-NAS。使用SMARTTM RACE cDNA(TaKaRa)试剂盒,按照说明书操作进行5′-RACE和3′-RACE。将RACE得到的PCR产物作为PCR中的复制模板,加入巢式引物HKⅡ-NS、HKⅡ-NAS进行巢式PCR。PCR产物经过电泳纯化后,切胶回收目的DNA,送至华大公司测序。将测序得到的5′端和3′端核苷酸序列与中间片段拼接,得到HKⅡ基因全长。将获得的核苷酸序列在NCBI数据库中Blast检索分析同源序列,利用DNAMAN软件进行HKⅡ氨基酸序列同源性分析,使用MEGA 4.1软件构建HKⅡ蛋白序列的系统进化树。使用ProtParam tool在线分析HKⅡ蛋白的理化性质和亲水性。使用PSIPRED分析HKⅡ蛋白的二级结构,利用SWISS-MODEL对HKⅡ蛋白进行三维结构的模拟。
1.2.4 体外重组HKⅡ蛋白 根据HKⅡ的核苷酸完整开放阅读框,使用Primer Premier 6.0设计带有不同酶切位点的引物HKⅡ-1和HKⅡ-2。RT-PCR获得HKⅡ的DNA全长与pMD18-T Vector连接,构建克隆载体。将克隆载体和pET-30a质粒分别用限制性内切酶双酶切后,采用T4 DNA Ligase连接目的片段,获得pET-30a-HKⅡ重组质粒。将重组质粒pET-30a-HKⅡ导入表达菌株BL21,经菌液PCR检测后进行体外重组蛋白。取200 μL菌液加入到10 mL含抗生素的培养基中,37 ℃摇菌至OD600=0.4~0.6,取1 mL菌液用于电泳检测,向剩余菌液中加入终浓度为1 mmol/L的IPTG,38 ℃条件下诱导8 h,取1 mL菌液进行12%的聚丙烯酰胺凝胶电泳检测。
1.2.5 HKⅡ重组蛋白的纯化 采用带有His标签的Ni-琼脂糖凝胶(Solarbio)进行蛋白质的纯化,按照说明书的使用方法操作。洗脱蛋白的咪唑洗脱液效果最佳浓度为200 mmol/L。用12%的SDS-PAGE分析纯化后的HKⅡ蛋白。
2 结果与分析
2.1 HKⅡ基因cDNA全长的克隆
通过GenBank中桃果实的HKⅡ基因片段,设计验证引物HKⅡ-F和HKⅡ-R,以反转录得到的cDNA为模板进行PCR反应,所得结果如图1-A所示,经过测序验证后序列一致。根据中间片段序列设计RACE引物以及巢式引物,进行RACE扩增和巢式PCR后得到与预期长度一致的目的条带,得到如图1-B所示的结果,将5′与3′-RACE的核苷酸序列与中间片段进行拼接后获得肥城桃HKⅡ基因cDNA全长序列,共1 835 bp。
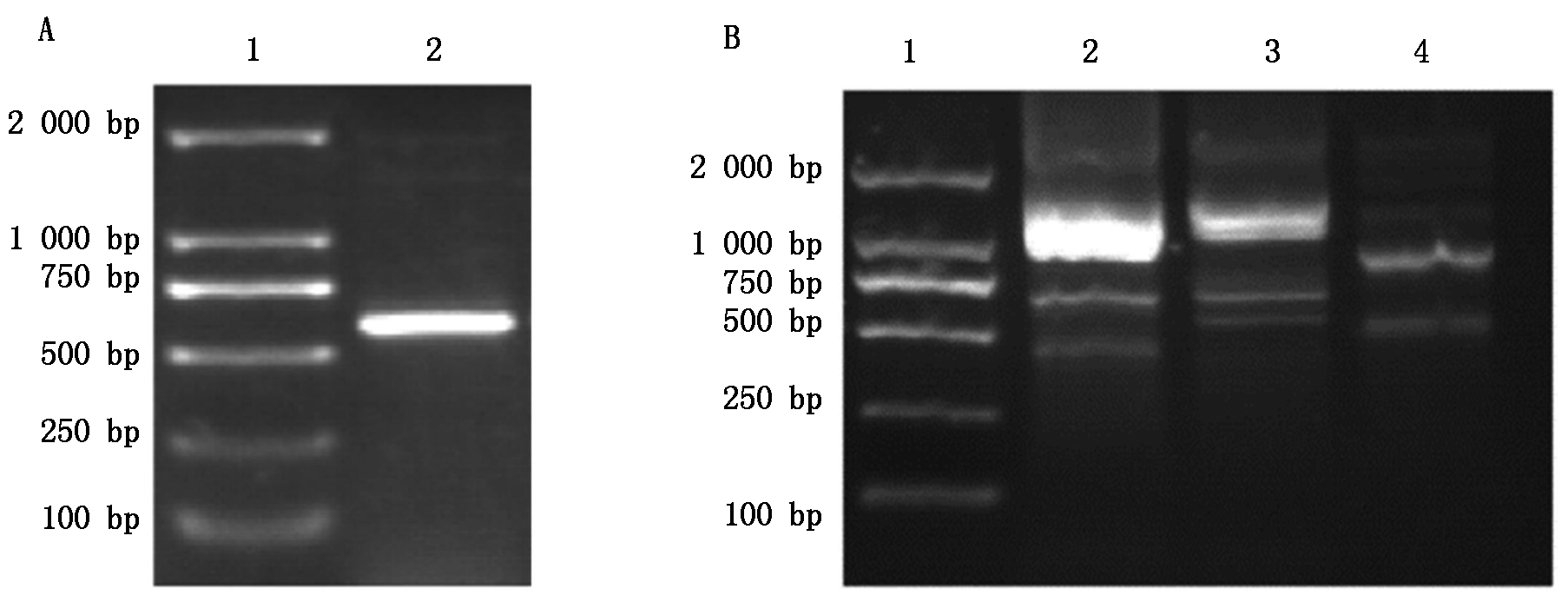
A.HKⅡ基因中间片段:1.DL2000分子量标准;2.PCR产物。B.巢式PCR:1.DL2000分子量标准;2,3.3′巢式PCR产物;4.5′巢式PCR产物。
A.Middle sequences of HKⅡ gene:1.DL2000 Marker;2.Product of PCR.B.Nested PCR:1.DL2000 Marker;2,3.Nested PCR of 3′-RACE products;4.Nested PCR of 5′-RACE products.
图1 HKⅡ基因的克隆
Fig.1 Gene cloning of HKⅡ
2.2 HKⅡ基因的生物信息学分析
对HKⅡ基因进行生物信息学分析(图2-A),该序列具有起始密码子ATG(173 bp)和终止密码子TGA(1 664 bp),存在完整的开放阅读框。阅读框共有1 496个碱基,编码497个氨基酸(图2-B)。PortParam tool预测蛋白分子式为C2379H3846N652O717S17,原子总数为7 611个,分子量为53.6 kDa,理论等电点为6.17,总平均疏水指数为0.023,表明HKⅡ蛋白为疏水性蛋白。TMHMM跨膜结构预测HKⅡ为跨膜蛋白,有1次跨膜,绝大部分在膜外。如图3-A所示,二级结构预测结果显示HKⅡ蛋白由15段α螺旋和11段β折叠和无规则卷曲构成。肥城桃HKⅡ蛋白预测的三级结构如图3-B所示,其蛋白结构呈V字型,折叠结构较多。
2.3 HKⅡ氨基酸序列同源比对和系统进化分析
试验获取的桃果实HKⅡ氨基酸序列在NCBI数据库中进行Blast,与其他植物HKⅡ氨基酸序列比对,得到如图4所示的同源性关系。比对显示,桃果实与其他植物的HKⅡ氨基酸的同源性较高,其中与猕猴桃(Actinidia deliciosa)、橙子(Citrus sinensis)、木豆(Cajanus cajan)、枇杷(Eriobotrya japonica)、苹果(Malus domestica)、葡萄(Vitis vinifera)、桑树(Morus notabilis)、香瓜(Cucumis melo)、烟草(Nicotiana tabacum)的相似度分别是91.58%,91.98%,92.18%,96.98%,96.58%,89.13%,93.59%,92.18%,90.78%,系统进化树(图5)中碧桃和枇杷在一支上,与同源比对结果一致。结果符合进化关系,说明植物的HKⅡ蛋白具有较高的保守性。

图2 HKⅡ基因cDNA序列(A)和氨基酸序列(B)
Fig.2 Full length sequence of cDNA (A) and amino acid sequence (B) of HKⅡ
2.4 HKⅡ的体外表达与纯化
将重组质粒pET-30a-HKⅡ导入大肠杆菌BL21(DE3)中,加IPTG至终浓度为1 mmol/L,诱导表达,获得HKⅡ重组蛋白。电泳结果如图6-A所示,HKⅡ重组蛋白表达成功。菌液通过超声破碎分离出包涵体,溶解于6 mol/L盐酸胍缓冲液中,经过Ni-琼脂糖凝胶纯化后,获得较高纯度的HKⅡ重组蛋白(图6-B)。
3 结论与讨论
本试验通过NCBI中碧桃HKⅡ的cDNA序列为模板设计验证引物,以肥城桃果实中反转录的cDNA为模板进行PCR,测序后试验结果与碧桃的序列片段一致,根据该片段设计RACE引物和巢式PCR引物,获得HKⅡ基因5′和3′端序列后,片段拼接得到共计1 664 bp的肥城桃果实HKⅡ基因cDNA序列,编码氨基酸497个。对HKⅡ进行序列比对和生物信息学分析,发现桃HKⅡ具有较高的同源性,与枇杷(ADZ96378.1)的HK同源性最高。本试验还体外表达了HKⅡ蛋白,通过Ni-琼脂糖凝胶纯化出带有His标签的目的蛋白。
人们在1956年发现并报道了己糖激酶,在随后的研究中发现植物体组织中存在好几种不同的己糖激酶,它们分布在细胞的叶绿体、线粒体、液泡、内质网、细胞核等不同的组织中,而且它们的层析和动力学性质有一定差异[18]。细胞质中的HK可活化其中的葡萄糖[19],而线粒体膜上的HK参与糖酵解过程[20],细胞核中HK可以影响调控葡萄糖信号基因的表达。有研究表明,苹果的HK在细胞质基质中含量最高,为39.1%,其次是线粒体,为17.4%[21],本研究为下一步桃果实中HKⅡ基因的亚细胞定位和探讨打下了基础。
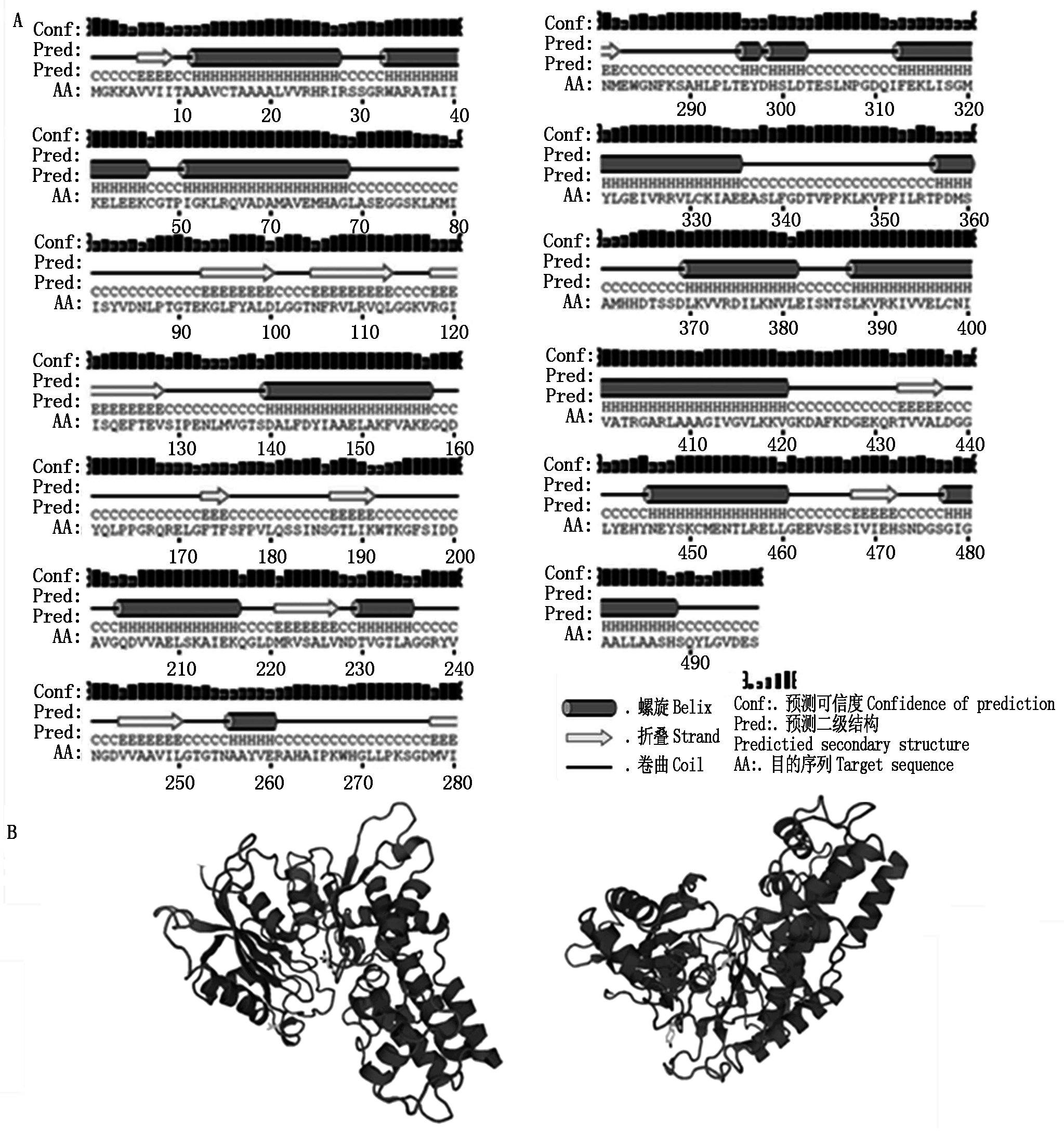
图3 HKⅡ蛋白二级结构(A)和三级结构预测(B)
Fig.3 The second structure (A) and thepredicted tertiary structure (B) of HKⅡ protein

由上而下依次为橙子、猕猴桃、木豆、枇杷、苹果、葡萄、桑树、香瓜、烟草、碧桃。
The amino acid sequence in the map which from the top to the bottom represent are:Citrus sinensis,Actinidia deliciosa,Cajanus cajan,Eriobotrya japonica,Malus domestica,Vitis vinifera,Morus notabilis,Cucumis melo,Nicotiana tabacum,Prunus persica.
图4 桃果实HKⅡ 氨基酸序列与其他植物HKⅡ蛋白氨基酸序列同源性分析
Fig.4 Alignment of amino acid sequence of HKⅡ in peach with HKⅡ proteins in other plants
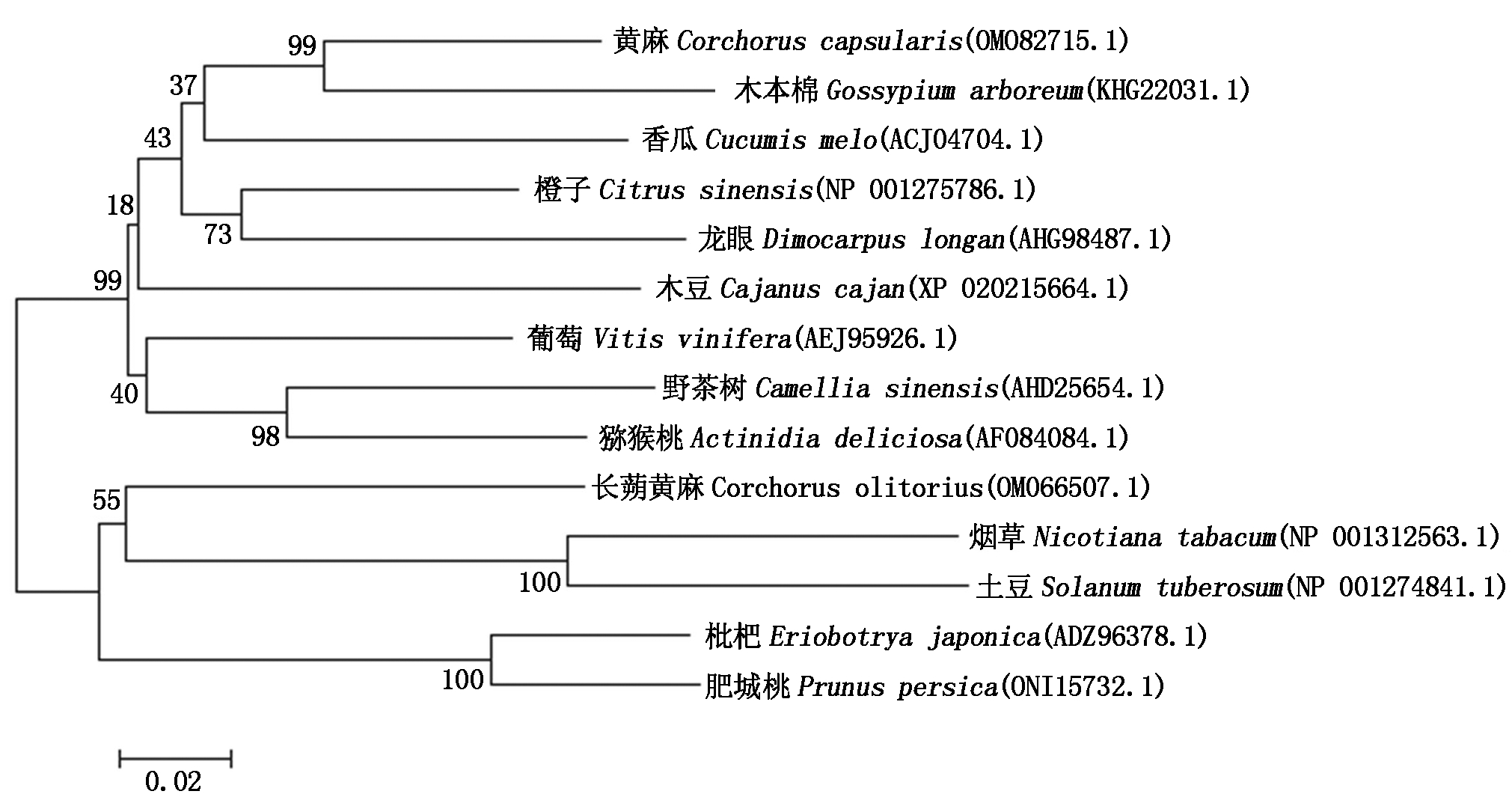
分支上的数值表示1 000次重复计算得到的Bootstrap值。
The values on the branches represent the Bootstrap values obtained by the 1 000 iteration.
图5 肥城桃果实HKⅡ与其他物种HKⅡ系统进化树
Fig.5 Phylogenetic tree of HKⅡ in peach with HKⅡ proteins in other plants
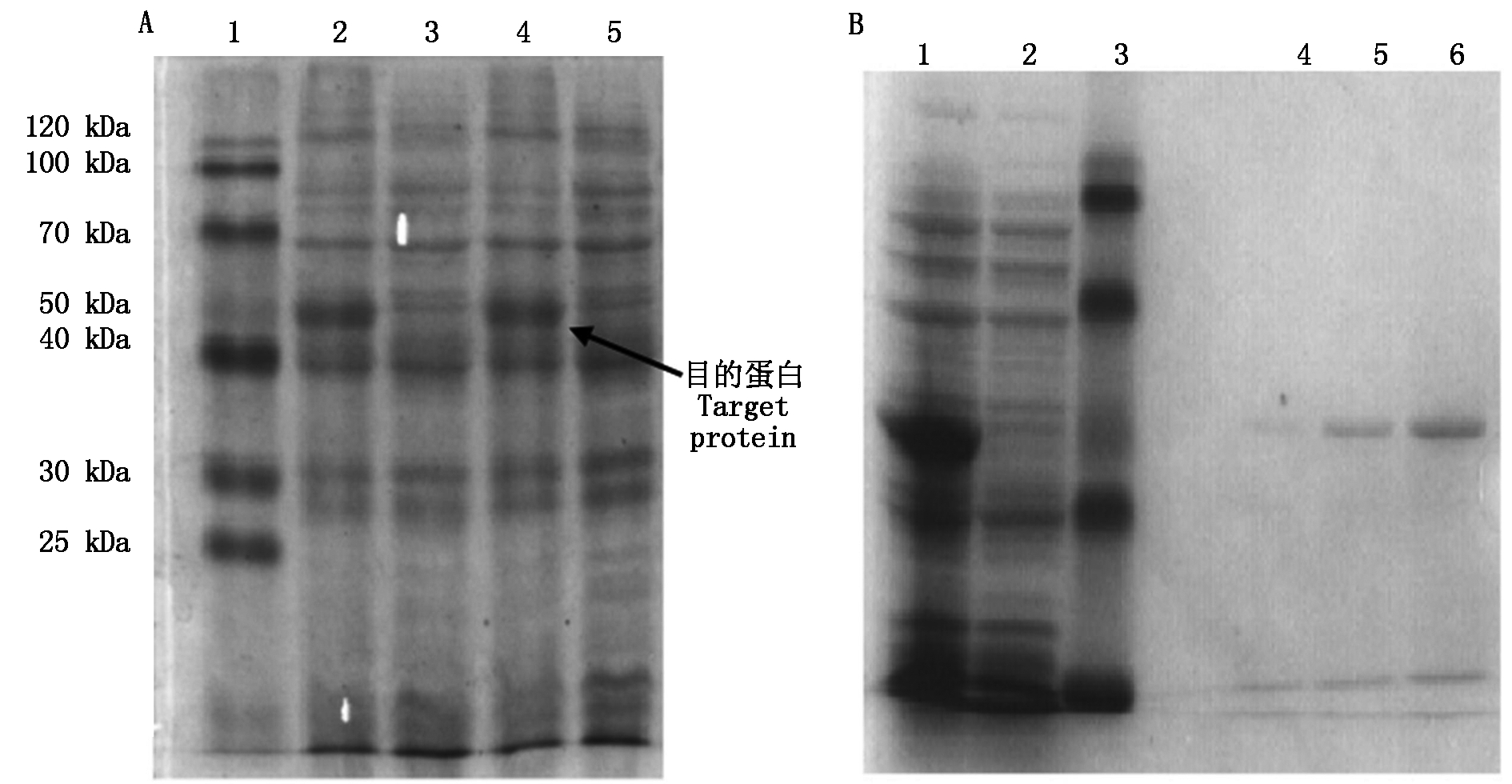
A.HKⅡ重组蛋白表达:1.低分子蛋白质分子量标准;2,4.含pET-30a-HKⅡ质粒,经IPTG诱导的蛋白;3.含pET-30a-HKⅡ质粒,未诱导的蛋白;5.含pET-30a的质粒,经IPTG诱导的蛋白。B.HKⅡ重组蛋白纯化:1.经IPTG诱导的蛋白;2.未经IPTG诱导的蛋白;3.低分子蛋白质分子量标准;4~6.纯化后的HKⅡ蛋白。
A.Recombinant protein expression of HKⅡ:1.Standard protein molecular mass Markers;2,4.pET-30a-HKⅡ with induction by IPTG;3.pET-30a-HKⅡ without induction;5.pET-30a with induction by IPTG.B.Purification of HKⅡ recombinant protein:1.pET-30a-HKⅡ with induction by IPTG;2.pET-30a-HKⅡ without induction;3.Standard protein molecular mass Markers;4-6.Purified HKⅡ protein.
图6 HKⅡ重组蛋白12% SDS-聚丙烯酰氨凝胶电泳
Fig.6 Recombinant HKⅡ protein in 12% SDS-PAGE
近年来的研究发现,己糖激酶参与高等植物的糖感受和信号转导的过程,植物细胞能够响应和感受己糖激酶信号,己糖激酶还参与了植物细胞程序性死亡。VDAC作为调控线粒体膜通透性和参与细胞凋亡通路的重要组成部分[22],和HK结合后影响了MPTP的开放。另有研究表明,在植物中VDAC和HK的表达量是一致的[23-24]。这表明,在植物体中HK参与糖酵解和细胞凋亡的信号转导途径,更多关于肥城桃果实HKⅡ的重组蛋白活性检测、结构分析的试验正在进行中,将为HK参与的多种信号通路和糖感受机制提供理论依据。
参考文献:
[1] Li L,Sheen J.Dynamic and diverse sugar signaling[J].Current Opinion in Plant Biology,2016,33:116-125.
[2] Li M,Feng F,Cheng L.Expression patterns of genes involved in sugar metabolism and accumulation during apple fruit development[J].PLoS One,2012,7(3):e33055.
[3] Yim H K,Lim M N,Lee S E,et al.Hexokinase-mediated sugar signaling controls expression of the calcineurin B-like interacting protein kinase 15 gene and is perturbed by oxidative phosphorylation inhibition[J].Journal of Plant Physiology,2012,169(15):1551-1558.
[4] Claeyssen E,Rivoal J.Isozymes of plant hexokinase:occurrence,properties and functions[J].Phytochemistry,2007,68(6):709-731.
[5] Granot D,David-Schwartz R,Kelly G.Hexose kinases and their role in sugar-sensing and plant development[J].Frontiers in Plant Science,2013,4(1):44.
[6] Alonso A P,Vigeolas H,Raymond P,et al.A new substrate cycle in plants.Evidence for a high glucose-phosphate-to-glucose turnover from in vivo steady-state and pulse-labeling experiments with[13C]glucose and [14C] glucose[J].Plant Physiology,2005,138(4):2220-2232.
[7] Zhao J,Sun M,Hu D,et al.Molecular cloning and expression analysis of a hexokinase gene,MdHXK1 in apple[J].Horticultural Plant Journal,2016,2(2):67-74.
[8] Moore B D.Bifunctional and moonlighting enzymes:lighting the way to regulatory control[J].Trends in Plant Science,2004,9(5):221-228.
[9] Kim Y M,Heinzel N,Giese J O,et al.A dual role of tobacco hexokinase 1 in primary metabolism and sugar sensing[J].Plant,Cell & Environment,2013,36(7):1311-1327.
[10] Feng J,Zhao S,Chen X,et al.Biochemical and structural study of Arabidopsis hexokinase 1[J].Acta Crystallographica Section D-Biological Crystallography,2015,71(Pt 2):367-375.
[11] Kelly G,Moshelion M,David-Schwartz R,et al.Hexokinase mediates stomatal closure[J].The Plant Journal :for Cell and Molecular Biology,2013,75(6):977-988.
[12] Claeyssen E,Wally O,Matton D P,et al.Cloning,expression,purification,and properties of a putative plasma membrane hexokinase from Solanum chacoense[J].Protein Expression and Purification,2006,47(1):329-339.
[13] Feng J,Zhao S,Chen X,et al.Biochemical and structural study of Arabidopsis hexokinase 1[J].Acta Crystallographica Section D-Biological Crystallography,2015,71(Pt 2):367-375.
[14] Rasola A,Sciacovelli M,Pantic B,et al.Signal transduction to the permeability transition pore[J].FEBS Letters,2010,584(10):1989-1996.
[15] Godbole A,Dubey A K,Reddy P S,et al.Mitochondrial VDAC and hexokinase together modulate plant programmed cell death[J].Protoplasma,2013,250(4):875-884.
[16] Szabo I,Zoratti M.Mitochondrial channels:ion fluxes and more[J].Physiological Reviews,2014,94(2):519-608.
[17] 陈长宝,朱树华,周 杰.改良CTAB法提取成熟肥城桃果实的总RNA[J].山东农业科学,2009(5):102-104.
[18] 秦巧平,张上隆,徐昌杰.己糖激酶与植物生长发育[J].植物生理学通讯,2003,39(1):1-8.
[19] Cheng W,Zhang H,Zhou X,et al.Subcellular localization of rice hexokinase (OsHXK) family members in the mesophyll protoplasts of tobacco[J].Biologia Plantarum,2011,55(1):173-177.
[20] Granot D,Kelly G,Stein O,et al.Substantial roles of hexokinase and fructokinase in the effects of sugars on plant physiology and development[J].Journal of Experimental Botany,2014,65(3):809-819.
[21] 赵 锦,孙美红,胡大刚,等.苹果己糖激酶基因MdHXK1的克隆与表达分析[J].园艺学报,2015,42(8):1437-1447.
[22] Vianello A,Casolo V,Petrussa E,et al.The mitochondrial permeability transition pore (PTP)-an example of multiple molecular exaptation?[J].Biochimica et Biophysica acta,2012,1817(11):2072-2086.
[23] Homblé F,Krammer E M,Prévost M.Plant VDAC:facts and speculations[J].Biochimica et Biophysica acta,2012,1818(6):1486-1501.
[24] Kusano T,Tateda C,Berberich T,et al.Voltage-dependent anion channels:their roles in plant defense and cell death[J].Plant Cell Reports,2009,28(9):1301-1308.