由黑腐皮壳菌(Valsa mali var.mali,Vmm)引起的苹果树腐烂病是苹果生产上的三大重要病害之一,该病在我国各苹果产区发生普遍,可造成果树主干及整树死亡,甚至毁园[1-2]。2008年,全国范围内苹果树腐烂病的总体发病率高达52.7%,且病情呈蔓延趋势[3];2011年,烟台苹果产区腐烂病再次大发生,发病程度明显重于一般年份[4]。现代苹果产业技术体系病虫害防控研究室的有关专家认为,我国苹果生产正面临腐烂病第5次发病高峰的威胁[2-3]。目前,由于缺乏对苹果树腐烂病菌致病机制的全面了解,导致该病尚无法得到有效控制。
苹果树腐烂病菌的主要致病机制,除产生毒素外,还可分泌一系列的细胞壁降解酶,其中包括木聚糖酶、纤维素酶、β-葡萄糖苷酶、多聚半乳糖醛酸酶和果胶甲基半乳糖醛酸酶[5-7]。臧睿[8]研究发现苹果树腐烂病菌不同菌株的致病力与其分泌的果胶酶活性关系密切,许春景等[7]报道腐烂病菌的果胶裂解酶基因Vmpl4及多聚半乳糖醛酸酶基因Vmpg7和Vmpg8被敲除后,突变体菌株的致病力均有不同程度的降低。苹果树腐烂病菌侵染致病过程中,分泌的5种细胞壁降解酶中以木聚糖酶的活性最高,且对苹果组织的浸渍能力最强[5],史祥鹏[9]对腐烂病菌的木聚糖酶基因功能进行了研究,发现敲除Xylanase突变体菌株的致病力和产生的木聚糖酶活性均显著降低。以上研究表明,果胶裂解酶、多聚半乳糖醛酸酶和木聚糖酶基因在腐烂病菌致病过程中具有重要作用。
β-葡萄糖苷酶能够水解结合于末端非还原性β-D-葡萄糖苷键,释放出β-D-葡萄糖和相应的配基,作为纤维素酶系的一个重要成员,β-葡萄糖苷酶在降解纤维素的过程中具有关键作用[10-13]。目前,已筛选到多种产β-葡萄糖苷酶的微生物菌株,如里氏木霉菌(Trichoderma reesei)、木蹄层孔菌(Fomes fomentarius)和白色念珠菌(Candida albicans)等,并广泛应用于食品、医药和饲料等领域[14-17]。研究表明,多种植物病原菌也可分泌高活性的β-葡萄糖苷酶,在其致病性中发挥重要作用。张大智等[18]报道细菌性角斑病菌(Xanthomonas campestris)接种杧果叶片后4 d,β-葡萄糖苷酶活性到达峰值是对照的4.4倍;金勤等[19]测定了炭疽菌(Collectotrichum gloeosporioide)接种油茶叶片后β-葡萄糖苷酶的活性变化,于接种后6 d酶活性水平最高。陈晓林等[5]对苹果树腐烂病菌分泌的β-葡萄糖苷酶活性进行了分析,发现随腐烂病菌的侵染和扩展,β-葡萄糖苷酶活性持续升高,最大酶活性是对照的4.5倍。
随着越来越多的β-葡萄糖苷酶基因被克隆和成功表达,为其基因结构和功能研究提供了重要依据[20-21]。Waksman[22]克隆了油菜菌核病菌(Sclerotinia sclerotiorum)的β-葡萄糖苷酶基因,并证实其原核表达蛋白具有β-葡萄糖苷酶活性。目前,有关其他植物病原菌β-葡萄糖苷酶基因的克隆及其在致病性中的作用机制研究还鲜有报道。本研究以苹果树腐烂病菌强致病力菌株LXS080601为材料,利用RT-PCR结合TA克隆技术获得其β-葡萄糖苷酶基因序列,对其序列进行生物信息学分析,并通过实时荧光定量PCR技术测定该基因在腐烂病菌侵染致病过程中的表达,以期为明确β-葡萄糖苷酶基因在苹果树腐烂病菌致病性中的作用机理奠定基础。
1 材料和方法
1.1 试验材料
供试菌株和植物材料:苹果树腐烂病菌菌株LXS080601采集自山东省烟台富士苹果园发病枝干,经单菌丝分离后鉴定并保存。3-4年生富士苹果(Malus domestica Borkh)幼树栽植于青岛农业大学试验田。
试剂:TRIzol试剂,美国Invitrogen公司;PrimeScriptTMⅡ 1st StrandcDNA Synthesis Kit、Prime ScriptTM RT reagent Kit with gDNA Eraser试剂盒、SYBR Master Mix、Prime STAR Max DNA Polymerase、pMD18-T克隆载体,宝生物工程(大连)有限公司;DNA凝胶回收试剂盒、DNA Marker DL2000,青岛擎科梓熙生物公司;大肠杆菌菌株DH5α,山东省植物病虫害综合防控重点实验室保存;氨苄青霉素、Oligo(dT)18,生工生物工程(上海)股份有限公司。
培养基:马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,定容至1 000 mL;LB (Luria-Bertani)培养基:胰蛋白胨10 g,酵母抽提物5 g,氯化钠5 g,定容至1 000 mL。
1.2 试验方法
1.2.1 苹果树腐烂病菌总RNA提取与cDNA合成 苹果树腐烂病菌于PDA培养基中培养3 d后刮取菌丝,用TRIzol法提取总RNA。超微量分光光度计测定提取RNA的浓度,并用1.2%琼脂糖凝胶电泳检测RNA质量。以1 μg总RNA为模版,Oligo dT18为反转录引物,参照cDNA合成试剂盒说明书合成第一链cDNA,-20 ℃保存备用。
1.2.2 苹果树腐烂病菌VmGluI基因cDNA序列的克隆 根据本实验室前期苹果树腐烂病菌基因组序列结果,利用Oligle 7软件设计β-葡萄糖苷酶基因的上下游引物(VmGluIFwd:5′-ATGGCCCGGATAATTTCGATG-3′;VmGluIRev:5′-TTATGTCTCCTGGTATATGTTGAACATATT-3′)。以第一链cDNA为模版,PCR反应体系为25 μL:2×PrimeSTAR Max DNA Polymerase 12.5 μL,上下游引物各0.5 μL,cDNA 0.25 μL、ddH2O 11.25 μL。反应条件为:95 ℃预变性3 min;95 ℃变性10 s,55 ℃退火15 s,72 ℃延伸8 s,35个循环;72 ℃延伸10 min。PCR产物经1.0%的琼脂糖凝胶电泳进行检测,回收纯化后连接至克隆载体pMD18-T,热击转入大肠杆菌DH5α,筛选阳性克隆提取质粒,委托青岛擎科梓熙生物技术有限公司进行测序。
1.2.3 苹果树腐烂病菌VmGluI序列的生物信息学分析 将克隆到的VmGluI序列在NCBI数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行Blast验证和同源性分析,并利用DNAMAN对苹果树腐烂病菌VmGluI和其他不同来源β-葡萄糖苷酶基因编码氨基酸序列进行多重比对。采用软件MEGA 5.1以邻接法构建VmGluI蛋白分子系统发育树。使用ExPASy生物信息学网站(http://web.expasy.org/protparam/)预测VmGluI编码蛋白的理化性质,使用SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsautomat.pl)在线软件进行蛋白质二级结构预测。
1.2.4 苹果树腐烂病菌VmGluI的表达分析 选取长势良好且粗细一致的1-2年生富士苹果枝条,用电烙铁造成直径约1~2 mm烫伤,活化培养3 d的腐烂病菌在菌落边缘处打取菌饼,接种于枝条的烫伤处,用保鲜膜固定并保湿[4]。接种后6,12,24,48,72 h分别取病健交界处组织,提取样品总RNA,利用Prime ScriptTM RT reagent Kit with gDNA Eraser试剂盒反转录获得cDNA。根据VmGluI基因序列,设计合成定量PCR引物VmGluI-qF(5′-ACAAACAAGACATTGCTCGGAT-3′)和VmGluI-qR(5′-ATTATCTGCTCGTCCAACCAC-3′)。以真菌EF1α基因作为内参[23],合成引物EF1α-qF (5′-TGAGTTCGAGGCTGGTATCTCCAA-3′)和EF1α-qR (5′-TGTCCATCTTGTTGATGGCGACGA-3′)。反应体系20 μL:SYBR Premix Ex TaqTM(TliRNaseH Plus)10.0 μL,上下游引物各0.4 μL,cDNA模板1.0 μL,去离子8.2 μL。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火20 s,72 ℃延伸15 s,40个循环。上述反转录的cDNA梯度稀释后作为模板,分别进行荧光定量PCR反应,绘制标准曲线,确定2对引物的扩增效率[24-25]。以PDA上培养的苹果树腐烂病菌作为对照,每个样品重复3次,根据2-ΔΔCT法计算VmGluI在腐烂病菌侵染致病过程中的相对表达量[26]。
2 结果与分析
2.1 苹果树腐烂病菌VmGluI的克隆和序列分析
提取苹果树腐烂病菌LXS080601的总RNA,反转录成cDNA,以该cDNA为模版,用VmGluIFwd和VmGluIRev特异性引物进行PCR扩增,产物经1%琼脂糖凝胶电泳检测,约1 700 bp处有一特异性条带(图1)。进行克隆测序获得1 689 bp的核苷酸序列,经预测该基因编码562个氨基酸残基,BlastN比对结果显示,该基因序列与NCBI数据库中的核苷酸序列相似性均不高;再用BlastP软件将该基因编码的氨基酸序列进行同源性比对,发现与苹果(登录号KUI68239.1)和梨树(登录号KUI56905.1)腐烂病菌的β-葡萄糖苷酶基因氨基酸序列相似性分别高达98.7%和87.8%。由此判断,所克隆序列为苹果树腐烂病菌β-葡萄糖苷酶基因,命名为VmGluI,并将基因序列提交至GenBank数据库(ID:KY646110)。
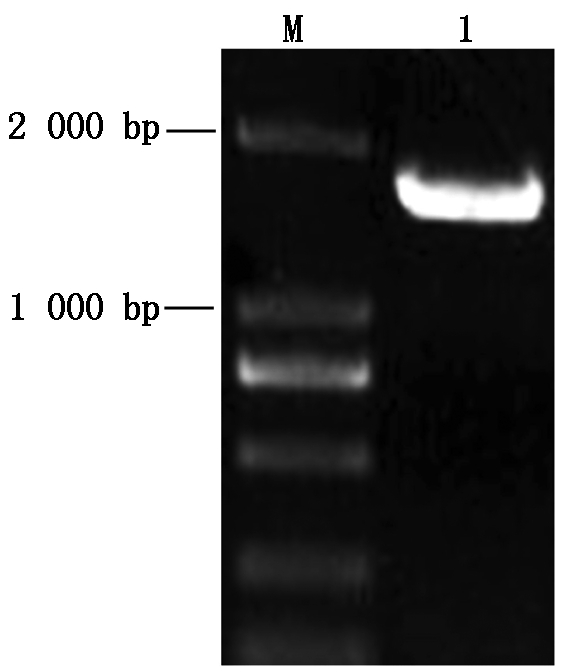
M.DNA分子标准;1.VmGluI PCR产物。
M.DNA Marker DL2000;1.PCR product of VmGluI.
图1 苹果树腐烂病菌VmGluI的PCR扩增电泳图
Fig.1 PCR amplification of VmGluI from Vmm
2.2 VmGluI编码蛋白的理化性质和二级结构预测
利用Expasy Proteomics Server的在线软件Protparam预测VmGluI编码蛋白的理化性质,该蛋白由562个氨基酸组成,分子式为C2868H4253N715O847S15,相对分子质量62.7 kDa,理论等电点pI为4.64,脂肪系数79.29,不稳定系数38.02,预测为稳定蛋白。利用ProtScale进行蛋白质的疏水性预测,使用Hphob./Kyte&Doolittl算法,总平均亲水性(Grand average of hydropathicity)为-0.162(图2),表明VmGluI蛋白为亲水蛋白。氨基酸组成中带正电残基(Arg+Lys)为34,带负电残基(Asp+Glu)为58,Gly (G)和Thr (T)使用频率较高,而Cys (C)、His (H)和Met (M)使用频率较低。此外,该基因编码的氨基酸序列有信号肽,在24与25位氨基酸之间存在裂解位点。
利用SOMPA在线软件对VmGluI蛋白的氨基酸序列的二级结构进行预测,发现VmGluI的二级结构由α-螺旋、β-转角、延伸链和无规则卷曲构成(图3),其中有562个氨基酸残基组成的α-螺旋含量最高,占35.59%,其次为无规则卷曲,含量占34.70%,最少的是β-转角,仅占9.79%,说明VmGluI蛋白的二级结构较稳定。对编码区进行蛋白质结构功能域分析发现,VmGluI的87-555区段为糖基水解酶家族1功能域(Pfam:00232,E-value:4.75e-113),且存在酪蛋白激酶Ⅱ磷酸化位点、蛋白激酶C磷酸化位点、N-肉豆蔻酰化位点和N-糖基化位点。
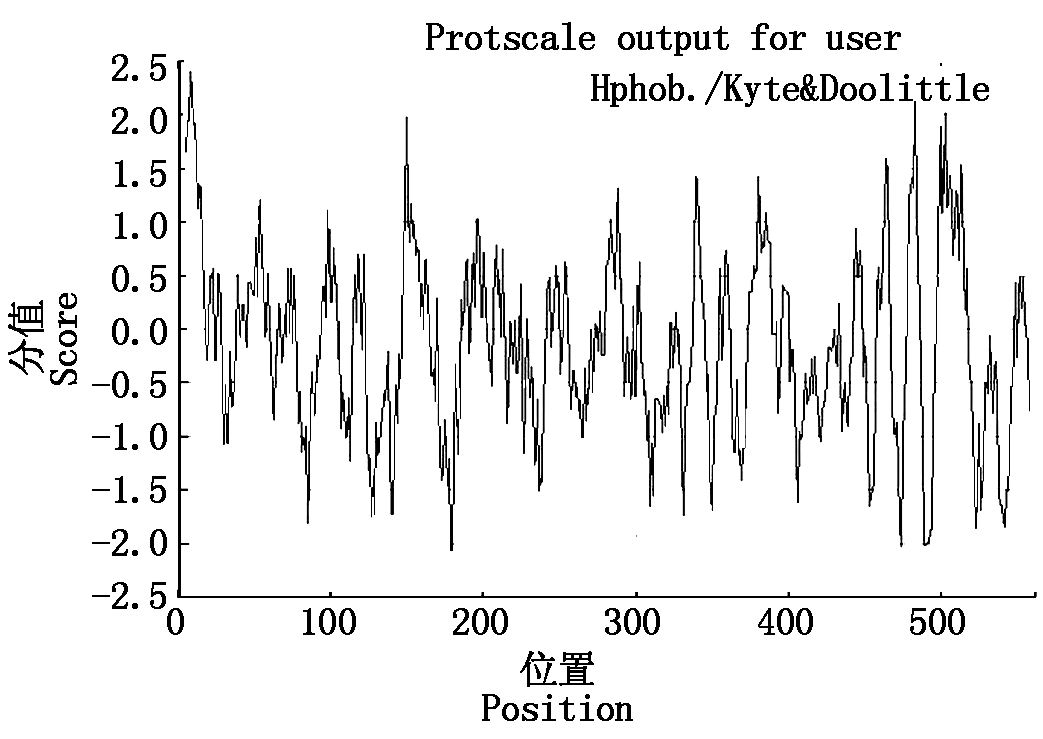
图2 苹果树腐烂病菌VmGluI蛋白亲水性/疏水性预测
Fig.2 Predicted the hydrophobicity/hydrophilicity of VmGluI protein from Vmm

h.α-螺旋;e.延伸链;t.β-转角;c.无规则卷曲。
h.Alpha helix;e.Extended strand;t.Beta turn;c.Random coil.
图3 苹果树腐烂病菌VmGluI蛋白二级结构预测
Fig.3 Predicted secondary structure of VmGluI protein from Vmm
2.3 VmGluI编码氨基酸序列比对及系统发育分析
将VmGluI编码的氨基酸序列与苹果和梨树腐烂病菌中β-葡萄糖苷酶基因氨基酸序列进行多重比对分析,图4结果显示,3条序列相似性高达94.2%,2个苹果树腐烂病菌β-葡萄糖苷酶基因氨基酸序列中有7个位点存在差异,其中6个位点集中在第235-304位氨基酸,而与梨树腐烂病菌β-葡萄糖苷酶基因氨基酸序列的差异位点分布则较均匀。靠近N端的94位和靠近C端的532位谷氨酸Glu (G)是2个关键活性残基,前者为亲子供体,后者为亲核试剂,与糖基水解酶家族1特有的保守氨基酸序列一致。
利用氨基酸BlastP比对功能进行同源性搜索,选取11条不同真菌来源的β-葡萄糖苷酶基因氨基酸序列,采用MEGA 5.1软件中的邻接法对包含VmGluI在内的12个β-葡萄糖苷酶基因氨基酸序列构建系统发育树(图5)。结果表明,苹果树腐烂病菌2个分离物β-葡萄糖苷酶基因所编码的氨基酸序列同源性最高,与梨树腐烂病菌(V.mali var.pyri,登录号KUI56905.1)氨基酸序列亲缘关系最近,并且与向日葵茎溃疡病菌(Diaporthe helianthi,登录号OCW40953.1)氨基酸序列相似性较高为71.0%,其聚在一个独立分支上,Bootstrap值为100%,而与其他真菌β-葡萄糖苷酶基因同源关系较远。白曲霉菌(Aspergillus kawachii,登录号GAA82784.1)、黑曲霉菌(Aspergillus niger,登录号XP 001401684.2)、青霉菌(Penicillium subrubescens,登录号OKO99982.1)和短梗霉菌(Aureobasidium namibiae,登录号XP 013431390.1)聚在一个大的独立分支,与苹果树腐烂病菌VmGluI的进化关系最远,可能与他们同属于产β-葡萄糖苷酶真菌,而非植物病原真菌有关。

Vmm.苹果树腐烂病菌;Vmp.梨树腐烂病菌;图中黑色区域代表100%的相似度;灰色代表大于50%的相似度。
Vmm.V.mali var.mali;Vmp.V.mali var.pyri;Blank areas indicate 100% similarity;Gray areas indicate at least 50% similarity.
图4 苹果和梨树腐烂病菌β-葡萄糖苷酶基因氨基酸序列多重比对
Fig.4 Multiple alignment of the amino acid sequences of β-glucosidase genes from Vmm and Vmp
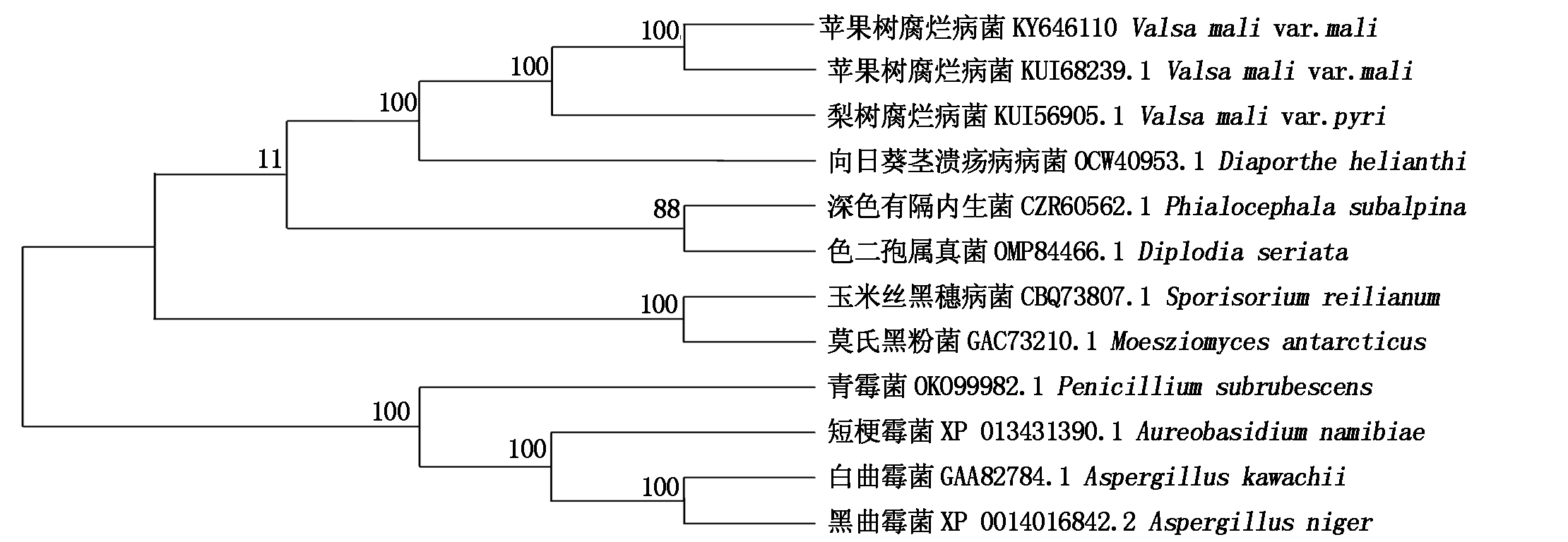
图5 苹果树腐烂病菌与其他真菌来源β-葡萄糖苷酶基因氨基酸序列的系统进化树
Fig.5 Phylogenetic analysis of β-glucosidase genes from Vmm and other species
2.4 苹果树腐烂病菌侵染致病过程中VmGluI的表达分析
苹果树腐烂病菌LXS080601分别烫伤接种富士离体和活体枝条,接种后48~72 h可观察到明显的发病症状,随接种时间延长,病斑不断扩展。于接种后定期取样,采用荧光定量PCR技术测定了苹果树腐烂病菌VmGluI表达量的时序变化。未接种苹果树腐烂病菌的枝条中无VmGluI的表达,接种病原菌的组织中均可检测到VmGluI表达,且基因表达量存在显著差异。图6-A结果显示,腐烂病菌接种离体枝条6~24 h后,VmGluI表达量相比PDA(0 h)对照无显著差异,接种48 h后,基因表达量开始显著升高为对照的3.4倍,接种72 h后,VmGluI表达量为对照6.3倍。苹果树腐烂病菌接种活体枝条后,VmGluI表达呈现先升高后降低再升高的趋势(图6-B)。接种6 h后,基因表达与PDA对照(0 h)无明显差异,但接种12 h后,基因表达量已显著升高为对照的11.2倍,之后表达量逐渐降低,于接种48 h后基因表达量出现低谷,但仍显著高于对照;随后,VmGluI表达水平快速升高,接种96 h后,基因表达水平量为对照的16.8倍,表明苹果树腐烂病菌在侵染离体和活体枝条过程中,VmGluI表达水平和时序变化存在明显差异。
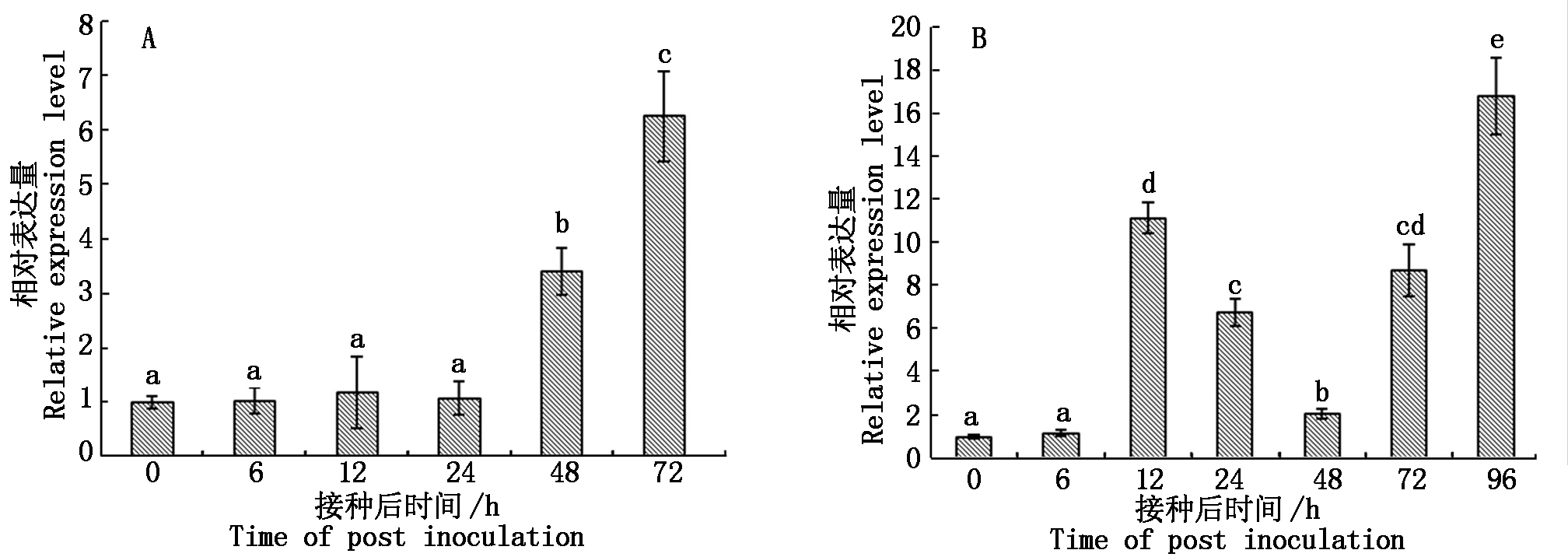
图中不同字母表示经Duncan氏新复极差法检验在P<0.05水平差异显著。
Different letters indicate significant difference at P<0.05 level by Duncan′s multiple range test.
图6 苹果树腐烂病菌接种富士离体(A)和活体(B)枝条后VmGluI的表达量
Fig.6 The expression level analysis of VmGluI in detached (A) and living (B) twigs inoculated by Vmm
3 讨论
β-葡萄糖苷酶能够破坏植物细胞壁结构,使病原菌易于侵入和扩展,已证实该酶是苹果树腐烂病菌侵染致病过程中分泌的一种细胞壁降解酶,说明其在腐烂病菌致病中具有重要作用[5]。本研究以强致病力菌株LXS080601为材料,首次克隆了苹果树腐烂病菌β-葡萄糖苷酶基因VmGluI的cDNA序列,该基因开放阅读框1 689 bp,编码562个氨基酸,蛋白分子量62.7 kDa,房伟等[27]从海洋微生物中克隆到一个新型β-葡萄糖苷酶基因bgl1B,编码449个氨基酸,蛋白分子量51.0 kDa,而陈辉等[28]克隆的斑玉蕈β-葡萄糖苷酶基因bgl1 cDNA全长2 574 bp,编码857个氨基酸,说明不同微生物来源的β-葡萄糖苷酶基因片段长度存在较大差异。已知的大部分β-葡萄糖苷酶pI酸性范围为3.5~5.5,VmGluI编码的蛋白预测pI (4.64)也为酸性。经Protparam预测VmGluI编码的蛋白为分泌型蛋白,1~24位氨基酸为信号肽序列,推测该基因对病原菌的侵染能力和特性具有重要作用[29]。
序列分析发现,VmGluI核苷酸序列与GenBank中提交序列相似性均不高,但其推导的氨基酸序列与苹果和梨树腐烂病菌β-葡萄糖苷酶基因氨基酸序列一致性分别为98.7%和87.8%,且与向日葵茎溃疡病菌氨基酸序列相似性也高达71.0%,但这些序列均来自全基因组测序,未对β-葡萄糖苷酶基因进行克隆和序列分析。VmGluI系统进化树分析表明,该基因编码的氨基酸序列与苹果和梨树腐烂病菌、向日葵茎溃疡病菌的亲缘关系最近,聚在一个单独的分支;而与其他非植物病原真菌β-葡萄糖苷酶基因氨基酸序列相似性较低,均不足40%,说明β-葡萄糖苷酶基因编码蛋白在植物病原真菌中具有相对保守性,但不同物种间存在很大的变异,从而使得其能在不同生物物种中发挥独特功能。
本研究发现,接种苹果树腐烂病菌的富士枝条组织中,VmGluI表达量显著上调,表明在病原菌侵染过程中VmGluI起到了重要的作用,但该基因在离体和活体枝条中的表达水平和时序变化存在显著差异。苹果树腐烂病菌接种离体枝条48 h后,VmGluI表达量开始显著升高为对照的3.4倍,而活体枝条接种12 h后,基因表达水平已升高至对照的11.2倍,推测腐烂病菌侵染活体苹果枝条要克服寄主的防御反应,需分泌更多的β-葡萄糖苷酶用于分解植物细胞壁。活体枝条接种腐烂病菌24~48 h后,VmGluI的表达量急剧下降,分析可能是寄主与腐烂病菌互作竞争时寄主的防御反应占优势,抑制了VmGluI表达;接种72~96 h后,该基因表达量快速上升,说明腐烂病菌在寄主组织中已成功侵染,此时可观察到明显的发病症状。这与王彩霞等[30]和雍道敬等[31]的报道结果一致,富士愈伤组织和叶片接种苹果树腐烂病菌后1~2 d,多酚氧化酶、过氧化物酶等多种防御酶活性显著升高并到达峰值,其可催化木质素和酚类氧化产物的形成,加厚细胞壁,形成阻止病原菌入侵的机械屏障,随接种时间延长防御酶活性快速降低至对照水平。纤维素酶各酶组分单独作用时效果不是很明显,但当其协同作用时表现出很强的分解活性[32]。本研究也发现,接种腐烂病菌的苹果枝条中,VmGluI的表达量显著低于木聚糖基因[9],但VmGluI与其他纤维素酶基因表达是否存在协同作用,以及该基因的作用机制尚待进一步研究。
参考文献:
[1] 陈 策.苹果树腐烂病发生规律和防治研究[M].北京:中国农业科学技术出版社,2009.
[2] 李保华,王彩霞,董向丽.我国苹果主要病害研究进展与病害防治中的问题[J].植物保护,2013,39(5):46-54.
[3] 曹克强,国立耘,李保华,等.中国苹果树腐烂病发生和防治情况调查[J].植物保护,2009,35(2):114-117.
[4] 王彩霞,董向丽,张振芳,等.2011年烟台苹果产区腐烂病发病情况调查与原因分析[J].农业科学与技术:英文版,2014,38(1):83-86.
[5] 陈晓林,牛程旺,李保华,等.苹果树腐烂病菌产生细胞壁降解酶的种类及其活性分析[J].华北农学报,2012,27(2):207-212.
[6] Shi X,Yu D,Kong Q,et al.Optimizing prokaryotic expression of a xylanasegene from the apple pathogen Valsa mali var.mali[J].Advance Journal of Food Science&Technology,2015,9(9):701-705.
[7] 许春景,吴玉星,戴青青,等.苹果树腐烂病菌多聚半乳糖醛酸酶基因Vmpg7和Vmpg8的功能[J].中国农业科学,2016,49(8):1489-1498.
[8] 臧 睿.陕西苹果树腐烂病菌不同分离株生物学特性及致病性研究[D].杨凌:西北农林科技大学,2006.
[9] 史祥鹏.苹果树腐烂病菌木聚糖酶基因的克隆及功能分析[D].青岛:青岛农业大学,2016.
[10] Saloheimo M,Kujapanula J,Ylösmäki E,et al.Enzymatic properties and intracellular localization of the novel Trichoderma reesei β-Glucosidase BGLII(CellA)[J].Applied & Environmental Microbiology,2002,68(9):4546-4553.
[11] Singhania R R,Patel A K,Sukumaran R K,et al.Role and significance of beta-glucosidases in the hydrolysis of cellulose for bioethanol production[J].Bioresource Technology,2013,127(1):500-507.
[12] Chen R Y,Baiya S,Sangkyu L,et al.Recombinant expression and characterization of the cytoplasmic rice β-glucosidase Os1BGlu4[J].PLoS One,2014,9(5):e96712.
[13] 陈 斌,钱 骅,闫淑珍,等.半夏内生真菌所产β-葡萄糖苷酶的酶学特性研究[J].中国野生植物资源,2016,35(2):7-9.
[14] Fang X,Shen Y,Zhao J,et al.Status and prospect of lignocellulosic bioethanol production in China[J].Bioresource Technology,2010,101(13):4814-4819.
[15] Jeng W Y,Wang N C,Lin M H,et al.Structural and functional analysis of three β-glucosidases from bacterium Clostridium cellulovorans,fungus Trichoderma reesei and termite Neotermes koshunensis[J].Journal of Structural Biology,2011,173(1):46-56.
[16] Větrovsky T,Baldrian P,Gabriel J.Extracellular enzymes of the white-rot fungus fomes fomentarius and purification of 1,4-β-glucosidase[J].Applied Biochemistry & Biotechnology,2013,169(1):100-109.
[17] 刘中美,谢梦圆,周哲敏.黑曲霉-葡萄糖苷酶的分离纯化及酶学性质[J].食品与生物技术学报,2015,34(11):1198-1202.
[18] 张大智,詹儒林,柳 凤,等.杧果细菌性角斑病菌细胞壁降解酶的致病作用[J].果树学报,2016(5):585-593.
[19] 金 勤,周国英,刘君昂,等.细胞壁降解酶在油茶炭疽病菌致病过程中的作用研究[J].植物保护,2017,43(3):97-102.
[20] 唐德芳,裴小琼,李晓璐,等.黑曲霉β-葡萄糖苷酶的筛选,克隆及表达[J].应用与环境生物学报,2009,15(3):423-426.
[21] Li L,Ji Q L,Hao J F,et al.Cloning and expression of β-Glucosidase gene from Bacillus pumilus[J].Applied Mechanics & Materials,2013,301:1271-1274.
[22] Waksman G.Molecular cloning of a beta-glucosidase-encoding gene from Sclerotinia sclerotiorum,by expression in Escherichia coli[J].Current Genetics,1989,15(4):295-297.
[23] Yin Z,Ke X,Huang D,et al.Validation of reference genes for gene expression analysis in Valsamali var.mali,using Real-time quantitative PCR[J].World Journal of Microbiology & Biotechnology,2013,29(9):1563-1571.
[24] Zhang Y,Shi X P,Li B H,et al.Salicylic acid confers enhanced resistance to Glomerella leaf spot in apple[J].Plant Physiology and Biochemistry,2016,106:64-72.
[25] 李玉婷,赵 奇,房 冰,等.禾谷缢管蚜热激蛋白Hsp90基因的克隆和表达分析[J].植物保护学报,2017,44(1):16-23.
[26] Kenneth J,Livak T D.Analysis of relative gene expression data using Real-time quantitative PCR and the 2-ΔΔCT method[J].Method,2001,25(4):402-408.
[27] 房 伟,方泽民,刘娟娟,等.新型海洋微生物β-葡萄糖苷酶基因的克隆,表达及重组酶性质[J].生物工程学报,2009,25(12):1914-1920.
[28] 陈 辉,冯志勇,冯 川,等.斑玉蕈β-葡萄糖苷酶基因的序列分析及皂苷对基因表达的影响[J].食用菌学报,2017,24(1):1-6.
[29] 陈相永,陈捷胤,肖红利,等.植物病原真菌寄生性与分泌蛋白组CAZymes的比较分析[J].植物病理学报,2014,44(2):163-172.
[30] 王彩霞,陈晓林,李保华.腐烂病菌侵染对苹果愈伤组织防御酶活性及丙二醛含量的影响[J].植物生理学报,2014(7):909-916.
[31] 雍道敬,李保华,王彩霞.苹果树腐烂病菌不同致病力菌株对苹果的诱导效应[J].植物生理学报,2014(6):810-816.
[32] Bhat S,Goodenough P W,Bhat M K,et al.Isolation of four major subunits from Clostridium thermocellum cellulosome and their synergism in the hydrolysis of crystalline cellulose[J].International Journal of Biological Macromolecules,1994,16(6):335-342.