棉花是我国重要的纤维作物及经济作物,在国民经济中具有举足轻重的战略地位。新疆棉区是我国最大的棉花产区,但是由于新疆地区地理位置特殊,春季气候多变,无霜期短,生长早期常有倒春寒,后期常有早霜等低温冷害天气。低温不仅会降低棉花的产量,也会使棉花的品质变差,从而直接影响棉花种植的经济效益。因此,研究棉花的抗寒机理,培育具有耐寒性的优质棉花具有重要的理论和现实意义。
Lyons的“膜脂相变” 学说[1]认为植物膜脂不饱和脂肪酸含量升高,膜脂相变温度会相应降低,从而增加细胞膜的流动性,使植物的抗寒性有所提高。Levitt[2]、Palta等[3]以及Orvar等[4]研究指出,低温对植物的伤害首先发生在植物细胞膜上,细胞膜的流动性和植物抗寒性密切相关,其稳定性对植物抵抗低温胁迫具有重要的意义。而在低温情况下,细胞膜上的磷脂双分子层的不饱和性决定了细胞膜的稳定性。因此,细胞膜膜质的不饱和性对植物的抗寒性有着重大影响[5]。我国许多学者都做了不饱和脂肪酸含量与植物抗寒性关系的研究[6-10]。
近年来,随着分子生物技术的发展,挖掘出了很多与脂肪酸含量相关的基因[11],学者们通过改变目的基因的表达来提高不饱和脂肪酸的含量,从而达到提高植物抗寒性的目的[12-15]。Δ9-硬脂酰-ACP 脱氢酶(Stearoyl-ACP desaturase,SAD)是不饱和脂肪酸合成代谢的关键酶[16],直接决定植物油脂中的不饱和脂肪酸的总量,以及饱和脂肪酸与不饱和脂肪酸的比例[17-18],对细胞膜在低温环境下的稳定性起重要的作用[19] 。因此,可以通过SAD基因的超量表达或反义表达等途径来调控饱和脂肪酸和不饱和脂肪酸的合成定向改变植物种质,以调节植物体中脂肪酸的成分和含量,从而改善植物的抗寒性。研究表明,膜脂中不饱和脂肪酸的比例及含量与植物的抗寒性有着相当密切的关系[20-24]。Cheesbrough[25-26] 研究发现,长在 20 ℃大豆的SAD基因活性比生长在 35 ℃大豆的SAD基因活性高5倍。Vega等[27]研究发现,低温4 ℃下,马铃薯 SAD 基因转录水平比对照组(20 ℃)显著升高,说明SAD基因的表达与马铃薯的低温适应性有一定关系。Polashock和Ma等[28-29]分别将酵母的 SAD基因和菠菜的SAD基因导入烟草,结果表明,转基因烟草的抗寒性都有不同程度增强。Los[30]分别将正向和反向SAD基因插入植物双元表达载体pBI121中,通过基因工程转入模式植物烟草中,结果表明,转正向表达SAD基因的转基因烟草抗寒性明显增强,反之转反向表达 SAD 基因的转基因烟草抗寒性明显减弱。银杏的GbSAD基因在4,15 ℃处理下该基因的水平稳步上升[31]。陆地棉GhSAD2基因在不同程度低温处理下均有上调表达[32]。Liu等[33]在GenBank中注册了陆地棉SAD基因的全长 cDNA 序列(X95988.1),但关于棉花SAD基因在抗寒性相关方面的研究未见报道。
本研究克隆陆地棉GhSAD2基因,构建植物表达载体pBI121-GhSAD2,并将该表达载体通过叶盘法转化烟草,通过测定转基因阳性烟草的电解质渗透率及其表型性状来探究GhSAD2基因在抗寒方面的作用,以期为提高棉花抗寒性提供理论指导。
1 材料和方法
1.1 试验材料
1.1.1 植物材料 新陆早33号种子和烟草种子由新疆农垦科学院棉花所提供。
1.1.2 菌株和载体 大肠杆菌感受态细胞Trans1-T1购于北京全式金生物有限公司;克隆载体pMD19-T购于日本TaKaRa公司;根癌农杆菌GV3101、表达载体pBI121由新疆石河子大学绿洲生态实验室提供。
1.1.3 试验所用的试剂 一些工具酶、T4连接酶、Pfu高保真酶、用于标定的标准的DNA分子量、PCR所用的Taq DNA 聚合酶等均购自北京全式金生物技术有限公司;试验中所用到的用来回收目的片段的胶回收试剂盒、用于提取菌液中质粒的质粒试剂盒等购于天根生化科技(北京)有限公司;试验中所用到的用于双酶切的XbaⅠ和SmaⅠ限制性内切酶、PrimerScriptTM RT Reagent Kit购自日本TaKaRa公司;蔗糖、MS购于Sigma公司。
1.1.4 引物合成及测序 试验所有涉及的PCR引物的合成过程以及在克隆时基因的测序过程,都是由上海生工完成的。
1.2 试验方法
1.2.1 试验材料种植 挑选颗粒饱满、颜色正常且没有受损的新陆早33号种子播种在事先准备好的蛭石和营养土比例为3∶1的花盆中,于28 ℃(16 h/8 h)的光照培养箱中取2~3片真叶的棉花幼苗叶片,提取植物总RNA,用于基因克隆分析。
烟草无菌苗种植:选取籽粒饱满、颜色正常的健康烟草种子放入1.5 mL的离心管中,用75%乙醇浸泡30 s,30% H2O2浸泡 10 min,浸泡过程中用移液枪反复吹打,随后用无菌水冲洗5次,每次1 min,最后将种子用牙签或1 mL移液枪均匀的点播于MS固体培养基,在 28 ℃(16 h/8 h)下培养5 d后,选取培养基中长势良好的幼苗接种于1/2MS培养基中,选取生长20 d后的无菌烟草苗作为转化植株。
1.2.2 棉花总RNA的提取和cDNA 的制备 采用CTAB法提取棉花叶片总RNA[34]。
1.2.3 棉花GhSAD2基因的克隆 从GenBank下载GhSAD2基因(KX197920)的序列,获得了1个包含GhSAD2全长ORF的基因序列,根据其开放阅读框序列设计克隆引物,分析GhSAD2基因和pBI121的酶切位点,根据分析结果,在每条引物上加入不同的酶切位点,用于构建表达载体。具体引物序列及酶切位点参照表1。
表1 基因扩增的引物
Tab.1 Primer sequence for gene amplification

引物名称Primer引物序列(5'-3') Primersequence Tm/℃说明IntroductionsGhSAD2-XbaⅠGCTCTAGAGCATGGCTCTGAAATTCAACCC65.4GhSAD2基因扩增GhSAD2-SmaⅠTCCCCCGGGGGAGAGCTGGACTTCTCTATCAAAT65.4
注:下划线所标注的碱基是用于表达载体构建在 PCR 扩增引物上所引入的限制性酶切位点。
Note:The underscore labeled base is used to express the vector construct on the PCR amplification primer introduced by the restriction site.
采用常规PCR方法克隆棉花GhSAD2基因序列,以棉花cDNA为模板,以高保真聚合酶Pfu高保真酶(全式金,北京)进行PCR扩增,扩增反应体系为:10×EasyPfu Buffer 2 μL,2.5 mmol/L dNTPs 2 μL,EasyPfu DNA Polymerase 0.4 μL,正向引物和反向引物各加入1 μL;棉花DNA模板1 μL后用ddH2O补充到20 μL。PCR时所用的反应条件为:预变性94 ℃ 5 min;变性94 ℃ 45 s,退火65.5 ℃ 30 s,延伸72 ℃ 2 min 30 s,共30个循环;72 ℃ 10 min。将扩增产物经1%的琼脂糖凝胶电泳检测,回收约1 200 bp的目的片段,将其连接到克隆载体pMD19-T上,构成重组质粒,所用的连接体系为:pMD19-T Vactor 1 μL,Solution I 1 μL,回收的目的片段4 μL。将重组质粒通过热激法转入大肠杆菌中,经过蓝白斑筛选,菌液PCR鉴定,将筛选得到的阳性菌液送至上海生工进行测序验证。用软件DNAMAN对测序结果进行比对,选取比对结果大于98%的菌液进行质粒的提取,并将其命名pMD19-T-GhSAD2。
1.2.4 棉花GhSAD2基因表达载体的构建 用Xba Ⅰ和Sma Ⅰ双酶切pMD19-T-GhSAD2质粒和pBI121双元表达载体,用1%的琼脂糖凝胶电泳检测酶切产物并回收大于10 000 bp的目的大片段和1 200 bp左右的目的小片段,从而获得GhSAD2基因片段和pBI121载体片段。将GhSAD2基因的线性片段和酶切消化的pBI121载体片段分子,按 3∶1摩尔比混合,T4连接酶(全式金,北京)4 ℃连接过夜。用热激法转入大肠杆菌感受态Trans1-T1中,并将其均匀涂布于含有Kan抗性的LB平板培养基上,放置37 ℃恒温箱中过夜,从中挑取出单克隆的菌落,用引物GhSAD2F和GhSAD2R进行菌落的PCR鉴定,凝胶电泳检测,跑胶结果中出现了预期条带的菌液为候选的阳性克隆菌液,用质粒提取试剂盒的操作步骤进行提质粒,将提取到的质粒用Xba Ⅰ、Sma Ⅰ限制性内切酶进行双酶切鉴定,最终获得pBI121-GhSAD2阳性克隆。
1.2.5 叶盘法转化烟草 将构建正确的重组质粒pBI121-GhSAD2电击转化到GV3101农杆菌感受态中,并将其均匀涂布于含有卡那霉素抗性和利福平抗性的LB平板上,在28 ℃下恒温培养约48 h。从中挑取单克隆的菌株将其接种于含50 μg/mL的卡那霉素和含50 μg/mL利福平霉素的2 mL 的LB液体培养基中,28 ℃振荡培养20 h左右,然后吸取1 mL培养的菌液接种至50 mL含相应抗性的LB液体培养基中,恒温28 ℃振荡培养,用分光光度计测其OD值 ,当OD值在1.2~1.6时。常温,4 000 r/min 离心10 min,用MS转化液重悬沉淀混匀至OD值=0.4~0.6,然后进行烟草的转化。
1.2.6 转基因烟草的鉴定和GUS活性组织染色 按照CTAB-SDS法提取野生型烟草和转基因烟草基因组DNA[35],并用GhSAD2F和GhSDA2R引物分别对野生型烟草和转基因烟草进行PCR扩增,通过对PCR产物电泳检测,确认GhSAD2基因是否已经成功导入并整合到转基因烟草的基因组中。表达载体pBI121-GhSAD2携带GUS报告基因,用GUS染色试剂盒进行染色,以PCR检测为阳性的转基因烟草幼嫩的叶片作为试验的材料,其中野生型烟草作为对照组。将需要检测烟草叶片放于2 mL的离心管中,并用事先配置好的X-Gluc染液将其完全浸没,置于28 ℃下显色2 h后,并用75%乙醇进行脱色3次,再用无水乙醇脱色1次,直至将对照叶片完全脱色时,将转基因烟草和野生型烟草放置在一起观测,并对2种类型的叶片进行拍照。
1.2.7 转基因烟草的抗寒性鉴定 选取苗龄2个月左右的转基因烟草用于烟草抗寒性的鉴定,选取长势一致的野生型烟草和转基因烟草作为本试验的试验材料,在4 ℃处理48 h后测定其电解质渗漏率。测定方法采用Gong等[36]的方法,重复3次,取平均值。
2 结果与分析
2.1 棉花GhSAD2基因的克隆
从GenBank已公布的数据中,下载棉花GhSAD2的基因序列(KX197920),用GhSAD2-Xba Ⅰ和GhSAD2-Sma Ⅰ引物(表1),从新陆早33的cDNA中克隆出大小约为1 200 bp左右的扩增条带(图1)。将特异条带切胶回收,然后连接PMD19-T 载体,转化Trans1-T1感受态细胞后,用蓝白斑筛选阳性克隆送测序公司测序。其测序结果通过DNAMAN多重序列对比分析,选取同源性最高的阳性质粒用Xba Ⅰ和Sma Ⅰ进行双酶切,得到约为1 200 bp的酶切小片段(图2),获得预期目的基因。
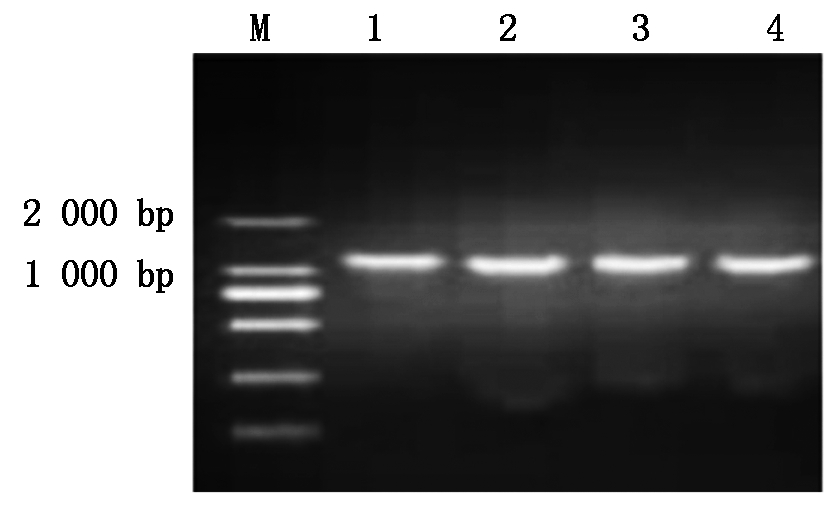
M. DL2000;1~4. GhSAD2的PCR片段。
M. DL2000;1-4. PCR fragment of GhSAD2.
图1 陆地棉GhSAD2基因的扩增
Fig.1 Amplification of GhSAD2 gene in Gossypium hirsutum
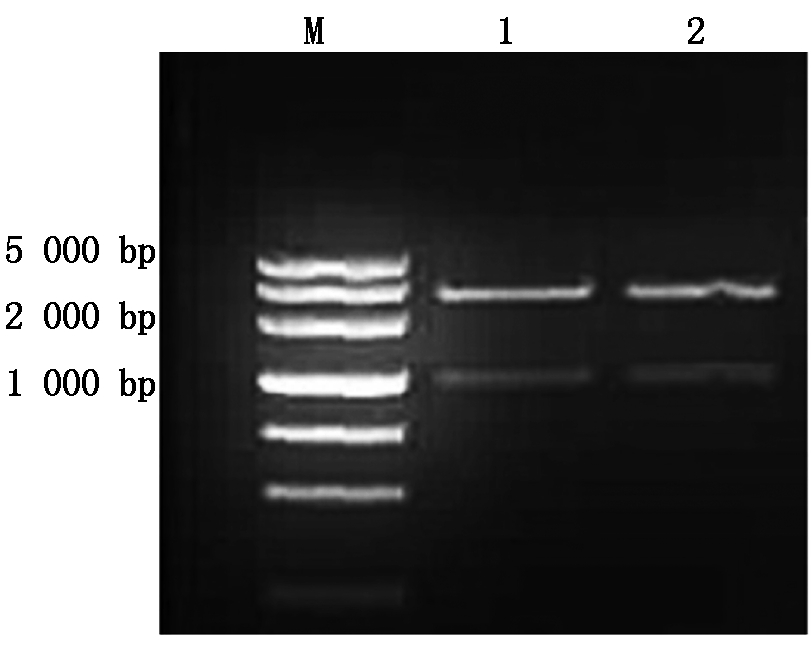
M.DL2000;1~2. 双酶切产物。
M. DL2000;1-2. Fragment of double enzyme.
图2 pMD19-T-GhSAD2的双酶切验证
Fig.2 Double enzyme digestion verification of pMD19-T-GhSAD2
2.2 棉花GhSAD2基因表达载体的构建
回收约1.2 kb的酶切基因片段,与经同酶切的表达载体pBI121约为14.7 kb的大片段相连接,获得重组质粒pBI121-GhSAD2(图3),重组载体中基本的载体骨架依旧为pBI121表达载体,本试验克隆得到的棉花GhSAD2基因是在CaMV35S下游Xba Ⅰ和Sma Ⅰ的酶切位点之间进行插入的。通过双酶切对重组子pBI121-GhSAD2进行酶切,凝胶电泳检测结果出现约1 200 bp左右的片段,该片段的大小和目的片段大小基本是保持一致的,该跑胶结果说明重组的过表达载体pBI121-GhSAD2已经成功构建(图4)。使用电击仪将验证阳性的重组的过表达载体pBI121-GhSAD2导入到事先准备好的农杆菌感受态中,经GhSAD2F和GhSAD2R引物进行PCR扩增,观测电泳的结果发现凝胶中出现和目的片段大小位置相同的特异片段(图5)。该跑胶结果说明上述构建的表达载体pBI121-GhSAD2已成功转入到农杆菌GV3101中并进行表达。
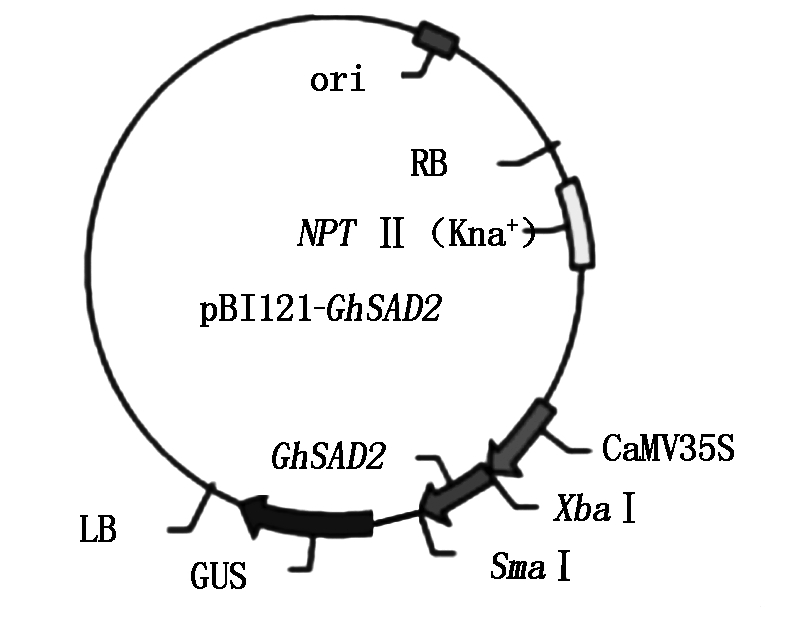
图3 pBI121-GhSAD2表达载体模式图
Fig.3 Diagram of expression voctor pBI121-GhSAD2
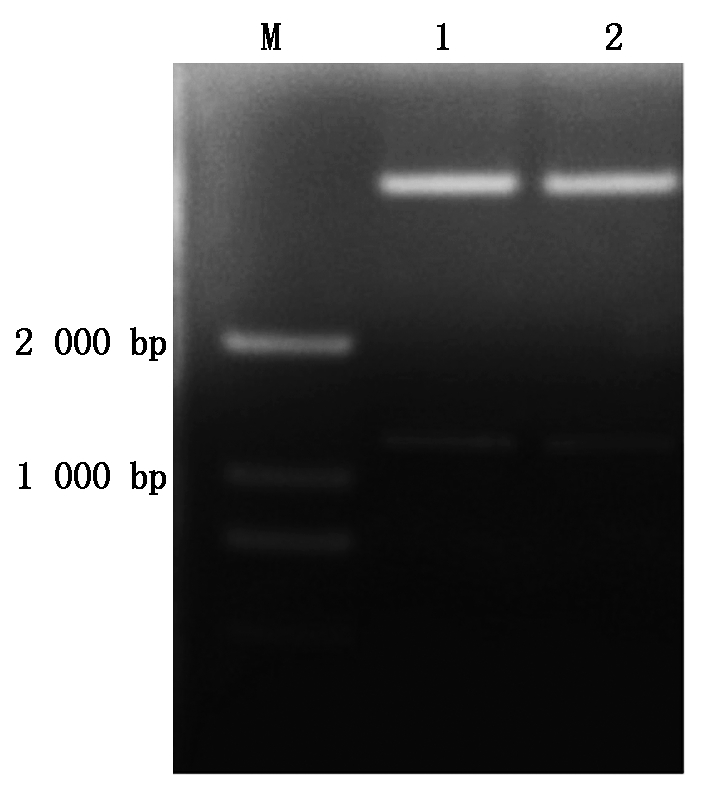
M.DL2000;1~2. 重组子双酶切产物。
M.DL2000;1-2. Recombinant double enzyme product.
图4 重组子pBI121-GhSAD2的双酶切验证
Fig.4 Verification of recombinant pBI121-GhSAD2 by double enzyme digestion

M. DL2000;1~5. 重组质粒pBI121-GhSAD2的扩增产物。
M. DL2000;1-5.Recombinant plasmid pBI121-GhSAD2 amplification product.
图5 重组子pBI121-GhSAD2的PCR验证
Fig.5 PCR verification of recombinant pBI121-GhSAD2
2.3 转基因烟草的鉴定及GUS活性染色
通过对培养瓶中的再生烟草进行抗性卡那霉素筛选,本试验共得到12株长势较好的再生转基因烟草植株,分别提取每个植株叶片的DNA并进行PCR扩增检测,用GhSAD2-XbaⅠ和GhSAD2-SmaⅠ引物进行扩增,跑胶结果表明,其中有9株可以扩增得到约1 200 bp的特异性条带,而野生型烟草作为对照组没有出现特异性条带(图6),此结果说明外源的棉花GhSAD2基因已经整合到了烟草的基因组中,因此,可以得到pBI121-GhSAD2在烟草上的转化率为75%。选取PCR跑胶结果为阳性的转基因烟草植株,摘取其幼嫩的叶片(大小基本相同)分别进行相同时间的GUS染色,染色完成后再分别脱色,脱色后转GhSAD2基因烟草植株的叶脉中呈现出不同程度的蓝色,野生型烟草叶片全呈黄白色(图7)。表明外源 GhSAD2基因连接载体pBI121后一起导入烟草中且能稳定表达。
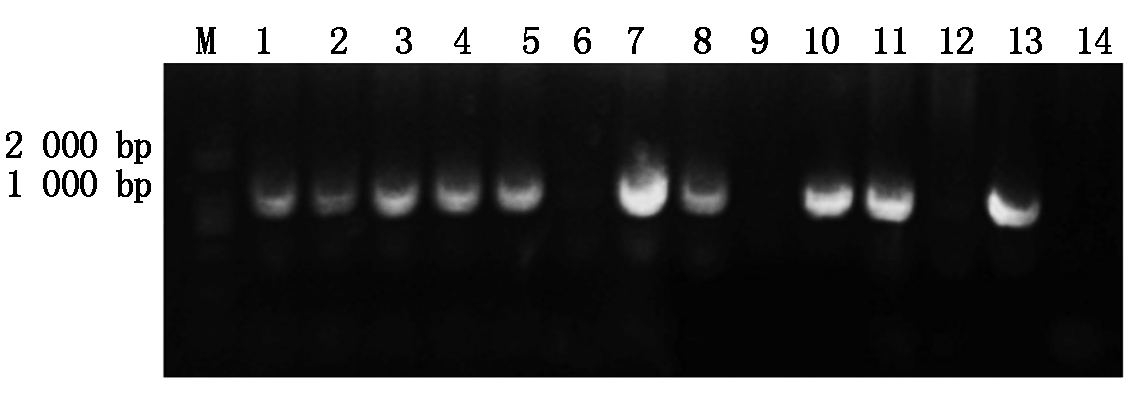
M. DL2000;1~12.转pBI121-GhSAD2基因烟草PCR产物;13. 重组子pBI121-GhSAD2扩增产物;14. 野生型烟草DNA扩增产物。
M. DL2000;1-12. Transgenic pBI121-GhSAD2 tobacco PCR product;13. Recombinant pBI121-GhSAD2 amplification product;14. Wild-type tobacco DNA amplification products.
图6 转基因烟草的PCR鉴定
Fig.6 PCR identification of transgenic tobacco
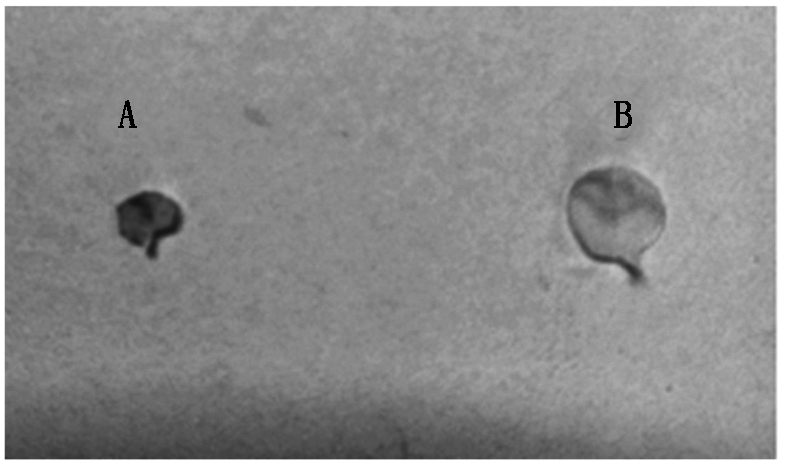
A. 转pBI121-GhSAD2基因烟草;B. 野生型阴性对照。
A.pBI121-GhSAD2 transgenic tobacco;B. Wild-type negative control.
图7 烟草GUS组织化学活性染色
Fig.7 Histochemical staining of a GUS activity in leaf of tobacco
2.4 转基因烟草的抗寒性鉴定
4 ℃低温胁迫48 h后,转pBI121-GhSAD2基因烟草和野生型烟草均表现为植株和叶片萎蔫、下垂,但转pBI121-GhSAD2基因烟草较野生型烟草萎蔫程度较轻(图8)。叶片相对电导率(REC)可以反映植物叶片细胞电解质渗出情况,即细胞膜受损程度。在相同时间的低温处理下,转pBI121-GhSAD2基因2个株系的烟草T1、T2相对电导率显著低于野生型烟草,但后两者无显著差异(图9)。表明转pBI121-GhSAD2基因烟草的细胞膜受损程度要显著低于野生型烟草。

A、C. 转pBI121-GhSAD2基因烟草;B. 野生型烟草。
A,C. Transgenic pBI121-GhSAD2 tobacco;B. Wild type tobacco.
图8 低温处理下不同基因型烟草的冷害症状
Fig.8 Different genotypes under low temperature treatment of tobacco chilling injury symptoms
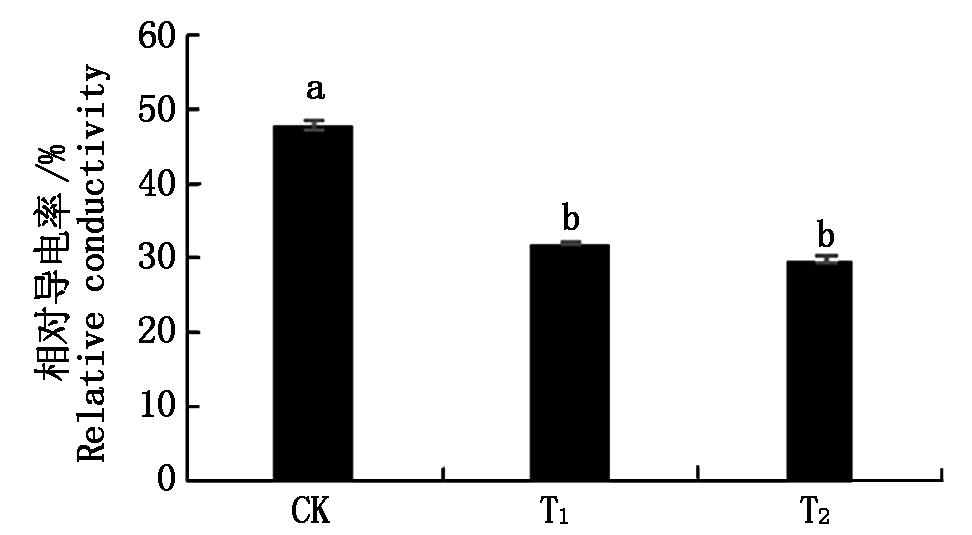
图中的小写字母a和b表示相同处理下不同株系处理间差异显著程度(P<0.05)。
The lowercase letters a and b in the figure indicate the significant difference in the treatment of different strains under the same treatment (P <0.05).
图9 低温处理下3种基因型烟草相对电导率的变化
Fig.9 Changes of relative conductivity in three genotypes tobacco under low temperature treatment
3 讨论
棉花不仅提供纺织原料,也是我国重要的油料和饲用作物[37]。脂肪酸组成是决定食用油品质的重要因素[38]。据报道,棉籽油中含有大量不饱和脂肪酸,其亚油酸的含量可超过 50%,具有较好的营养价值,是高质量的食用油。脂肪酸去饱和酶Δ9-硬脂酰-ACP是目前研究最多、最广泛的脂肪酸去饱和酶,因为它不仅影响着植物脂肪酸的组成,也同时与植物抗寒性密切相关,而关于SAD与植物抗寒性关系研究已经成为分子生物学研究的热点。
目前已从多种植物中分离获得 SAD基因的 cDNA,其中包括油菜[39]、芝麻[40]、油茶[41]、核桃[42]、棉花[32,43]等。SAD基因在高等植物的各个器官中均有表达,而表达模式和表达量存在差异。例如SAD基因在油樟的叶、种子、花中表达量较高,而在根和茎中表达量较低[42] 。而在海滨锦葵中,SAD基因在其叶子中的表达量最高,在花中的表达量最低,SAD基因在海滨锦葵种子不同阶段的表达量随种子的发育而逐渐降低[44]。Liu等[43]通过 RNA干涉棉花SAD基因的表达,其棉籽的硬脂酸含量从正常的20%上升到40%,同时还伴随棉籽油中棕榈酸、油酸和亚油酸的减少。Wendy 等[17]将土豆的SAD基因转入烟草中,发现叶片和种子的脂肪酸组分发生了变化,其不饱和脂肪酸含量增加。目前,对SAD基因的研究大多集中在SAD基因的表达模式及其对脂肪酸含量及组分的变化上,在抗寒方面的研究,主要集中在低温胁迫下SAD基因相关表达量的变化情况,但对于SAD基因在抗寒中的具体作用却鲜有报道。本研究主要通过基因工程的手段克隆棉花GhSAD2基因,构建植物表达载体pBI121-GhSAD2并将其转入模式植物烟草中,通过低温下烟草的表型性状及检测其电解质渗漏率,研究棉花GhSAD2基因在植株抗寒中的具体作用。研究结果显示,陆地棉GhSAD2基因能够显著增强非低温驯化植物烟草的抗寒性,从而提高植物细胞的低温防御能力,但由于该研究中所用的转pBI121-GhSAD2基因烟草均为T0的烟草植株,所以该研究中对于抗寒性的研究结果只能作为基础,对于GhSAD2基因在抗寒中的具体作用需要进一步通过纯合的高代植株及棉花直接来验证。
通过转基因技术改良棉花脂肪酸的组成及抗寒性是一项意义重大的工作,接下来将测定已纯合的转pBI121-GhSAD2基因烟草的各项生理指标及脂肪酸成分来进一步研究GhSAD2基因的抗寒作用。并将构建好的过表达载体pBI-GhSAD2转入棉花中直接研究其抗寒性,以期可以将其用于改善植物的抗寒性。
参考文献:
[1] Lyons J M. Chilling injury in Plants[J].Annual Review Plant Physiology,1973,24:445-528.
[2] Levitt J. Responses of plants to environmental stress:chilling,freezing and high temperature[M]. New York:Academic Press,1980.
[3] Palta J P,Whitaker B D,Weiss L S. Plasma membrane lipids associated with genetic variability in freezing tolerance and cold acclimation of solanum species[J]. Plant Physiology,1993,103(3):793-803.
[4] Orvar B L,Sangwan V,Omann F,et al. Early steps in cold sensing by plant cells:the role of actin cytoskeleton and membrane fluidity[J]. The Plant Journal:for Cell and Molecular Biology,2000,23(6):785-794.
[5] 赵金梅,周 禾,孙启忠,等. 植物脂肪酸不饱和性对植物抗寒性影响的研究[J]. 草业科学,2009,26(9):129-134.
[6] 张云虹,李爱民,张永泰,等.甘蓝型油菜种子发育过程中油脂合成基因的表达[J]. 扬州大学学报:农业与生命科学版,2015, 36(1): 59-64.
[7] 马 宁,王 玉,周克福.自然降温过程中茶树叶片脂肪酸含量分析[J]. 青岛农业大学学报:自然科学版, 2012, 29(2): 101-105.
[8] 孙英超,刘 伟,何秋伶,等.不同脂肪酸种类及浓度对棉纤维分化发育的影响[J]. 浙江大学学报:农业与生命科学版, 2014, 40(6): 621-626.
[9] 张三润, 杨 茜. 低温对钝顶螺旋藻质膜上6种脂肪酸含量的影响[J]. 内蒙古医科大学学报, 2013(35)3: 169-178.
[10] 谢冬微, 王晓楠, 付连双, 等. 低温胁迫对冬小麦分蘖节膜脂脂肪酸的影响[J]. 麦类作物学报, 2013, 33(4): 746-751.
[11] 王 莉, 杨维才.陆地棉基因组测序-开辟棉花育种新篇章[J]. 中国科学: 生命科学, 2015, 45:517-518.
[12] Kumar S,Asif M H,Chakrabarty D,et al. Expression of a rice Lambda class of glutathione S-transferase,OsGSTL2,in Arabidopsis provides tolerance to heavy metal and other abiotic stresses[J]. Journal of Hazardous Materials,2013,248 /249: 228 -237.
[13] Niu X G,Xiong F J,Liu J,et al. Co-expression of ApGSMT and ApDMT promotes biosynthesis of glycine betaine in rice (Oryza sativa L.) and enhances salt and cold tolerance[J]. Environmental and Experimental Botany,2014,104: 16- 25.
[14] Gao L, Sun R, Liang Y, et al. Cloning and functional expression of a cDNA encoding stearoyl-ACP Δ9-desaturase from the endosperm of coconut (Cocos nucifera L.) [J]. Gene, 2014, 549(1): 70-76
[15] 段俊枝, 李 莹,周 雷, 等. 利用基因工程技术提高水稻耐冷性的研究进展[J]. 浙江农业学报, 2015, 27(4) : 705-712.
[16] Yukawa Y,Takaiwa F,Shoji K,et al. Structure and expression of two seed-specific cDNA clones encoding stearoyl-acyl carrier protein desaturase from sesame,Sesamum indicum L.[J]. Plant & Cell Physiology,1996,37(2):201-205.
[17] Wendy C, Paolo L, Nunzia S, et al. Transplastomic tobacco plants expressing a fatty acid desaturase gene exhibit altered fatty acid profiles and improved cold tolerance[J].Transgenic Res, 2008, 17(5): 769-782.
[18] Kachroo A,Shanklin J,Whittle E,et al. The Arabidopsis stearoyl-acyl carrier protein-desaturase family and the contribution of leaf isoforms to oleic acid synthesis[J]. Plant Molecular Biology,2007,63(2):257-271.
[19] Los D A,Murata N. Structure and expression of fatty acid desaturases[J]. Biochimica et Biophysica acta,1998,1394(1):3-15.
[20] Kodama H,Horiguchi G,Nishiuchi T,et al. Fatty acid desaturation during chilling acclimation is one of the factors involved in conferring low-temperature tolerance to young tobacco leaves[J]. Plant Physiology,1995,107(4):1177-1185.
[21] Somerville C. Direct tests of the role of membrane lipid composition in low-temperature-induced photoinhibition and chilling sensitivity in plants and cyanobacteria[J]. Proceedings of the National Academy of Sciences of the United States of America,1995,92(14):6215-6218.
[22] Kodama H,Hamada T,Horiguchi G,et al. Genetic enhancement of cold tolerance by expression of a gene for chloroplast [omega]-3 fatty acid desaturase in transgenic tobacco[J]. Plant Physiology,1994,105(2):601-605.
[23] Murata N,Ishizaki-Nishizawwa O,Higashi S,et al. Genetically engineered alteration in the chilling sensitivity of plants[J]. Nature,1992,23(356):710-713.
[24] 杨玉珍,罗 青,彭方仁.不同种源香椿叶片脂肪酸组分含量与抗寒性关系[J]. 林业科技开发,2011,25(5):21-25.
[25] Cheesbrough T M. Changes in the enzymes for fatty acid synthesis and desaturation during acclimation of developing soybean seeds to altered growth temperature[J]. Plant Physiology,1989,90(2):760-764.
[26] Cheesbrough T M. Decreased growth temperature increases soybean stearoyl-acyl carrier protein desaturase activity[J]. Plant Physiology,1990,93(2):555-559.
[27] Vega S E,Del Rio A H,Bamberg J B,et al. Evidence for the up-regulation of stearoyl-ACP (Δ9) desaturase gene expression during cold acclimation[J]. American Journal of Potato Research,2004,81(2):125-135.
[28] Polashock J,Lipson D A. Comparison of freezing injury in cat and rye:Two cereals atextremes of freezing tolerance[J]. Plant Physiology,1993,102:160.
[29] Ma J,Lju D. Chitinase genes response to cold encodes antifreeze proteins in winter cereals[J]. Plant Physiology,1996,111(2):814.
[30] Los D. Cloning of a temperature- dependent expression of desaturase desA gene in Synechocysti PCC6803[J]. Febs,1993,318(1):57-60.
[31] Wang H L,Cao F L,Zhang W X,et al. Cloning and expression of Stearoyl-ACP desaturase and two oleate desaturases genes from Ginkgo biloba L.[J]. Plant Molecular Biology Reporter,2013,31(3):633-648.
[32] 蔡 曼,李卫华,王 娟,等. 陆地棉 GhSAD2基因克隆与表达特征研究[J]. 西北植物学报,2016,36(9):1713-1720.
[33] Liu Q,Singh S P,Green A G. Validation of a cotton-specific gene,Sad1,used as an endogenous reference gene in qualitative and Real-time quantitative PCR detection of transgenic cottons[J]. Plant Cell Reports,2005,24(4):237-245.
[34] Vega S E,Del Rio A H,Bamberg J B,et al. Evidence for the up-regulation of stearoyl-ACP (Δ9) desaturase gene expression during cold acclimation[J]. American Journal of Potato Research,2004,81(2):125-135.
[35] 李荣华,夏岩石,刘顺枝,等. 改进的CTAB提取植物DNA方法[J]. 实验室研究与探索,2009,28(9):14-16.
[36] Gong M,Li Y J,Chen S Z. Abscisic acid-induced thermotolerance in maize seedling is mediatexl by calcium and associated with antioxidant systems[J]. J Plant Physiol,1998,153:488-496.
[37] 王美霞,马 磊,徐双娇,等. 我国主栽棉花品种的棉籽油资源评价与分析[J]. 棉花学报,2017,29(2):204-212.
[38] 李 兰,彭振英,陈 高,等. 花生种子发育过程中脂肪酸积累规律的研究[J]. 华北农学报,2012,27(1):173-177.
[39] 贾艳丽,吴 磊,卢长明. 甘蓝型油菜Δ9硬脂酰ACP脱氢酶(SAD)基因的克隆与表达分析[J]. 中国油料作物学报,2014,36(2):135-141.
[40] 张党权,谭晓风,陈鸿鹏,等. 油茶SAD基因的全长cDNA克隆及生物信息学分析[J]. 林业科学,2008,44(2):155-159.
[41] Shanklin J,Somerville C. Stearoyl-acyl-carrier-protein desaturase from higher plants is structurally unrelated to the animal and fungal homologs[J]. Proceedings of the National Academy of Sciences of the United States of America,1991,88(6):2510-2514.
[42] 陈 虹,潘存德,王 蓓,等. 核桃种子发育主要营养物质积累之间的关系及脂肪酸动态变化[J]. 河北农业大学学报,2016,39(1):57-62,74.
[43] Liu Q,Singh S P,Green A G. High-stearic and High-oleic cottonseed oils produced by hairpin RNA-mediated post-transcriptional gene silencing[J]. Plant Physiology,2002,129(4):1732-1743.
[44] Luo T,Deng W Y,Zeng J,et al. Cloning and characterization of a stearoyl-acyl carrier protein desaturase gene from Cinnamoum longepaniculatum[J]. Plant Molecular Biology Reporter,2009,27(1):13-19.