野生稻是水稻的野生近缘种,分布在中国的野生稻有普通野生稻、药用野生稻和疣粒野生稻3种[1]。由于野生稻长期生长在自然环境中,具有丰富的遗传多样性,因此其保存有许多栽培稻已经丧失的优异基因[2-3]。药用野生稻拥有许多优良的抗性基因,比如抗褐飞虱、白背飞虱、白叶枯病基因等[4-5]。药用野生稻对逆境胁迫具有耐受和抵抗的功能,这是水稻遗传改良的重要材料[6]。常规远缘杂交、胚培养、胚拯救、原生质体融合、单体异源附加系、外源基因渗入系是药用野生稻优良基因资源发掘和利用的传统方法[7-8]。Jena等[9]首次报道从5个药用野生稻和2个栽培稻回交的高代 BC2F8获得52个渗入系,第4,10和12染色体上的渗入片段与褐飞虱的抗性基因相关。文库构建、转基因、高通量测序技术的利用使更高效发掘和利用药用野生稻优良基因资源成为可能,如药用野生稻BIBAC文库[10]和药用野生稻TAC文库的构建[11]。刘蕊等[12]利用抗逆相关转录因子基因序列作为探针,从药用野生稻 TAC文库筛选出特异性克隆,通过遗传转化并筛选出抗非生物胁迫的转基因材料,更有效地利用药用野生稻有利基因。谭碧兰[13]对20%PEG6000和未处理的药用野生稻四叶期幼苗叶片的转录产物进行了测序分析,得到743个与野生稻干旱胁迫相关基因。
ADF(Actin depolymerizing factor/cofilin,ADF/cofilin)通过结合肌动蛋白,从而调控植物生长发育以及外界胁迫的响应[14-16]。目前,动物中一些ADF/cofilin蛋白的晶体结构被解析,如疟原虫(Malaria parasite)Pf ADF1 和 Pb ADF2[17-18];一些植物的ADF/cofilin基因也已被分离和克隆,如水稻中OsADF3、拟南芥中AtADF2、AtADF4和AtADF5以及小麦中TaADF7可以提高植株对生物或非生物胁迫的耐受性和抗病性[19-23]。拟南芥中,AtADF1过量表达会导致细胞微丝束的长度变短[24],AtADF7可以调控花粉管顶端的正常生长[25],AtCDPK6基因可以调控拟南芥AtADF1N端的丝氨酸磷酸化过程,从而调节AtADF1与肌动蛋白的互作[26],拟南芥第三亚家族ADFs基因的表达量能被高温和低温特异的诱导,但是其他ADFs缺少这一特征[27-28],AtADF4在 ABA 和干旱诱导气孔关闭过程中起作用[29]。玉米的ZmADF4与地中海玉米螟的抗性显著相关[30]。还有研究表明,ADFs通过影响肌动蛋白的聚合与解聚来调节微丝骨架形成,并且ADFs的同源基因具有不同的表达模式[31];基于肌动蛋白的进化,在植物中ADF的复制、亚功能化或者新功能化对于ADF蛋白的功能分化具有重要作用[32]。抵御病原时,小麦TaADF7蛋白通过改变肌动蛋白动力学来调节SOD积累、过敏反应,从而提高植株对条锈病的抵抗能力[33]。水稻中OsADF对花粉的形成和花粉管的伸长发挥着不同的作用,是花粉的特异性表达基因[34]。这些都说明,利用分子生物技术改善作物抗逆性和提高作物产量,逐渐成为一种解决粮食问题的重要途径[35]。
近年来,高通量测序技术的利用促进了野生稻基因组重测序、转录组学和基因进化等的研究,为有效地分离、克隆野生稻有利基因提供了基础。谭碧兰[13]分析了药用野生稻干旱胁迫转录组数据,并筛选出逆境胁迫相关的基因,其中OoADF1基因胁迫后,表达水平显著提高。本试验在此研究结果的基础上,设计ADF特异性引物,通过PCR扩增、测序,从而克隆该基因;利用qRT-PCR技术研究了OoADF1的表达模式和胁迫处理后的表达变化特性,并选用原核表达载体初步探讨了OoADF1基因对低温、高温、干旱和高盐等非生物胁迫下的抗逆特征,旨在为进一步研究药用野生稻OoADF1的抗逆性奠定基础。
1 材料和方法
1.1 药用野生稻ADF基因的克隆与序列分析
药用野生稻抗旱转录谱中Unigene(comp29080_c0)注释为ADF家族基因,干旱胁迫后其表达水平提升5.4倍[13]。本试验根据Unigene(comp29080_c0)的注释,将它命名为OoADF1,利用Oligo 6.0软件,设计引物OoADF1的上游引物(5′-ATGGCGAAC
GCGACATCAGAT-3′)和下游引物(5′-TTAGGAGGT
GTGGTCCTTGAGCACG-3′)以扩增其完整的开放阅读框(ORF)。
试验植物材料系广西药用野生稻,种植于华南农业大学野生稻核心收集圃。选取幼嫩叶片,利用TRIzol法(Invitrogen公司)提取总RNA。采用FastQuant RT Kit (with gDNase)(天根生化科技有限公司),将总RNA逆转录成第一链。RT-PCR以逆转录的cDNA为模板,扩增体系为50 μL,内含cDNA模板5 μL、上游引物(10 μmol/L)1 μL、下游引物(10 μmol/L)1 μL、2×Taq Buffer 25 μL、DNA Polymerase(2.5 U/μL)0.5 μL和ddH2O 17.5 μL。PCR反应条件为95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸5 min。其中OoADF1-F为5′-CCACATCTGATG
TCGCGTTCGCCAT5-3′;OoADF1-R为5′-CGTGCTCA
AGGACCACACCTCCTAA-3′。
1.2 实时荧光定量PCR
qRT-PCR反应体系:2×SuperReal Premix 10 μL,Forward Primer(10 μmol/L) 0.5 μL,Reverse Primer(10 μmol/L)0.5 μL,Templete cDNA 2 μL和RNase-Free ddH2O 12 μL,其中cDNA模板为反转录后的cDNA第一链(1∶10稀释),选Actin作为内参基因。荧光定量PCR反应采用Roche-480仪器,反应体系为25 μL,根据Roche荧光定量试剂盒,反应程序:95 ℃预变性15 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,进行40个循环扩增。融解曲线反应程序:由60 ℃递进升温到95 ℃,步进0.5 ℃,恒温10 s。OoADF1上游引物为5′-ACGGCGGACGTGAG
GAGCAA-3′,OoADF1下游引物为5′-TTGAGCACGT
CGAGGGTGA-3′。内参基因Actin上游引物为5′-GCTTCTAATTCTTCGGACCCAA-3′下游引物为5′-GGTTGAAAACTTTGTCCACGCTA-3′。
1.3 OoADF1基因原核表达
1.3.1 原核表达载体的构建 设计上游引物(5′-CGGGATCCATGGCGAACGCGACATCAGAT-3′,下划线为BamHⅠ酶切位点序列)和下游引物(5′-CG
GAATTCTTAGGAGGTGTGGTCCTTGAGCACG-3′,下划线为EcoRⅠ酶切位点序列),扩增带有酶切位点序列的OoADF1完整的CDS片段,琼脂糖凝胶电泳并切胶回收目的片段。将目的片段和原核表达载体pET-28a(+)分别用限制性内切酶BamHⅠ和EcoRⅠ双酶切,OoADF1目的片段的连接与pET-28a(+)采用T4连接酶(天根生化科技有限公司)。通过热击法将连接产物转化大肠杆菌(DH5α),挑取单克隆进行菌液PCR检测并测序,将连接正确的质粒命名为pET-28a-OoADF1。
1.3.2 重组原核表达载体的转化和诱导表达 利用热激法将重组质粒pET-28a-OoADF1与pET-28a分别转化到表达菌株BL21(DE3)中,用LB(50 mg/L Kan)固体培养基培养并筛选挑取阳性单克隆进行菌液PCR验证,-20 ℃保存备用。取300 μL菌液接种到3 mL LB(50 mg/L Kan)培养基中过夜培养,然后将菌液按1∶50的比例加入到100 mL LB(50 mg/L Kan)培养基中,150 r/min 、37 ℃ 摇床扩大培养2~3 h,OD600为0.6时,从扩大培养物中取分别取4 mL菌液加入不同浓度的IPTG进行诱导表达(150 r/min 、37 ℃),分别诱导1,2,3,4 h,同时收集未经 IPTG 诱导的pET-28a(+)和pET-28a-OoADF1作为空白对照。5 000 r/min、2 min收集菌体,加入1 mL 灭菌水洗涤沉淀,8 000 r/min离心2 min,弃上清。在收集的菌体中加入200 μL 1×SDS-PAGE Loading Buffer,收集上清4 ℃ 保存备用。配置SDS-PAGE分离胶与浓缩胶,样品点30 μL,恒压70 V电泳,溴酚蓝至胶槽底部时,停止电泳,然后进行考马斯亮蓝过夜染色,蒸馏水冲洗干净后,倒入考马斯亮蓝脱色液脱色至胶背景透明。
1.3.3 高盐胁迫下重组菌株BL21(DE3)生长曲线测定和菌落数分析 保存的菌液接种于LB(50 mg/L Kan)培养基中过夜活化。按1∶100接种量分别接种于LB、LB(500 mmol/ L NaCl)和LB(600 mmol/L NaCl)的LB液体培养基中,再分别加入终浓度为0.1 mmol/L的IPTG,37 ℃、150 r/min培养,每隔2 h测定其OD600值,用SigmaPlot12绘制生长曲线,重复3次。
将含有pET-28a-OoADF1、pET-28a(+)的BL21重组菌株经最适浓度的IPTG诱导培养2 h至OD600为1.0。菌体经4 500 r/min离心5 min之后用无菌水重悬菌体,调OD600至1.0。取100 μL重悬菌液稀释至1 mL,混匀后再从中取100 μL菌液稀释至1 mL,如此依次稀释到第6级。取100 μL菌液分别涂布在含有不同浓度的LB(50 mg/L Kan)培养基平板上,37 ℃过夜培养,统计菌落个数,试验3次重复。
2 结果与分析
2.1 OoADF1的序列分析
转录谱测序结果分析发现,药用野生稻经20% PEG模拟干旱胁迫后,表达水平上升的Unigene有459个,其中comp29080_c0的表达水平上升5.4倍,注释为肌动蛋白结合蛋白(Actin depolymerizing factor/cofilin,ADF/cofilin,ADF)[13]。利用EditSeq软件分析表明,comp29080_c0总长为1 158 bp,推测ORF长度为453 bp。RT-PCR扩增片段的长度与预测相符(图1-A),切胶回收并测序,MegAlign双序列比对表明,扩增片段的序列与comp29080_c0预测的ORF序列一致,ORF长度为453 bp,推测编码150个氨基酸残基。利用PFAM(http://pfam.xfam.org/search)搜索发现,comp29080_c0 ORF 推测的氨基酸序列含有完整ADF结构域的基因,命名为OoADF1。为了研究OoADF1的基因组序列是否有内含子,以药用野生稻基因组DNA为模板,应用高保真酶和特异性引物OoADF1-F和OoADF1-R进行OoADF1基因组DNA扩增,获得预测大小长度的条带(图1-B),回收条带,并与T载体连接,菌液PCR鉴定后,提取重组质粒并送样测序,获得OoADF1的基因组序列,在GSDS(http://gsds.cbi.pku.edu.cn/)上进行基因结构分析,结果显示,OoADF1基因无内含子。BlastP搜索结果发现,单子叶植物中存在许多OoADF1的同源基因,从中选出栽培稻同源基因OsADF1、3、5、6、7、9、10和11,与OoADF1进行多序列比对和系统发育树分析,OoADF1与OsADF3聚成一类,并有高自展值支持(图2)。双序列比对结果发现,OoADF1和OsADF3的氨基酸长度均为150个,两者仅存在5个氨基酸的差异,氨基酸序列相似性高达96.7%,表明两者具有很高的同源性。
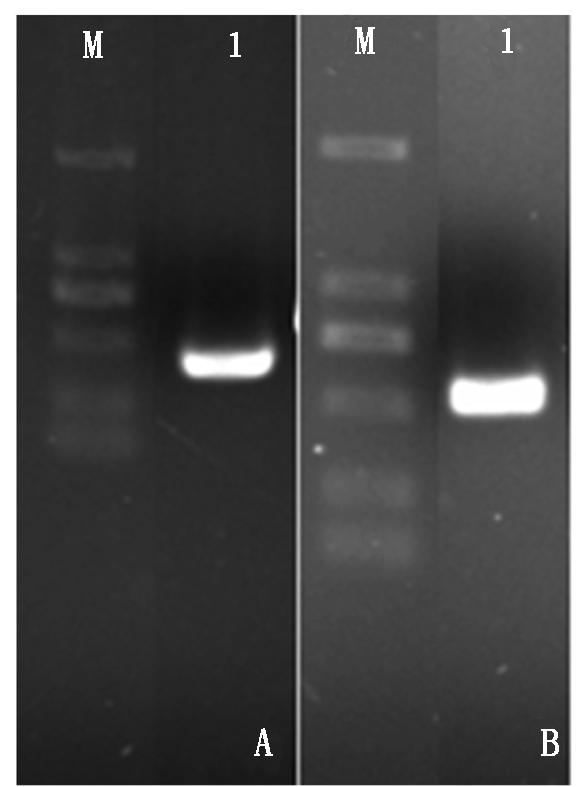
A和B图中泳道1分别为OoADF1的cDNA和基因序列扩增条带;M.Marker 2000。
A.Amplification of OoADF1 cDNA;B.Amplification of OoADF1genome;M.DNA Marker 2000.
图1 药用野生稻OoADF1 cDNA与基因组扩增凝胶电泳
Fig.1 Detection of RT-PCR amplification of Oryza officinalis OoADF1 cDNA and genome
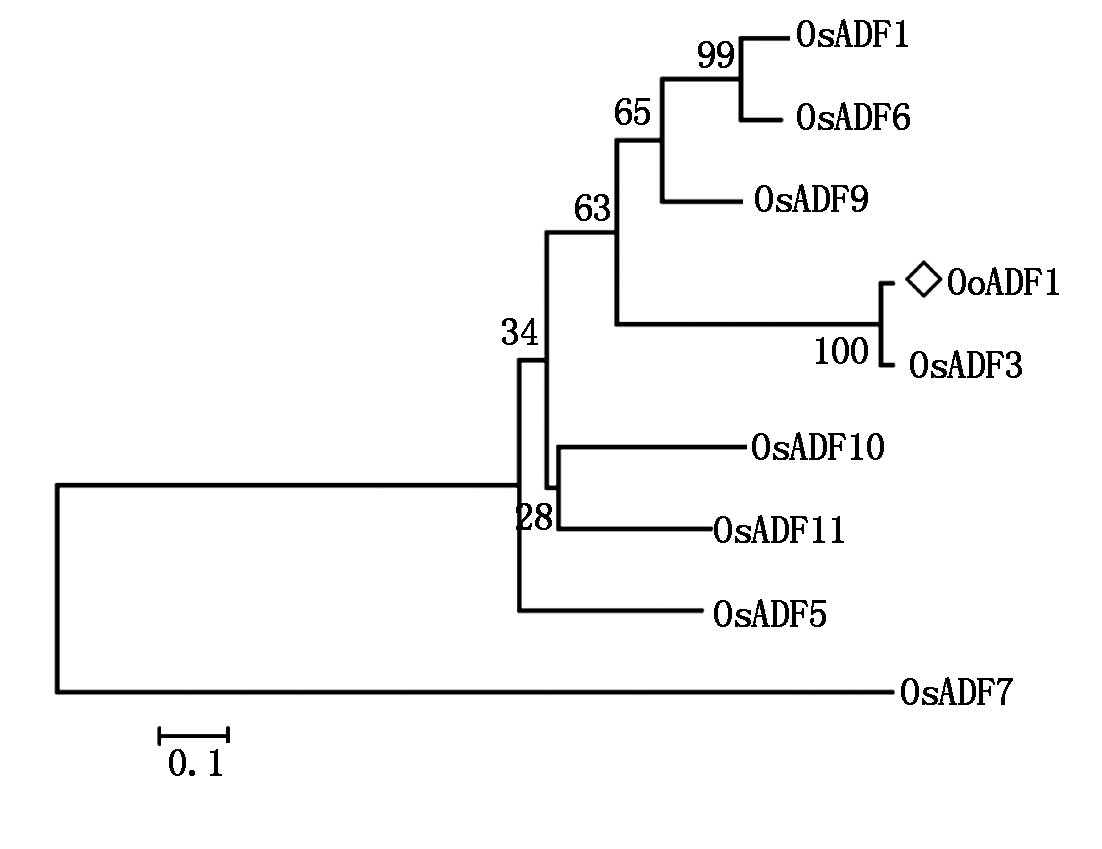
图2 药用野生稻与栽培稻ADF氨基酸序列的系统进化分析
Fig.2 Phylogenetic analysis on amino acid sequences of ADF in Oryza officinalis and Oryza sativa
2.2 药用野生稻OoADF1基因表达模式分析
为了分析药用野生稻OoADF1的组织表达特性,以幼苗四叶期叶片、叶鞘和根、抽穗期的叶片、叶鞘、茎和幼穗等7个组织的cDNA为模板进行qRT-PCR扩增,结果表明,OoADF1在四叶期的叶片、叶鞘、根、抽穗期的叶片、叶鞘、茎和幼穗等7个组织中均表达,四叶期根部表达量最高,抽穗期叶鞘表达量最高,随着生长发育,营养器官OoADF1表达水平逐渐变大(图3),OoADF1在各组织中均有表达,不具有表达的组织特异性。
为了探讨药用野生稻OoADF1的抗逆特性,对药用野生稻四叶期幼苗进行干旱、高温、低温和高盐胁迫处理,选取不同处理和未处理幼苗叶片,用TRIzol法提取总RNA,qRT-PCR扩增结果表明,OoADF1在不同胁迫下的表达量均有上调,在干旱和高盐浓度胁迫时表达量上调倍数较大;OoADF1在干旱胁迫时最高表达水平比对照上调了17.9,在高盐胁迫时最高表达水平比对照上调了40.0倍,4 ℃或42 ℃胁迫时,OoADF1最高表达水平分别上调9.7,7.2倍;OoADF1在低温和干旱胁迫早期表达水平变化较大,后期较小;高盐胁迫时,随着时间变长,表达水平变化倍数增加(图4)。结果表明,药用野生稻OoADF1可能参与干旱、高温、低温和高盐等非生物胁迫调控。
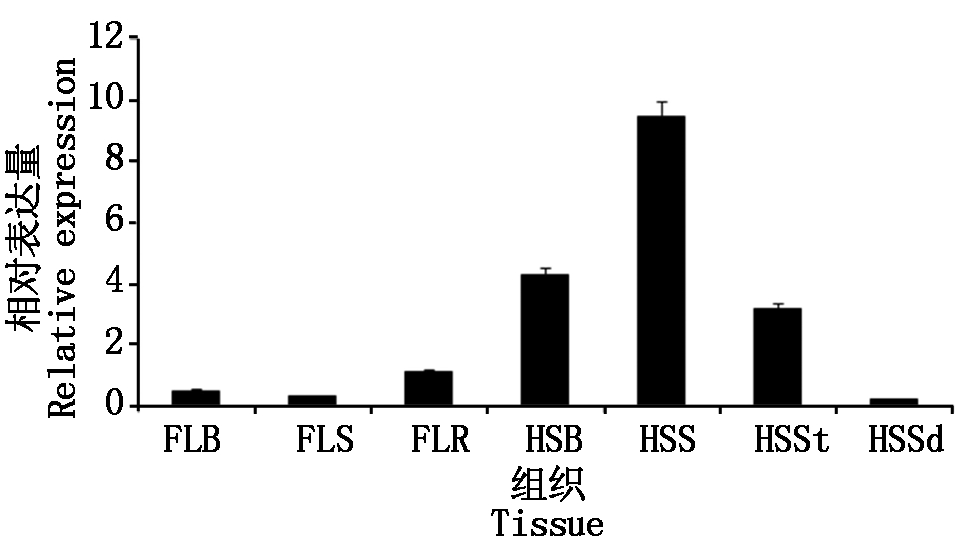
FLB.四叶期叶片;FLS.四叶期叶鞘;FLR.四叶期根;HSB.抽穗期叶片;HSS.抽穗期叶鞘;HSSt.抽穗期茎;HSSd.抽穗期幼穗。
FLB.Leaf blade at four-leaves stage;FLS.Leaf sheath at four-leaves stage;FLR.Root at four-leaves stage;HSB.Blade at heading stage;HSS.Sheath at heading stage;HSSt.Stem at heading stage;HSSd.Young panicle at heading stage.
图3 药用野生稻OoADF1在药用野生稻各组织表达水平
Fig.3 Expression level of OoADF1 in various tissues of Oryza officinalis
2.3 药用野生稻OoADF1蛋白的诱导表达
为了探讨OoADF1所编码的特异蛋白的表达特性,将OoADF1的ORF序列融合到原核表达载体pET-28a(+)质粒中,构建了药用野生稻OoADF1基因的原核表达载体pET-28a-OoADF1。采用不同诱导时间和不同IPTG浓度对原核表达体系进行优化。IPTG浓度梯度优化试验结果(图5)表明,当IPTG终浓度小于0.2 mmol/L时,融合蛋白表达量随着浓度增加而变大;当IPTG终浓度大于0.2 mmol/L时,融合蛋白表达量则逐渐变低。诱导时间梯度优化试验结果表明,随着诱导时间增加,融合蛋白表达量增加,但诱导时间超过3 h,表达量增加不显著,所以诱导3 h时是最佳的诱导蛋白表达时间。SDS-PAGE检测结果显示,重组子pET-28a-OoADF1蛋白分子质量约为23 kDa,载体pET-28a(+)阅读框编码的蛋白大小约为7 kDa,因此OoADF1蛋白的分子质量为16 kDa,这一结果与预测大小相符。
2.4 药用野生稻OoADF1高盐胁迫抗性分析
为进一步了解OoADF1在生物体中对胁迫响应的作用,用转入重组子pET-28a-OoADF1和pET-28a(+)的大肠杆菌BL21(DE3)菌株,涂布在含浓度为0,500,600 mmol/L NaCl的LB液体培养基中分别培养,加入终浓度为0.2 mmol/L的IPTG诱导,在恒温摇床(37 ℃、150 r/min)中连续培养35 h,期间每隔2 h测定OD值并观察其生长曲线。结果表明,转入重组子pET-28a-OoADF1的菌株在正常培养和高盐胁迫条件下,菌液活力均较对照高,说明表达OoADF1的菌株不仅能够在正常条件下生活力比对照高,而且能够更好地耐受高浓度NaCl的胁迫(图6-A-C)。进一步将重组子pET-28a-OoADF1和pET-28a(+)涂布于含有不同浓度的NaCl固体LB培养基上,在37 ℃下生长18 h,pET-28a-OoADF1菌株在400,600 mmol/L NaCl固体培养基上能够长出较多的菌落,在800 mmol/L NaCl固体培养基上未长菌落(图6-D)。结果表明,该OoADF1基因表达的蛋白质耐受一定浓度的高盐胁迫。
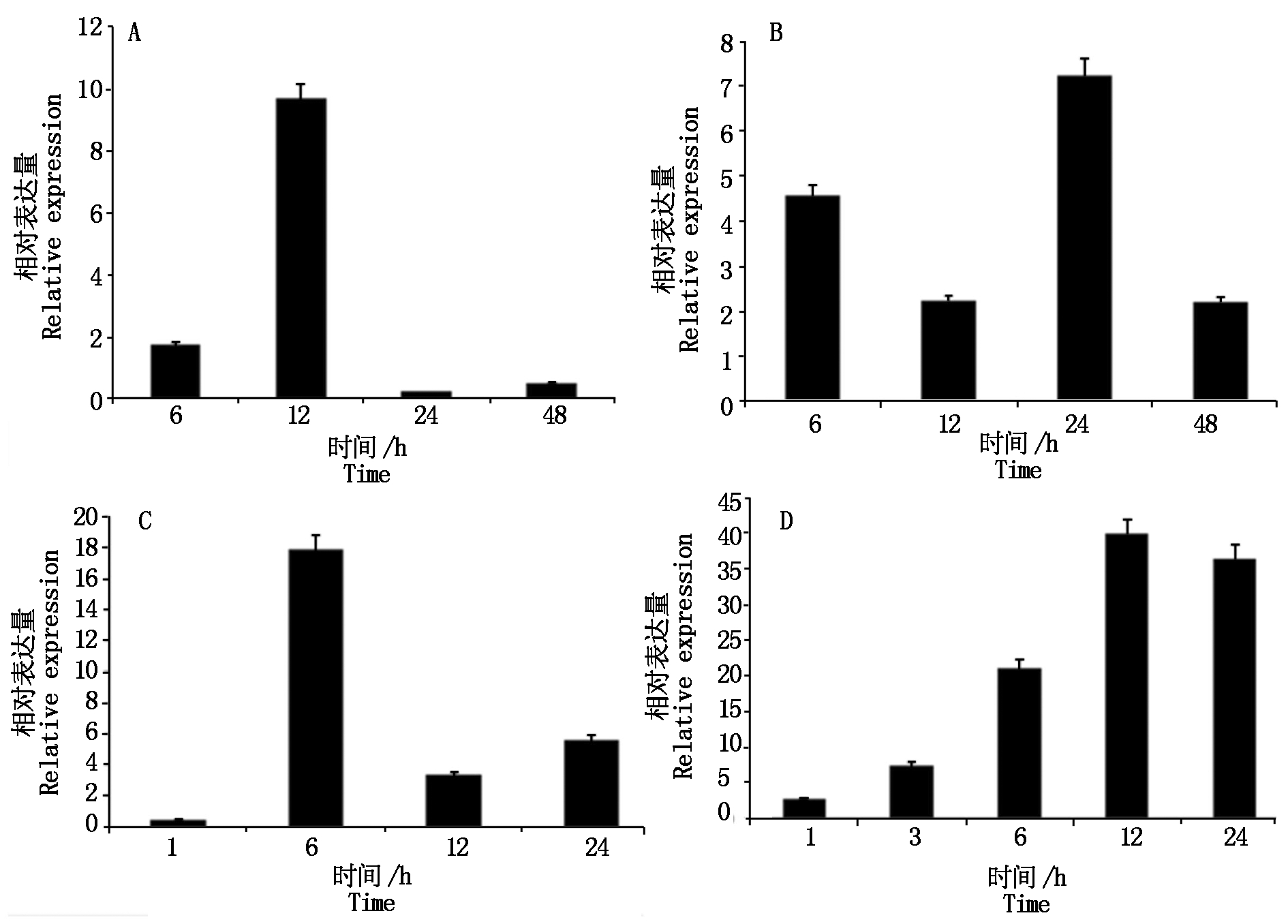
A.4 ℃;B.42 ℃;C.20% PEG-6000;D.200 mmol/L NaCl。
图4 OoADF1在不同胁迫下的表达变化
Fig.4 Expression changes of OoADF1 in different stress
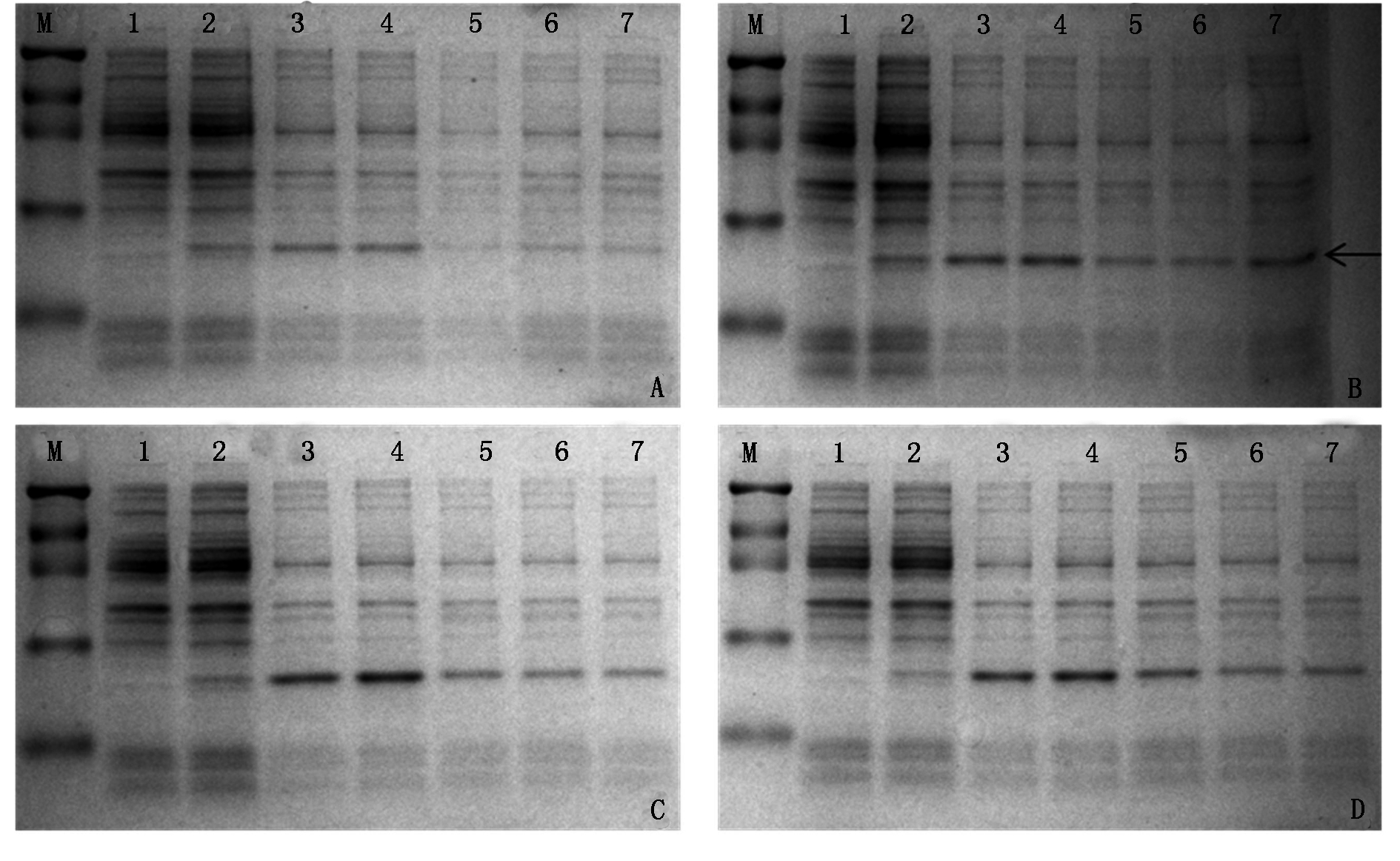
M.蛋白Marker(94,60,45,27,18 kDa);1.未经IPTG诱导的载体pET-28a(+);2.未经IPTG诱导的重组子pET-28a-OoADF1;3~7.经终浓度分别为0.1,0.2,0.5,0.8,1.0 mmol/L的IPTG诱导重组子pET-28a-OoADF1;A、B、C、D分别为经IPTG诱导1,2,3,4 h;箭头是特异蛋白。M.Protein Marker(94,60,45,27,18 kDa);1.pET-28a(+) with no IPTG induce;2.pET-28a-OoADF1 with no IPTG induce;3-7.pET-28a-OoADF1 with IPTG induce(final concentration:0.1,0.2,0.5,0.8,1.0 mmol/L);A,B,C,D.IPTG induce with 1,2,3,4 h;Arrow is specific protein.
图5 重组子pET-28a-OoADF1 SDS-PAGE检测图
Fig.5 RT-PCR detection of recombination pET-28a-OoADF1
3 讨论与结论
模式植物拟南芥和水稻基因组中分别存在12,15个ADF家族成员,部分成员分子生理功能和作用已得到系统研究确认[15,36]。本研究利用药用野生稻(CC染色体组)干旱胁迫的转录谱组装序列,成功克隆了药用野生稻的ADF基因OoADF1的ORF为453 bp,编码150个氨基酸残基,具有典型的ADF结构域。OoADF1与OoADF3氨基酸序列相似性高达96.7%,两者具高度同源性,预测着药用野生稻(CC组)和栽培稻(AA组)分化之前就存在ADF的共同祖先。OoADF1在幼苗的根中和抽穗期的叶鞘中表达最高,而在穗部表达较低。OsADF3主要在90 d栽培稻日本晴的茎、叶片、鞘和穗表达,12 d日本晴的茎中微弱表达[19],两者具有相似的组织表达模式。已有研究表明,植物肌动蛋白在应激生物胁迫和非生物胁迫起着重要作用[37-38]。日本晴和中花8苗期OsADF3受干旱和渗透胁迫诱导,而不受盐、冷和ABA诱导[39]。然而Yan等[40]指出,日本晴根部OsADF3蛋白受盐胁迫诱导,并且Chen等[41]认为OsADF3蛋白受外源ABA诱导,与根部生长和发育过程中形态特性变化相关。Huang等[19]的研究结果表明,OsADF3受盐、ABA、干旱和冷等4种非生物胁迫诱导表达。研究结果表明,OoADF1受低温、高温、高盐和干旱等不同胁迫诱导表达,大肠杆菌BL21(D23)表达融合蛋白pET-28a-OoADF1在高盐胁迫下表现出更强的生活力,表明该基因能够提升菌株的耐盐性。本研究结果为进一步探讨药用野生稻OoADF1抗逆胁迫功能提供了坚实基础。
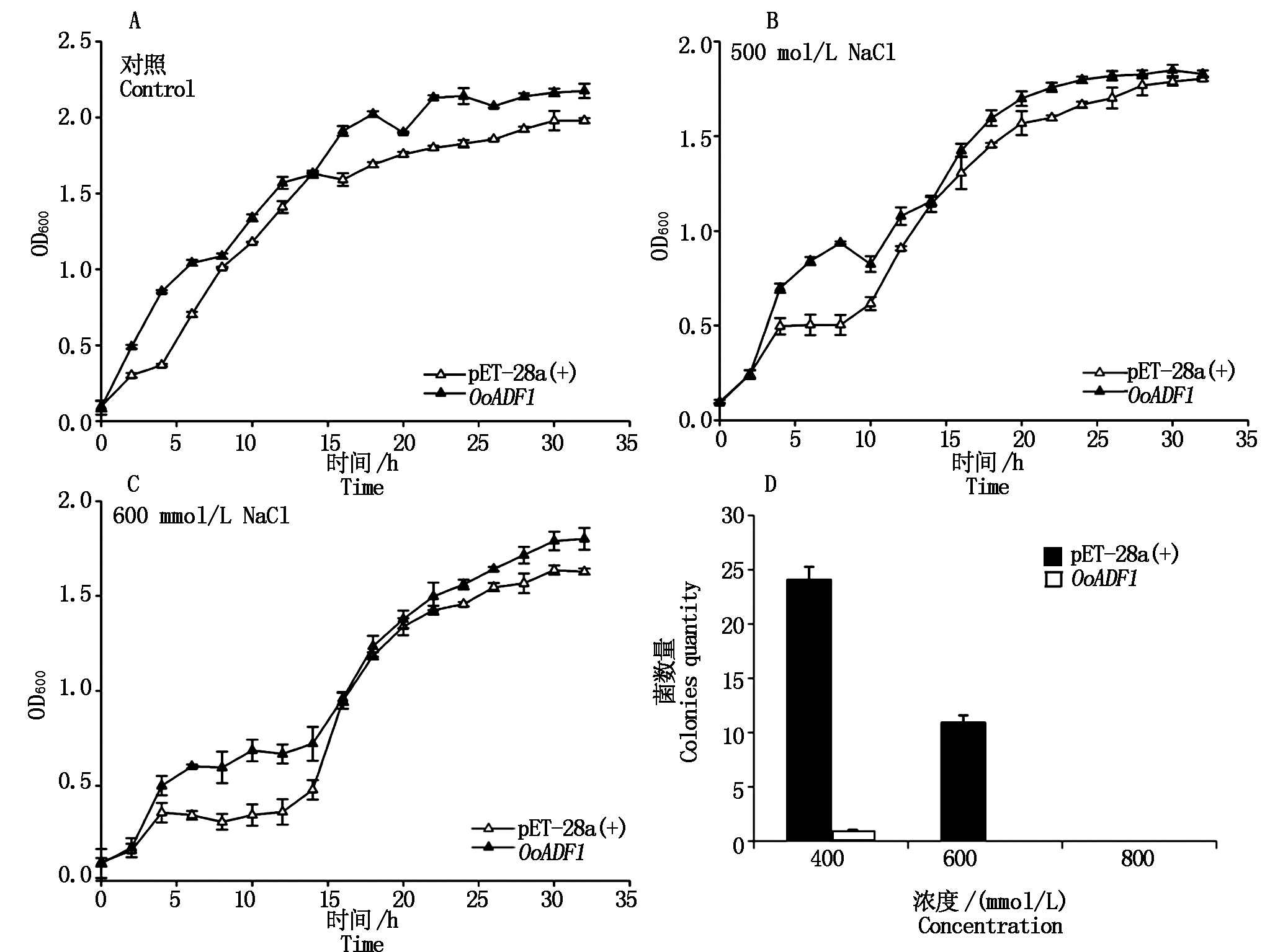
A、B、C.正常、500 mmol/L NaCl和600 mmol/L NaCl下对照菌株和重组pET-28a-OoADF1菌株的生长曲线;D.高盐胁迫下重组pET-28a-OoADF1大肠杆菌菌落数量统计。
A,B,C.Growth curve of contrast and recombination pET-28a-OoADF1 Escherichia coli with 0,500,600 mmol/L NaCl;D.Quantity statistics of colony pET-28a-OoADF1 of bacteria of Escherichia coli.
图6 不同浓度盐胁迫下重组pET-28a-OoADF1大肠杆菌生长曲线
Fig.6 The Escherichia coli growth curve of pET-28a-OoADF1 in different concentration of salt stress
药用野生稻OoADF1的ORF长度为453 bp,编码150个氨基酸残基。OoADF1在四叶期幼苗的根中和抽穗期的叶鞘中表达量最高;OoADF1均在高温、干旱和高盐浓度胁迫时表达量上调较大,其中在干旱和高盐胁迫时表达量较对照分别上调了17.9,40.0倍;OoADF1蛋白分子量约为16 kDa,且在IPTG终浓度为0.2 mmol/L时诱导蛋白表大量最大。经用转入重组子的大肠杆菌BL21(DE3)菌株分别进行500,600 mmol/L NaCl(液体)胁迫处理,经处理之后菌株与对照菌株相比,均能够更好地耐受高浓度NaCl的胁迫,由此表明了OoADF1能够在一定程度上相应盐胁迫使细胞免受高盐的毒害。
参考文献:
[1] 张乃群,李运贤,祝莉莉,等.稻属分类研究综论[J].中国水稻科学,2003,17(4):393-397.
[2] 孙传清,王象坤,吉村淳,等.普通野生稻和亚洲栽培稻遗传多样性的研究[J].遗传学报,2000,27(3):227-234.
[3] 董玉琛.作物野生种质资源及其利用[C]//中国野生稻研究与利用.第一届全国野生稻大会论文集,2003:3-7.
[4] 李容柏,秦学毅.广西野生稻抗病虫性鉴定研究的主要进展[J].广西科学,1994,1(1):83-85.
[5] 陈成斌,李道远.广西野生稻优异种质评价与利用研究进展[J].广西农业科学,1995(5):193-195.
[6] 蓝伟侦,何光存,吴士筠,等.利用水稻C0t-1 DNA和基因组DNA对栽培稻,药用野生稻和疣粒野生稻基因组的比较分析[J].中国农业科学,2006,39(6):1083-1090.
[7] Liu Y G,Nagaki K,Fujita M,et al.Development of an efficient maintenance and screening system for large-insert genomic DNA libraries of hexaploid wheat in a transformation-competent artificial chromosome (TAC) vector[J].The Plant Journal:for Cell and Molecular Biology,2000,23(5):687-695.
[8] Song J,Dong F,Lilly J W,et al.Instability of bacterial artificial chromosome (BAC) clones containing tandemly repeated DNA sequences[J].Genome,2001,44(3):463-469.
[9] Jena K K,Kochert G,Khush G S.RFLP analysis of rice (Oryza sativa L.) introgression lines[J].Theoretical and Applied Genetics,1992,84(5/6):608-616.
[10] 何瑞锋.药用野生稻基因组文库构建与大片段 DNA 转化[D].武汉:武汉大学,2003.
[11] 潘小芬.基于新型TAC载体的药用野生稻文库构建与性能分析[D].广州:华南农业大学,2006:3-14.
[12] 刘 蕊,张欢欢,陈志雄,等.筛选和转化药用野生稻TAC克隆获得耐旱水稻[J].中国农业科学,2014,47(8):1445-1457.
[13] 谭碧兰.药用野生稻抗旱转录谱分析[D].广州:华南农业大学,2014.
[14] 王 楠,吕香玲,李 亮,等.植物肌动蛋白解聚因子ADF的研究进展[J].西北植物学报,2015,35(11):2349-2354.
[15] Bamburg J R.Proteins of the ADF/cofilin family:essential regulators of actin dynamics[J].Annual Review of Cell and Developmental Biology,1999,15(1):185-230.
[16] Maciver S K,Hussey P J.The ADF/cofilin family:actin-remodeling proteins[J].Genome Biology,2002,3(5):reviews,3007.1-3007.12.
[17] Singh B K, Sattler J M, Chatterjee M, et al. Crystal structures explain functional differences in the two actin deploymerization factors of the malaria parasite[J]. The Journal of Biological Chemistry, 2011, 286(32):28256-28264.
[18] Wong W,AI Webb, Maya A Olshina, et al. A mechanism for actinfilament severing by malaria parasite actin depolymerizing factor 1 via a low affinity binding interface[J].Biol Chem,2014,289(7):4043-4054.
[19] Huang Y C,Huang W L,Hong C Y,et al.Comprehensive analysis of differentially expressed rice actin depolymerizing factor gene family and heterologous overexpression of OsADF3 confers Arabidopsis thaliana drought tolerance[J].Rice,2012,5(1):33.
[20] 叶 佳.低温胁迫下拟南芥肌动蛋白解聚因子ADF5的功能研究[D].甘肃:兰州大学,2010.
[21] Clément M,Ketelaar T,Rodiuc N,et al.Actin-depolymerizing factor2-mediated actin dynamics are essential for root-knot nematode infection of Arabidopsis[J].The Plant Cell,2009,21(9):2963-2979.
[22] Fu Y,Duan X,Tang C,et al.TaADF7,an actin-depolymerizing factor,contributes to wheat resistance against Puccinia striiformis f.sp. tritici[J].The Plant Journal :for Cell and Molecular Biology,2014,78(1):16-30.
[23] Henty-Ridilla J L,Li J,Day B,et al.ACTIN DEPOLYMERIZING FACTOR4 regulates actin dynamics during innate immune signaling in Arabidopsis[J].The Plant Cell,2014,26(1):340-352.
[24] 陈 琼, 黄善金, 于 荣. 植物微丝骨架动态变化的调节[J]. 植物生理学报, 2011, 47(1): 18-26.
[25] Zheng Y,Xie Y,Jiang Y et al. Arabidopsis actin-depolymerizing factor7 severs actin filaments and regulates catin cable turnover to promote normal pollen tube growth[J].Plant Cell, 2013,5: 3405-3423.
[26] Dong C H, Hong Y. Arabidopsis CDPK6 phosphorylates ADF1 at N-terminal serine 6 predominantly[J]. Plant Cell Reports, 2013, 32(11): 1715-1728.
[27] Fan T T, Ni J J, Dong W C, et al. Effect of low temperature on profilins and ADFs transcription and actin cytoskeleton reorganization in Arabidopsis[J].Biol Plant,2015, 59(4): 793-796.
[28] Fan T W, Cao S. Heat stress induces actin cytoskeletal reorganization and transcript profiles of vegetative profilins and actin deploy merizing factors(ADFs) in Arabidopsis[J].Acta Physiol plant,2016,38:37.
[29] Zhao S, Jiang Y, Zhao Y, et al. CaseinKINASE1-LIKE PROTEIN2 regulates actin filament stability and stomatal closure via phosphorylation of actin depolymerizing factor[J].Plant Cell ,2016,28(6): 1422-1439.
[30] Samayoa L F,Malvar R A,Olukolu B A,et al.Genome-wide association study reveals a set of genes associated with resistance to the Mediterranean corn borer (Sesamia nonagrioides L.) in a maize diversity panel[J].BMC Plant Biology,2015,15(1):35.
[31] Kijima S T, Hirose K, Kong S G, et al. Distinct biochemical properties of Arabidopsis thaliana actin isoforms[J].Plant Cell Physiol, 2016,57(1): 46-56.
[32] Gunning P W, Ghoshdastider U, Whitaker S, et al. The evolution of compositionally and functionally distinct actin filaments[J].J Cell Sci, 2015,128(11):2009-2019.
[33] Fu Y, Duan X, Tang C, et al. TaADF7, an actin-depolymerizing factor, contributes to wheat resistance against Puccinia striiformis f. sp. tritici[J]. The Plant Journal: for Cell and Molecular Biology, 2014, 78(1): 16-30.
[34] Li L, Li Y, Song S, et al. An anther development F-box (ADF) protein regulated by tapetum degeneration retardation (TDR) controls rice anther development[J]. Planta, 2015, 241(1): 157-166.
[35] Hong L, Xu L, Ma J X, et al. Cloning and expression analysis of a novel tetratricopeptide repeat gene (TaTPR1) from Triticum L.[J].Journal of Triticeae Crops, 2014, 34(9): 1161-1169.
[36] Feng Y, Liu Q, Xue Q. Comparative study of rice and Arabidopsis actin-depolymerizing factors gene families[J]. Journal of Plant Physiology, 2006, 163(1): 69-79.
[37] Solanke A U,Sharma A K.Signal transduction during cold stress in plants[J].Physiology and Molecular Biology of Plants:an International Journal of Functional Plant Biology,2008,14(1/2):69-79.
[38] Drobak B K,Franklin-Tong V E,Staiger C T .The role of the actin cytoskeleton in plant cell signaling[J].New Phytol,2004,163(1):13-30.
[39] Ali G M,Komatsu S.Proteomic analysis of rice leaf sheath during drought stress[J].Journal of Proteome Research,2006,5(2):396-403.
[40] Yan S,Tang Z,Su W,et al.Proteomic analysis of salt stress-responsive proteins in rice root[J].Proteomics,2005,5(1):235-244.
[41] Chen C W,Yang Y W,Lur H S,et al.A novel function of abscisic acid in the regulation of rice (Oryza sativa L.) root growth and development[J].Plant & Cell Physiology,2006,47(1):1-13.