
起始密码子、终止密码子和3′UTR区的终止信号用下划线标记。The start codon, stop codon and termination signals of 3′UTR regionare underlined.
图1 StBAG3基因的核酸序列和氨基酸序列
Fig.1 The nucleotide sequence and amino acid sequence of StBAG3
摘要:为了研究马铃薯内源BAG基因在晚疫病抗性建立中的作用,利用拟南芥和水稻的BAG基因保守序列,在马铃薯基因库中比对获得马铃薯内源StBAG3的基因序列。以StBAG3基因序列为模板设计引物,通过RT-PCR克隆得到了StBAG3基因cDNA序列。序列分析的结果表明,该基因开放阅读框为1 026 bp,编码341个氨基酸。蛋白二级结构预测结果表明,StBAG3具有UBQ和BAG 2个保守功能域。StBAG3基因的表达谱分析结果显示,不同马铃薯品种中StBAG3基因表达水平存在差异,其中在冀张薯12号中表达量最高,而夏坡蒂中表达量最低。该基因在马铃薯不同组织中表达量测定结果表明,马铃薯茎中的表达水平最高,老叶中表达水平最低。接种晚疫菌后,StBAG3能够被显著上调并在接种48 h后达到最高值,预示着StBAG3基因在马铃薯晚疫病抗性建立过程中具有一定的调控作用。
关键词:马铃薯;StBAG3;基因克隆;晚疫菌;表达
马铃薯(Solanum tuberosum L.)是世界第四大粮食作物[1],其种植面积和产量仅次于小麦、水稻和玉米[2]。目前,我国马铃薯的种植面积和总产量居世界首位[3],而内蒙古是我国重要的马铃薯种薯、商品薯和加工专用薯的生产基地。2015年,我国农业部正式将马铃薯作为主粮产品进行产业化开发[4]。因此,保障马铃薯产业的安全是从事马铃薯研究人员的重要任务。
马铃薯种植过程中会受到多种病虫害的危害,其中以马铃薯晚疫病危害最为严重[5]。由于马铃薯主栽品种缺乏对晚疫病的抗性,导致了化学药剂成为防控晚疫病的主要措施[6]。高频率大剂量的使用杀菌剂,一方面,增加了晚疫病菌对杀菌剂的抗性[7-10],另一方面,过度使用化学杀菌剂容易导致土壤板结,增加CO2的排放,从而对生态环境产生负面影响[11]。因此,采用分子生物学技术进行抗病育种是未来保障马铃薯产业持续稳定发展的关键。
BAG蛋白(Bcl-2 associated athanogene)是一类多功能蛋白家族,最初从哺乳物克隆得到,由于这类蛋白能够与抗凋亡蛋白Bcl-2结合并促进细胞生存,因而被命名为Bcl-2 关联基因[12]。目前,在酵母、动物、植物中都发现了BAG蛋白[13-15]。相比于动物,植物中的BAG基因功能研究较少[13]。研究者最早从拟南芥中克隆得到植物BAG基因并证明了它能够调控植物的抗逆反应[16];如超量表达AtBAG4的烟草表现出对紫外胁迫、盐胁迫、干旱胁迫、氧胁迫的多种抗性[17]。敲除AtBAG4的拟南芥突变体与野生型突变体相比,出现提前开花,营养期和生殖期缩短,根和花序多分支的现象[16]。但是,在拟南芥过表达来源于葡萄的BAG基因HSG1也会出现提前开花情况,并表现出对高温胁迫的抗性[18]。也有一些有关BAG基因参与植物抗病过程的报道,如敲除AtBAG6的拟南芥突变体更易被腐生性真菌侵染,过表达AtBAG6的拟南芥突变体则表现出植株矮小、叶片损伤症状[17],同时转基因植株细胞中胼胝质含量提高的结果预示着AtBAG6可能是通过调控植株的过敏反应来加强拟南芥生物胁迫抗性[16]。类似的,在拟南芥中超量表达来源于草莓的BAG6基因FvBAG6能够提高对炭疽病的抗性水平[19]。目前,水稻中发现6个BAG蛋白的同源物,它们在水稻对各种生物胁迫的反应中也具有一定的调控作用[20]。而有关马铃薯中的BAG基因的研究还未见报道。
通过分析拟南芥和水稻中已经克隆得到的AtBAG4和OsBAG4的蛋白序列,找到BAG蛋白的功能域保守序列,以此序列在马铃薯基因库中比对得到StBAG3的基因序列。以此序列为模板设计引物,通过PCR克隆得到StBAG3基因。通过ExPASy对StBAG3基因编码的蛋白氨基酸序列和相应的蛋白结构进行了预测。同时,还对BAG基因的表达谱以及接种晚疫病菌后该基因转录水平进行了研究。该研究结果填补了BAG基因在马铃薯中的研究空白,初步探究了StBAG3在马铃薯晚疫病抗性建立过程中的作用。
1.1 试验材料
1.1.1 供试的马铃薯材料 供试的马铃薯为无菌试管苗克新1号、冀张薯12、夏坡蒂、大西洋、费乌瑞它、底西瑞。试管苗在人工气候室的培养条件为光照16 h,25 ℃,黑暗8 h,18 ℃。提取RNA所用马铃薯在人工气候室培养14 d即可取样。
1.1.2 供试载体与菌株 克隆载体pEASY-Blunt Simple Cloning Kit(卡纳霉素抗性)和大肠杆菌感受态Trans-T1购自全式金公司(北京);马铃薯晚疫菌由内蒙古农业大学植物分子病理实验室保存,其交配型是A1型。
1.1.3 酶及试剂 高保真酶PrimeSTAR HS DNA Polymerase、RNA提取试剂盒RNAiso Reagent和PCR产物回收试剂盒均购自TaKaRa公司(北京)。反转录试剂盒购自Vazyme公司(南京),PCR产物纯化回收试剂盒购自Axygen公司(北京)。
1.1.4 引物设计 根据StBAG3序列和GAPDH序列设计引物,引物由Sagon公司(上海)合成。分别为:BAG3-F:5-′CATGCCATGGATGATGCGAATGAAGACC-3′;BAG3-R:5-′CGGACTAGTCGAGCAAATCCCAATTG-3′;GAPDH-F:5-′TGGACAATGGAAGCACCATGAGC-3′;GAPDH-R:5-′TGCTTGACCTGCTGTCACCAAGA-3′。
1.2 试验方法
1.2.1 RNA的提取和cDNA合成 利用RNAiso(TaKaRa公司)试剂提取生长14 d的马铃薯幼苗叶片总RNA,cDNA第一链合成参照Vazyme公司的反转录试剂盒说明书。
1.2.2 StBAG3基因克隆 以cDNA为模板,BAG3-F和BAG3-R为引物进行PCR扩增。PCR程序为:98 ℃预变性10 min;94 ℃变性10 s,55 ℃退火15 s,72 ℃延伸70 s,循环30次,最后4 ℃终止反应。利用Axygen公司的PCR产物纯化回收试剂盒对PCR产物进行纯化,连接到中间载体pEASY-Blunt Simple Cloning Kit上,将中间载体转化至大肠杆菌,筛选阳性克隆后,送美吉生物公司测序。
1.2.3 StBAG3基因表达谱分析 提取不同马铃薯品种(克新1号、冀张薯12、夏坡蒂、大西洋、费乌瑞它、底西瑞)叶片和大西洋、夏坡蒂不同组织(老叶、嫩叶、茎、根)的总RNA,采用半定量RT-PCR方法,以GAPDH基因为内参,分析StBAG3基因相对表达量,PCR程序为:98 ℃预变性10 min;94 ℃变性10 s,55 ℃退火15 s,72 ℃延伸70 s,循环30次;最后4 ℃终止反应。利用软件Quantity One分析表达量,根据PCR产物条带的强弱,以StBAG3/GAPDH表达StBAG3基因相对表达量。
1.2.4 接种晚疫菌后StBAG3基因表达量分析 将生长30 d的马铃薯晚疫菌的菌丝用接种针刮入装有无菌水的离心管中反复摇晃冲洗,4 ℃下放置3 h诱导游动孢子释放,调节孢子浓度至1×106个/mL。取10 μL孢子液接种在离体马铃薯叶片背面,并放置在光照培养箱中进行培养(光照16 h,25 ℃,黑暗8 h,20 ℃)。分别在接种后0,12,24,36,48,72 h取样检测StBAG3基因相对表达量。
2.1 StBAG3基因的克隆
通过对AtBAG4和OsBAG4的蛋白序列比对分析在马铃薯基因库中找到StBAG3基因,该基因全长为2 074 bp,开放阅读框为1 026 bp,编码341个氨基酸(图1)。通过RT-PCR的方法克隆得到StBAG3的cDNA片段,cDNA片段长度约1 000 bp(图2)。测序结果表明,克隆得到的cDNA片段与StBAG3同源性为100%(图3)。

起始密码子、终止密码子和3′UTR区的终止信号用下划线标记。The start codon, stop codon and termination signals of 3′UTR regionare underlined.
图1 StBAG3基因的核酸序列和氨基酸序列
Fig.1 The nucleotide sequence and amino acid sequence of StBAG3
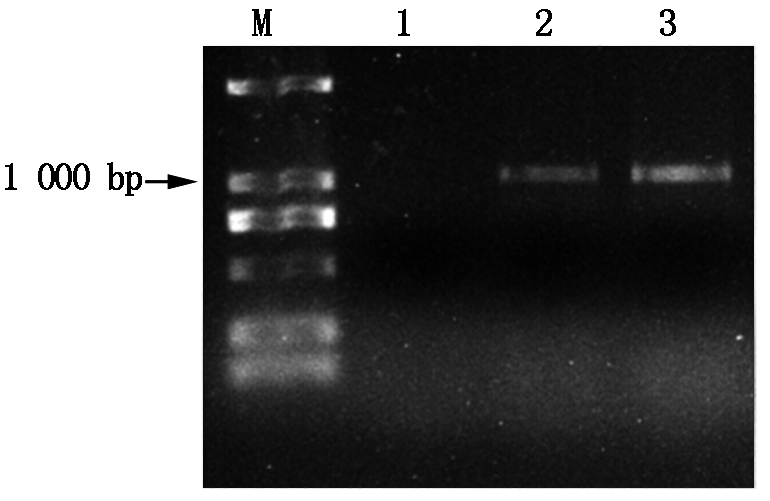
M.D2000 Marker;1.阴性对照;2、3.不同样本。M.D2000 Marker;1.Negative control;2,3.Different samples.
图2 StBAG3 cDNA克隆
Fig.2 Amplification of a cDNA fragment of StBAG3
2.2 不同物种来源的StBAG基因的聚类分析
为了进一步确定StBAG3和其他物种同源基因的遗传距离,选取了番茄、烟草、拟南芥、水稻、小麦和首次发现BAG蛋白的动物家鼠的BAG蛋白与马铃薯的StBAG3蛋白进行聚类分析(图4)。结果表明StBAG3与来自于番茄SlBAG1、SlBAG3和烟草的NtBAG1基因遗传距离最近,其次为拟南芥的AtBAG1和AtBAC3基因,与水稻OsBAG1和小麦TaBAG3遗传距离最远。
2.3 StBAG3蛋白结构的预测
利用NCBI网站中的Conserved Domain Search Service(CD Search)工具对StBAG3基因编码的蛋白结构进行了预测,结果表明,和拟南芥AtBAG4以及水稻的OsBAG4蛋白结构一样,StBAG3也有2个保守的功能域UBQ domain和BAG domain(图5)。二级结构的预测结果表明,StBAG3和其他物种的同源蛋白一样含有BAG功能域。信号肽预测结果显示,

图3 克隆片段与StBAG3同源性比较
Fig.3 Sequence alignment between PCR fragment and StBAG3
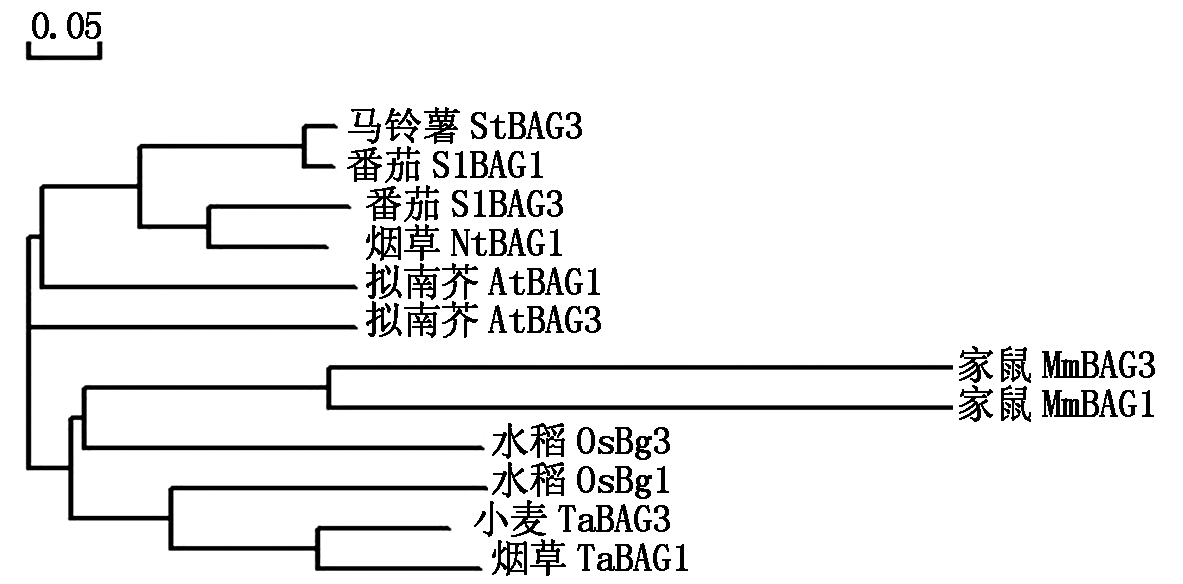
图4 不同物种来源BAG蛋白cDNA序列同源性比较
Fig.4 Alignment of different BAG proteins on cDNA sequence
StBAG3无信号肽。亲水性和疏水性分析显示StBAG3蛋白是一种胞内可溶性蛋白。蛋白的空间构象预测结果显示,该蛋白在细胞核、细胞质、线粒体中均存在。
2.4 不同马铃薯中StBAG3表达量分析
StBAG3基因在6个马铃薯品种(克新1号、冀张薯12、夏坡蒂、大西洋、费乌瑞它、底西瑞)中表达水平检测结果表明,该基因在供试的6个品种中都有表达,但表达量不同。其中,冀张薯12中表达量最高,夏坡蒂StBAG3基因表达量最低,其余4个品种中StBAG3的表达量介于上述2个品种之间(图6)。

图5 AtBAG4、OsBAG4和StBAG3的功能域比较
Fig.5 The functional domain alignment of AtBAG4,OsBAG4 and StBAG3
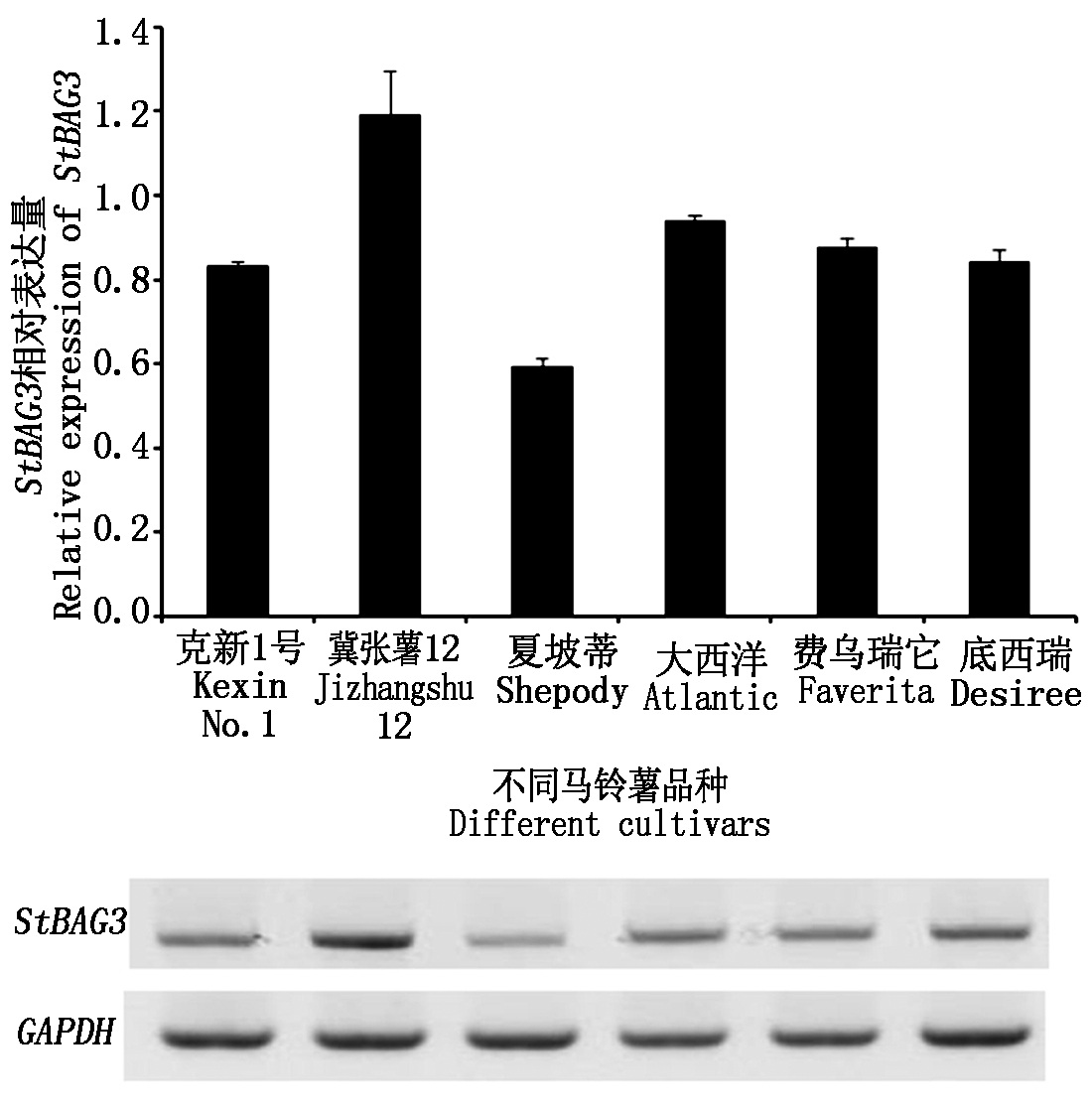
图6 不同马铃薯品种中内源StBAG3相对表达量
Fig.6 Endogenous StBAG3 expression level in different potato cultivars
2.5 马铃薯不同组织中StBAG3表达量分析
以大西洋和夏坡蒂的老叶、嫩叶、茎、根为样本,检测不同组织中StBAG3基因相对表达量,结果表明,StBAG3在供试的2个马铃薯品种的不同组织的表达模式非常相似,即StBAG3基因的相对表达量由高到低依次是:茎、嫩叶、根、老叶(图7)。
2.6 马铃薯叶片中StBAG3在接种前后转录水平的变化
为了研究StBAG3在马铃薯抗晚疫病过程中的功能,用晚疫菌接种不同的马铃薯品种(夏坡蒂和冀张薯12)并在不同时间点取样测定StBAG3的相对表达量。结果表明,接种晚疫菌后,2个不同马铃薯中StBAG3基因的表达量均被上调,并在接种48 h后达到峰值,随后开始下降。相比较而言,冀张薯12中StBAG3基因接种后上调的幅度要高于夏坡蒂(图8)。
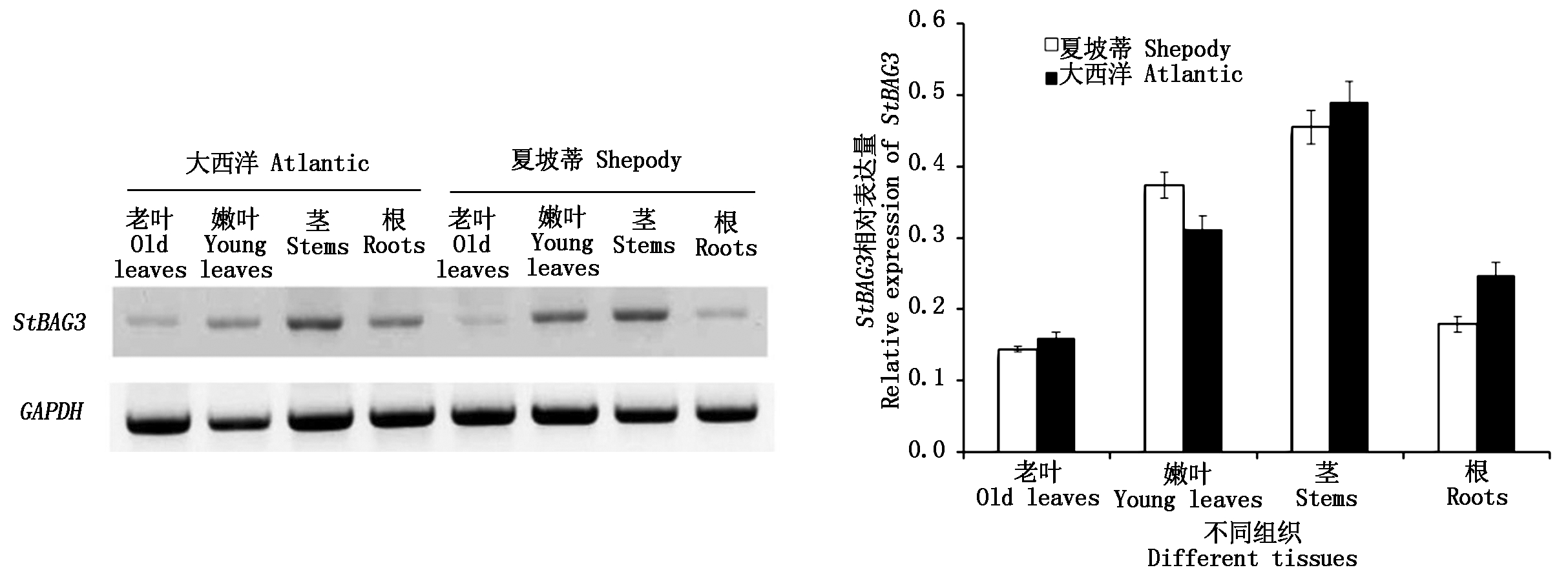
图7 马铃薯不同组织中StBAG3基因的相对表达量
Fig.7 Relative expression of StBAG3 by densitometric analysis in different tissues of different potato cultivars
本试验通过分析拟南芥和水稻的BAG蛋白得到2个保守的功能域BAG功能域和UBQ功能域,利用BAG功能域的保守序列,在马铃薯基因库中比对获得马铃薯内源StBAG3基因序列。利用NCBI网站中的Conserved Domain Search Service(CD Search)工具对StBAG3基因编码的蛋白结构进行了预测,结果表明,和拟南芥AtBAG4以及水稻的OsABG4蛋白结构一样,StBAG3也有2个保守的功能域UBQ domain和BAG domain。氨基酸序列聚类分析结果表明,StBAG3与番茄BAG蛋白(SlBAG1、SlBAG3)和烟草BAG蛋白(NtBAG1)亲缘关系较近,预示着,BAG蛋白能在马铃薯、番茄和烟草中发挥相似的作用。
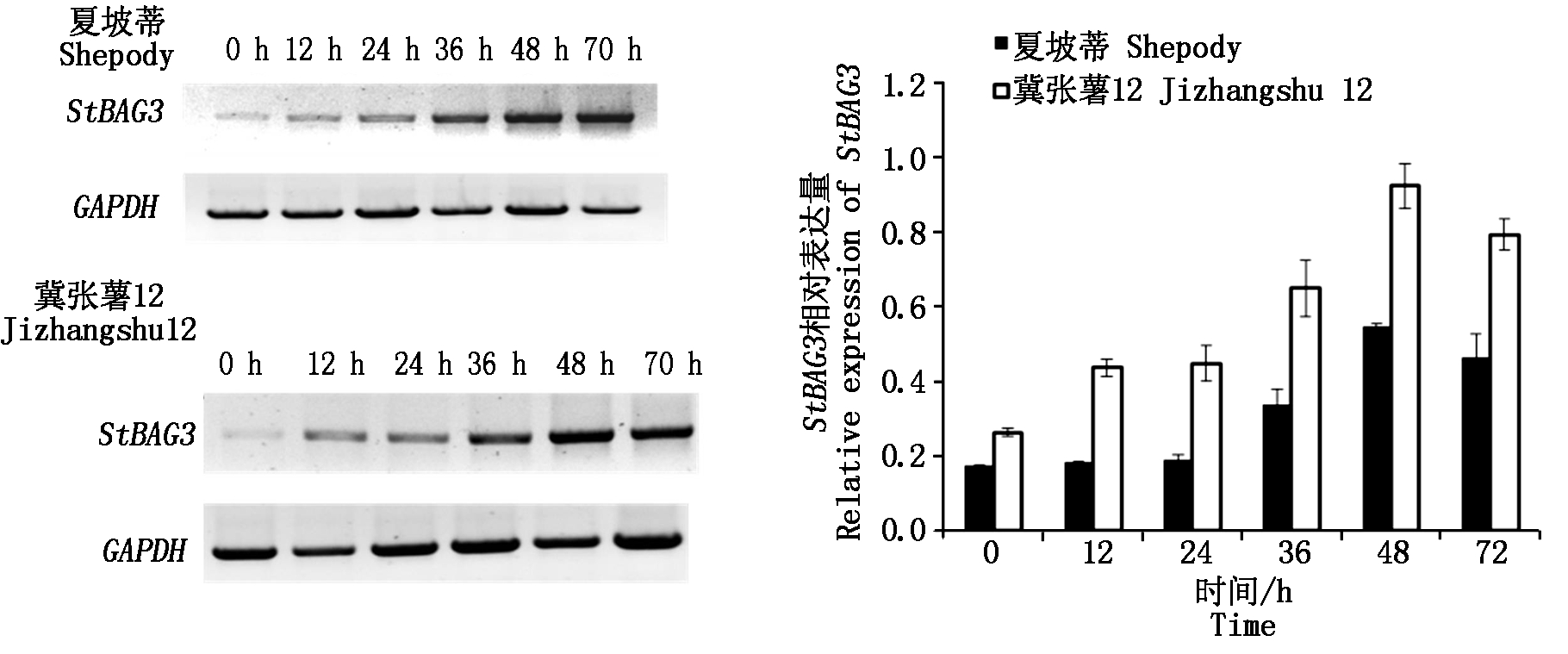
图8 不同晚疫菌接种时间StBAG3的表达量
Fig.8 The quantification of the expression level of StBAG3 inoculated with P.infestans at different time point
StBAG3基因在不同品种的马铃薯和马铃薯的不同组织细胞中都有表达,但是其表达水平有明显的差异,说明马铃薯中的StBAG3可能参与调节马铃薯的生长发育过程。此外,StBAG3基因在茎和嫩叶的相对表达量较高,说明StBAG3极有可能调控马铃薯的茎和叶片的生长和分化。不同品种的马铃薯在受到马铃薯晚疫菌的诱导后,StBAG3基因的表达量都有上升,说明StBAG3可能参与调控马铃薯抗晚疫病过程,这一初步的结果预示着StBAG3可能会成为马铃薯的抗性育种中可以被利用的抗性基因。然而,StBAG3在马铃薯抗晚疫病过程中如何发挥其调控作用还有待进一步研究。
在人体中,BAG蛋白被证明参与肿瘤发生[21]、HIV侵染[22-23]和帕金森综合征的发生[24],因此,对动物细胞中BAG蛋白的功能研究比较充分。相比之下,对植物中BAG蛋白的同源物的功能并未完全了解[13]。植物中的BAG蛋白最早在拟南芥中发现[16],水稻也已经发现了BAG蛋白的同源物[20],目前尚未有关于马铃薯BAG蛋白的研究报道。本研究首次克隆出StBAG3基因,并证明StBAG3能够被晚疫菌诱导表达,说明StBAG3可能参与调控马铃薯抗晚疫病过程。类似的,拟南芥[17]和草莓[19]中的BAG基因被证实能提高植物对病原菌的抗性水平,预示着植物BAG基因可能与植物的抗病性有关。StBAG3对马铃薯晚疫病抗性是正向调控还是负向调控及StBAG3在马铃薯抗晚疫病过程中如何发挥其调控作用还有待进一步研究。
参考文献:
[1] Na R,Zhang Z,Yu X,et al.ROS and salicylic acid(SA)play roles on the resistance establishment of the potato cultivar Zihuabai to Phytophthora infestans[J].Journal of Plant Diseases and Protection,2012,119(5):191-199.
[2] 魏延安.世界马铃薯产业发展现状及特点[J].世界农业,2005(3):29-32.
[3] 卢肖平.马铃薯主粮化战略的意义、瓶颈与政策建议[J].华中农业大学学报:社会科学版,2015(3):1-7.
[4] 屈冬玉,金黎平,谢开云.中国马铃薯产业10年回顾[M].北京:中国农业科学技术出版社,2010.
[5] Haverkort A J,Struik P C,Visser R,et al.Applied biotechnology to combat late blight in potato caused by Phytophthora infestans[J].Potato Research,2009,52(3):249-264.
[6] Haverkort A J,Struik P C,Visser R ,et al.Applied biotechnology to combat late blight in potato caused by Phytophthora infestans[J].Potato Research,2009,52(3,SI):249-264.
[7] Cooke D E,Cano L M,Raffaele S,et al.Genome analyses of an aggressive and invasive lineage of the Irish potato famine pathogen[J].PLOS Pathogens,2012,8(10):e1002940.
[8] Schepers H,Kessel G J T,Evenhuis A,et al.Reduced efficacy of fluazinam against some Green 33-isolates of Phytophthora infestans in Europe[C]//Abstracts 17th International Reinhardsbrunn Symposium.Friedrichroda:2013:102.
[9] 张军辉.植物保护与农产品质量安全[J].河南农业,2010(19):18.
[10] 李 凯,袁 鹤.植物病害生物防治概述[J].山西农业科学,2012,40(7):807-810.
[11] Haverkort A J,Hillier J G.Cool farm Tool-potato:model description and performance of four production systems[J].Potato Research,2011,54(4,SI):355-369.
[12] Takayama S,Xie Z,Reed J C.An evolutionarily conserved family of Hsp70/Hsc70 molecular chaperone regulators[J].Journal of Biological Chemistry,1999,274(2):781.
[13] Kabbage M,Dickman M B.The BAG proteins:a ubiquitous family of chaperone regulators[J].Cellular and Molecular Life Sciences,2008,65(9):1390-1402.
[14] 吴曙辉,江孝清.多功能蛋白BAG-1的研究进展[J].医学综述,2014,20(7):1183-1186.
[15] 魏瑞敏,谢玲玲,欧阳娴,等.植物 BAG 蛋白家族的结构及其功能特征综述[J].湖南农业科学,2016(9):115-120.
[16] 房莎莎.植物BAG蛋白的结构和功能研究[D].天津:南开大学,2013.
[17] Doukhanina E V,Chen S,Van D E,et al.Identification and functional characterization of the BAG protein family in Arabidopsis thaliana[J].Journal of Biological Chemistry,2006,281(27):18793.
[18] Kobayashi M,Takato H,Fujita K,et al.HSG1,a grape Bcl-2-associated athanogene,promotes floral transition by activating CONSTANS expression in transgenic Arabidopsis plant[J].Molecular Biology Reports,2012,39(4):4367-4374.
[19] 张庆雨.草莓BAG6基因在植物炭疽病抗性中的作用研究[D].杨凌:西北农林科技大学,2014.
[20] Rana R M,Dong S,Ali Z,et al.Identification and characterization of the Bcl-2-associated athanogene(BAG)protein family in rice[J].African Journal of Biotechnology,2012,11(1):88-98.
[21] Zhu H,Wu W,Fu Y,et al.Overexpressed bag3 is a potential therapeutic target in chronic lymphocytic leukemia[J].Annals of Hematology,2014,93(3):425-435.
[22] Bruno A P,De Simone F I,Iorio V,et al.HIV-1 tat protein induces glial cell autophagy through enhancement of BAG3 protein levels[J].Cell Cycle,2014,13(23):3640-3644.
[23] Rosati A,Leone A,Del Valle L,et al.Evidence for BAG3 modulation of HIV-1 gene transcription[J].Journal of Cellular Physiology,2007,210(3):676-683.
[24] Hoang Q Q.Pathway for parkinson disease[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(7):2402-2403.
Cloning of cDNA StBAG3 and Induced Express by Pathogen of Potato Late Blight
Abstract:In order to study the functions of StBAG3 during the establishment of potato resistance to Phytophthora infestans (P.infesans),endogenous StBAG3 gene was cloned from potato through PCR with primers devised based on the conserved sequence of BAG cloned from Arabidopsis and rice.The sequence analysis results showed the open reading frame of StBAG3 gene was 1 026 bp and encodes 341 amino acids.The protein secondary structure prediction indicated that the StBAG3 contains two conserved domains,UBQ and BAG.The expression level of StBAG3 gene in different potato cultivars was variable and Jizhanghsu 12 showed the highest level,whereas,the expression level in Shepody was the lowest one.Also,the expression profile in different tissues of potato was also variable,and it showed highest in stem,but,the lowest in the old leaves.After inoculation with P.infestans,the StBAG3 gene expression was significantly induced and reached to the highest level at 48 h,indicating StBAG3 is involved in the establishment of potato resistance against potato late blight.
Key words:Potato;StBAG3;Gene clone;P.infestans; Expression
收稿日期:2017-07-01
基金项目:国家自然科学基金项目(31260425)
中图分类号:Q812;Q87
文献标识码:A
文章编号:1000-7091(2017)05-0142-07
doi:10.7668/hbnxb.2017.05.022