湖南省健康猪群中不同基因型猪博卡病毒流行性及进化分析
屈泰龙,李润成,罗斌宇,葛 猛,严美君,胡辉灿,余兴龙
(湖南农业大学 动物医学院,湖南 长沙 410128)
摘要:为了解猪博卡病毒在不同年龄健康猪群中的感染情况,通过对GenBank登录的猪博卡病毒基因序列分析设计2对引物可分别扩增PBoV1/2的部分NS1基因和PBoV3/4/5的部分VP1基因。提取2016年8-12月收集自湖南5个集约化猪场2~20周龄猪共430份肛门拭子样品的DNA并进行PCR检测。PBoV阳性率为64.6%(278/430),PBoV1/2阳性率为27.2%(117/430),PBoV3/4/5阳性率为45.1%(194/430),混合感染率为7.7%(33/430),PBoV3/4/5阳性率显著高于PBoV1/2阳性率(P=0.034)。PBoV1/2在 2~10周检出率高于其他周龄,但是与其他周龄猪体内检出率统计分析无显著性差异,PBoV3/4/5主要感染8~16周猪,与4周以内猪差异显著,与其他猪群差异不显著。对各型的核苷酸与参考序列核苷酸相似性分析显示PBoV1/2之间的平均相似度为85.4%,PBoV3/4/5之间的平均相似度为67.2%。PBoV在健康猪群中流行广泛且存在共同感染现象,对猪的健康尤其是肠道微生物平衡可能存在潜在影响。
关键词:猪博卡病毒;流行性;进化分析;混合感染;致病性
猪博卡病毒(Porcine bocavirus, PBoV)属于细小病毒科博卡病毒属,主要感染猪,2009年首次从患有仔猪断奶后多系统衰竭综合征的仔猪体内鉴定[1]。随后,在许多国家均有报道猪群受该病毒感染,并获得了全基因组或者部分基因[2-4]。根据碱基相似性将PBoV分为5个基因型,通过基因差异设计了引物用于PCR检测,加快了该病毒的流行病学调查[5-6]。目前对于该病毒的调查多集中在发病猪,如腹泻、咳嗽等,阳性率不等[7-10],为该病的流行病学规律提供了一定的基础知识。有部分研究人员对健康猪进行了PBoV感染情况调查,但是因为调查样本数量太少,因此不能准确说明PBoV在健康猪群中的流行情况[11]。我们在湖南省内调查了5个规模猪场健康猪群中PBoV的流行情况,以期为了解PBoV对猪潜在的影响提供信息。
1 材料和方法
1.1 样品收集
2016年8-12月,于不同猪场采集430份肛门拭子。样品采集于湖南省3个市5个集约化猪场,来自于不同猪群的猪:2~20周(间隔2周采集1次),采样猪均健康,无腹泻症状。A、B、C 3个猪场每个阶段采集8份样本,D和E每个阶段采集10份样本(D场20周龄猪无样本)。采集样品时,每份拭子单独存放于一个灭菌离心管,并于低温条件下运送至湖南农业大学动物医学院病原分子与诊断实验室。
1.2 样品处理和病毒DNA提取
分别向含拭子的离心管中加入500 μL生理盐水,漩涡振荡混匀,于7 500 r/min 离心5 min。取离心后的上清液200 μL采用DNAout kit(北京天恩泽基因科技有限公司)提取DNA,操作步骤按说明书执行。
1.3 引物设计及PCR扩增
下载GenBank内登录的PBoV基因序列,经比对分析后发现在PBoV1/2型的NS1基因和PBoV3/4/5型的VP1基因存在一定的保守区域,在这2处分别设计引物(表1),可对应扩增PBoV1/2型NS1基因和PBoV3/4/5型VP1基因的部分序列。将PBoV1/2、PBoV3/4/5的PCR产物测序经验证后分别构建至pMD19-T载体,并将其做101~108稀释用于PCR方法的敏感性检测;使用以上2对引物分别扩增猪圆环病毒2型(Porcine circovirus 2,PCV2)、猪细小病毒(Porcine parvovirus,PPV)、PEDV(Porcine epidemic diarrhea virus,PEDV)和猪撒佩罗病毒(Porcine sapelovirus,PSV)的DNA或cDNA及PBS;分别使用2对引物对肛门拭子的DNA进行扩增,20 μL PCR反应体系包含:2×Mix 10 μL,10 mmol/L 上下游引物各0.2 μL,DNA模板1 μL,双蒸水补足至20 μL。PCR反应采用如下程序:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,34个循环;72 ℃ 7 min,PCR产物经0.8%琼脂糖凝胶电泳检测。
表1 PBoV1/2和PBoV3/4/5扩增引物信息
Tab.1 Primers information for PBoV1/2 and PBoV3/4/5

引物名称Primersname引物序列 Primerssequence 扩增长度/ntPCRproductlength退火温度/℃AnnealingtemperaturePBoV1/2FAGWCCTACGCCATCAGCAGCATC459ntPBoV1/255.3PBoV1/2RTCCCRCCTGCCAGGGATTGT55.9PBoV3/4/5FGGGTTTTACTATCACTCCA-CAAGAAT549ntPBoV3/4/555.3PBoV3/4/5RAGAGTCAGACTGCAAAGAGTCGAT55.2
1.4 测序及进化分析
将经2对引物扩增为阳性的部分样品DNA经纯化后送Qsingke生物测序,所得序列与GenBank内PBoV1/2型、PBoV3/4/5型序列进行进化分析。将序列经MAFFT软件比对,DAMBE软件进行序列饱和度检测,Jmodeltest程序分析最佳碱基进化模型,根据以上信息用MEGA 6软件选择合适参数构建Maximum likelihood (ML ) tree。
1.5 统计分析
将样本内PBoV1/2型和PBoV3/4/5检测结果汇总于Excel 2010:同一猪场不同周龄样本的检测数据作为一组,共有5组,每组8~10个数据;同一周龄不同猪场样本的检测数据作为一组,共有10组,每组5个数据。数据用单因素方差分析(IBM SPSS Statistics 19软件的)方法进行统计分析,置信区间设置为95%,P<0.05为差异显著。
2 结果与分析
2.1 PCR引物扩增特异性和敏感性
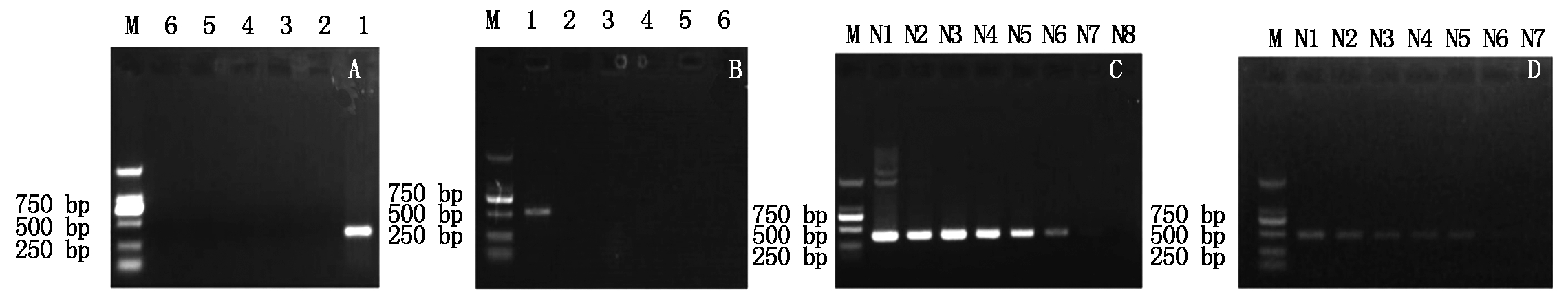
分别使用引物扩增样品及PCV2、PPV、PEDV、PSV的DNA或cDNA及PBS,仅从各自对应的样品中扩增到阳性信号,而其他对照均为阴性(图1-A、B)。将稀释至不同浓度的质粒pMDT-PBV1/2和pMDT-PBV3/4/5分别用PBoV1/2F和PBoV1/2R引物扩增,引物PBoV1/2最低可扩增拷贝数为38 拷贝/mL,PBoV3/4/5最低可扩增拷贝数为94拷贝/mL(图1-C、D)。
2.2 PBoV流行性检测
PBoV阳性率为64.6%(278/430),PBoV1/2阳性率为27.2%(117/430),PBoV3/4/5阳性率为45.1%(194/430),混合感染率为7.7%(33/430),PBoV3/4/5阳性率显著高于PBoV1/2(P=0.034)。
将检测数据按照不同周龄和不同猪场总阳性率进行统计分析,PBV1/2周龄总阳性率为2.9%~43.2%,其中2周龄仔猪样本内检出率最高为43.2%(19/44),随着年龄的增长,阳性率呈现渐低趋势,至20周阳性率为2.9%(1/43)。对不同猪场的检测结果进行分析,阳性率达到30%以上的猪场有A(36.3%,29/80)和B(32.5%,26/80),其余猪场阳性率从高到低依次为C(28.7%,23/80),D(22.2%,20/90)和E(25.0%,25/100)。将各个养殖场阳性率和周龄阳性率分别进行单因素方差分析,结果各个养殖场之间PBoV1/2阳性率无显著差异,周龄差异显著性分析显示,除20周阳性率显著低于2~10周龄检出率外,其他各周龄之间无显著差异,详细数据见表2。
A、B分别为PBoV1/2、PBoV3/4/5引物特异性检测结果:M.DL2000;1.样本DNA;2.PBS;3.PCV2;4.PPV;5.PEDV;6.PSV。C、D分别为PBoV1/2、PBoV3/4/5引物扩增梯度稀释质粒结果:M.DL2000;N1~N8分别为质粒101~108稀释倍数;PBoV1/2引物最高可扩增稀释倍数为107;含拷贝数为38拷贝/mL;PBoV3/4/5引物最高可扩增稀释倍数为106;含拷贝数为94拷贝/mL。
A,B are specify amplification result of primer for PBoV1/2 and PBoV3/4/5,respectively: M.DNA Ladder 2000;1.Target DNA (PBov1/2 or PBoV3/4/5);2.PBS;3.PCV2;4.PPV;5.PEDV;6.PSV.C,D.Amplification results using primers for PBoV1/2 and PBoV3/4/5 with gradient dilution plasmid:M.DNA Ladder 2000;N1-N8.Dilutions of Plasmid with target gene from 101-108,the minimum amplification copies number for PBoV1/2 and PBoV3/4/5 are 38,94 copies/mL,respectively.
图1 PBoV引物特异性及敏感性检测
Fig.1 Specify and sensitivity of primers for PBoV amplification
表2 不同猪群中PBoV1/2 阳性率
Tab.2 The positive rate of PBoV1/2 in different pig group %
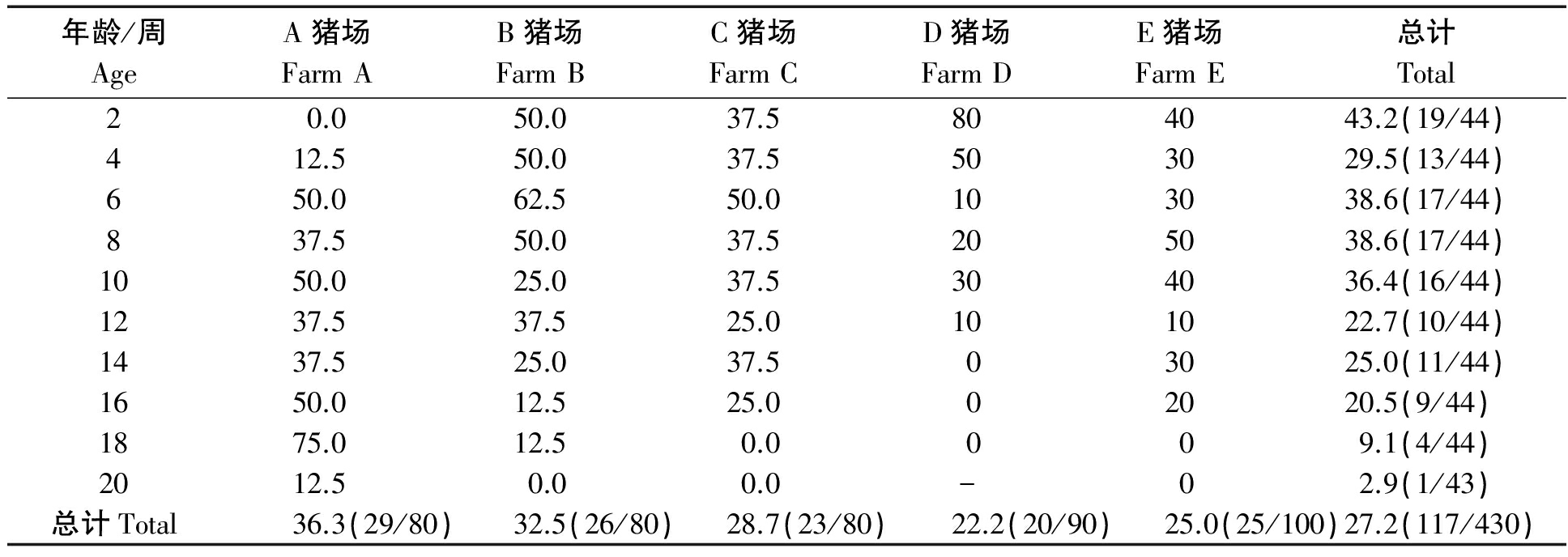
年龄/周AgeA猪场FarmAB猪场FarmBC猪场FarmCD猪场FarmDE猪场FarmE总计Total20.050.037.5804043.2(19/44)412.550.037.5503029.5(13/44)650.062.550.0103038.6(17/44)837.550.037.5205038.6(17/44)1050.025.037.5304036.4(16/44)1237.537.525.0101022.7(10/44)1437.525.037.503025.0(11/44)1650.012.525.002020.5(9/44)1875.012.50.0009.1(4/44)2012.50.00.0-02.9(1/43)总计Total36.3(29/80)32.5(26/80)28.7(23/80)22.2(20/90)25.0(25/100)27.2(117/430)
PBoV3/4/5周龄总阳性率为4.5%~68.2%,总阳性率从2周龄最低(4.5%,2/44)至8周龄时达到最高(68.2%,30/44),随后阳性率呈现下降趋势,20周龄样本检出率为32.3%(11/43)。将不同周龄的数据进行统计分析,根据SPSS统计数据差异性分析将数据分为3组,1组:8,10,12,16周;2组:6,14,18,20周;3组:2,4周。3个小组各组内数据无显著差异,1组内各年龄段检测数据与2组内各年龄段检测数据,2组内各年龄段检测数据与3组内各年龄段检测数据之间无显著差异,但1组内各年龄段检测数据与3组各年龄段检测数据之间差异显著,1组、2组之间无统计学差异,但1组数据平均值高于2组,详见表3。
根据不同猪场总阳性率统计显示D(71.1%,64/90)和C(66.3%,53/80)最高,随之B(30.0%,24/80)、E(29.0%,29/100)和A(26.3%,21/80)逐渐降低。D和C 2个猪场内阳性率显著(P<0.05)高于B、E和A猪场阳性率(表4)。
2.3 进化分析
将扩增样品所得序列分别与GenBank内下载的序列进行统计分析,经DAMBE软件分析,Iss数值小于Iss.cSym,且差异显著(P<0.05,表5),碱基序列进化度未饱和,可做进化分析。将试验所得序列与参考序列构建ML进化树(图2),2对引物扩增所得序列分别与相对应的参考序列归为一支,PBV1/2试验序列与参考序列平均碱基相似性为85.4%,除了与参考序列JN400876(碱基相似性42.3%~46.7%)距离较远,与其他多数PBoV1/2型参考序列亲缘关系较近(碱基相似性80.1%~99.6%)。试验所得序列之间平均碱基相似性为94%,彼此之间的碱基相似性为83.7%(Y6-1与2-1)~99.8%(Y4-2和Y4-3),尤其是来源于同一猪场的样品(Y系列)彼此之间的相似性为91.8%~99.8%。PBoV3/4/5平均碱基相似性为67.2%,可分为2支,其中有8条序列单独分为一簇,彼此之间的碱基相似性为68.5%~98.0%,另外8条序列与其余参考序列分为一簇,彼此之间的碱基相似性为68.4%~89.8%。
表3 不同猪群中PBoV3/4/5阳性率
Tab.3 The positive rate of PBoV3/4/5 in different pig groups %
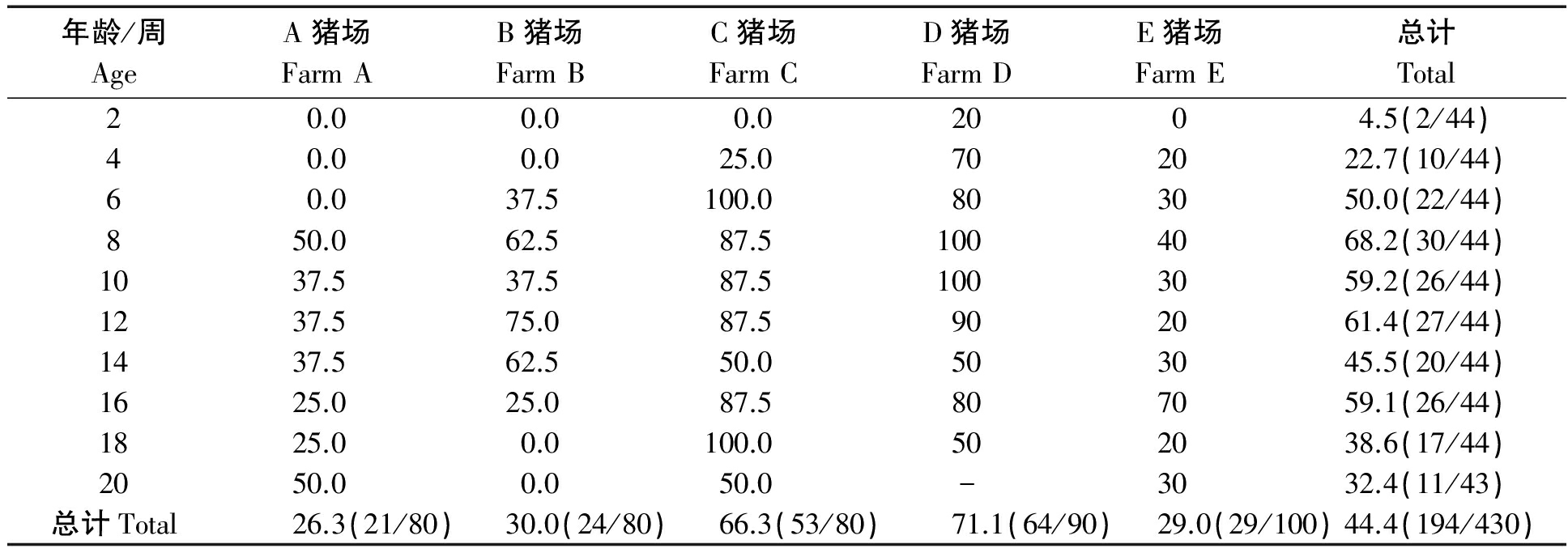
年龄/周AgeA猪场FarmAB猪场FarmBC猪场FarmCD猪场FarmDE猪场FarmE总计Total20.00.00.02004.5(2/44)40.00.025.0702022.7(10/44)60.037.5100.0803050.0(22/44)850.062.587.51004068.2(30/44)1037.537.587.51003059.2(26/44)1237.575.087.5902061.4(27/44)1437.562.550.0503045.5(20/44)1625.025.087.5807059.1(26/44)1825.00.0100.0502038.6(17/44)2050.00.050.0-3032.4(11/43)总计Total26.3(21/80)30.0(24/80)66.3(53/80)71.1(64/90)29.0(29/100)44.4(194/430)
表4 PBoV3/4/5按照不同周龄和猪场统计分析结果
Tab.4 t-test of PBoV3/4/5 based on age and farm
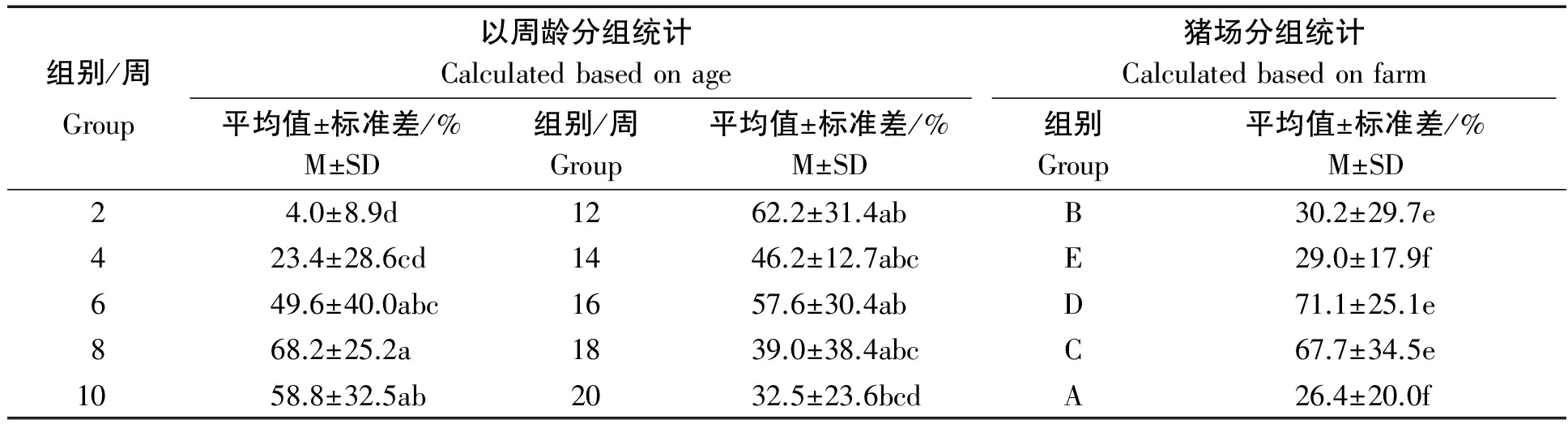
组别/周以周龄分组统计Calculatedbasedonage猪场分组统计CalculatedbasedonfarmGroup平均值±标准差/%M±SD组别/周Group平均值±标准差/%M±SD组别Group平均值±标准差/%M±SD24.0±8.9d1262.2±31.4abB30.2±29.7e423.4±28.6cd1446.2±12.7abcE29.0±17.9f649.6±40.0abc1657.6±30.4abD71.1±25.1e868.2±25.2a1839.0±38.4abcC67.7±34.5e1058.8±32.5ab2032.5±23.6bcdA26.4±20.0f
注:表内数据为平均值加减标准差;其中a~d为按周龄分组统计时差异显著标识;e和f为按猪场统计是差异显著标识;不同小写字母表示差异显著。
Note: Data of the calculations displayed as mean value added and subtract with standard deviation; a-d mean significant differences based on age;while e and f mean significant differences based on farm; Different lowercase indicate significant differences.
表 5 碱基进化饱和度检测
Tab.5 Test of nucleotides substitution saturation
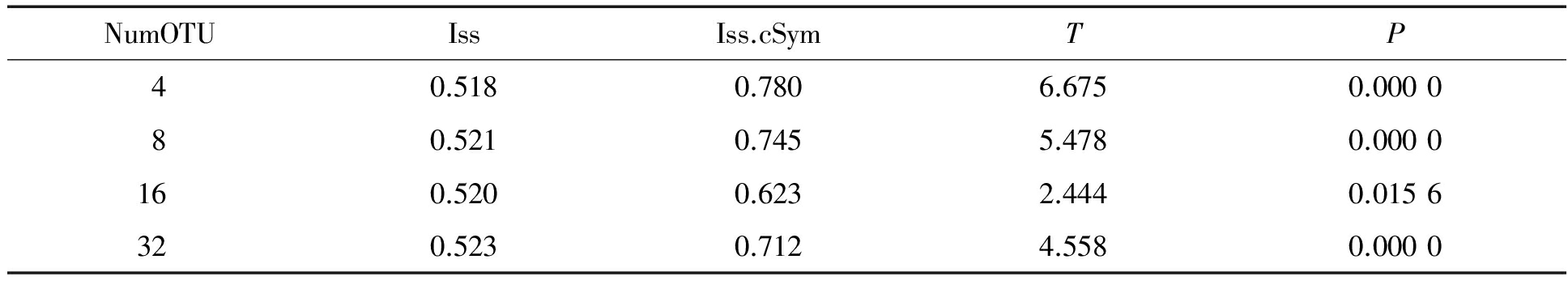
NumOTUIssIss.cSymTP40.5180.7806.6750.000080.5210.7455.4780.0000160.5200.6232.4440.0156320.5230.7124.5580.0000
3 讨论
目前PBoV共有5个基因型,主要有3个ORF,分别编码NS1、NP1和VP1/VP2[11-12]。曾有研究人员试图建立3个ORF的ELISA方法并希望可用于血清学调查研究[13]。但是根据3个ORF氨基酸同源性分析,基因型之间氨基酸相似度为29.4%~48.4%,基因型内氨基酸相似度为73.3%~99.5%,均存在较大差异,因此,不能够准确地对临床样品进行流行型检测[14-15]。通过对GenBank内登录PBoV基因组进行对比分析,发现PBoV1型和PBoV2型之间、PBoV3、PBoV4和PBoV5型之间的序列比较接近,设计2对引物,构建PCR检测方法,可分别特异性扩增相对应的基因型。
文献报道PBoV在病猪(腹泻,PMWS等)的阳性率为20%~100%[10,16],在健康猪群中的阳性率为6%~56%[8,17]。Blomström等[1]对34头患有PMWS和24头健康猪进行PBoV-like (经过比对分析为PBoV1)检测,发现患有PMWS的猪PBoV检出率为88%,而无PMWS症状的猪体内PBoV检出率为46%。PCR检测阳性率差异性有2个主要原因,其一由于PBoV碱基序列差异性较大,而不同的研究团队所使用的引物扩增靶序列的基因型有很大差异,多数为某单一基因型;其二,每个团队调查的猪群健康状况不一致,甚至猪群年龄构成有很大差异。我们设计了可有效扩增PBoV1/2、PBoV3/4/5的引物,同时对不同年龄的健康猪进行了检测,系统的检测了猪群中PBoV的流行状况。试验样品共有430份健康猪肛门拭子,其中PBoV阳性率为64.6%,PBoV1/2阳性率为27.2%,PBoV3/4/5阳性率为45.1%,混合感染率为7.7%,表明湖南省内PBoV3/4/5阳性率高于PBoV 1/2流行型。2周龄仔猪PBoV1/2便有较高阳性率,且随着年龄的增长检出率逐渐降低,表明仔猪易感,而随着年龄增大,PBoV1/2对猪的感染能力下降,母猪可能未曾感染,因此无相应的抗体,而仔猪也无从获得相应母源抗体。PBoV3/4/5总阳性率则呈先升高后降低趋势,2周龄时仅在D猪场有阳性样本,其余猪场检测均为阴性。2周龄之后年龄段猪群中均有阳性,表明PBoV3/4/5可感染所有猪群,而2周龄核酸检测阳性率低可能是母源抗体的保护。从以上结果及分析可以得知:PBoV3/4/5对猪的感染能力可能强于PBoV1/2。PBoV3/4/5在肥猪群(8~16周)阳性率明显高于PBoV1/2型阳性率,也说明PBoV3/4/5感染能力或者在猪体内适应性强于PBoV1/2。观察分析PBoV3/4/5感染规律:2~8周龄感染率逐渐上升,在8周龄达到最高值(68.2%)并在8~12周龄保持一个相对稳定阳性率,12周龄后呈下降趋势,至20周龄时,阳性率为32.4%。这个感染规律与PCV2感染规律相一致。5个猪场中有2个猪场免疫PCV2疫苗5年以上(C和D场),2个免疫PCV2疫苗2.5年左右(B和E场),1个未免疫过PCV-2疫苗(A场)。通过对PBoV1/2和PBoV3/4/5统计分析,本研究发现,随着猪场内PCV-2免疫时间的增长,PBoV1/2阳性率逐渐降低,而PBoV3/4/5阳性率则逐渐升高。PCV2感染主要导致机体的免疫系统功能性下降,而PCV2疫苗免疫则可以预防PCV2感染,从而使机体免疫系统保持相对健康。因此,PBoV1/2感染随PCV2疫苗免疫时间增长而下降。PBoV3/4/5随着猪场中PCV2疫苗免疫时间的增长而呈现逐渐升高的现象是比较出乎意料的.目前这两者之间的相关性未有相关报道,因此需要进一步加强研究以阐明相关性。由于目前PBoV尚未有效的体外培养方法,无法实施试验控制条件下的攻毒试验,因此对其具体致病性理解仍需加强相关研究。
ML进化树采用MEGA 6软件绘制,采用Tamura-Nei model和Gamma distributed 模型,自展值(Bootstrap)设定为1 000,比对中产生的空格在进化树构建过程中均删除。A.PBoV1/2共有15条样本序列(标记为●),7条参考序列,样本序列长度为445~451 bp。B.PBoV3/4/5共有16条样本序列(标记为■),17条参考序列,样本序列长度为504~543 bp。
Maximum likelihood tree was conducted using MEGA 6 with Tamura-Nei model and Gamma distributed model with Bootstrap of 1 000 and the gap during alignment was complete delete.A.15 obtained (marked with ●) and 7 reference PBoV1/2 with 445-451 bp;B.16 obtained (marked with ■) and 17 reference PBoV3/4/5 with 504-543 nucleotides.
图2 PBoV样本序列与参考序列进化分析
Fig.2 Phylogenetic analysis of PBoV based on obtained and reference sequences
PBoV各型之间NS1或VP1基因有一段保守序列,可用于设计引物[12,18-19]。本研究设计的引物扩增序列高度变异,经与参考序列比对分析碱基相似度85.4%(NS1),67.2%(VP1)。由于PBoV全基因组差异较大,因此扩增相对麻烦,用全基因组进化分析也比较难以进行。许多研究团队采用NS1或VP1代替全基因组进行进化,虽然有一定差异,但总体具有可信度[20]。进化分析显示样本序列与参考序列交叉分布,进一步说明样本序列核酸的多态性。
2010年,该病毒仅在瑞典和中国有报道[21],但是,目前该病毒已在许多国家猪群中存在[7,22-23]。国际间种猪及猪肉加工产品的贸易日益频繁,但是PBoV并未列入入境检验检疫范围,因此,在某种程度上促进了该病毒在国际间的流通。PBoV无论是在健康猪群中还是发病猪群中均有一定比例的检出率,该病对于猪的健康状况是否存在影响还不能确定,因此需要进一步加强对该病毒的研究。
参考文献:
[1] Blomström A L,Belák S,Fossum C,et al.Detection of a novel Porcine boca-like virus in the background of Porcine circovirus type 2 induced postweaning multisystemic wasting syndrome[J].Virus Research,2009,146(1/2):125-129.
[2] Liu M,Li Y,Sun D,et al.Detection and genetic analysis of Porcine bocavirus in different swine herds in North Central China[J].The Scientific World Journal,2014,2014(3):947084.
[3] Cheung A K,Wu G,Wang D,et al.Identification and molecular cloning of a novel Porcine parvovirus[J].Archives of Virology,2010,155(5):801-806.
[4] Huang J,Mor S K,Erber J,et al.Detection and characterization of Porcine bocavirus in the United States[J].Archives of Virology,2014,159(7):1797-1801.
[5] 蔡雨函,朱 玲,周远成,等.猪博卡病毒双重PCR检测方法的建立及其应用[J].中国兽医科学,2013(8):833-838.
[6] 付朋飞,李梦奇,乔 涵,等.猪博卡病毒1型/2型PCR检测方法的建立[J].中国预防兽医学报,2016,38(7):572-575.
[7] Mcmenamy M J,Mckillen J,Mcnair I,et al.Detection of a Porcine boca-like virus in combination with Porcine circovirus type 2 genotypes and Torque teno sus virus in pigs from postweaning multisystemic wasting syndrome(PMWS)-affected and non-PMWS-affected farms in archival samples from Great Britain[J].Veterinary Microbiology,2013,164(3/4):293-298.
[8] Ndze V N,Cadar D,Cságola A,et al.Detection of novel Porcine bocaviruses in fecal samples of asymptomatic pigs in Cameroon[J].Infection,Genetics and Evolution :Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases,2013,17(3):277-282.
[9] Shan T,Lan D,Li L,et al.Genomic characterization and high prevalence of Bocaviruses in swine[J].PLoS One,2011,6(4):e17292.
[10] Zhai S,Yue C,Wei Z,et al.High prevalence of a novel Porcine bocavirus in weanling piglets with respiratory tract symptoms in China[J].Archives of Virology,2010,155(8):1313-1317.
[11] Yang W Z,Yu J M,Li J S,et al.Genome characterization of a novel Porcine bocavirus[J].Archives of Virology,2012,157(11):2125-2132.
[12] Blomström A L,Ståhl K,Okurut A R,et al.Genetic characterisation of a Porcine bocavirus detected in domestic pigs in Uganda[J].Virus Genes,2013,47(2):370-373.
[13] 李 彬,毛 立,何孔旺,等.猪博卡病毒NP1基因的克隆与原核表达[J].华北农学报,2011,26(3):28-31.
[14] Wang E,Liu W,Yang B,et al.Complete sequence and phylogenetic analysis of a Porcine bocavirus strain swBoV CH437[J].Virus Genes,2014,48(2):387-390.
[15] 周 宇,唐连飞,朱事康,等.猪博卡病毒的基因分型[J].中国动物检疫,2015(2):63-68.
[16] Lau S K,Woo P C,Yip C C,et al.Co-existence of multiple strains of two novel porcine bocaviruses in the same pig,a previously undescribed phenomenon in members of the family Parvoviridae,and evidence for inter- and intra-host genetic diversity and recombination[J].Journal of General Virology,2011,92(9):2047-2059.
[17] Amimo J O,El Zowalaty M E,Githae D,et al.Metagenomic analysis demonstrates the diversity of the fecal virome in asymptomatic pigs in East Africa[J].Archives of Virology,2016,161(4):887-897.
[18] Cheng W X,Li J S,Huang C P,et al.Identification and nearly full-length genome characterization of novel Porcine bocaviruses[J].PLoS One,2010,5(10):e13583.
[19] 胡军勇,张 倩,王丹丹,等.猪博卡病毒PCR检测方法的建立及其初步流行病学调查[J].中国预防兽医学报,2012,34(8):632-636.
[20] 周 宇,唐连飞,朱事康,等.两株猪博卡病毒的检测及遗传演化分析[J].中国兽医杂志,2014,50(10):9-12.
[21] 翟少伦,岳 城,韦祖樟,等.猪博卡病毒PCR检测方法的建立及其应用[J].中国动物传染病学报,2010,18(2):14-17.
[22] Zhang Q,Zhang C,Gao M,et al.Evolutionary,epidemiological,demographical,and geographical dissection of Porcine bocavirus in China and America[J].Virus Research,2015,195(195):13-24.
[23] Zhou F,Sun H,Wang Y.Porcine bocavirus:achievements in the past five years[J].Viruses,2014,6(12):4946-4960.
Prevalence and Phylogenetic Analysis of Multiple Porcine bocavirus Genotypes in Clinically Healthy Pigs in Hunan Province
QU Tailong,LI Runcheng,LUO Binyu,GE Meng,YAN Meijun,HU Huican,YU Xinglong
(Veterinary Faculty,Hunan Agricultural University,Changsha 410128,China)
Abstract:To evaluate the prevalence of PBoV in healthy pig in different age,primers targeting to partial NS1 gene of PBoV1/2 and VP1 gene of PBoV3/4/5 were designed based on the analysis of PBoV sequences from GenBank.Total 430 anal swab species were collected from 5 pig farms with the pig′age of 2-20 weeks from August to December 2016 in Hunan Province.The total positive rate of PBoV was 64.6% (278/430),PBoV1/2 for 27.2%(117/430),PBoV3/4/5 for 45.1%(194/430) and with 7.7%(33/430) positive rate of coinfection.The mainly infection age of PBoV1/2 ranged 2-10 weeks,and PBoV3/4/5 from 8-16 weeks.The average nucleotide identity of obtained sequences and references of PBoV1/2 and PBoV3/4/5 was 85.4% and 67.2%,respectively.High prevalence and coinfection were observed in clinically healthy pigs,which may cause potential effect to the microbes in the gut.
Key words: PBoV; Prevalence; Phylogenetic analysis; Coinfection; Pathogenicity
收稿日期:2017-07-22
基金项目:湖南省战略性新兴产业科技攻关类项目(2016GK4015)
作者简介:屈泰龙(1986-),男,河南开封人,在读博士,主要从事动物疫病防控研究。
通讯作者:余兴龙(1965-),男,湖南岳阳人,教授,博士,博士生导师,主要从事畜禽疫病的诊断、分子病毒学与基因工程研究。
中图分类号:S855.3
文献标识码:A
文章编号:1000-7091(2017)05-0136-06
doi:10.7668/hbnxb.2017.05.021