副猪嗜血杆菌vacJ基因缺失菌株构建及其生物学特性分析
赵良友1,2,高雪丽1,刘超男1,申海龙4,姜 南3,万伟泉1,吕晓萍1,郑世民1
(1.东北农业大学 动物医学学院,黑龙江省实验动物与比较医学重点实验室,黑龙江 哈尔滨 150030;2.黑龙江中医药大学,药物安全性评价中心,黑龙江 哈尔滨 150040;3.大连大学 生命科学与技术学院,辽宁 大连 116622;4.浙江省湖州市长兴县农业局,浙江 湖州 313100)
摘要:为了探究副猪嗜血杆菌外膜脂蛋白编码基因vacJ在其致病中的作用,以血清5型临诊分离株HS49为研究对象,构建了vacJ基因缺失菌株(ΔvacJ),进而比较了野生株与缺失株在生长特性、对细胞的黏附及入侵和毒力等方面的差异。结果显示,与野生株相比较,缺失vacJ后的菌株生长速率明显下降,对PK-15细胞的黏附和入侵能力则明显降低,形成生物被膜的能力也显著下降。缺失vacJ菌株对Balb/C小鼠感染模型的LD50是野生株的14倍,表明vacJ基因敲除后,副猪嗜血杆菌毒力明显下降。表明vacJ 基因与副猪嗜血杆菌生长、黏附入侵、生物被膜形成及毒力密切相关。
关键词:副猪嗜血杆菌;vacJ基因;生物学特性;毒力
副猪嗜血杆菌病又称为革拉瑟氏病(Glässer′s disease),是由副猪嗜血杆菌(Haemophilus parasuis,HPS)引起的一种以纤维素性多发性浆膜炎、关节炎及脑膜炎为特征的重要猪细菌性传染病[1]。过去一直认为HPS主要是作为猪的一种呼吸道共栖菌存在,仅在特定条件下侵入机体导致发病[2]。然而近年来,随着集约化养猪场的迅猛发展和养殖模式的不断变化,HPS已成为严重危害养化猪业的三大细菌性传染病病原之一,给全球养猪业造成了严重的经济损失[3]。
一直以来,由于遗传操作工具的缺乏,对于HPS的致病机制及其毒力因子知之甚少,给该病预防和治疗带来了很大困难。最初针对HPS毒力因子的研究主要局限于常规毒力因子的范围,如荚膜、外膜蛋白、菌毛、脂多糖等[4],对临诊诊断及治疗指导意义不大。近几年,各种新型技术的涌现使得HPS分子生物学研究取得了明显进展[5-7]。目前通常利用同源重组原理构建HPS的基因缺失株,研究靶基因的各种生物学功能[8-9]。研究发现,HPS具有在自然条件下摄取外源DNA的能力。Bigas等[10]首次报道了HPS 利用腺苷酸环化酶(cAMP)依赖的自然转化系统,可接受携带有ACCGAACTC信号序列的外源DNA,据此成功构建出了HPS胸苷酸合成酶 (Thy) 缺失株。马艳平[11]利用结合转移方法,利用带有以蔗糖敏感系统为基础的负向选择标记的pDM4自杀载体成功构建了密度感应信号相关基因luxS 和鞭毛基因pilA的缺失株。但在实际操作中,上述2种方法的成功率并不高。Zhang等[12-13]从HPS全基因组序列中发现ACCGCTTGT序列与已报道的USS很相似,并证实了该序列适用HPS的自然转化,成功建立了一种改进的自然转化方法并对其进行优化,分别构建出了HPS ΔompP2和ΔompP5缺失株,为HPS遗传操作和基因功能的研究提供了技术平台。
外膜脂蛋白在革兰氏阴性菌中广泛存在,是许多细菌的重要免疫原性蛋白,同时也被认为与致病菌的毒力密切相关[14-15]。VacJ脂蛋白存在于巴斯德菌科的多数成员中,但是其在HPS致病过程中的作用迄今尚未阐明。故本研究利用上述改进的自然转化方法在成功构建HPS vacJ 基因缺失株的基础上,并进一步分析了缺失株的生物学特性,以期阐明vacJ基因在HPS致病中的作用,为该病及其相关疾病的防治提供十分重要的科学参考依据。
1 材料和方法
1.1 菌株和质粒
本研究所用菌株和质粒见表1。
表1 菌株及质粒
Tab.1 Bacterial strains and plasmids

菌株和质粒Strainsandplasmids相关特性Relevantcharacteristics来源SourceDH5α大肠杆菌感受态细胞E.coliDH5αFΦ80ΔlacZΔM15Δ(lacZYA-argF)U169recA1endA1hs-dR17本实验室保存副猪嗜血杆菌H.parasuisHS49副猪嗜血杆菌5型临床分离株本实验室保存ΔvacJ副猪嗜血杆菌vacJ缺失株(KanR)本研究构建(HS49ΔvacJ∷kan)质粒PlasmidspK18mobsacB自杀性载体质粒(KanR)本研究构建pK18-ΔvacJpk18mobsacB重组载体质粒(含ΔvacJ,KanR)本研究构建pK18-ΔvacJ∷kanpk18mobsacB重组载体质粒(含ΔvacJ∷kan,KanR)本研究构建pBAD18-KmKan抗性基因盒转移载体质粒(KanR)本研究构建
1.2 引物
根据NCBI中发布的HPS 5型菌株SH0165序列[16]设计所用引物(表2),所用引物均由上海生工生物工程公司合成。
表2 引物及其序列
Tab.2 Primers used for PCR amplification

引物Primers序列(5'-3')SequenceP1(vacJ-up-F)CGCAAGCTTACCGCTTGTGCAGAAATTGTTGAT-TACTCP2(vacJ-up-R)GTCGACATGCTCGGATCCATGACTACTTTA-AAAAAGGGP3(vacJ-down-F)GGATCCGAGCATGTCGACTGATTTACCTGTA-AAAATTTP4(vacJ-down-R)CGGAATTCACAAGCGGTTCACTCGATTCTTTAATGCGP5(Kan-F)CGGGATCCGTAAGGTTGGGAAGCCCTGCP6(Kan-R)CGCGTCGACGGTCGGTCATTTCGAACCCCP7(16S-F)GCATTTCATACTGGGTGGCTP8(16S-R)CCCGACCAAATCGCTGGCAAP9(vacJ-F)CGCGGATCCATGAAAAAAATTAAACTTCTP10(vacJ-R)CAACCTTACTTACCATAATCAATCAATATTT
注:下划线部分为酶切位点。
Notes:The underlined part is the enzyme loci.
1.3 HPS vacJ基因缺失菌株的构建
利用细菌基因组试剂盒提取HPS 5型临诊分离株HS49基因组DNA,分别利用引物P1/P2和P3/P4从中扩增vacJ 基因的上游同源臂片段(488 bp)和下游同源臂片段(461 bp)。以上下游同源臂片段为模板,用引物P1/P4进行重叠PCR扩增,纯化回收PCR产物,克隆至pMD19-T载体获得质粒p1。用BamH Ⅰ和SalⅠ双酶切质粒p1后回收目的片段,将其克隆至用同样酶双酶切后的pK18mobsacB上得到质粒p2。利用引物P5/P6扩增出卡那霉素抗性片段(935 bp),并将其转入质粒p2得到质粒p3,用优化的自然转化方法[12]将质粒p3转入HS49菌株,经PCR鉴定获得vacJ 基因缺失株ΔvacJ。
1.4 细菌生长速率的比较
将野生株HS49和缺失株ΔvacJ接种至TSB培养基,37 ℃培养过夜。取等量的2种菌株(OD600≈0.1)的菌液再次转接后振荡培养,每隔1 h测取OD600值,培养至12 h,绘制生长曲线,重复试验3次。
1.5 缺失菌株的稳定性分析
菌株SS2-GD01ΔSsn A在 TSA 平板上划线培养,挑取单菌落接种到TSB培养基中,37 ℃培养12 h,增殖的菌液为1代。然后将1代菌液再于TSA平板上划线培养,挑取单菌落接种到TSB培养基中,37 ℃振荡培养12 h,增殖的菌液为2代,如此反复在TSA和TSB培养基中进行传代,连续培养20代,每隔2代对增殖的菌液用引物进行PCR扩增鉴定。
1.6 细胞黏附及入侵试验
将PK-15细胞铺于24孔细胞培养板长成单层,吸取上清,用无菌PBS洗涤细胞3次。按照细菌与细胞比例100∶1加入用RPMI 1640培养液稀释的菌液1 mL。孵育2 h后去掉培养液,用PBS洗5次,加含0.25% 胰蛋白酶(Trypsin)/0.02% EDTA的PBS 100 μL 裂解细胞。将细胞破碎液倍比稀释涂布于TSA平板,置于37 ℃培养,过夜生长后计算菌落数量,比较不同菌株对细胞黏附的差别。入侵试验是于黏附试验结束后,每孔加入1 mL含100 μg链霉素和5 μg青霉素的PBS孵育1 h。
1.7 vacJ基因缺失对HPS生物被膜形成的影响
准备洁净的玻璃试管数支并分为3组,每支试管加入1 mL新鲜TSB培养基(含新生牛血清和NAD)。分别向每组试管中接入20 μL的野生菌或缺失菌。试管在37 ℃下静置培养18 h,用移液枪移除菌液并用PBS轻轻冲掉游离菌体,于室温下用1.5 mL 1%的结晶紫溶液染色5 min;之后用流水轻缓冲洗3~5 min直至冲洗液变为无色为止,自然风干后观察结果[17]。设立空白对照,每组设立3个重复。
1.8 野生株HS49与缺失株ΔvacJ对小鼠的致病力比较
选取7周龄雌性Balb/C小鼠,用于小鼠半数致死量(LD50)测定试验。将野生株HS49和缺失株ΔvacJ培养至对数生长期后离心,以适量TSB培养液重悬菌体沉淀,分别按照预试验测定的LD0与LD100,在两者剂量区间内分别设置5 个剂量组,经腹腔感染小鼠0.5 mL/只。阴性对照组小鼠(5只)给予等量TSB培养基,观察记录小鼠发病及死亡情况,然后计算两者的LD50。
2 结果与分析
2.1 HPS vacJ基因缺失株筛选及其鉴定
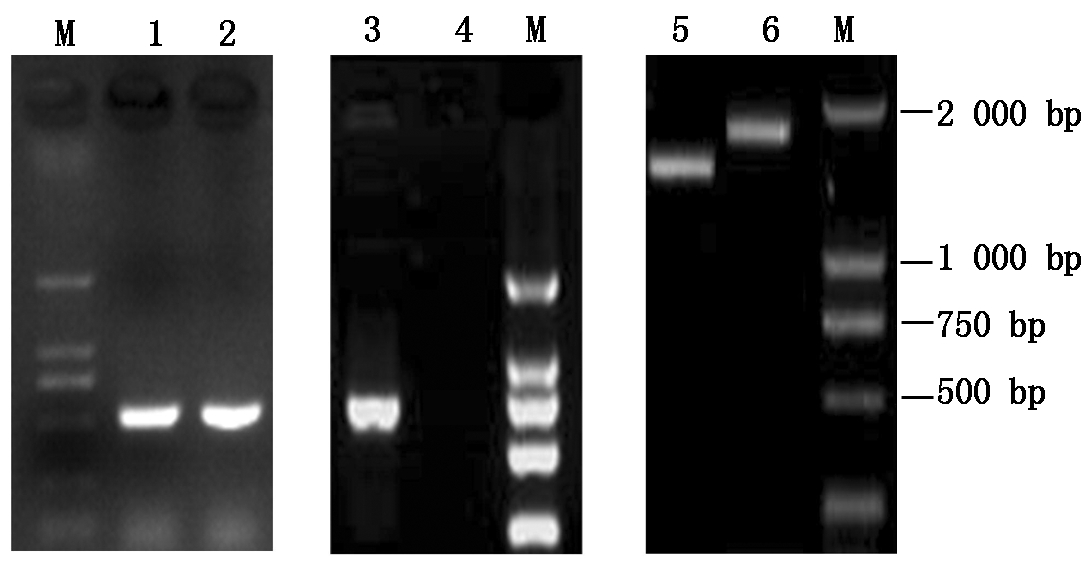
将构建的自然转化质粒转化至HPS野生株 HS49中,涂布含Kan抗性的TSA平板进行筛选,获得Kan抗性的接合子。通过PCR进一步鉴定缺失菌株,利用HPS 16S rRNA引物扩增野生株HS49和缺失株ΔvacJ均能得到510 bp 大小的片段;利用P9/P10引物扩增目的基因vacJ时,HS49 能扩增出一条747 bp大小的目的条带,而ΔvacJ无此条带扩出;利用引物对P1/P4 分别扩增出2条大小不同的目的带,表明ΔvacJ 缺失株是由Kan抗性片段取代野生菌HS49中vacJ 基因目的片段而成(图1)。
M.DL2000 Marker;1~2.野生株HS49和缺失株ΔvacJ 的16S rRNA片段扩增;3~4.野生株HS49和缺失株ΔvacJ 的 vacJ 基因扩增;5~6.野生株HS49和缺失株ΔvacJ 的上游同源臂+插入片段+下游同源臂片段扩增。
M.DL2000 Marker;1-2.The H. parasuis 16S rRNA fragment from the wild-type HS49,and ΔvacJ strains;3-4.The vacJ gene from the wild-type HS49,and ΔvacJ strains;5-6.The segments (the upstream homologous arm region,the intermediate region,and the down homologous arm region of vacJ) were amplified from the wild-type HS49,and ΔvacJ strains.
图1 HPS缺失株ΔvacJ的鉴定
Fig.1 Identification of the ΔvacJ deletion strain
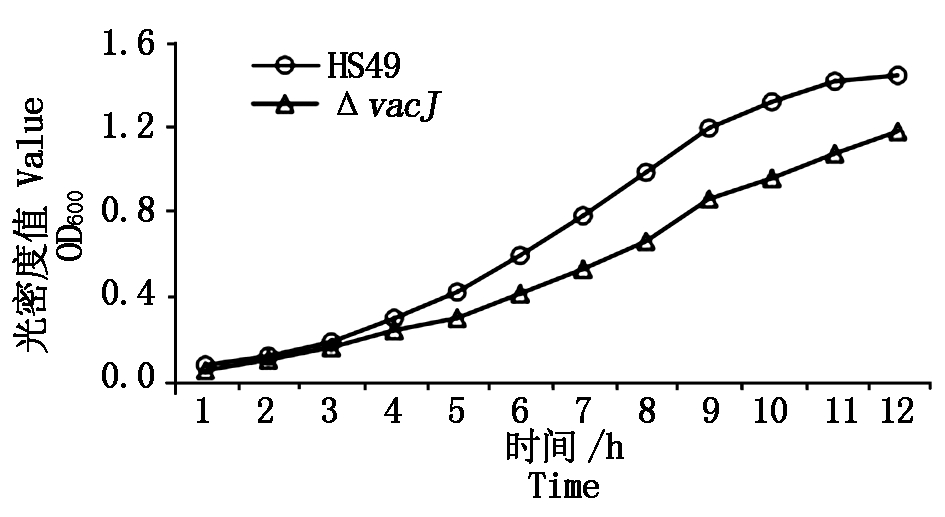
2.2 缺失株ΔvacJ的生物学特性分析
在相同培养条件下,于TSB 培养基中37 ℃振荡培养野生株和缺失株,以培养时间为横坐标,OD600
值为纵坐标绘制生长曲线。如图2所示,ΔvacJ生长速度明显比野生株缓慢。将缺失株反复在TSA和TSB培养基中进行传代,连续培养20代,分别以每代菌液作为模板所扩增的结果均无差别,表明构建的基因缺失菌株ΔvacJ能够稳定遗传。
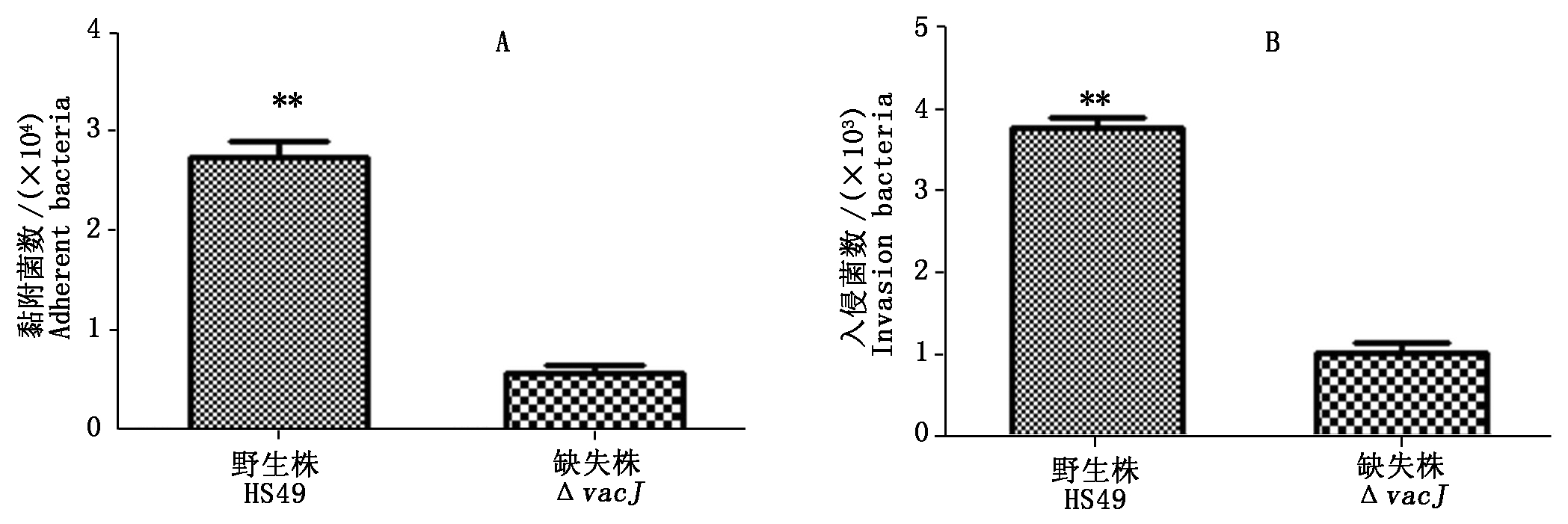
2.3 缺失株ΔvacJ与野生株HS49对宿主细胞黏附入侵力的比较
采用PK-15细胞验证缺失株ΔvacJ和野生株HS49的黏附能力,试验重复3次,每次3复孔。结果发现,缺失株ΔvacJ对PK-15 细胞的黏附率明显低于野生株HS49,统计学上有极显著差异(P<0.01)
(图 3-A)。同样,细胞侵袭试验也得到相似结果(图3-B)。表明HPS的vacJ基因缺失后,其对宿主细胞无论是黏附力还是入侵力均明显降低。
2.4 野生株HS49与缺失株ΔvacJ生物被膜形成能力的比较
以玻璃试管为载体,通过结晶紫染色方法,观察比较野生株HS49与缺失株ΔvacJ的生物被膜形成能力。如图4显示,vacJ基因缺失后HPS菌株的生物被膜形成能力明显下降。
2.5 野生株HS49与缺失株ΔvacJ对小鼠致病力的比较
如表3所示,HPS基因缺失株ΔvacJ的LD50约为野生株HS49的14倍,表明vacJ基因敲除后,HPS毒力明显下降。提示vacJ参与了5型HPS的致病过程,是一种新的毒力相关因子。
表3 缺失株ΔvacJ与野生株HS49对小鼠致病力的比较
Tab.3 Virulence of the deletion strain ΔvacJ and the wild-type HS49 strain in mice

菌株Strains攻击剂量/cfuChallengedose死亡数量NumberdeadLD50值/cfuValueofLD50衰减倍数Foldattenu-ation野生株2.0×1070Wild-type4.2×1070(HS49)8.9×10711.62×10811.9×10834.0×10862.0×10804.2×1080缺失株8.9×10812.29×10914Mutant1.9×1093(ΔvacJ)4.0×1094
注:衰减倍数.与野生株HS49比较,缺失株ΔvacJ对小鼠致病力的衰减倍数。
Notes:Fold attenuation.Fold attenuation normalised to the wild-type strain.
3 讨论
VacJ脂蛋白最早被发现存在于弗氏志贺菌中,与其传播有密切关系[18]。随后研究证明,VacJ对非分型流感嗜血杆菌的血清抗性和IgM蛋白结合功能起到重要作用,并能够调节细菌逃避补体杀伤作用[19]。最新研究证实,VacJ是HPS的一个重要免疫原性蛋白,能够对小鼠起到很好的免疫保护作用[20]。为进一步分析vacJ 作为潜在毒力因子在HPS致病过程中的作用,本研究选取HPS 血清5型临诊分离株作为研究对象,将vacJ 基因敲除后获得ΔvacJ缺失株,并对其生物学特性进行了分析。
细菌黏附是其寄生活动的基础和前提条件,细菌黏附宿主细胞后,在该局部组织定居,大量繁殖,产生毒素或侵入深部,损伤或破坏组织,进而造成感染。研究证实,ops X、CDT、rfa D、rfa E和lgt F等基因是HPS的重要黏附因子,均能显著降低HPS对宿主细胞的黏附力[8]。在本研究中,vacJ基因缺失后HPS菌株对于PK-15细胞的黏附力以及入侵力均明显下降,提示vacJ基因可能是HPS的黏附因子之一,或是通过调节其他黏附因子表达而起作用,其具体作用机制还有待进一步研究证实。
生物被膜形成能力是病原菌一种重要的毒力标志,多数血清型的HPS菌株能在体外形成生物被膜,被认为与其能抵抗不利环境和发挥致病作用有关[17]。研究已证实,某些在病原菌致病作用中发挥重要作用的基因,如流感嗜血杆菌的lsg B和sia A基因缺失后能导致细菌生物被膜的丢失[21]。本研究将HPS的vacJ基因缺失后,其生物被膜形成能力明显降低,进一步提示vacJ 基因与HPS毒力相关。
为了进一步证实vacJ基因对HPS毒力的影响,本项目进而开展了小鼠体内致病性研究,比较了野生株和缺失株对小鼠的LD50。VacJ 缺失株相比于野生株需要更高的剂量才能导致小鼠半数致死,表明该基因缺失导致HPS 毒力降低。据此推测vacJ 基因缺失可能影响了某些致病性相关基因表达从而引起表型改变,但其对HPS毒力的具体调控机制还需要进一步探讨。
本研究成功构建了HPS 5型临诊分离株HS49的vacJ基因缺失株,通过一系列生物学特性比较显示,vacJ 基因缺失对HPS 生长速度、生物被膜形成、黏附入侵及毒力均有调节作用,这一研究结果对进一步探究vacJ基因在HPS致病中的作用奠定了基础,并为研究相关弱毒疫苗提供了科学试验依据。
参考文献:
[1] Oliveira S,Pijoan C. Haemophilus parasuis:new trends on diagnosis,epidemiology and control[J]. Veterinary Microbiology,2004,99(1):1-12.
[2] Møller K,Kilian M. V factor-dependent members of the family Pasteurellaceae in the porcine upper respiratory tract[J]. Journal of Clinical Microbiology,1990,28(12):2711-2716.
[3] Cerdà-Cuéllar M,Naranjo J F,Verge A,et al. Sow vaccination modulates the colonization of piglets by Haemophilus parasuis[J]. Veterinary Microbiology,2010,145(3/4):315-320.
[4] Costa-Hurtado M,Aragon V. Advances in the quest for virulence factors of Haemophilus parasuis[J]. Veterinary Journal,2013,198(3):571-576.
[5] Hill C E,Metcalf D S,Macinnes J I. A search for virulence genes of Haemophilus parasuis using differential display RT-PCR[J]. Veterinary Microbiology,2003,96(2):189-202.
[6] Sack M,Baltes N. Identification of novel potential virulence-associated factors in Haemophilus parasuis[J]. Veterinary Microbiology,2009,136(3/4):382-386.
[7] Lillie B N,Hammermueller J D,Macinnes J I,et al. Porcine mannan-binding lectin A binds to Actinobacillus suis and Haemophilus parasuis[J]. Developmental and Comparative Immunology,2006,30(10):954-965.
[8] 曾 泽,何 欢,岳 华,等. 副猪嗜血杆菌lgt F 基因缺失株的构建及其部分生物学特性[J]. 畜牧兽医学报,2015,46(11):2056-2062.
[9] Huang J,Wang X,Cao Q,et al. ClpP participates in stress tolerance and negatively regulates biofilm formation in Haemophilus parasuis[J]. Veterinary Microbiology,2016,182:141-149.
[10] Bigas A,Garrido M E,De Rozas A M,et al. Development of a genetic manipulation system for Haemophilus parasuis[J]. Veterinary Microbiology,2005,105(3/4):223-228.
[11] 马艳平. 副猪嗜血杆菌生物被膜形成相关基因luxS和pilA的克隆和功能鉴定[D]. 北京:中国农业科学院,2010.
[12] Zhang B,Feng S,Xu C,et al. Serum resistance in Haemophilus parasuis SC096 strain requires outer membrane protein P2 expression[J]. FEMS Microbiology Letters,2012,326(2):109-115.
[13] Zhang B,Xu C,Zhou S,et al. Comparative proteomic analysis of a Haemophilus parasuis SC096 mutant deficient in the outer membrane protein P5[J]. Microbial Pathogenesis,2012,52(2):117-124.
[14] Sutcliffe I C,Harrington D J,Hutchings M I. A phylum level analysis reveals lipoprotein biosynthesis to be a fundamental property of bacteria[J]. Protein & Cell,2012,3(3):163-170.
[15] Cloeckaert A,Vizcaíno N,Paquet J Y,et al. Major outer membrane proteins of Brucella spp.:past,present and future[J]. Veterinary Microbiology,2002,90(1/4):229-247.
[16] Yue M,Yang F,Yang J,et al. Complete genome sequence of Haemophilus parasuis SH0165[J]. Journal of Bacteriology,2009,191(4):1359-1360.
[17] Jin H,Zhou R,Kang M,et al. Biofilm formation by field isolates and reference strains of Haemophilus parasuis[J]. Veterinary Microbiology,2006,118(1/2):117-123.
[18] Suzuki T,Murai T,Fukuda I,et al. Identification and characterization of a chromosomal virulence gene,vacJ,required for intercellular spreading of Shigella flexneri[J]. Molecular Microbiology,1994,11(1):31-41.
[19] Nakamura S,Shchepetov M,Dalia A B,et al. Molecular basis of increased serum resistance among pulmonary isolates of non-typeable Haemophilus influenzae[J]. PLOS Pathogens,2011,7(1):e1001247.
[20] Li M,Li C,Song S,et al. Development and antigenic characterization of three recombinant proteins with potential for Glässer′s disease prevention[J]. Vaccine,2016,34(19):2251-2258.
[21] Greiner L L,Watanabe H,Phillips N J,et al. Nontypeable Haemophilus influenzae strain 2019 produces a biofilm containing n-acetylneuraminic acid that May mimic sialylated o-linked glycans[J]. Infection and Immunity,2004,72(7):4249-4260.
Construction and Biological Characterization of vacJ Gene Deletion Strain of Haemophilus parasuis
ZHAO Liangyou1,2,GAO Xueli1,LIU Chaonan1,SHEN Hailong4,JIANG Nan3,WAN Weiquan1,LÜ Xiaoping1,ZHENG Shimin1
(1.College of Veterinary Medicine,Northeast Agricultural University,Heilongjiang Key Laboratory for Laboratory Animals and Comparative Medicine,Harbin 150030,China;2.Drug Safety Evaluation Center of Heilongjiang University of Chinese Medicine,Harbin 150040,China;3.College of Life Science and Technology,Dalian University,Dalian 116622,China;4.Agriculture Bureau of Changxing,Huzhou 313100,China)
Abstract:To investigate the role of the vacJ gene in Haemophilus parasuis (HPS) virulent strain HS49,the vacJ gene-deletion mutant ΔvacJ strain was constructed. To better assess the role of vacJ gene in the virulence of HPS,growth characteristics,adhesion and invasion to host cells,and experimental infection of mice were performed. The results supported that compared to the wild-type strain,the growth rate of vacJ deletion strain was decreased. The ΔvacJ deletion strain exhibited a significantly decrease ability to adhere to and invade PK-15 cell. Furthermore,the ΔvacJ was attenuated in a murine (Balb/C) model of infection and its LD50 value was approximately fourteen-fold higher than the wild-type. The data obtained in this study indicate that vacJ plays an essential role in growth,adherence to and invasion of host cells,biofilm formation,and related to HPS and further suggest a putative role of vacJ lipoprotein in virulence regulation.
Key words:Haemophilus parasuis;vacJ gene;Biological characteristics;Virulence
收稿日期:2017-08-03
基金项目:国家自然科学基金项目(31472169)
作者简介:赵良友(1982-),男,黑龙江哈尔滨人,助理研究员,在读博士,主要从事动物免疫病理和毒性病理研究。
通讯作者:郑世民(1959-),男,黑龙江哈尔滨人,教授,博士,主要从事动物免疫病理研究。
中图分类号:Q78
文献标识码:A
文章编号:1000-7091(2017)05-0019-06
doi:10.7668/hbnxb.2017.05.004