
图1 不同温度条件下制备的小麦秸秆生物炭
Fig.1 Photos of wheat-straw-biochar under different temperature
摘要:研究了炭化温度对小麦秸秆生物炭产率及理化特性的影响,为小麦秸秆生物炭的制备及还田作用机制提供理论依据。通过低氧炭化法,以20 ℃/min的升温速度将小麦秸秆炭化至特定温度(100,200,300,400,500,600,700,800 ℃),然后对其炭化产率和理化性质(孔隙状况、全碳及无机碳含量、CEC含量、表面含氧官能团情况及pH值、FTIR)进行分析,结果表明,低温炭化时小麦秸秆生物炭呈酸性,400 ℃之后呈碱性;随热解温度的升高,小麦秸秆生物炭的炭化程度逐渐增大,100~400 ℃产率自91.32%降至18.52%;炭化过程中,小麦秸秆生物炭孔隙增加,结构疏松;比表面积、孔径和比孔容均表现出先增大后减小的趋势,且均在400 ℃时达到最大,分别为6.675 m2/g、13.992 nm、0.015 cm3/g;有机碳含量在200~400 ℃较高;CEC含量于400~800 ℃维持在较高水平,处于69.13~84.35 cmol/kg;FTIR和表面含氧官能团的结果显示,小麦秸秆生物炭的芳香化程度随着热解温度的升高而增大,结构也愈加稳定。小麦秸秆的制备以400 ℃左右的炭化温度条件较为理想。
关键词:小麦秸秆;热解温度;生物炭;产率;理化特性
生物炭是一种在无氧或者限氧条件下,对生物质原料进行高温热解而得到的一种细粒状、多孔性的炭质材料[1]。生物炭较大的表面积和孔隙度可以为微生物提供良好的栖息环境[2],并且生物炭能够通过改变土壤中有机质腐殖化、矿质化等进程,改良土壤肥力,提高土壤有效性营养元素的含量,改善土壤理化性质[3-4]。同时生物炭也可以作为肥料缓释的载体进而提高肥料利用率,增强土壤固碳能力,减少土壤向大气排放温室气体的量[5]。此外,其制备过程可产出焦油、裂解气、木醋液等副产品[6],有利于实现农用生物炭生产过程中能源的循环利用,提升生物炭的附加价值。
生物质资源来源广泛,应用潜力巨大。我国是世界上农业废弃物产出量最大的国家,年排放量达到40多亿t[7],而小麦又是我国的主要粮食作物之一。据统计,每年我国的小麦秸秆产量约有1.19×108 t,其中有33%~40%被废弃在田间或露天焚烧[8],造成生物质资源的严重浪费,同时导致严重的大气环境污染。
前人已经做过很多关于生物炭的研究,比如对重金属污染的控制[9-10]及环境效应[11]、对土壤的改良作用[3-4]或者对农作物产量品质的影响[12]等,但主要集中在生物炭的应用方面,对其作用机制研究尚不明确,特别是土壤改良方面。此外,不同种类的生物质材料、不同的制炭方式都会导致所获得的生物炭性质不尽相同[13],而关于小麦秸秆生物炭制备及理化性质方面缺乏系统的研究。因此,本试验从100~800 ℃ 8个热解温度对小麦秸秆进行低氧炭化,并对其炭化产率及理化性质进行分析,以期为综合利用小麦秸秆改良土壤、阐述其作用机制提供参考。
1.1 试验材料与生物炭制备
于2013年选择河南省平顶山市自然风干的冬小麦秸秆为试验材料。将小麦秸秆放入定制托盘(铁制托盘:长23 cm、宽18 cm、高8 cm)内,每盘0.20 kg,置于马弗炉中进行炭化。炭化温度分别设置为100,200,300,400,500,600,700,800 ℃,升温速度为20 ℃/min,达到温度后炭化2 h,关闭电源,自然冷却至常温,取出样品[14]。样品过直径0.841 mm筛备用。
1.2 分析指标与方法
采用程序控温马弗炉(KSW-4D-11,上海跃进医疗器械厂)进行炭化;产率为小麦秸秆炭化前后质量比。
采用全自动比表面积及微孔分析仪(美国Quantachrome Instruments公司)测定比表面积及生物炭孔径,利用t-Plot方法得到微孔数据和BJH方程计算得到中孔的孔径分布;采用碳氮元素分析仪(Vario MAX CN,德国Elementar公司)测定全碳含量(质量分数);采用盐酸滴定法测定无机碳(质量分数);用pH计(pHS-2F,上海雷磁)测定pH值;采用乙酸钠交换法测定阳离子交换量(CEC);采用Boehm滴定法测定表面含氧官能团,其含量为通用耗碱量(mmol/g)表示,利用傅立叶变换红外光谱仪(Nicolet FTIR 6700,赛默飞世尔科技公司)测定FTIR图谱。
1.3 统计方法
试验数据用Microsoft Office Excel 2010和SPSS 21.0进行相关分析,多重比较用Duncan法。
2.1 不同温度下小麦秸秆炭化产率的变化
由图1可知,随着温度升高,小麦秸秆炭化程度越来越彻底。300 ℃之后小麦秸秆逐渐炭化为黑色,说明炭化温度达到300 ℃时效果才得以显现,与相关文献报道基本相符[15-16]。

图1 不同温度条件下制备的小麦秸秆生物炭
Fig.1 Photos of wheat-straw-biochar under different temperature
由图2可知,小麦秸秆制备生物炭的产率随温度的升高而降低。尤其在100~400 ℃,小麦秸秆炭化产率下降趋势明显,从91.32%下降至18.52%。500 ℃以后的产率变化较小,基本稳定在15%左右。
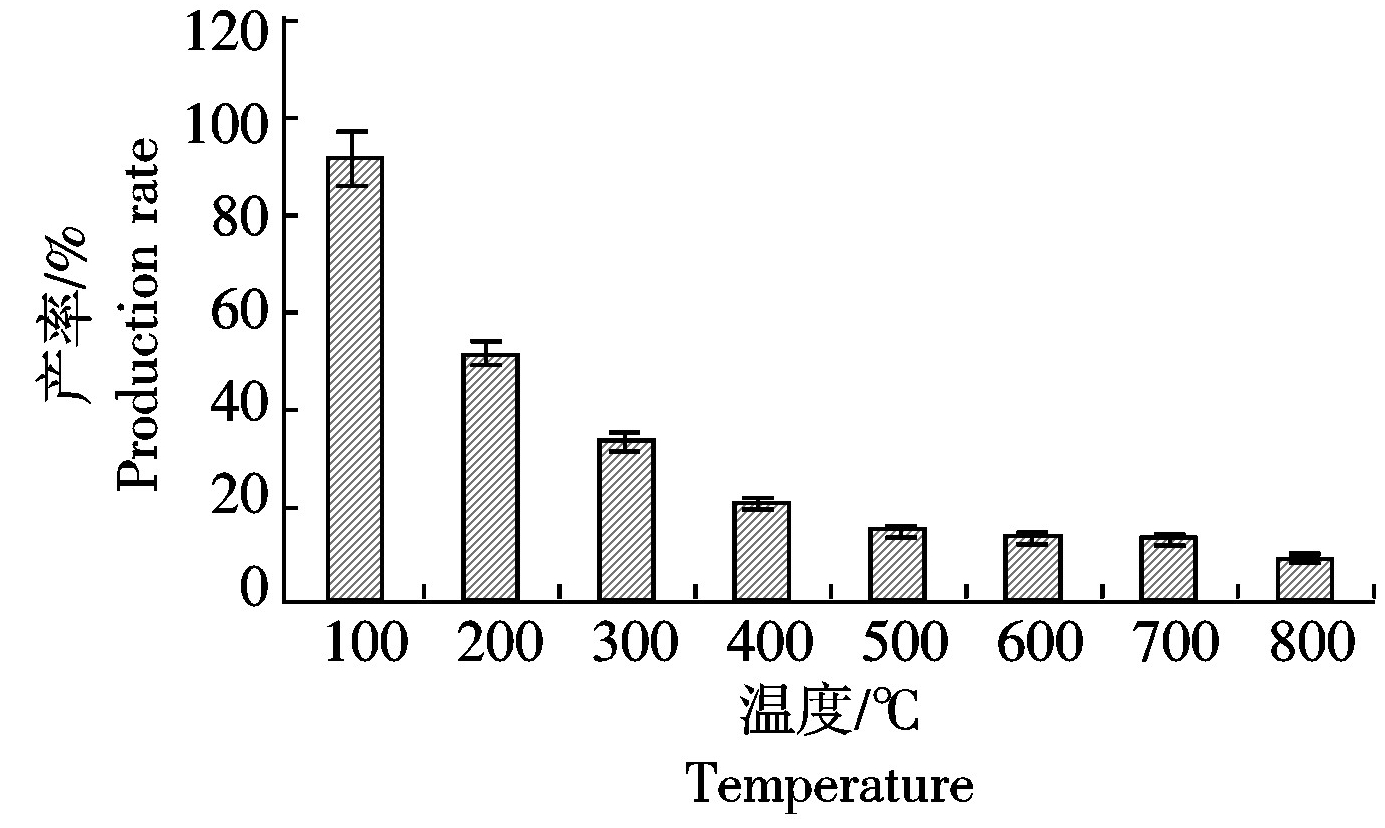
图2 不同温度下小麦秸秆炭化产率的变化
Fig.2 Production rate of wheat-straw-biochar under different temperature
2.2 小麦秸秆生物炭孔隙状况随热解温度的变化
热解温度对小麦秸秆生物炭的孔隙结构有较大影响。由表1可知,随着热解温度的升高,小麦秸秆生物炭的比表面积及比孔容均是先升高再下降,比表面积在400 ℃达到最大值6.675 m2/g。100~600 ℃范围内,小麦秸秆生物炭的孔径随热解温度的升高先增大后减小,400 ℃达到最大值,在700,800 ℃略有回升。据有关研究,生物炭的吸附性能主要由其孔结构[17](孔形状、孔径及分布和表面官能团)[18]决定,孔结构对生物炭的性能影响很大[19],关系到生物炭保持养分离子的能力[20]。而生物炭的比表面积主要来自于微孔的贡献,而中孔含量对孔容有较大影响[21]。从表1看到,微孔比表面积和中孔孔容均随热解温度的升高先增大后减小,400 ℃时小麦秸秆生物炭的微孔比表面积及中孔孔容均达到最大值。由此可知,400~500 ℃条件下形成的小麦秸秆生物炭保持养分离子的能力最强。从表2的相关性分析可知,不同热解温度下小麦秸秆生物炭孔隙的比表面积与比孔容、中孔比表面积及中孔孔容存在极显著相关关系,孔径与比孔容、微孔比表面积及中孔孔容显著相关,比孔容与微孔比表面积显著相关,与中孔比表面积及中孔孔容呈极显著相关。孔径越大,比表面积、比孔容越大。此外,微孔比表面积与中孔比表面积有显著相关,与中孔孔容呈极显著相关,即微孔比表面积越大,中孔比表面积和中孔孔容越大,保持养分离子的能力就越强。
表1 小麦秸秆生物炭的比表面积和孔结构参数
Tab.1 Specific surface area and pore structure parameters of wheat-straw-biochar under different pyrolysis temperature
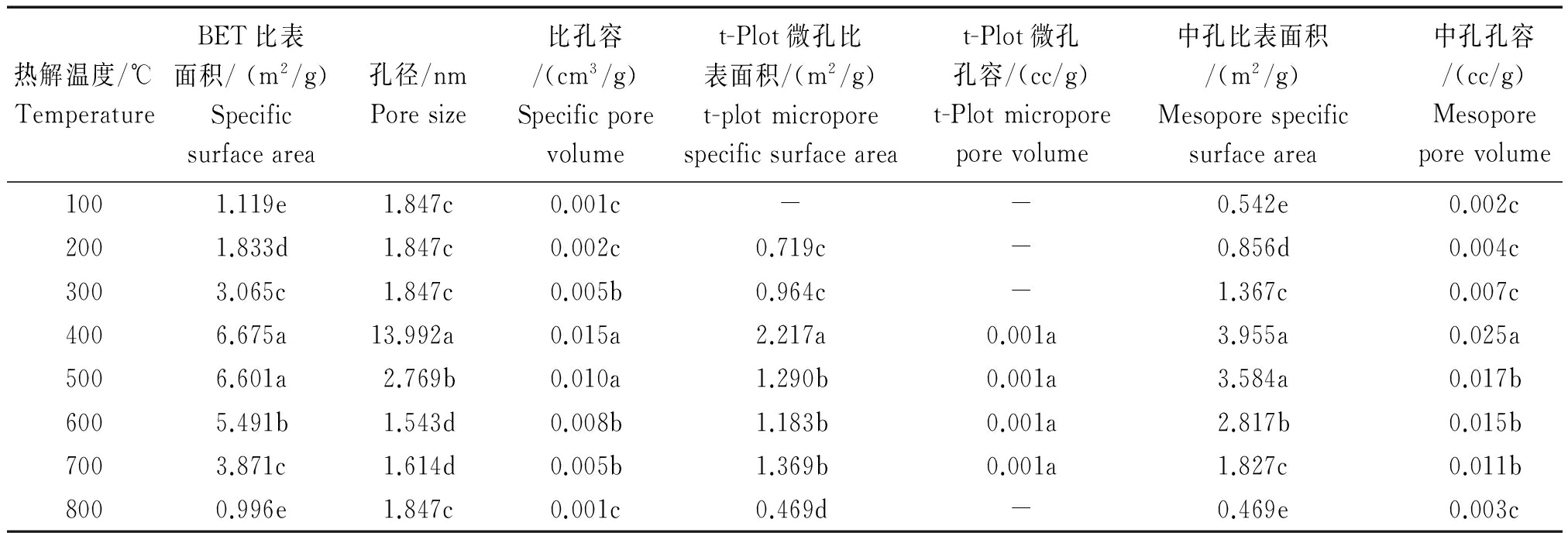
热解温度/℃TemperatureBET比表面积/(m2/g)Specificsurfacearea孔径/nmPoresize比孔容/(cm3/g)Specificporevolumet-Plot微孔比表面积/(m2/g)t-plotmicroporespecificsurfaceareat-Plot微孔孔容/(cc/g)t-Plotmicroporeporevolume中孔比表面积/(m2/g)Mesoporespecificsurfacearea中孔孔容/(cc/g)Mesoporeporevolume1001.119e1.847c0.001c--0.542e0.002c2001.833d1.847c0.002c0.719c-0.856d0.004c3003.065c1.847c0.005b0.964c-1.367c0.007c4006.675a13.992a0.015a2.217a0.001a3.955a0.025a5006.601a2.769b0.010a1.290b0.001a3.584a0.017b6005.491b1.543d0.008b1.183b0.001a2.817b0.015b7003.871c1.614d0.005b1.369b0.001a1.827c0.011b8000.996e1.847c0.001c0.469d-0.469e0.003c
注:表中同列数据后不同小写字母表示各处理间差异性显著( P<0.05);-.未检测到数值。表3同。
Note:Different lowercase letters in the same column stand for significant differences among treatments ( P<0.05);-.Not detected.The same as Tab.3.
表2 不同温度下小麦秸秆炭化后比表面积和孔结构参数的相关性分析
Tab.2 The correlation of specific surface area and pore structure parameters of wheat-straw-biochar under different temperature
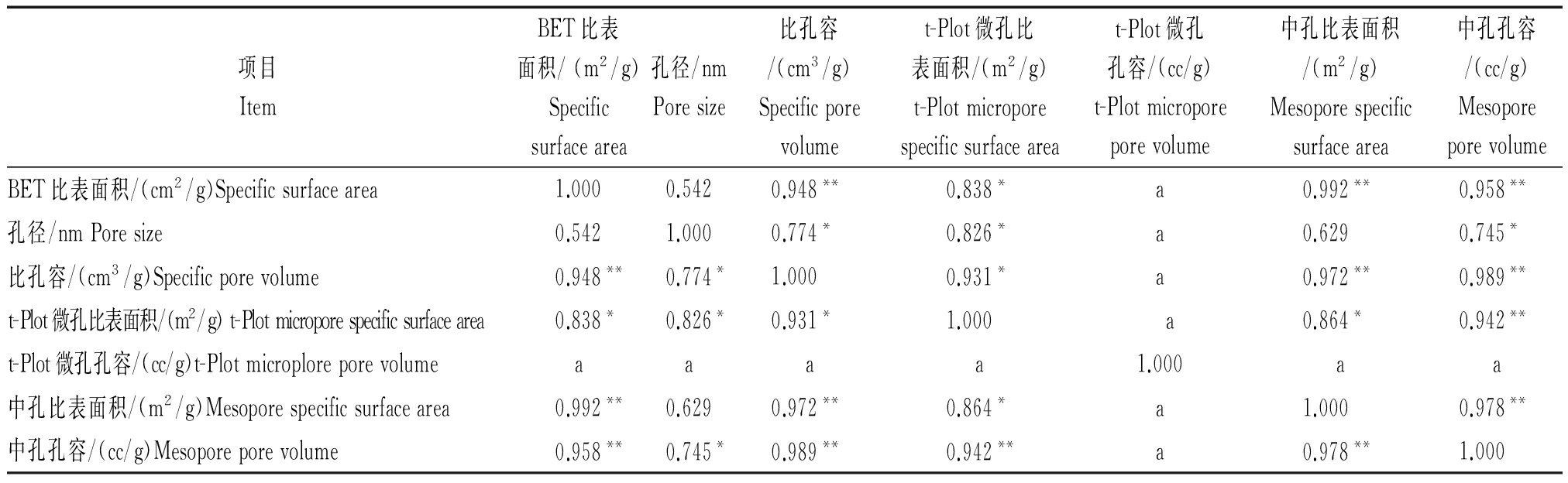
项目ItemBET比表面积/(m2/g)Specificsurfacearea孔径/nmPoresize比孔容/(cm3/g)Specificporevolumet-Plot微孔比表面积/(m2/g)t-Plotmicroporespecificsurfaceareat-Plot微孔孔容/(cc/g)t-Plotmicroporeporevolume中孔比表面积/(m2/g)Mesoporespecificsurfacearea中孔孔容/(cc/g)MesoporeporevolumeBET比表面积/(cm2/g)Specificsurfacearea1.0000.5420.948**0.838*a0.992**0.958**孔径/nmPoresize0.5421.0000.774*0.826*a0.6290.745*比孔容/(cm3/g)Specificporevolume0.948**0.774*1.0000.931*a0.972**0.989**t-Plot微孔比表面积/(m2/g)t-Plotmicroporespecificsurfacearea0.838*0.826*0.931*1.000 a0.864*0.942**t-Plot微孔孔容/(cc/g)t-Plotmicroploreporevolumeaaaa1.000aa中孔比表面积/(m2/g)Mesoporespecificsurfacearea0.992**0.6290.972**0.864*a1.0000.978**中孔孔容/(cc/g)Mesoporeporevolume0.958**0.745*0.989**0.942**a0.978**1.000
注:**.在0.01 水平(双侧)上显著相关;*.在 0.05 水平(双侧)上显著相关;a.因为至少有一个变量为常量,所以无法进行计算。
Note:**.The two asterisks represent the significant correlation on the level of 0.01;*.The asterisk represent the significant correlation on the level of 0.05;a. For at least one variable is constant,so can′t to calculate.
2.3 不同温度下小麦秸秆炭化后全碳及无机碳含量的变化
热解温度决定着热解过程中碳的损失,随着热解温度的升高,纤维素、半纤维素、木质素等组分热裂解失重增加,生物炭中残留碳含量有所减少[22]。由图3可知,100~200 ℃时,炭化后的小麦秸秆重量减轻,全碳所占比率急剧增加,在300 ℃达到最大值39.48%,此时大量的结合水散失,半纤维素、纤维素部分分解。热解温度为800 ℃时全碳含量所占的比重略有增加。
由图4可知,热解温度为200~300 ℃时,无机碳在总碳中所占比例较小,即有机碳占有较高的比例,且200~400 ℃的热解温度得到的生物炭拥有较大的炭化产率。结合图3,4,小麦秸秆在200~400 ℃炭化得到的生物炭具有较高的有机碳含量。Schipper等[23]指出,土壤有机碳含量是评价土壤质量的一个重要指标,它与土壤物理、化学以及生物学性质密切相关,其含量的提高不仅可以增加土壤持水量和养分的有效性,更有助于缓解温室气体对环境的影响。即200~400 ℃热解得到的小麦秸秆生物炭还田后有增加土壤保水保肥能力的效果。
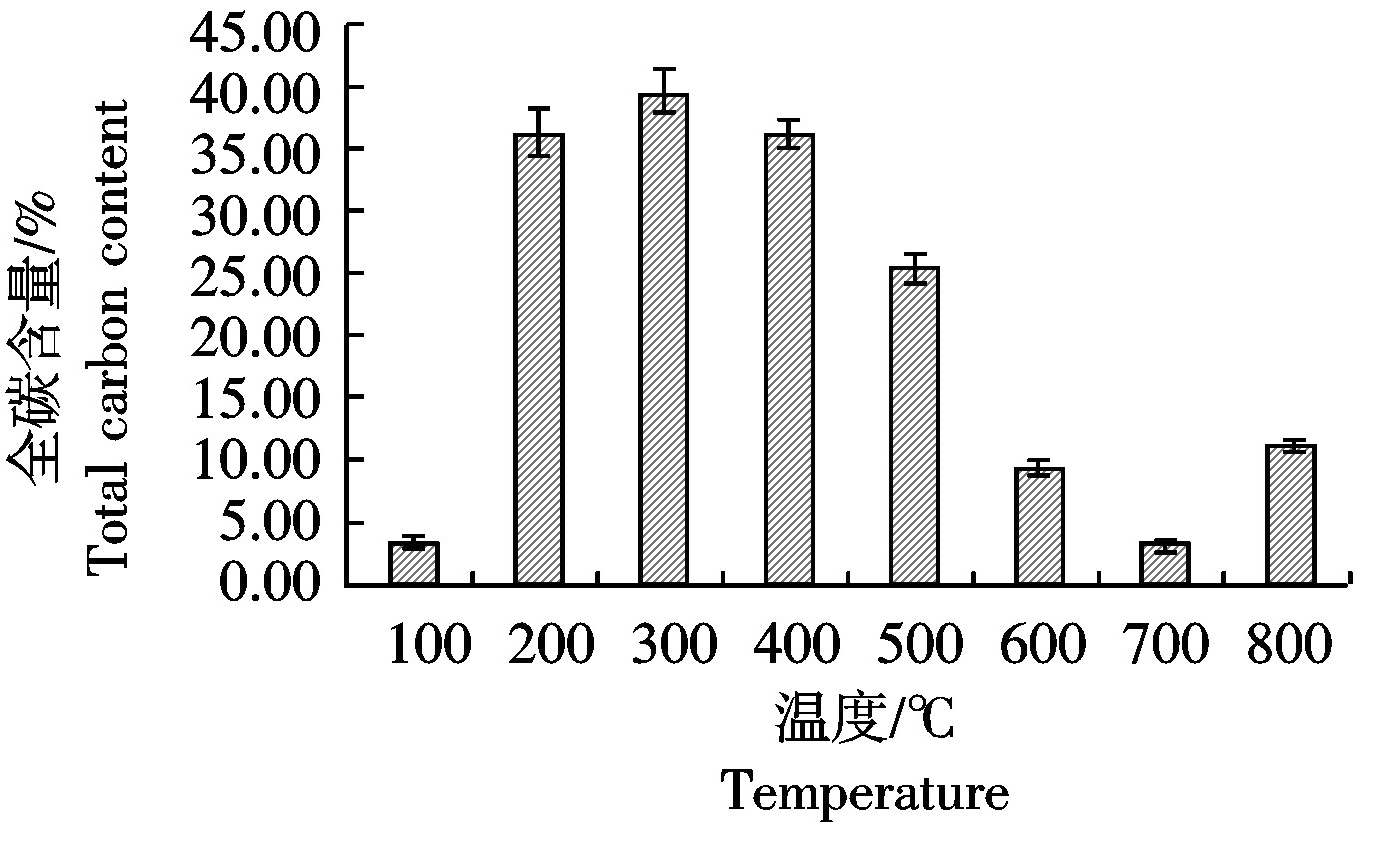
图3 不同温度下小麦秸秆炭化后全碳含量的变化
Fig.3 Total carbon content of wheat-straw-biochar under different temperature
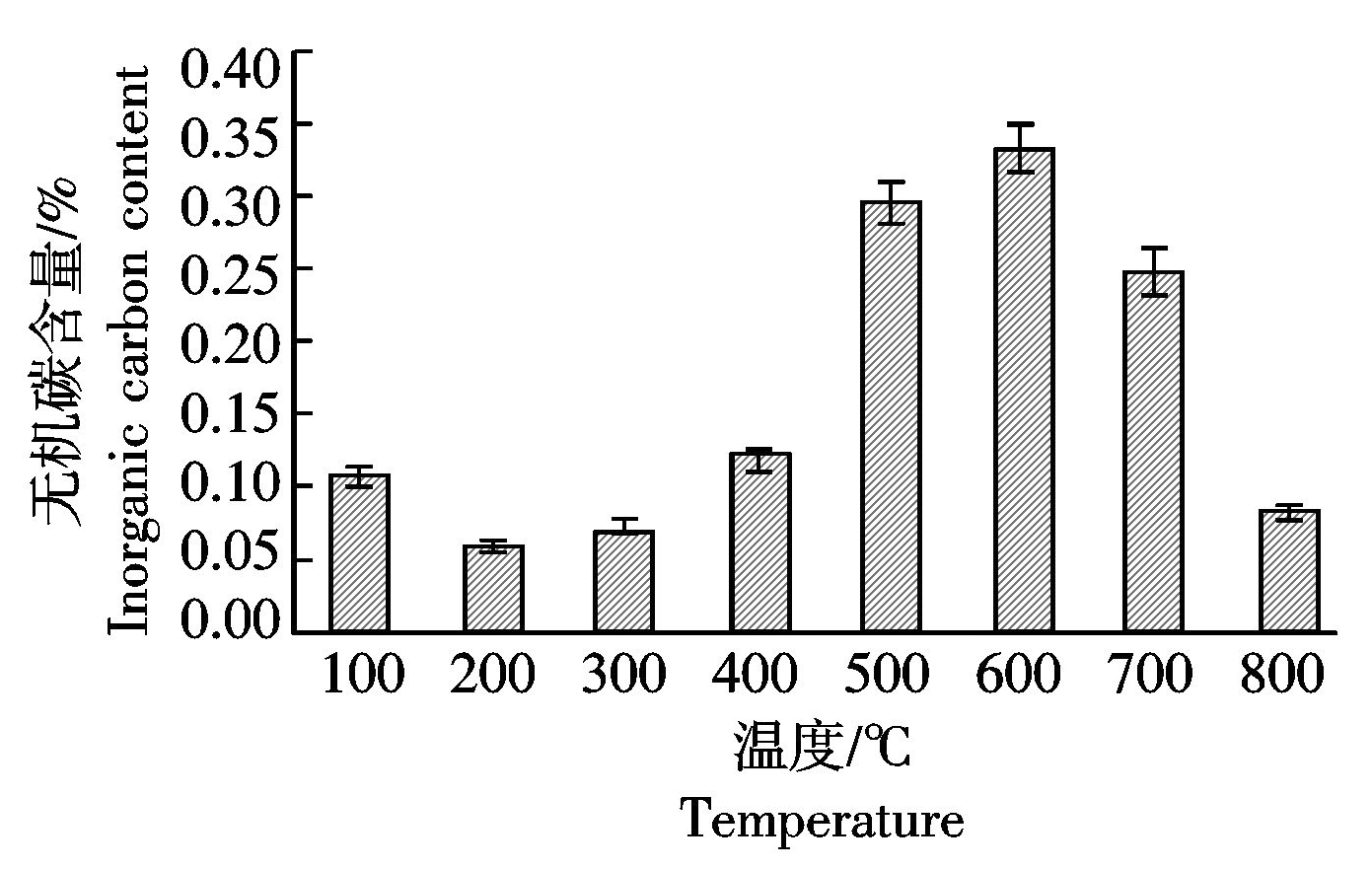
图4 不同温度下小麦秸秆炭化后无机碳含量的变化
Fig.4 Inorganic carbon content of wheat-straw-biochar under different temperature
2.4 不同温度下小麦秸秆炭化后 CEC的变化
土壤CEC是土壤缓冲性能的主要来源,可作为评价土壤保肥能力的指标,生物炭的CEC含量反映了生物炭对外界阳离子的交换能力[24]。由图5可知,小麦秸秆生物炭CEC的含量整体表现出随着热解温度的升高而增加的趋势。100~400 ℃小麦秸秆生物炭的CEC含量急剧升高,600 ℃时,CEC含量达到最大值84.35 cmol/kg,之后趋于稳定。由此可见,400~800 ℃炭化出的小麦秸秆生物炭CEC含量较高,为69.13~84.35 cmol/kg施入土壤后可消耗土壤质子,提高对阳离子的吸附,进而提高土壤保肥能力,更适于添加酸性土壤用于提高土壤 pH 值,提高一些养分的有效性[25]。
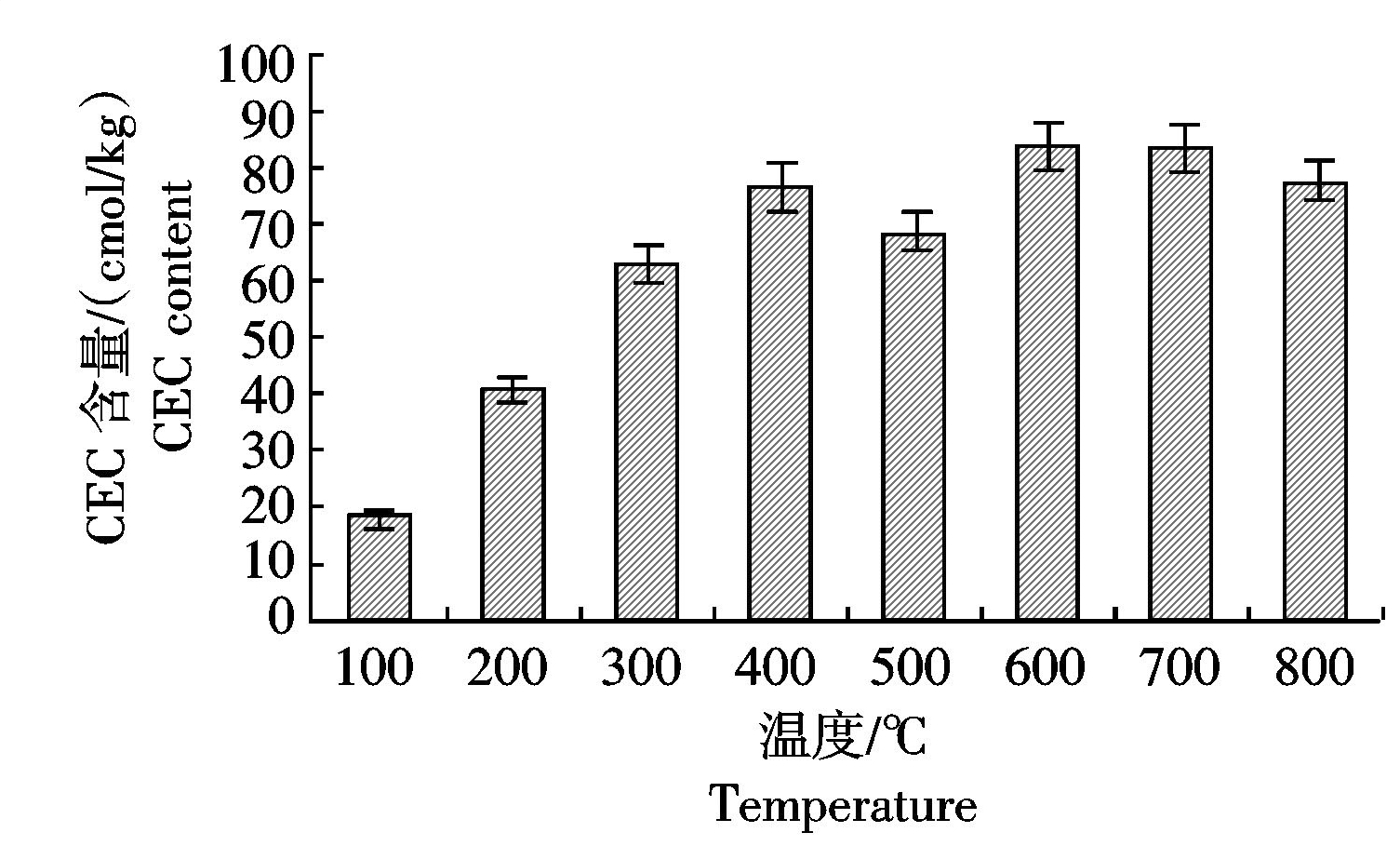
图5 不同温度下小麦秸秆炭化后CEC含量的变化
Fig.5 CEC content of wheat-straw-biochar under different temperature
2.5 不同温度下小麦秸秆炭化后表面含氧官能团及pH值的变化
随热解温度升高,小麦秸秆生物炭的碱性官能团数量呈现逐渐增加趋势,600~700 ℃达到最高水平;而酸性官能团数量表现出先增大后降低趋势,300 ℃升高至最大值3.50 mmol/g,700~800 ℃略有回升。生物炭的表面酸性官能团具有阳离子交换特性,有利于吸附各种极性较强的化合物,因此酸性极性官能团数量的差异可能会影响生物炭的亲水性及其对重金属离子的吸附[26]。由表3可知,随着热解温度的升高,小麦秸秆生物炭表面的酚羟基和羧基数量的变化趋势与酸性官能团数量类似,400 ℃之后酚羟基显著减少;而内酯基所占的比重逐渐增大。
由图6可知,在热解温度为100~300 ℃,小麦秸秆生物炭pH值<7,呈酸性。热解温度为300~500 ℃,小麦秸秆生物炭pH值增加明显,400 ℃后表现出强碱性。随着热解温度的进一步升高,pH值变化较小,保持在10左右。700 ℃时小麦秸秆生物炭pH值达到最大值,为10.45。热解温度为800 ℃时,pH值略有下降。结合表3,pH值的整个变化过程与生物炭表面含氧官能团的变化规律相似。
表3 小麦秸秆生物炭表面含氧官能团随热解温度的变化
Tab.3 The change of oxygen-containing functional group content of wheat-straw-biochar on the surface of under different temperature
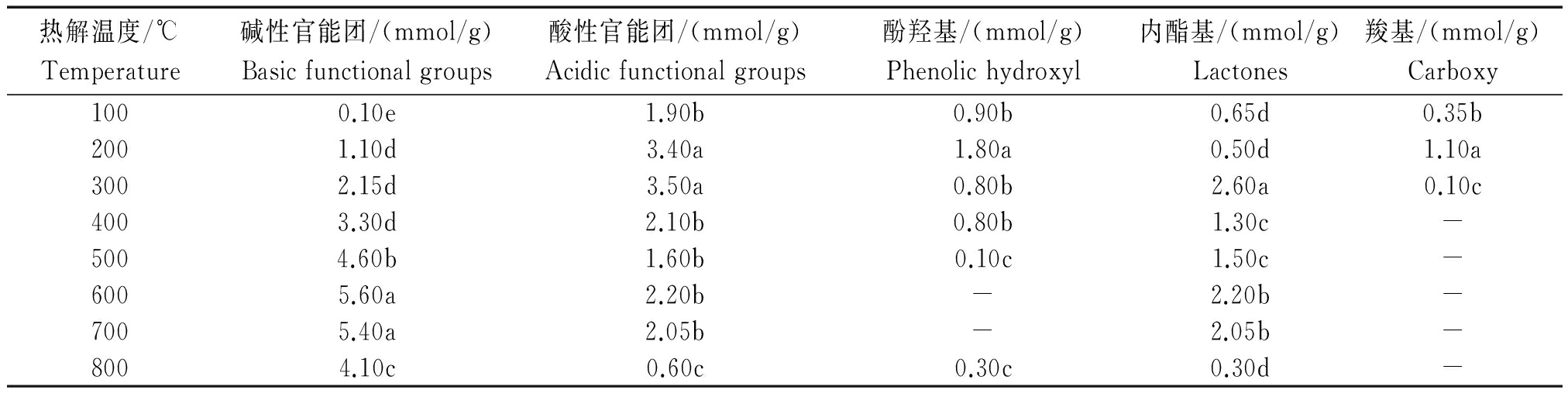
热解温度/℃Temperature碱性官能团/(mmol/g)Basicfunctionalgroups酸性官能团/(mmol/g)Acidicfunctionalgroups酚羟基/(mmol/g)Phenolichydroxyl内酯基/(mmol/g)Lactones羧基/(mmol/g)Carboxy1000.10e1.90b0.90b0.65d0.35b2001.10d3.40a1.80a0.50d1.10a3002.15d3.50a0.80b2.60a0.10c4003.30d2.10b0.80b1.30c-5004.60b1.60b0.10c1.50c-6005.60a2.20b-2.20b-7005.40a2.05b-2.05b-8004.10c0.60c0.30c0.30d-
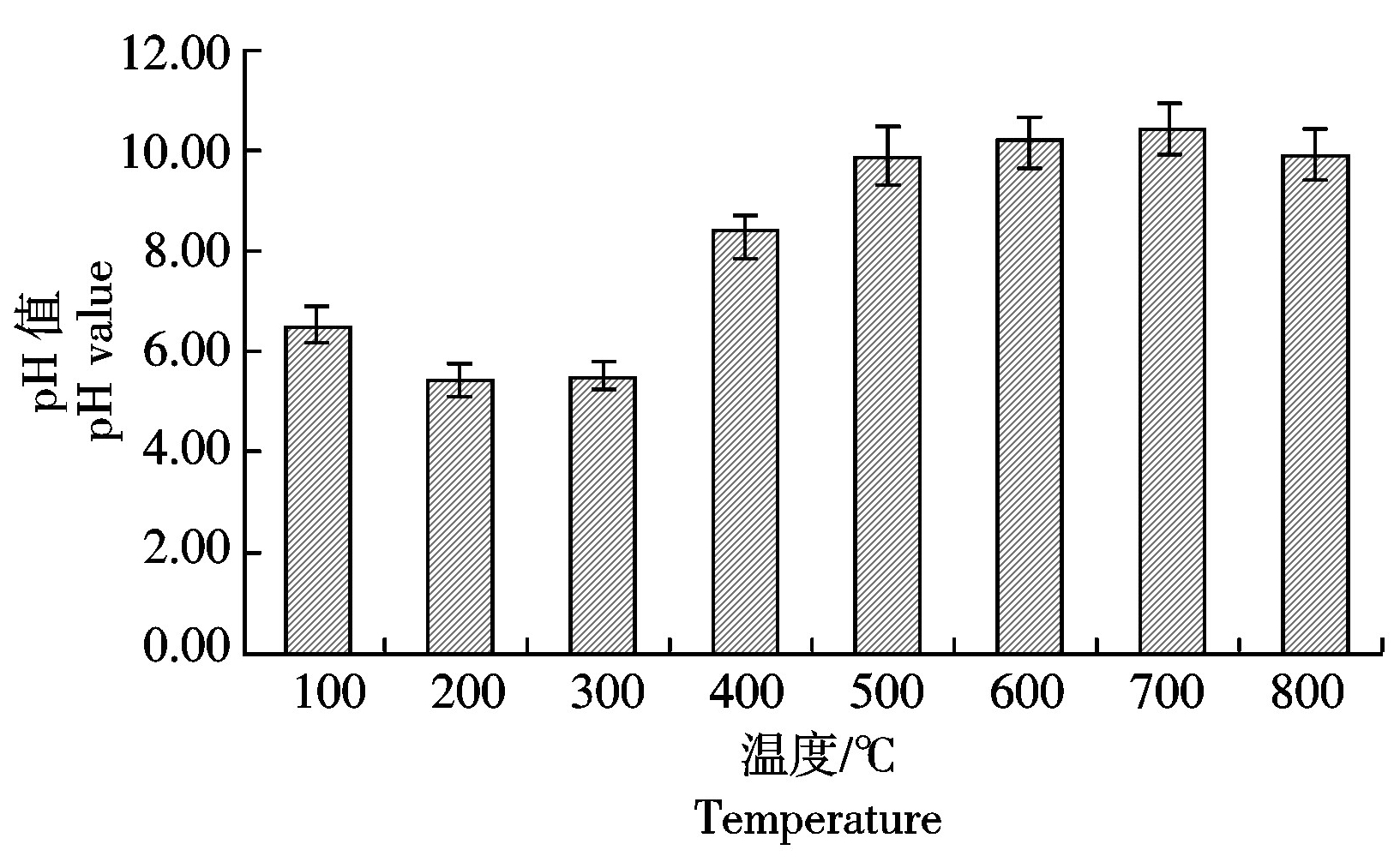
图6 不同温度下小麦秸秆炭化后pH值的变化
Fig.6 pH of wheat-straw-biochar under different temperature
2.6 不同温度下小麦秸秆炭化后的FTIR图谱
由图7可以看到,3 443 cm-1左右谱峰强度随着热解温度的升高而减弱,说明羟基随热解温度升高逐渐减少,特别是300~400 ℃之后脱羟基作用更加明显。2 916,2 852 cm-1处谱峰分别代表亚甲基的反对称伸缩振动和对称伸缩振动[27],由图7可知,随着热解温度的升高,亚甲基逐渐被降解或改变,说明温度升高发生了脱甲氧基、脱甲基和木质素的脱水反应,意味着不稳定的脂肪族化合物随着热解温度升高而减少[16]。在1 727~1 383 cm-1出现强度不等的4个峰,即芳香烃的伸缩振动,谱峰随热解温度升高而变宽变大,说明形成了大量的π共轭芳香结构[28],芳香化程度逐渐升高。1 118 cm-1处为纤维素、半纤维素中的对称性C-O的伸缩振动吸收峰[29],随着温度的升高,谱峰逐渐减弱,说明纤维素、半纤维素在小麦秸秆的热解过程中被大量分解。1 041 cm-1附近的谱峰为SiO2的伸缩振动,随着温度的升高,谱峰变宽,500 ℃之后谱峰开始升高,意味着SiO2的增加,说明小麦秸秆炭化愈加完全。
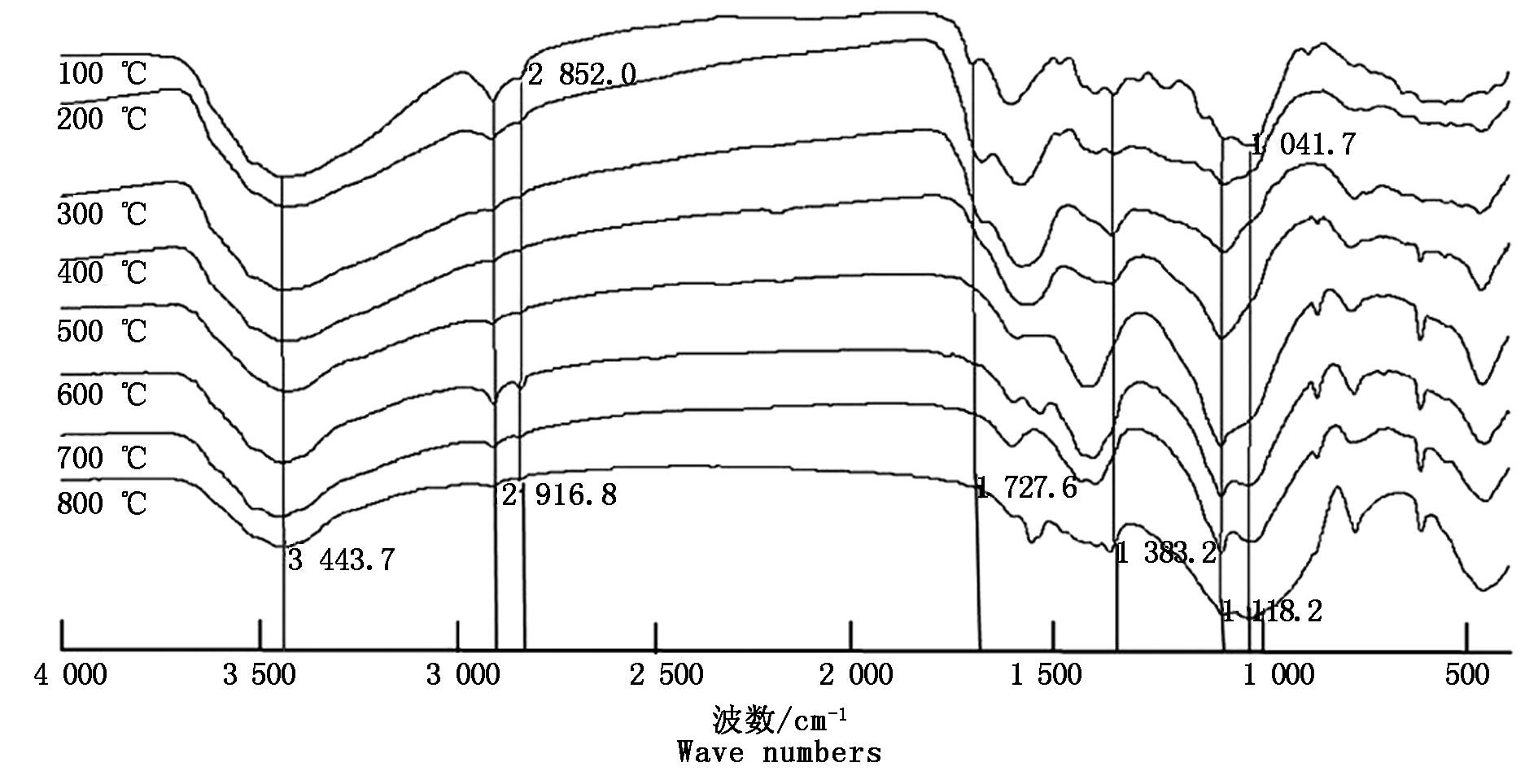
图7 不同温度下小麦秸秆炭化后的FTIR图谱
Fig.7 FTIR spectra of wheat-straw-biochar under different temperature
本研究表明,小麦秸秆生物炭的产率在100~400 ℃随温度的升高而降低,而500 ℃以后的产率变化较小,基本保持稳定。赵蒙蒙等[30]研究表明,小麦秸秆中纤维素与半纤维素的含量占到68.81%,木质素仅占24.49%。纤维素在52 ℃时开始热分解,随着温度升高降解逐步加剧,至350~370 ℃时降解为低分子碎片,半纤维素在225~325 ℃分解,其热解机制与纤维素相似,木质素由3种苯丙烷单体组成,是含有丰富支链结构的聚合体,受热时主要发生脱侧链和缩合反应[31]。王宗华等[32]也认为,400 ℃之前主要是半纤维素、纤维素和木质素发生强烈分解释放出大量挥发组分,当温度高于500 ℃时,半纤维素和纤维素的热分解基本结束,木质素较难分解,其分解跨越整个热解过程。因此,200 ℃之前主要是小麦秸秆的吸附水脱除,部分半纤维素和纤维素结构裂解生成水挥发,秸秆快速失重,300 ℃时纤维素分解半完全,木质素开始降解,400 ℃之后就仅是木质素的热解,因此产率变化较小,这与小麦秸秆组成中木质素占极小一部分的结果吻合。
热解温度100~400 ℃,小麦秸秆生物炭随着温度的升高,比表面积增加,孔径变大,同时比孔容变大,尤其在300~400 ℃,有助于生物质炭开孔作用,孔结构发育更完全。在400 ℃的热解温度下微孔的比表面积和中孔孔容出现了极大值,此时炭化后的小麦秸秆结构疏松,含有丰富的孔隙结构,极大地增大了孔隙度和比表面积,有关研究的电镜照片也有此结论[15]。继400 ℃之后孔径、微孔比表面积及中孔孔径等指标均随热解温度升高而减小,结合FTIR图谱中300~400 ℃之后强烈的脱羟基作用,可能是在较400 ℃之后更高的热解温度下,由于稠环结构的协同变化,-OH和-CH2-的烧失引起孔变形[33]。而生物炭孔径在700~800 ℃略有回升,微孔比表面积也在700 ℃时略有升高,800 ℃时急剧减少,猜测是反应过剧造成孔隙过大引起了部分结构的坍塌[34],800 ℃时炭化趋于完全导致孔结构破碎。侯建伟等[15]的沙蒿生物炭电镜扫描照片也显示,炭化温度达到700 ℃时,髓部孔隙增大并开始外化破裂,800 ℃时韧皮部、木质部及髓呈簇状脱落,主体部分被较大程度破坏。
小麦秸秆生物炭中CEC含量随热解温度的升高而升高,300~800 ℃保持较高水平,热解温度为500 ℃时CEC含量略有下降。而姚红宇等[35]在不同炭化温度(300,450,600 ℃)下对制备出的棉秆炭研究表明,其CEC含量随炭化温度的升高而降低。这种不同主要是由生物质材料的不同以及生物质炭中芳香族碳结构的差异造成的[36]。Jensen等[37]研究表明,生物炭的CEC含量与氧原子和碳原子的比值(O/C)相关,O/C比值越高,CEC值越大。500 ℃时CEC含量的下降意味着O/C 的降低,说明含氧官能团如羟基、羧基和羰基等被大量烧失,这与500 ℃时酸性官能团含量急剧减少相吻合。
热解温度在300~700 ℃时,小麦秸秆生物质pH值基本保持稳定上升,表面含氧官能团的组成发生变化,碱性官能团的数目逐渐增多,酸性官能团逐渐减少,芳香化程度逐渐增大。这主要是因为高温热解能使大量羧基和酚羟基高度酯化,可解离质子减少,表面高度共轭的芳香结构是其呈碱性的主要原因[28]。但热解温度达到800 ℃时,pH值略有下降,这可能与热解残留物质的脱氢脱氧过程有关[38]。随炭化温度的升高,氢、氧元素以气体形式逸出,且温度进一步升高,氢、氧元素越多地与碳元素形成高热值组分逸出[39],可能在逸出的过程中残留了部分酸性盐。但也有研究认为是部分氮化合物逸出,生物质中的一些氮存在于芳香杂环化合物(吡啶核苷酸或核酸)中,较高温度下生物质热解将产生H自由基,这些H自由基使芳香杂环中的含氮部位活化,进而在生物焦二次裂解中氢化生成NH3或者HCN逸出[32]。高温下这些气体的逸出也正是造成800 ℃热解温度下全碳相对含量升高的原因。
综合考虑小麦秸秆生物炭的各项指标以及制备成本,400 ℃左右的热解温度较好。
参考文献:
[1] 姜志翔,郑 浩,李锋民,等.生物炭碳封存技术研究进展[J].环境科学,2013,34(8):3327-3333.
[2] Lehmann J D,Joseph S. Biochar for environmental management:science and technology[J]. Science and Technology;Earthscan,2009,25(11):15801-15811.
[3] Atkinson C J,Fitzgerald J D,Hipps N A. Potential mechanisms for achieving agricultural benefits from biochar application to temperate soils:a review[J]. Plant and Soil,2010,337(1/2):1-18.
[4] Xu G,Lv Y C,Sun J N,et al. Recent advances in biochar applications in agricultural soils:benefits and environmental implications[J]. Clean-Soil Air Water,2012,40(10,SI):1093-1098.
[5] Asai H,Samson B K,Stephan H M,et al. Biochar amendment techniques for upland rice production in Northern Laos:1. Soil physical properties,leaf SPAD and grain yield[J]. Field Crops Research,2009,111(1/2):81-84.
[6] Aburas H,Demirbas A. Evaluation of beech for production of bio-char,bio-oil and gaseous materials[J]. Process Safety and Environmental Protection,2015,94:29-36.
[7] 陶思源.关于我国农业废弃物资源化问题的思考[J].理论界,2013(5):28-30.
[8] 李飞跃,汪建飞.中国粮食作物秸秆焚烧排碳量及转化生物炭固碳量的估算[J].农业工程学报,2013(14):1-7.
[9] 林雪原,荆延德,巩 晨,等.生物炭吸附重金属的研究进展[J].环境污染与防治,2014,36(5):83-87.
[10] 范世锁,汤 婕,程 燕,等.污泥基生物炭中重金属的形态分布及潜在生态风险研究[J].生态环境学报,2015(10):1739-1744.
[11] 郎印海,刘 伟,王 慧.生物炭对水中五氯酚的吸附性能研究[J].中国环境科学,2014(8):2017-2023.
[12] 张伟明,孟 军,王嘉宇,等.生物炭对水稻根系形态与生理特性及产量的影响[J].作物学报,2013,39(8):1445-1451.
[13] Verheijen F,Jeffery S,Bastos A C. Biochar application to Soils-A critical scientific review of effects on Soil properties,processes and functions[M]. Luxembourg:Office for the Official Publications of the European Communities,2009:149.
[14] 徐 勇,吕成福,陈国俊,等.川东南龙马溪组页岩孔隙分形特征[J].岩性油气藏,2015,27(4):32-39.
[15] 侯建伟,索全义,梁 桓,等.炭化温度对沙蒿生物炭形貌特征和化学性质的影响[J].土壤,2014(5),814-818.
[16] 朱金陵,何晓峰,王志伟,等.玉米秸秆颗粒热解制炭的试验研究[J].太阳能学报,2010,31(7):789-793.
[17] Beesley L,Marmiroli M. The immobilisation and retention of soluble Arsenic,Cadmium and Zinc by biochar[J]. Environmental Pollution,2011,159(2):474-480.
[18] Lee J W,Kidder M,Evans B R,et al. Characterization of biochars produced from cornstovers for soil amendment[J]. Environmental Science & Technology,2010,44(20):7970-7974.
[19] 王 宁,侯艳伟,彭静静,等.生物炭吸附有机污染物的研究进展[J].环境化学,2012,31(3):287-295.
[20] 王 欣,尹带霞,张 凤,等.生物炭对土壤肥力与环境质量的影响机制与风险解析[J].农业工程学报,2015(4):248-257.
[21] 林晓芬,张 军,尹艳山,等.生物质炭孔隙分形特征研究[J].生物质化学工程,2009,43(3):9-12.
[22] 罗 煜,赵立欣,孟海波,等.不同温度下热裂解芒草生物质炭的理化特征分析[J].农业工程技术:新能源产业,2013(7):52.
[23] Schipper L A,Sparling G P. Accumulation of soil organic C and change in C:N ratio after establishment of pastures on reverted scrubland in New Zealand[J]. Biogeochemistry,2011,104(1/3):49-58.
[24] 王 群,李飞跃,曹心德,等.植物基与固废基生物炭的结构性质差异[J].环境科学与技术,2013(8):1-5.
[25] 袁 帅,赵立欣,孟海波,等.生物炭主要类型、理化性质及其研究展望[J].植物营养与肥料学报,2016,22(5):1402-1417.
[26] 安增莉,侯艳伟,蔡 超,等.水稻秸秆生物炭对Pb(Ⅱ)的吸附特性[J].环境化学,2011,30(11):1851-1857.
[27] 郑庆福,王永和,孙月光,等.不同物料和炭化方式制备生物炭结构性质的FTIR研究[J].光谱学与光谱分析,2014(4):962-966.
[28] 李 力,陆宇超,刘 娅,等.玉米秸秆生物炭对Cd(Ⅱ)的吸附机理研究[J].农业环境科学学报,2012(11):2277-2283.
[29] 丁文川,田秀美,王定勇,等.腐殖酸对生物炭去除水中Cr(VI)的影响机制研究[J].环境科学,2012,33(11):3847-3853.
[30] 赵蒙蒙,姜 曼,周祚万.几种农作物秸秆的成分分析[J].材料导报,2011,25(16):122-125.
[31] 赵超超,杜官本.操作条件对生物质热解的影响研究[J].林业机械与木工设备,2009,37(5):7-10.
[32] 王宗华,张军营,赵永椿,等.生物质热解过程中NO,NH3和HCN的释放特性[J].燃料化学学报,2011,39(2):99-102.
[33] Bagreev A A,Broshnik A P,Strelko V V,et al. Effect of oxidizing treatment of walnut shell on the properties of activated Carbon[J]. Russian Journal of Applied Chemistry,2001,74(9):1453-1457.
[34] 夏笑虹,石 磊,何月德,等.炭化温度对烟杆基活性炭孔结构及电化学性能的影响研究[J].化学学报,2011,69(21):2627-2631.
[35] 姚红宇,唐光木,葛春辉,等.炭化温度和时间与棉杆炭特性及元素组成的相关关系[J].农业工程学报,2013(7):199-206.
[36] Fontecha-Cámara M A,López-Ramón M V,Alvarez-Merino M A,et al. Effect of surface chemistry,solution pH,and Ionic strength on the removal of herbicides diuron and amitrole from water by an activated Carbon fiber[J]. Langmuir :the ACS Journal of Surfaces and Colloids,2007,23(3):1242-1247.
[37] Jensen A,Dam-Johansen K,Wójtowicz M A,et al. TG-FTIR study of the influence of Potassium chloride on wheat straw pyrolysis[J]. Energy & Fuels,1998,12(5):929-938.
[38] Greil P. Biomorphous ceramics from lignocellulosics[J]. Journal of the European Ceramic Society,2001,21(2):105-118.
[39] 何莉莉.生物炭对土壤微生态环境的影响及机理研究[D].北京:中国林业科学研究院,2013.
Effects of Carbonization Temperature on Biochar Yield and Physicochemical Properties from Wheat-straw
Abstract:The paper studied the effects of carbonization temperature on biochar yield and the physicochemical properties from wheat-straw improved the application of wheat-straw biochar,in order to further expound the mechanism of action of wheat straw biochar.The effects of different carbonization temperatures(100,200,300,400,500,600,700,800 ℃)on wheat-straw biochar yield and the physicochemical properties (porosity condition,the content of total carbon and inorganic carbon,CEC content,oxygen-containing functional group,pH and FTIR) were studied through mionectic carbonization with the heating rate of 20 ℃/min. Fourier transform infrared spectrometer was used to obtain infrared spectra and the reasons for the changes of biochar physicochemical properties were analyzed.The wheat-straw of low temperature carbonization was acidic,after 400 ℃,was alkaline. The degree of wheat straw biochar carbonized increased with the increased of carbonization temperature,and the yield decreased from 91.32% to 18.52% in 100-400 ℃. In the carbonization process,the wheat-straw biochar porosity increased,the structure was loose. Pore size,specific surface area and specific pore volume showed first increased and then decreased trend,and all reached the maximum at 400 ℃,were 6.675 m2/g,13.992 nm,0.015 cm3/g respectively.In 200-400 ℃,the content of organic carbon was high. The content of CEC was maintained at a high level in 400-800 ℃,between 69.13-84.35 cmol/kg.The analysis of infrared spectrum and surface oxygen functional groups showed that,with the increase of pyrolysis temperature,the degree of aromatization of wheat-straw biochar increased,and the structure became more stable. The carbonization temperature of wheat-straw is more ideal at about 400 ℃.
Key words:Wheat-straw;Pyrolysis temperature;Biochar;Biochar yield;Physicochemical properties
收稿日期:2017-06-11
基金项目:烟草行业烟草栽培重点实验室资助项目;河南省烟草公司资助项目(HYKJ201301);重庆市烟草公司资助项目(NY20140401070010)
中图分类号:S210;X610
文献标识码:A
文章编号:1000-7091(2017)04-0201-07
doi:10.7668/hbnxb.2017.04.032