摘要:为了获得纯化的SnRK1.1与FD蛋白,分析蛋白激酶SnRK1.1是否能够磷酸化开花调控途径中的转录因子FD,成功克隆了1 608 bp的SnRK1.1基因以及858 bp的FD与FD-T282A基因,分别与PGEX-4T-3载体连接,获得原核表达载体GST-SnRK1.1、GST-FD和GST-FD-T282A,并分别转化大肠杆菌BL21菌株;SDS-PAGE电泳和考马斯亮蓝染色(CBB)表明,0.5 mmol/L IPTG能够成功诱导出GST-SnRK1.1、GST-FD和GST-FD-T282A蛋白。利用GST纯化介质纯化获得了84 kDa的GST-SnRK1.1蛋白以及58 kDa的GST-FD与GST-FD-T282A融合蛋白;利用体外磷酸化体系证实SnRK1.1能够磷酸化FD,不能磷酸化突变的FD-T282A。研究结果为进一步解析SnRK1.1通过磷酸化转录因子FD参与开花途径调控的机制奠定了良好的基础。
关键词:SnRK1.1;FD;蛋白激酶;转录因子;磷酸化
蛋白质所受的修饰调节直接影响其活性及生物学功能。磷酸化作为一种重要的蛋白质翻译后修饰,广泛参与植物的激素信号转导,抗逆境胁迫、气孔发育、光信号转导等多种生命活动[1-2]。近年来的研究表明,蛋白质磷酸化修饰也存在于植物开花调控过程中[3-5]。转录因子FD只有在被磷酸化之后才能与成花素蛋白FT以及生长调节因子14-3-3蛋白形成成花素激活复合体(FAC) [6-10]。蛋白激酶CPKs家族成员CPK6和CPK33能够磷酸化FD蛋白C末端第282位苏氨酸[11-13]。
笔者在筛选FD互作蛋白时发现了蛋白激酶SnRK1.1。SnRK1.1是植物蔗糖非发酵-1相关蛋白激酶SnRK1的催化亚基,此外,还有SnRK1.2和SnRK1.3 2个同源基因编码其催化亚基。SnRK1通常由1个催化亚基和2个具有调节功能的亚基组装成三聚体发挥功能[14-17]。SnRK1参与调控植物矿物质营养的摄取、脱落酸ABA信号转导、非生物/生物胁迫、逆境响应等很多植物生长发育过程 [18-20]。蛋白激酶SnRK1.1与CPKs都能识别并磷酸化具有R-X-X-pS/T-X-P氨基酸序列的蛋白 [21]。但是,SnRK1.1是否也能磷酸化转录因子FD尚不清楚。本研究从大肠杆菌中分别纯化了SnRK1.1、FD和FD-T282A(第282位丝氨酸突变为丙氨酸)融合蛋白,体外激酶试验检测发现SnRK1.1能够磷酸化转录因子FD,不能磷酸化带有突变位点的FD-T282A蛋白,表明T282位点参与SnRK1.1对转录因子FD的磷酸化作用。研究结果为后续研究SnRK1.1通过磷酸化转录因子FD参与植物开花调控提供了直接的证据。
1.1 试验材料
DH5α和BL21菌株由华北理工大学基因组学与计算生物学研究中心保存;基因克隆相关试剂购于大连生工公司;GST蛋白纯化介质、纯化柱和HRP标记的二抗购于美国Bio-Rad公司;anti-pThr抗体购于Sigma公司;Western Blot免疫印迹检测底物购于Pierce公司。
1.2 试验方法
1.2.1 FD、FD-T282A及SnRK1.1基因的克隆 分别利用各自的基因特异引物扩增获得全长基因。第282位苏氨酸靠近FD蛋白KC末端,因此可以直接设计带有突变位点的引物来扩增FD-T282A。所用的引物分别如下(下划线标注酶切位点):FD-BamH Ⅰ-F:5′-CGGGATCCATGTTGTCATCAGCTAAGCATC-3′,FD-Not Ⅰ-R:5′-ATAAGAATGCGGCCGCAAATGGAGCTGTGGAAGACCG-3′,FD-T282A-NotⅠ-R:5′-ATAAGAATGCGGCCGCTCAAAATGGAGCTGCGGAAGAC-3′,SnRK1.1-BamH I-F:5′-CGGGATCCATGGATGGATCAGGCACAGG-3′,SnRK1.1-NotⅠ-R:5′-ATAAGAATGCGGCCGCGAGGACTCGGAGCTGAGCA-3′。
1.2.2 GST-FD、GST-FD-T282A和GST-SnRK1.1表达载体构建 利用BamH Ⅰ和NotⅠ酶切扩增产物,连入PGEX-4T-3载体,分别获得GST-FD、GST-FD-T282A和GST-SnRK1.1表达载体。
1.2.3 GST-FD、GST-FD-T282A和GST-SnRK1.1蛋白纯化 离心收集菌体,弃上清,用样品缓冲液重悬沉淀。菌体经过超声破碎后于4 ℃,14 000 r/min离心15~20 min。将上清液于离心管中与纯化介质混合低温低速混匀2~3 h。500~1 000 r/min离心后舍弃上清,样品缓冲液重悬洗涤GST基质3次。利用适量体积的蛋白洗脱缓冲液与纯化介质孵育洗脱目标蛋白,可重复洗脱多次,再用浓缩管离心来收集目标蛋白。
1.2.4 蛋白质的透析与纯度检测 透析的目的是去除蛋白质溶液中的谷胱甘肽,避免对后续试验的影响。将纯化的蛋白溶液装入透析袋,置于装有适量透析液的烧杯中,缓慢搅拌,更换数次透析液,直至充分降低蛋白溶液中谷胱甘肽的浓度。透析后取0.5~1.0 μg蛋白,加入适量的2×SDS上样缓冲液,95 ℃加热10 min,12 000 r/min离心5 min,取上清液进行SDS-PAGE电泳,检测目标蛋白的质量。
1.2.5 体外激酶试验 将1.0 μg GST-SnRK1.1与0.5 μg GST-FD或者0.5 μg GST-FD-T282A在激酶反应缓冲液(40 mmol/L Tris.HCl,pH值7.4,1 mmol/L MgCl2,10 μmol/L ATP)中室温孵育20~30 min。然后利用Western Blot免疫印迹技术以及特异检测磷酸化修饰的抗体anti-pThr检测GST-FD或者GST-FD-T282A是否被GST-SnRK1.1磷酸化。
2.1 FD、FD-T282A基因的克隆及表达载体的构建
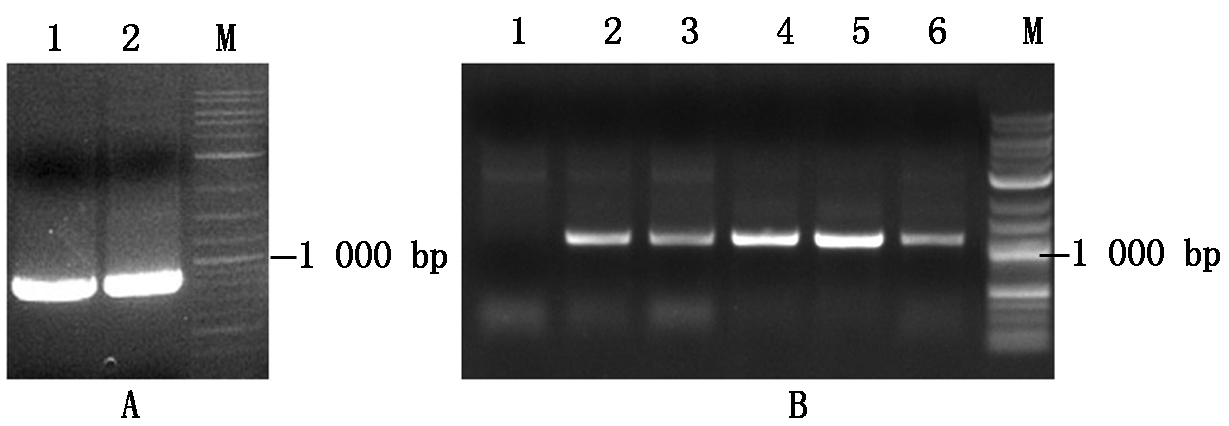
利用FD特异性引物PCR扩增,分别获得858 bp的FD和858 bp FD-T282A全长基因(图1-A)。将目的条带利用BamH Ⅰ和Not Ⅰ酶切后与表达载体PGEX-4T-3连接转化DH5α,菌落PCR扩增鉴定后测序获得正确的表达载体GST-FD和GST-FD-T282A(图1-B)。

A. PCR扩增FD基因:1. FD,2.突变的FD-T282A; B. GST-FD和GST-FD-T282A的菌落PCR扩增结果:1~3. GST-FD菌落,4~6. GST-FD-T282A菌落;M.DNA分子量标准。
A. PCR amplification of FD:1. FD gene,2. Mutated FD-T282A gene; B. Colony PCR amplification of GST-FD and GST-FD-T282A: 1-3. GST-FD colonies,4-6. GST-FD-T282A colonies;M.DNA Marker.
图1 FD表达载体的构建
Fig.1 Construction of expression vector of FD
2.2 SnRK1.1基因的克隆及表达载体的构建
利用SnRK1.1基因上下游引物扩增,获得1 608 bp的SnRK1.1全长基因(图2-A)。BamHⅠ和Not Ⅰ酶切后连接到PGEX-4T-3载体上,经菌落PCR及测序鉴定获得正确的表达载体GST-SnRK1.1(图2-B)。
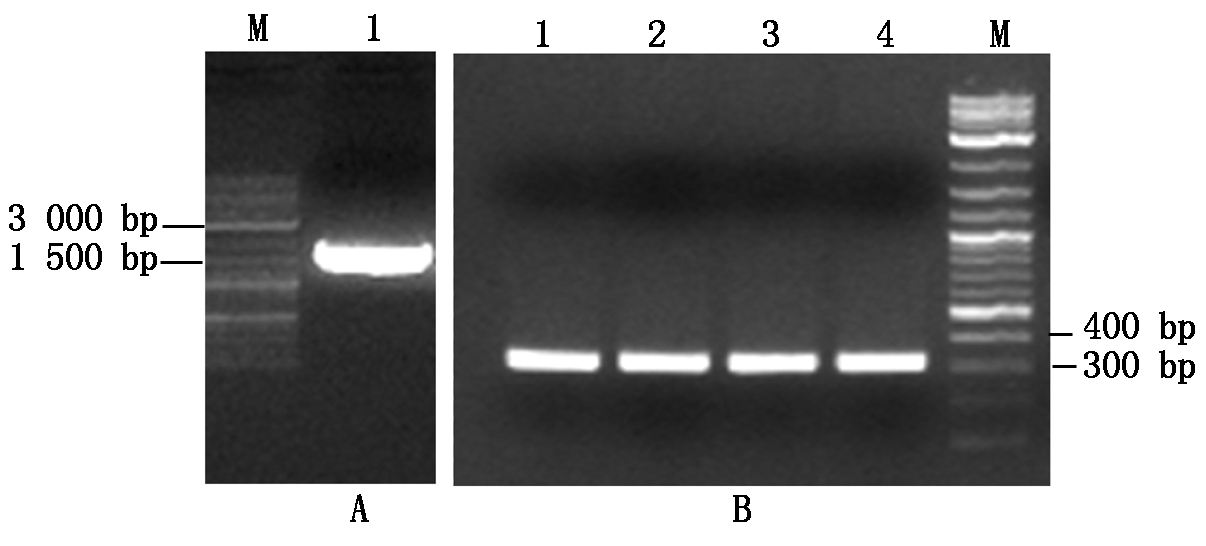
A. PCR扩增SnRK1.1基因:1.SnRK1.1; B. GST-SnRK1.1菌落PCR扩增结果:1~4. GST-SnRK1.1菌落;M.DNA分子量标准。
A. PCR amplification of SnRK1.1;B.Colony PCR amplification of GST-SnRK1.1:1-4.GST-SnRK1.1 colonies;M.DNA Marker.
图2 SnRK1.1表达载体的构建
Fig.2 Construction of expression vector of SnRK1.1
2.3 GST-FD和GST-FD-T282A蛋白的诱导表达
将分别转化重组载体GST-FD或GST-FD-T282A的大肠杆菌利用合适浓度的IPTG室温诱导6 h。SDS-PAGE电泳和考马斯亮蓝染色(CBB)结果表明,室温0.5 mmol/L IPTG能够诱导出分子量约为58 kDa的GST-FD和GST-FD-T282A蛋白(图3)。
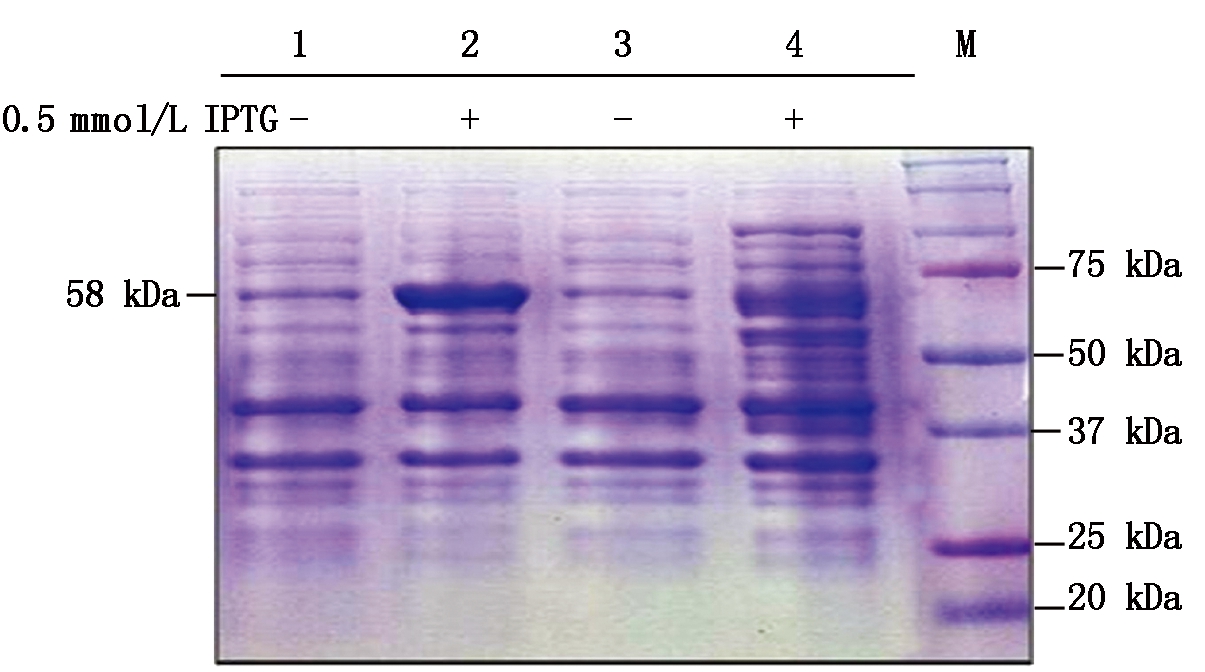
1.GST-FD诱导前;2.GST-FD诱导后;3.GST-FD-T282A诱导前;4.GST-FD-T282A诱导后;M.蛋白分子量标准。
1. GST-FD before induction;2.GST-FD after induction; 3. GST-FD-T282A before induction;4.GST-T282A after induction;M.Protern Marker.
图3 GST-FD和GST-FD-T282A蛋白的诱导表达
Fig.3 Induction of GST-FD and GST-FD-T282A proteins
2.4 GST-SnRK1.1蛋白的诱导表达
将转化空载体PGEX-4T-3或重组载体GST-SnRK1.1的大肠杆菌利用合适浓度的IPTG,18 ℃诱导过夜。SDS-PAGE电泳和考马斯亮蓝染色(CBB)结果表明,0.5 mmol/L IPTG诱导出分子量为84 kDa的GST-SnRK1.1蛋白和26 kDa的GST蛋白(图4)。
2.5 GST-FD和GST-FD-T282A融合蛋白的纯化
将分别转化GST-FD或GST-FD-T282A表达载体的大肠杆菌进行大量诱导,超声破碎菌体,离心,收集上清液使用GST纯化介质纯化。透析去除蛋白洗脱液中的谷胱甘肽。SDS-PAGE电泳和考马斯亮蓝染色(CBB)分析,获得的GST-FD和GST-FD-T282A蛋白纯度高,分子量为58 kDa(图5)。
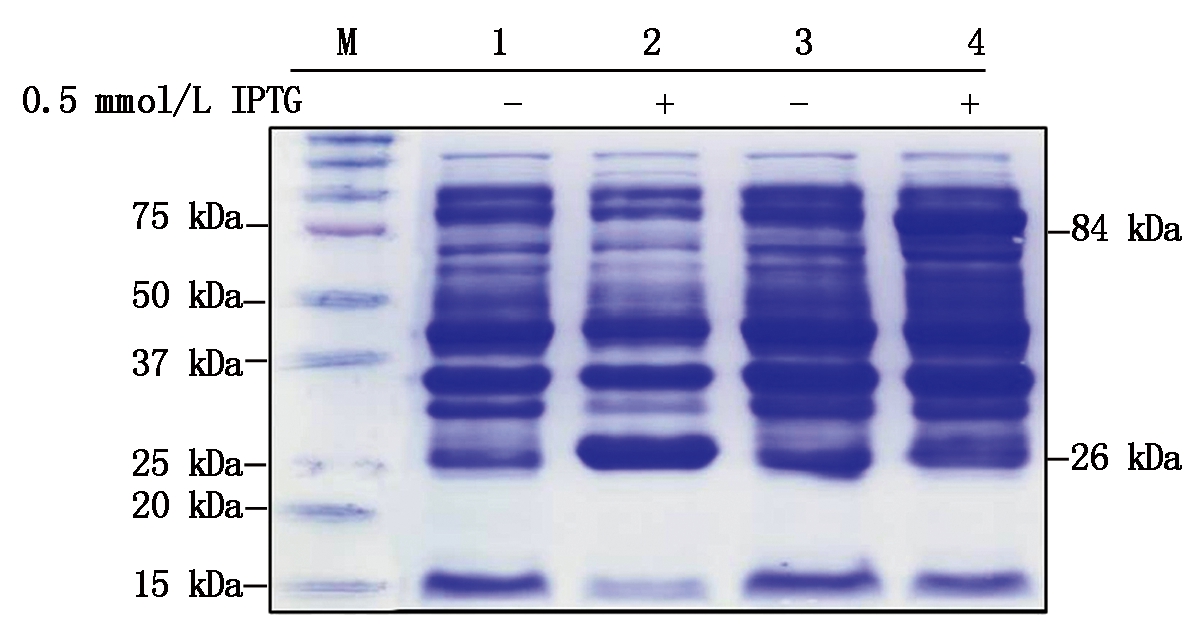
1.GST诱导前;2.GST诱导后;3.GST-SnRK1.1诱导前;4. GST-SnRK1.1诱导后;M.蛋白分子量标准。
1. GST before induction;2.GST after induction; 3. GST-SnRK1.1 before induction;4.GST-SnRK1.1 after induction;M.Protein Marker.
图4 GST和GST-SnRK1.1蛋白的诱导表达
Fig.4 Induction of GST and GST-SnRK1.1 proteins
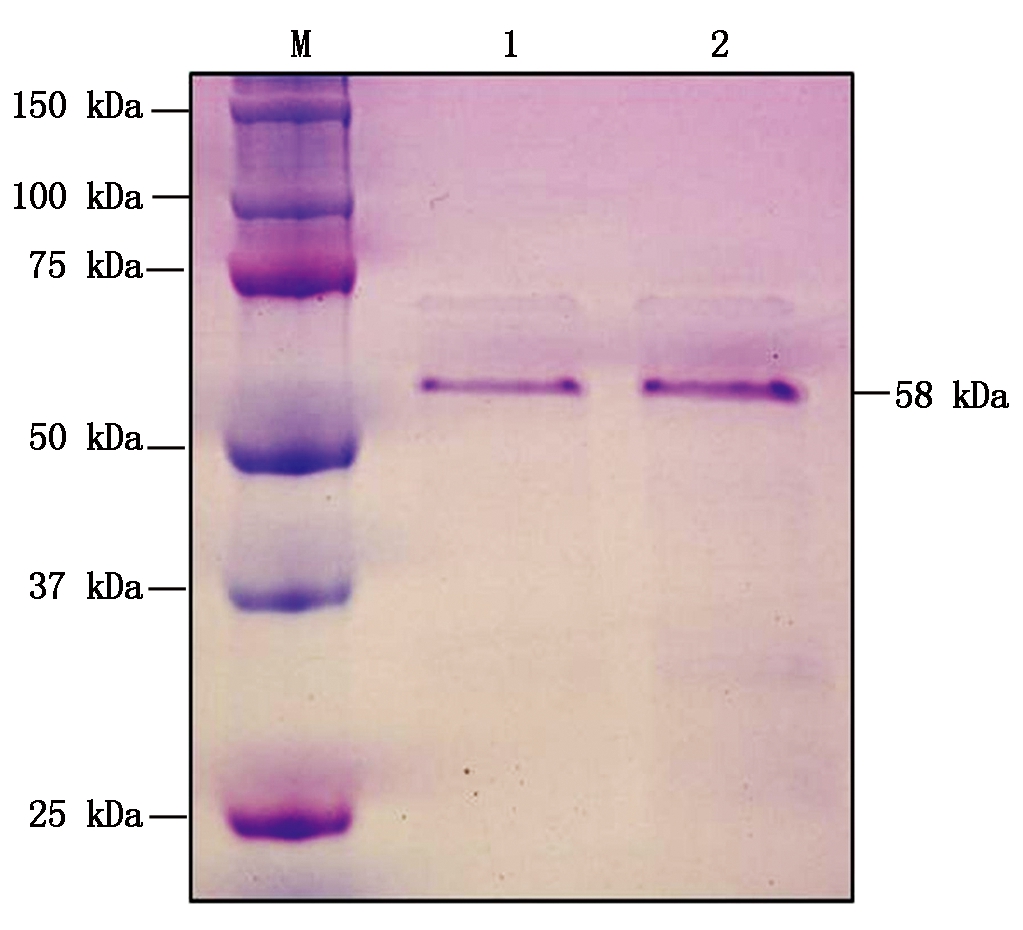
1. GST-FD;2.GST-FD-T282A;M.蛋白分子量标准。
1. GST-FD;2.GST-FD-T282A;M.Protein Marker.
图5 GST-FD和GST-FD-T282A蛋白的纯化Fig.5 Purification of GST-FD and GST-FD-T282A proteins
2.6 GST-SnRK1.1融合蛋白的纯化
利用上述同样的方法进行GST-SnRK1.1蛋白的纯化。SDS-PAGE电泳和考马斯亮蓝染色(CBB)分析,获得了纯度好、分子量84 kDa 的GST-SnRK1.1融合蛋白,与预期蛋白分子量大小一致(图6)。
2.7 蛋白激酶GST-SnRK1.1能够磷酸化GST-FD
室温条件下,将1.0 μg GST-SnRK1.1分别与0.5 μg GST-FD或0.5 μg GST-FD-T282A于激酶反应缓冲液中孵育30 min。然后利用Western Blot免疫印迹技术和anti-pThr抗体检测GST-FD或GST-FD-T282A是否能被激酶GST-SnRK1.1磷酸化。蛋白质的苏氨酸(Thr)位点被磷酸化后可以被anti-pThr抗体识别。试验结果显示,与GST-SnRK1.1共同孵育的GST-FD(泳道2)被anti-pThr识别,但是与GST-SnRK1.1共同孵育的GST-FD-T282A(泳道3)未被anti-pThr识别,其余泳道为单独的GST-SnRK1.1、GST-FD或者GST-FD-T282A作为阴性对照。该结果直接证实了GST-SnRK1.1能够磷酸化GST-FD但不能磷酸化GST-FD-T282A(图7)。
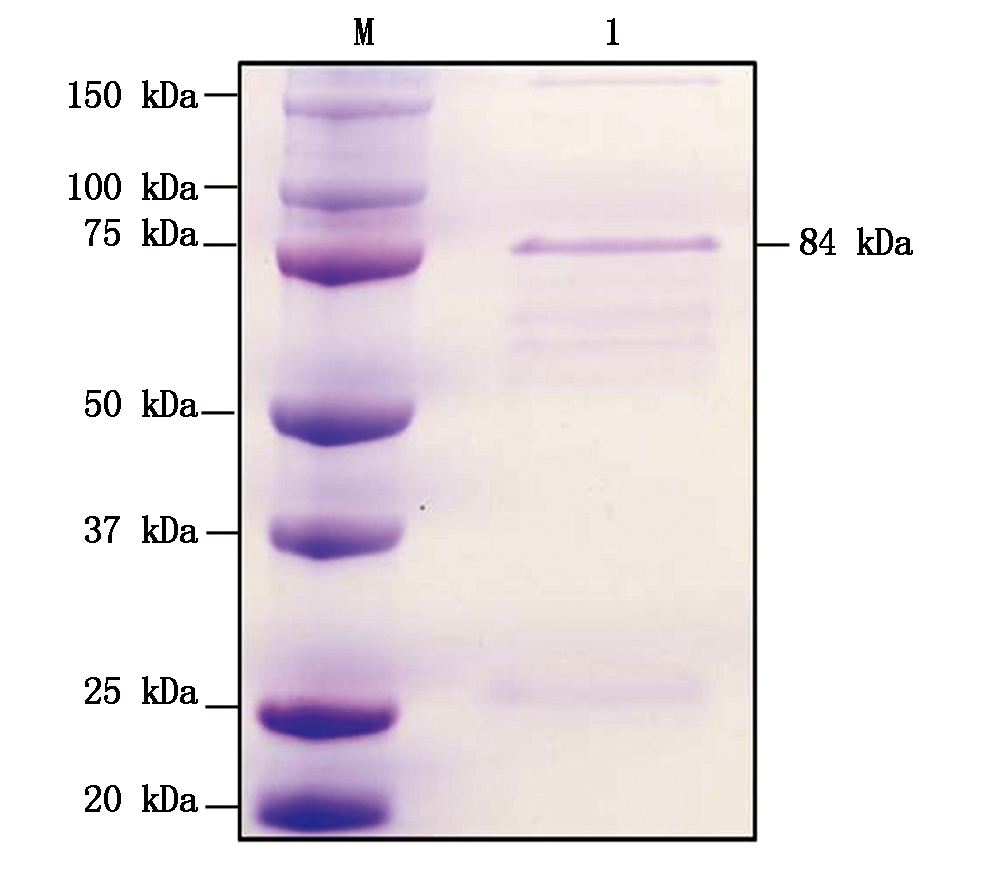
1. GST-SnRK1.1蛋白;M. 蛋白分子量标准。
1. GST-SnRK1.1 recombinant protein;M. Protein Marker.
图6 GST-SnRK1.1蛋白的纯化
Fig.6 Purification of GST-SnRK1.1 protein
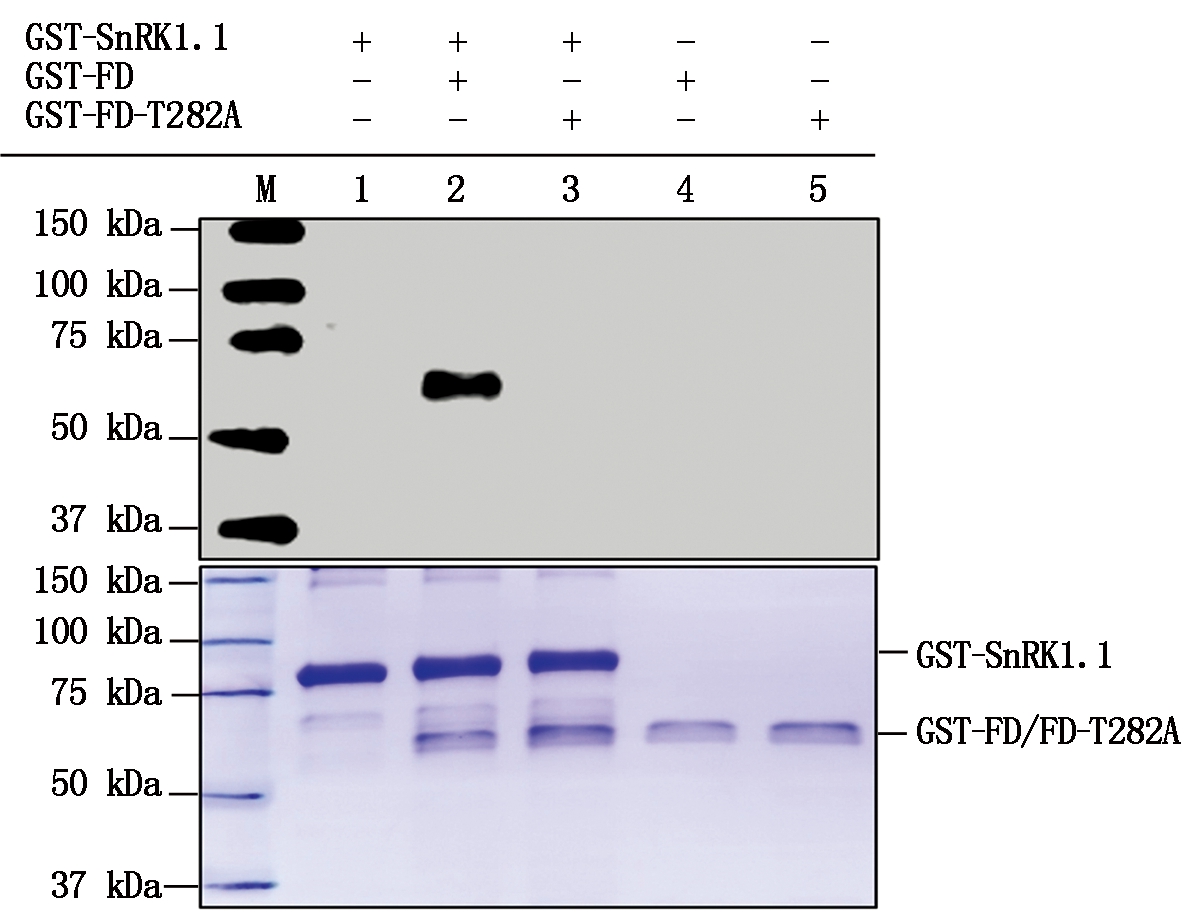
1.单独GST-SnRK1.1;2. GST-SnRK1.1和GST-FD;3. GST-SnRK1.1和GST-FD-T282A;4. 单独GST-FD;5. 单独GST-FD-T282A;M.蛋白分子量标准。
1.GST-SnRK1.1 alone;2.GST-SnRK1.1 and GST-FD;3.GST-SnRK1.1 and GST-FD-T282A;4.GST-FD alone;5.GST-FD-T282A alone;M.Protein Marker.
图7 GST-SnRK1.1蛋白能够磷酸化GST-FD
Fig.7 GST-SnRK1.1 could phosphorylate GST-FD
生物体执行生命活动最终是依靠蛋白质来完成的,并且常常通过蛋白翻译后修饰来传递遗传信息。由蛋白激酶和蛋白磷酸酶分别控制的蛋白质可逆磷酸化修饰是一种十分重要的修饰方式,参与调控生物体内许多的生物学过程。近年来的研究表明,蛋白质的磷酸化修饰在植物开花途径中发挥重要作用,主要在于开花途径转录因子FD蛋白存在磷酸化修饰调节。FD是bZIP转录因子家族成员,FD的磷酸化修饰对于其在开花途径中发挥必不可少的作用。只有磷酸化状态的FD才能够与成花素蛋白FT结合进而调节下游 SOC1和AP1基因的表达,促进花分生组织的形成。因此,寻找并研究开花途径中负责磷酸化FD的蛋白激酶对于解读植物开花机制具有十分重要的意义。SnRK1.1是植物蔗糖非发酵-1相关蛋白激酶SnRK1家族的重要成员,结构非常复杂,广泛参与植物非生物/生物胁迫、逆境信号转导、脱落酸ABA信号转导以及植物生长发育等众多生物学过程,但是目前关于SnRK1.1是否参与植物开花调控还不清楚。Williams等[9-10,14]的研究结果表明,拟南芥SnRK1.1过表达转基因植株表现出轻微的晚花表型。那么,SnRK1.1是否直接参与开花时间调控值得进一步研究和探索。
蛋白激酶CPKs家族成员CPK6和CPK33能够磷酸化FD蛋白,作用位点是第282位的苏氨酸[13]。本研究利用原核表达技术纯化了高质量的GST-SnRK1.1、GST-FD以及GST-FD-T282A蛋白,体外激酶试验证实了蛋白激酶SnRK1.1能够磷酸化FD,不能磷酸化突变的GST-FD-T282A蛋白。由此看出SnRK1蛋白激酶也能够磷酸化FD蛋白的第282位苏氨酸位点。CPKs与SnRK1蛋白激酶都能够磷酸化FD蛋白,那么CPKs与SnRK1对FD的磷酸化有何区别,二者如何协调控制FD蛋白的磷酸化,二者是否在不同的条件下或者不同的时段分别磷酸化FD,对FD蛋白氨基酸序列进行分析发现该蛋白上存在多个丝氨酸/苏氨酸位点,除了第282位苏氨酸位点,CPKs与SnRK1是否能够磷酸化其他的丝氨酸/苏氨酸位点,以及CPKs与SnRK1是否通过磷酸化不同的位点或者不同数目的位点发挥作用等都将是值得研究的问题。
参考文献:
[1] Kim T W,Michniewicz M,Bergmann D C,et al. Brassinosteroid regulates stomatal development by GSK3-mediated inhibition of a MAPK pathway[J]. Nature,2012,482(7385):419-422.
[2] Kim T W,Wang Z Y. Brassinosteroid signal transduction from receptor kinases to transcription factors[J]. Annual Review of Plant Biology,2010,61:681-704.
[3] Andrés F,Coupland G. The genetic basis of flowering responses to seasonal cues[J]. Nature Reviews Genetics,2012,13(9):627-639.
[4] Cai Y,Chen X,Xie K,et al. Dlf1,a WRKY transcription factor,is involved in the control of flowering time and plant height in rice[J]. PLoS One,2014,9(7):e102529.
[5] Amasino R. Seasonal and developmental timing of flowering[J]. The Plant Journal:for Cell and Molecular Biology,2010,61(6):1001-1013.
[6] Takada S,Goto K. Terminal flower2,an Arabidopsis homolog of heterochromatin protein1,counteracts the activation of flowering locus T by constans in the vascular tissues of leaves to regulate flowering time[J]. The Plant Cell,2003,15(12):2856-2865.
[7] An H,Roussot C,Suárez-López P,et al. CONSTANS acts in the phloem to regulate a systemic signal that induces photoperiodic flowering of Arabidopsis[J]. Development,2004,131(15):3615-3626.
[8] Taoka K I,Ohki I,Tsuji H,et al. 14-3-3 proteins act as intracellular receptors for rice Hd3a florigen[J]. Nature,2011,476(7360):332-335.
[9] Abe M,Kobayashi Y,Yamamoto S,et al.FD,a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex[J].Science,2005,309(5737):1052-1056.
[10] Wigge P A,Kim M C,Jaeger K E,et al. Integration of spatial and temporal information during floral induction in Arabidopsis[J]. Science,2005,309(5737):1056-1059.
[11] Wickland D P,Hanzawa Y. The FLOWERING LOCUS T/TERMINAL FLOWER 1 gene family:functional evolution and molecular mechanisms[J]. Molecular Plant,2015,8(7):983-997.
[12] Taoka K I,Ohki I,Tsuji H,et al. Structure and function of florigen and the receptor complex[J]. Trends in Plant Science,2013,18(5):287-294.
[13] Kawamoto N,Sasabe M,Endo M,et al. Calcium-dependent protein kinases responsible for the phosphorylation of a bZIP transcription factor FD crucial for the florigen complex formation[J]. Scientific Reports,2015,5:8341.
[14] Williams S P,Rangarajan P,Donahue J L,et al. Regulation of sucrose non-Fermenting related kinase 1 genes in Arabidopsis thaliana[J]. Frontiers in Plant Science,2014,5:324.
[15] Fragoso S,Espíndola L,Páez-Valencia J,et al. SnRK1 isoforms AKIN10 and AKIN11 are differentially regulated in Arabidopsis plants under phosphate starvation[J]. Plant Physiology,2009,149(4):1906-1916.
[16] López-Paz C,Vilela B,Riera M,et al. Maize AKINbetagamma dimerizes through the KIS/CBM domain and assembles into SnRK1 complexes[J]. FEBS Letters,2009,583(12):1887-1894.
[17] Emanuelle S,Hossain M I,Moller I E,et al. SnRK1 from Arabidopsis thaliana is an atypical AMPK[J]. The Plant Journal:for Cell and Molecular Biology,2015,82(2):183-192.
[18] Chae M J,Lee J S,Nam M H,et al. A rice dehydration-inducible SNF1-related protein kinase 2 phosphorylates an abscisic acid responsive element-binding factor and associates with ABA signaling[J]. Plant Molecular Biology,2007,63(2):151-169.
[19] Jossier M,Bouly J P,Meimoun P,et al. SnRK1 (SNF1-related kinase 1) has a central role in sugar and ABA signalling in Arabidopsis thaliana[J]. The Plant Journal:for Cell and Molecular Biology,2009,59(2):316-328.
[20] Rodrigues A,Adamo M,Crozet P,et al. ABI1 and PP2CA phosphatases are negative regulators of Snf1-related protein kinase1 signaling in Arabidopsis[J]. The Plant Cell,2013,25(10):3871-3884.
[21] Huang J Z,Huber S C. Phosphorylation of synthetic peptides by a CDPK and plant SNF1-related protein kinase. Influence of proline and basic amino acid residues at selected positions[J]. Plant & Cell Physiology,2001,42(10):1079-1087.
Protein Kinase SnRK1.1 Phosphorylates Transcriptional Factor FD in Arabidopsis thaliana
Abstract:This study aimed at obtaining purified SnRK1.1 and FD proteins,and analyzing whether SnRK1.1 could phosphorylate transcription factor FD in flowering regulation pathway. 1 608 bp SnRK1.1 gene and 858 bp FD/FD-T282A genes were cloned successfully and linked into PGEX-4T-3 vector respectively. GST-SnRK1.1,GST-FD and GST-FD-T282A expression vectors were made and transformed into E.coli strain BL21. SDS-PAGE and CBB staining showed that 0.5 mmol/L IPTG could successfully induce GST-SnRK1.1,GST-FD and GST-FD-T282A proteins. 84 kDa GST-SnRK1.1 and 58 kDa GST-FD or mutated GST-FD-T282A proteins were purified using GST tag protein purification system. The purified GST-SnRK1.1 recombinant protein could phosphorylate GST-FD proteins but not mutated GST-FD-T282A protein. This result would provide a good basis to study how SnRK1.1 mediates flowering through phosphorylating FD.
Key words:SnRK1.1;FD;Protein kinase;Transcription factor;Phosphorylation
收稿日期:2017-06-01
基金项目:国家自然科学基金项目(31401212);河北省自然科学基金项目(C2014209134);唐山市科技局项目(15140202a)
中图分类号:Q71;Q78
文献标识码:A
文章编号:1000-7091(2017)04-0037-05
doi:10.7668/hbnxb.2017.04.006