猪链球菌ssnA基因缺失突变菌株的构建及毒力分析
李 淼1,2,3,李春玲1,2,3,宋 帅1,2,3,杨冬霞1,2,3,蔡汝健1,2,3,李 艳1,2,3,蒋智勇1,2,3,勾红潮1,2,3,楚品品1,2,3
(1.广东省农业科学院 动物卫生研究所,广东 广州 510640;2.广东省畜禽疫病防治研究重点实验室,广东 广州 510640;3.广东省兽医公共卫生公共实验室,广东 广州 510640)
摘要:分泌型核酸酶基因ssnA是近年来研究发现的一种脱氧核糖核酸酶,被认为是一种猪链球菌2型(SS2)潜在的毒力因子。为了分析ssnA基因对于SS2毒力的影响,通过体外构建具有同源臂的重组自杀性质粒,电转化进入 SS2,经同源重组构建了SS2流行毒力株GD01的ssnA基因缺失突变菌株,并通过比较分析了野生菌株与缺失突变菌株的生长特性及溶血活性等生物学特性。结果显示,GD01株与ΔssnA突变株的生长速度及溶血活性没有明显差异;ssnA基因缺失后SS2对Hep-2细胞的黏附及入侵能力则明显下降。小鼠毒力试验结果显示,ssnA基因缺失突变菌株对于CD1小鼠LD50是6.17×108 cfu,而SS2野生菌株的LD50 是4.42×107 cfu,缺失突变株的LD50约是野生株的14倍,表明ssnA的缺失对SS2毒力产生明显影响,提示ssnA基因在其致病过程中具有重要作用,其具体作用机制需进一步分析。
关键词:猪链球菌2型;ssnA基因;基因缺失;毒力
猪链球菌(Streptococcus suis,S.suis)是当前严重危害养猪业的一种最重要的病原菌,能够引起猪关节炎、脑膜炎、肺炎、心内膜炎、败血症甚至急性死亡[1-3]。根据猪链球菌表面多糖抗原分型,其目前主要分为35个血清型[4]。其中猪链球菌2型 (SS2) 分布最广,分离率最高,致病性最强,同时也是一种重要的人兽共患病原菌[5-6]。1968 年丹麦首次报道了人感染猪链球菌的病例,随后在英国、美国、巴西、澳大利亚、西班牙及新西兰等国均有过人感染猪链球菌的报道[7-9]。1998年和2005年在中国江苏和四川分别发生了较大规模的人感染猪链球菌疫情,累计报告发病229 例,死亡52例,对公共卫生安全造成了严重影响[10]。最近研究证实,多种血清型的猪链球菌均能感染人类[11]。
目前,国内外缺乏对猪链球菌毒力因子和致病机制的全面了解,已确认与猪链球菌的致病性相关的毒力因子包括荚膜多糖(CPS)、溶血素(SLY)、胞外因子(EF)、溶菌酶释放蛋白(MRP)、谷氨酸脱氢酶(GDH)、甘油醛-3-磷酸脱氢酶(GAPDH)、精氨酸氨基肽酶(ADIs)及纤连蛋白结合蛋白(FBPS)等[12-17]。但由于毒力因子的多样性以及复杂性,单靠现有的毒力因子还不足以全面解释SS2的致病机理。
分泌型核酸酶因其具有脱氧核糖核酸酶活性而能够直接作用于细胞中关键的大分子物质DNA,因此推测其是潜在的毒力因子。Fontaine 等[18]在 SS2 致病菌株 SX332 和后来的 1~9 型菌株中,发现了一种分泌型核酸酶SsnA。反转录 PCR 表明ssnA在猪链球菌整个生长过程中均表达。该研究分析分离于猪上颌棉拭子或鼻拭子以及猪内部器官的猪链球菌发现,ssnA的表型与其分离位置密切相关,提示ssnA是一种新型的毒力因子。最新的研究已经证实,ssnA是SS9的一个毒力因子[19]。本研究利用同源重组技术构建了SS2强毒株ssnA基因的缺失突变菌株ΔssnA,比较了野生菌株与ΔssnA的生长特性及对宿主细胞的黏附与入侵,进一步分析了ssnA基因缺失对猪链球菌毒力的影响,为研究该基因的功能以及其在猪链球菌致病过程中的作用奠定了基础。
1 材料和方法
1.1 菌株、质粒及生化试剂
大肠杆菌DH5α、BL21由广东省农业科学院动物卫生研究所猪病实验室保存;SS2菌株GD01由本实验室从发病猪体内分离、鉴定并保存;温敏型自杀质粒pSET4s由Takamatsu[20]博士惠赠;T4 DNA连接酶、DNA限制性内切酶及pMD19-T载体购于宝生物工程(大连) 有限公司;壮观霉素(Spc)及氯霉素(Cm)购自 Sigma 公司。
1.2 细胞系及试验动物
人喉上皮癌细胞系Hep-2由本实验室保存,6周龄雌性CD1小鼠购自北京维通利华实验动物技术有限公司。
1.3 引物
本研究所用引物均由上海生工生物工程有限公司合成(表1),下划线部分为酶切位点。
表1 引物序列
Tab.1 Primers sequence

引物Primers引物序列(5'-3')Primerssequence用途UseP1-FGAGTCGACTCAAACTGTCTGGGAGA扩增ssnA基因上游同源臂P1-RGCGGATCCATAAAACTCCTTTTTCP2-FGAGGATCCTCATTTTTTGAGCTTG扩增ssnA基因上游同源臂P2-RGCGAGCTCGCTCCAGGTAAAACTTCm-FGCGGATCCTAATTCGATGGGTTCCGAGG扩增CmR抗性表达盒Cm-RTCTGGATCCGAAAACACTAGAGCTTGATGSpc-FGTGTTCGTGAATACATGTTATA扩增SpcR抗性表达盒Spc-RGTTTTCTAAAATCTGATTACCAP3-FGTTAAACAAAATGAATATGGCACCssnA基因缺失突变鉴定引物P3-RATTGACAGCCAAAATCTGATTGGCSS-16S-FCAGTATTTACCGCATGGTAGATAT扩增猪链球菌16SrRNASS-16S-RGTAAGATACCGTCAAGTGAGAA
1.4 基因缺失突变株的构建及鉴定
以 SS2 分离株GD01基因组DNA为模板,分别扩增ssnA基因上游序列P1和下游序列P2;以穿梭质粒 pSET3 为模板,扩增 CmR 基因盒序列,将得到的3个片段的基因序列分别连接到 pMD19-T 载体上,经测序鉴定正确后酶切回收目的基因片段并定向以P1-Cm-P2的顺序连接到温敏型自杀性载体质粒 pSET4S 中,得到自杀性质粒 pSET4SΔssnA;将其转入 GD01 菌株中,筛选具有 CmR 的克隆,利用 PCR 鉴定和测序证实获得ssnA基因缺失突变株 ΔssnA。
1.5 基因缺失突变株 ΔssnA的生物活性测定
将ssnA基因缺失突变菌株ΔssnA和野生菌株GD01分别接种于TSB培养基中,37 ℃振荡培养至平台期,将2种菌株分别在血平板上划线,在37 ℃、5% CO2 孵箱内培养24 h,观察菌落形态和溶血环大小。测定平台期2个菌株的OD600,用TSB培养基稀释至OD600=0.2后,按1%比例转接,连续培养12 h,每隔1 h 测OD600,绘制生长曲线。
1.6 基因缺失突变株对Hep-2细胞的黏附和入侵
将基因缺失菌株 ΔssnA和野生菌株GD01培养至对数生长期,用1640培养基稀释至5×106~1×107 cfu/mL。将Hep-2细胞在24孔培养板中培养至单层后加入适当稀释的菌液,于37 ℃、5%CO2条件下孵育。感染2 h后,用无菌PBS(pH值7.4)洗涤3次。然后每孔加入200 μL细胞洗脱液(含0.1% EDTA和0.25%胰蛋白酶的PBS)。洗脱后,每孔加入800 μL PBS(含0.025%Triton X-100)对细胞进行破碎。将上述溶液倍比稀释涂布于TSA平板,37 ℃培养过夜后统计菌落数量。
细胞入侵试验是在上述试验结束后,每孔加入1 mL细胞培养液(含5 μg青霉素和100 μg链霉素),于37 ℃、5%CO2条件下孵育1 h。
1.7 基因缺失突变株ΔssnA对小鼠致病力分析
选取6周龄CD1雌性远交系小鼠,用于小鼠半数致死量(LD50)测定试验。将野生菌GD01和缺失菌ΔssnA培养至对数生长期后进行细菌计数。按照预试验得出的最高、最低剂量对数差,分成几个对数等距的剂量组。以腹腔接种的方式注射CD1小鼠,每天观察小鼠的临床症状和死亡情况,观察期为14 d。最后通过PCR 对死亡小鼠和正常处死小鼠的肝脏、肾脏和脾脏等器官分离的细菌进行鉴定。
2 结果与分析
2.1 GD01株ssnA基因缺失菌株ΔssnA的构建及鉴定
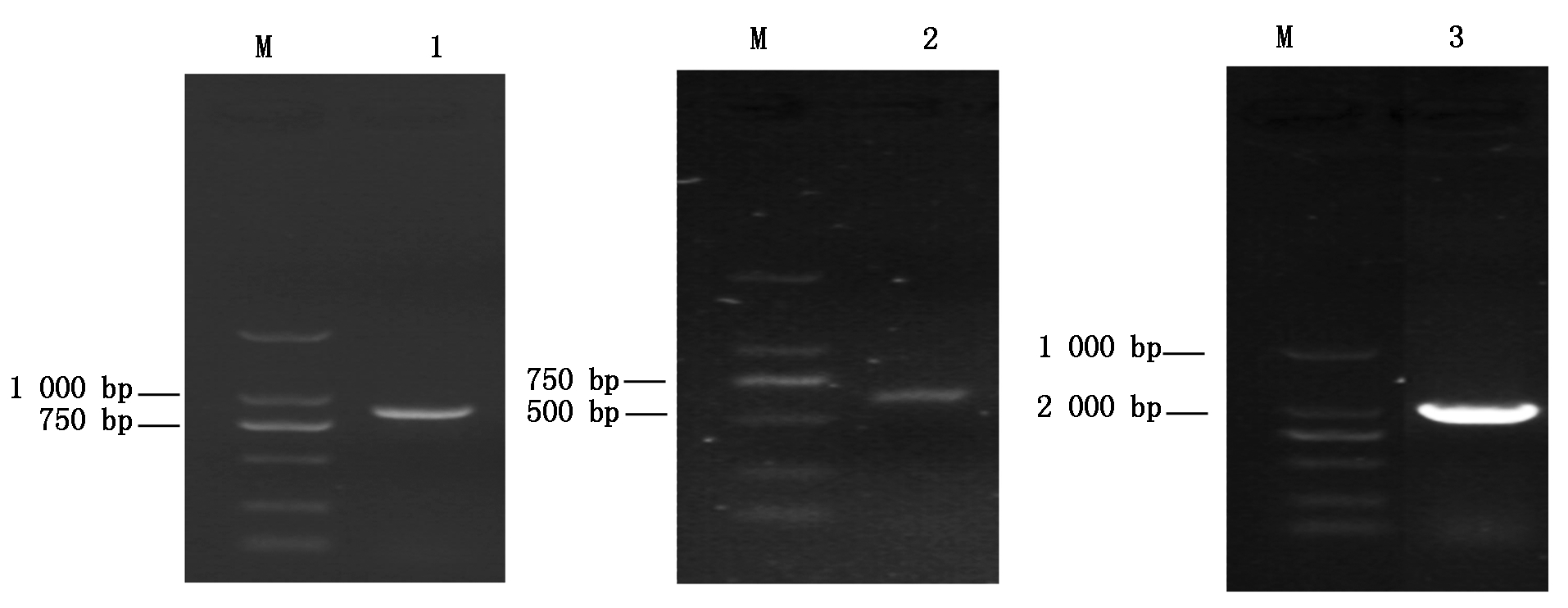
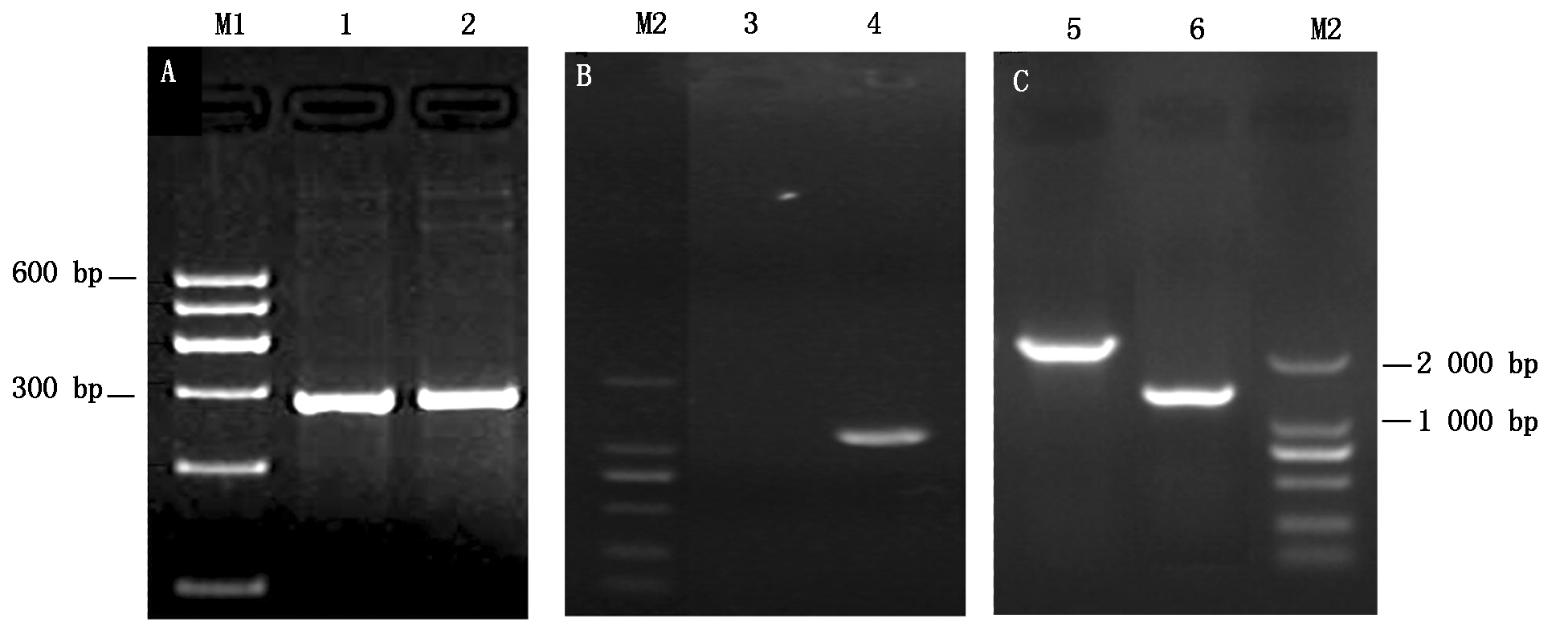
根据GenBank中登录的SC84菌株全基因序列(序列号为NC_012924),设计扩增出ssnA基因上游序列P1(865 bp) 和下游序列P2(624 bp);根据GenBank登陆的穿梭质粒pSET3序列(No.AB042431)设计扩增出Cm基因(1 056 bp),结果如图1所示;将酶切后的目的片段和pSET4S载体连接转化后,构建得到自杀性载体质粒pSET4SΔssnA。将 pSET4SΔssnA 质粒加入新鲜制备的GD01野生菌株电转感受态细胞中进行电击转化后,利用4对PCR引物鉴定及测序证实ssnA基因被Cm抗性基因盒所替代,如图2所示,SS 16S rRNA阳性,成功缺失 ssnA 基因的突变株 CmR 阳性,SpcR 阴性,ssnA 基因敲除鉴定引物阳性,PCR 扩增结果如上述预期,说明成功获得 SS2 ssnA 基因缺失突变菌株。
2.2 缺失菌株ΔssnA的生长特性
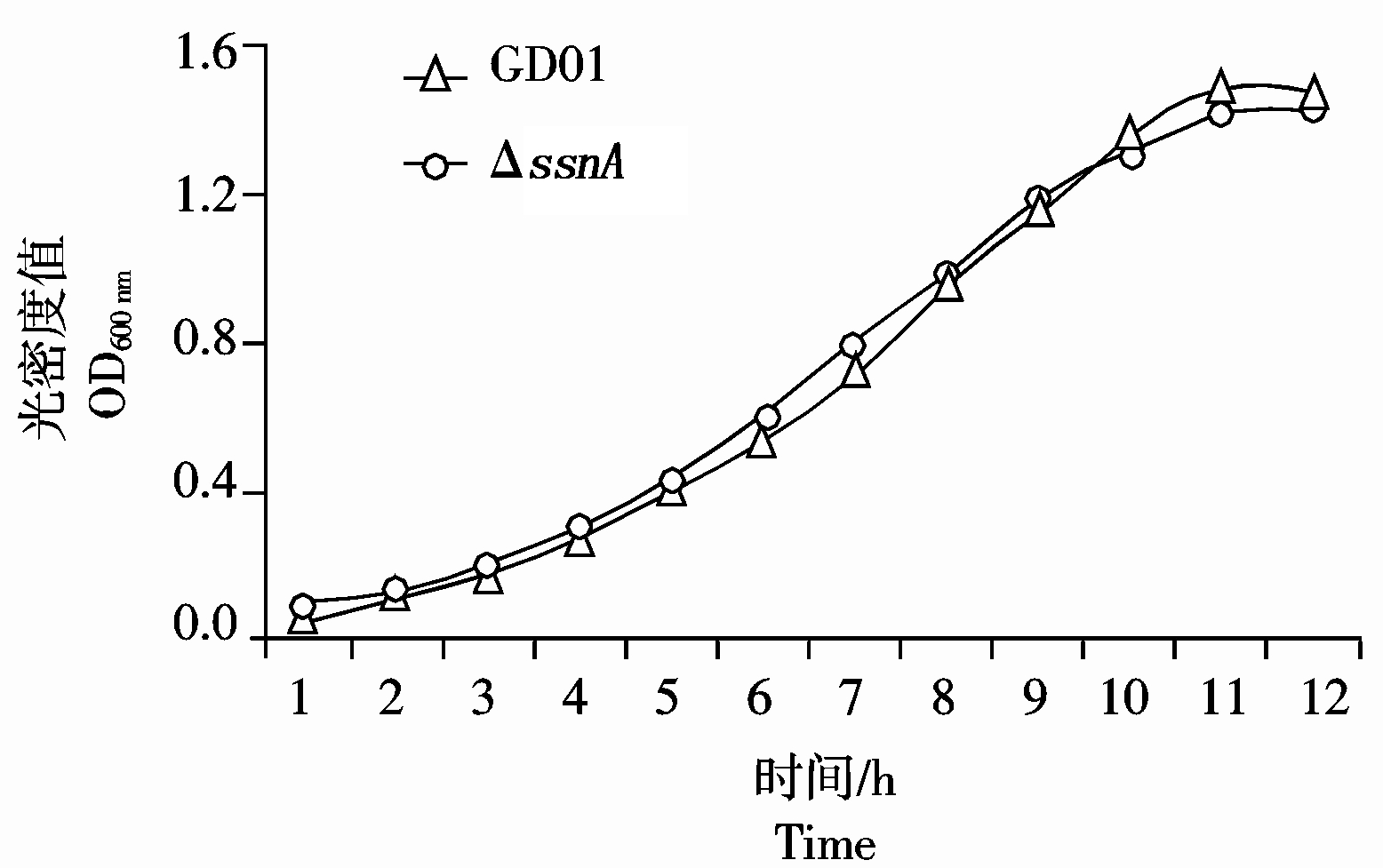
观察发现野生株及缺失株的菌落形态和溶血环大小无明显区别。如图3所示,缺失菌株 ΔssnA与野生型菌株的生长特性相似。
2.3 细胞黏附及入侵试验
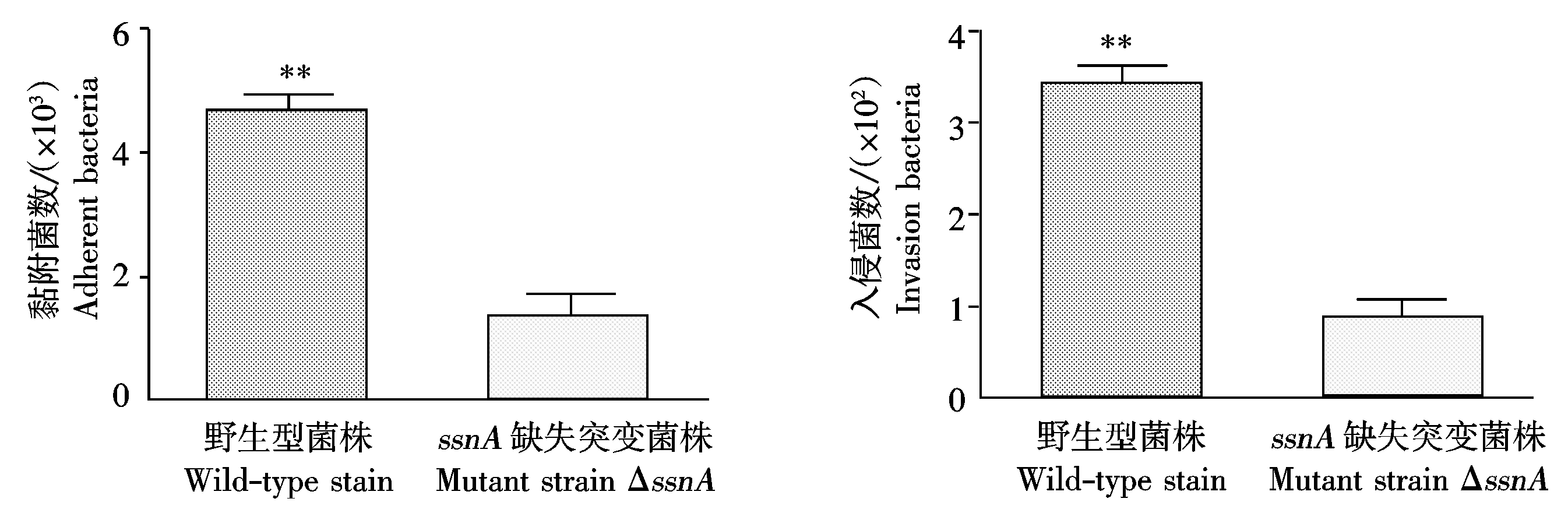
本试验以Hep-2细胞为模型,比较了野生菌株与基因缺失菌株ΔssnA黏附及入侵的能力。如图4所示,ssnA基因缺失菌株ΔssnA的黏附和入侵能力极显著低于野生菌株GD01,提示ssnA基因可能与猪链球菌的致病性相关。
2.4 小鼠致病力分析
选取CD1小鼠为动物模型,用不同浓度的野生菌GD01和ssnA基因缺失菌株对其进行攻毒,观察记录小鼠的存活情况 (表2)。结果表明,ΔssnA菌株的LD50 (6.17×108) 约为野生菌株 ΔssnA 的 LD50 (4.42×107) 的14倍,表明ssnA基因缺失后,SS2毒力明显下降。
表2 野生株GD01和基因缺失突变株ΔssnA对小鼠的LD50结果
Tab.2 The LD50 of the GD01 and ΔssnA strains in CD1 mice
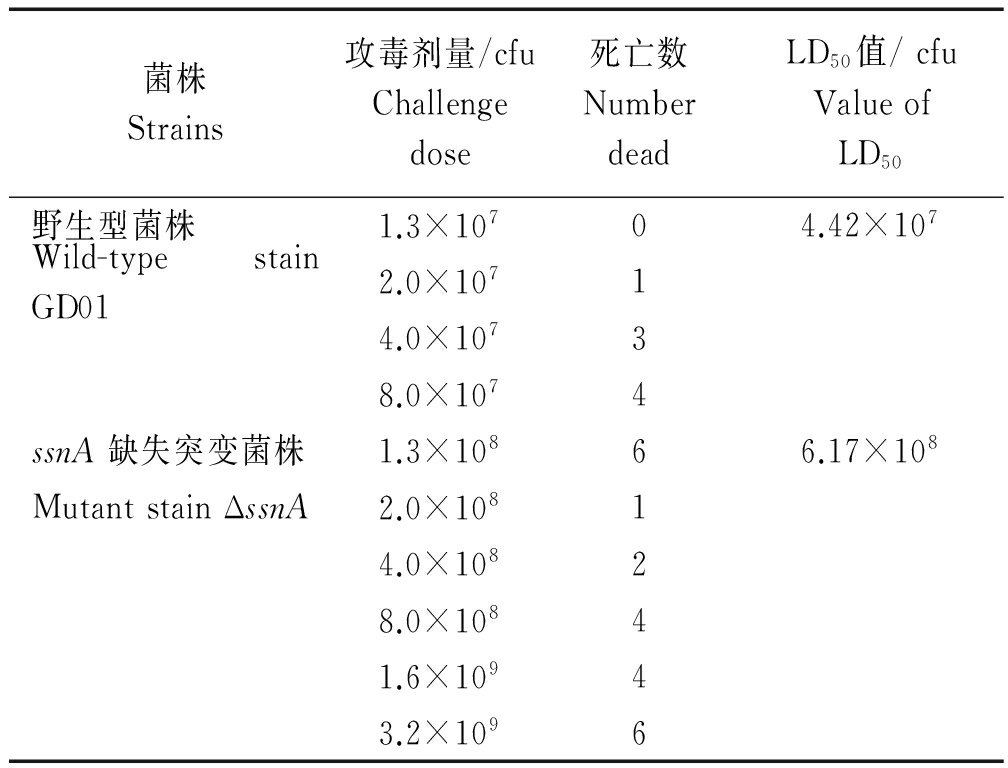
菌株Strains攻毒剂量/cfuChallengedose死亡数NumberdeadLD50值/cfuValueofLD50野生型菌株1.3×10704.42×107Wild-typestainGD012.0×10714.0×10738.0×1074ssnA缺失突变菌株1.3×10866.17×108MutantstainΔssnA2.0×10814.0×10828.0×10841.6×10943.2×1096
3 讨论
近年来新发现的一些酶类,如三磷酸甘油醛脱氢酶(GAPDH)和谷氨酸脱氢酶(GDH)能严重影响 SS2 的致病力[21-22]。GAPDH是一种参与糖分解途径的酶,其作为毒力因子可通过与肌球蛋白、纤连素、肌动蛋白和血纤蛋白溶酶等不同的宿主蛋白结合而发挥作用。猪链球菌GDH在细胞表面表达,是NADP(H)特异性酶,GDH有保守的抗原性,能与猪链球菌的阳性猪血清反应,因此,可作为检测猪链球菌的重要标志性抗原。分泌型核酸酶基因ssnA作为猪链球菌的潜在毒力因子,最早是由Fontaine等[18]发现的。随后,张东[23]研究了ssnA的部分生物学特性,建立了能特异性检测猪链球菌ssnA基因的PCR检测方法,并用甲苯胺蓝法检测验证了其核酸酶的活性。近年来,De Buhr等[24]通过体外试验证实了ssnA 能够有效降解中性粒细胞胞外陷阱(Neutrophil extracellular traps,NETs),但并未通过动物试验证实其对细菌毒力的影响。目前为止,仍然缺乏针对ssnA基因在猪链球菌致病过程中作用的具体研究。因此,本研究以猪链球菌中分泌型核酸酶基因ssnA作为研究对象,构建了ssnA基因缺失突变株ΔssnA,并在此基础上分析了ssnA的缺失对SS2基本生物学性状以及致病力的影响,为探明猪链球菌潜在的毒力因子及其致病机理奠定了基础。
为了构建ssnA基因缺失突变株,利用穿梭载体pSET4S携带ssnA基因的侧翼序列,通过经典的同源重组技术将SS2流行强毒株中的ssnA从基因组中敲除。pSET4S是一种温敏型自杀性载体质粒,当温度为28 ℃时可以在猪链球菌中正常复制,而质粒上的温敏复制子在温度达到37 ℃时失去作用,从而实现质粒自杀。由于影响基因缺失菌株构建的因素很多[25-26],且通常在整个过程中只有极少的细菌发生了重组,因此需要进一步通过抗性筛选、PCR鉴定等进行验证。本研究利用经典的基因重组技术成功构建了ssnA基因缺失突变株ΔssnA,为研究ssnA基因的功能提供了保障。
本研究针对分泌型核酸酶SsnA对SS2致病力的影响进行了分析,体外生长特性试验结果显示,基因缺失突变株与野生株的生长速率及溶血活性没有明显差异。细胞感染结果显示,ΔssnA菌株对Hep-2细胞的黏附及入侵能力均明显降低。由于猪链球菌入侵宿主时,先是黏附于表面上皮细胞,进一步突破上呼吸道屏障后通过血液循环系统到达全身各处,并最终引起机体感染。因此,揭示ssnA可能在猪链球菌的感染过程中也发挥了一定的作用。CD1小鼠的体内动物试验分析进一步证实,ssnA基因敲除后,猪链球菌毒力下降明显,表明ssnA是SS2的毒力因子,但其具体作用机制尚需进一步的研究。
参考文献:
[1] Feng Y J,Zhang H M,Wu Z W,et al.Streptococcus suis infection an emerging/reemerging challenge of bacterial infectious diseases? [J].Virulence,2014,5(4):477-497.
[2] Gottschalk M,Segura M.The pathogenesis of the meningitis caused by Streptococcus suis:the unresolved questions[J].Veterinary Microbiology,2000,76(3):259-272.
[3] Galina L,Vecht U,Wisselink H J,et al.Prevalence of various phenotypes of Streptococcus suis isolated from swine in the U S A based on the presence of muraminidase-released protein and extracellular factor[J].Canadian Journal of Veterinary Research,1996,60(1):72-74.
[4] Goyette-Desjardins G,Auger J P,Xu J,et al.Streptococcus suis,an important pig pathogen and emerging zoonotic agent-an update on the worldwide distribution based on serotyping and sequence typing[J].Emerging Microbes & Infections,2014,3(6):e45.
[5] Wei Z G,Li R,Zhang A D,et al.Characterization of Streptococcus suis isolates from the diseased pigs in China between 2003 and 2007[J].Veterinary Microbiology,2009,137(1/2):196-201.
[6] Higgins R,Gottschalk M,Boudreau M,et al.Description of six new capsular types (29-34) of Streptococcus suis[J].Journal of Veterinary Diagnostic Investigation:Official Publication of the American Association of Veterinary Laboratory Diagnosticians,Inc,1995,7(3):405-406.
[7] Rosenkranz M,Elsner H A,St ürenburg H J,et al.Streptococcus suis meningitis and septicemia contracted from a wild boar in Germany[J].Journal of Neurology,2003,250(7):869-870.
[8] Tarradas C,Arenas A,Maldonado A,et al.Identification of Streptococcus suis isolated from swine:proposal for biochemical parameters[J].Journal of Clinical Microbiology,1994,32(2):578-580.
[9] Kopi J,Paradzik M T,Pandak N.Streptococcus suis infection as a cause of severe illness:2 cases from Croatia[J].Scandinavian Journal of Infectious Diseases,2002,34(9):683-684.
J,Paradzik M T,Pandak N.Streptococcus suis infection as a cause of severe illness:2 cases from Croatia[J].Scandinavian Journal of Infectious Diseases,2002,34(9):683-684.
[10] Tang J,Wang C,Feng Y,et al.Streptococcal toxic shock syndrome caused by Streptococcus suis serotype 2[J].PLOS Medicine,2006,3(5):e151.
[11] Kerdsin A,Hatrongjit R,Gottschalk M,et al.Emergence of Streptococcus suis serotype 9 infection in humans[J].Journal of Microbiology,Immunology,and Infection,2015(15):821-822.
[12] Fittipaldi N,Segura M,Grenier D,et al.Virulence factors involved in the pathogenesis of the infection caused by the swine pathogen and zoonotic agent Streptococcus suis[J].Future Microbiology,2012,7(2):259-279.
[13] Li Q,Fu Y,Ma C,et al.The non-conserved region of MRP is involved in the virulence of Streptococcus suis serotype 2[J].Virulence,2017,31:1-16.
[14] Musyoki A M,Shi Z,Xuan C,et al.Structural and functional analysis of an anchorless fibronectin-binding protein FBPS from Gram-positive bacterium Streptococcus suis[J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(48):13869-13874.
[15] 王 虹, 彭 爽, 陈德芳.链球菌毒力因子溶血素S的研究进展[J].中国人兽共患病学报,2017,33(3):287-292.
[16] Vecht U,Wisselink H J,Jellema M L,et al.Identification of two proteins associated with virulence of Streptococcus suis type 2[J].Infection and Immunity,1991,59(9):3156-3162.
[17] Segura M,Fittipaldi N,Calzas C,et al.Critical Streptococcus suis virulence factors:are they all really critical? [J].Trends in Microbiology,2017(17):30030-30038.
[18] Fontaine M C,Perez-Casal J,Willson P J.Investigation of a novel DNase of Streptococcus suis serotype 2[J].Infection and Immunity,2004,72(2):774-781.
[19] 唐欢宇, 任海燕, 吴宗福, 等.DNA核酸酶与猪链球菌9型毒力的关系[J].微生物学报,2017,57(4):480-489.
[20] Takamatsu D,Osaki M,Sekizaki T.Thermosensitive suicide vectors for gene replacement in Streptococcus suis[J].Plasmid,2001,46(2):140-148.
[21] Okwumabua O,Persaud J S,Reddy P G.Cloning and characterization of the gene encoding the glutamate dehydrogenase of Streptococcus suis serotype 2[J].Clinical and Diagnostic Laboratory Immunology,2001,8(2):251-257.
[22] Brassard J,Gottschalk M,Quessy S.Cloning and purification of the Streptococcus suis serotype 2 glyceraldehyde-3-phosphate dehydrogenase and its involvement as an adhesin[J].Veterinary Microbiology,2004,102(1/2):87-94.
[23] 张 东.猪链球菌潜在毒力因子SsnA和ADS的分子生物学研究[D].重庆:西南大学,2007.
[24] De Buhr N,Neumann A,Jerjomiceva N,et al.Streptococcus suis DNase ssnA contributes to degradation of neutrophil extracellular traps (NETs) and evasion of NET-mediated antimicrobial activity[J].Microbiology,2014,160(Pt 2):385-395.
[25] 张雪寒, 何孔旺, 周俊明, 等.猪链球菌 2 型次黄嘌呤核苷酸脱氢酶缺失株的构建[J].中国农业科学,2009,42(5):1789-1796.
[26] 王 勇, 祝昊丹, 何孔旺, 等.猪链球菌2型调控因子Rex缺失株的构建及其致病性鉴定[J].中国预防兽医学报,2017,39(3):201-205.
Construction and Virulence Analysis of the ssnA Gene Knock-out Mutant of Streptococcus suis Serotype 2
LI Miao1,2,3,LI Chunling1,2,3,SONG Shuai1,2,3,YANG Dongxia1,2,3,CAI Rujian1,2,3,LI Yan1,2,3,JIANG Zhiyong1,2,3,GOU Hongchao1,2,3,CHU Pinpin1,2,3
(1.Institute of Animal Health,Guangdong Academy of Agricultural Sciences,Guangzhou 510640,China;2.Guangdong Provincial Key Laboratory of Livestock Disease Prevention,Guangzhou 510640,China;3.Guangdong Open Laboratory of Veterinary Public Health,Guangzhou 510640,China)
Abstract:Streptococcus suis nuclease A (ssnA) is a recently discovered deoxyribonuclease (DNase),which is one of potential virulence factors of Streptococcus suis serotype 2(SS2).To determine the effects of ssnA on virulence,the ssnA deletion mutant (ΔssnA) was constructed by using the suicide vector pSET4S.The growth and hemolytic activity of the ssnA gene mutant strain had no obvious difference compared with the wild-type strain.The ability of ΔssnA mutant to interact with human laryngeal epithelial cell (Hep-2) was evaluated and it exhibited dramatically decreased ability to adhere to and invade Hep-2 cells.For CD1 mice,the LD50 of the mutation strain was 6.17×108 cfu,whereas the LD50 of wild-type strain was 4.42×107 cfu.This mutation was found to exhibit significant attenuation of virulence when evaluated in CD1 mice,suggesting ssnA plays a critical role in the pathogenesis of SS2,the mechanism of this protein is valuable for further analysis.
Key words:Streptococcus suis 2; ssnA; Gene mutant; Virulence
收稿日期:2017-04-22
基金项目:广州市科技计划项目(201510010142);广东省科技计划项目(2016B020202004);广东省公益研究与能力建设专项资金(2014B070706011);广东省国际合作项目(2015B050501007)
作者简介:李 淼(1982-),女,黑龙江哈尔滨人,副研究员,博士,主要从事细菌分子生物学研究。
通讯作者:李春玲(1965-),女,河南长葛人,研究员,博士,主要从事兽医微生物学研究。
中图分类号:Q78; S828
文献标识码:A
文章编号:1000-7091(2017)04-0001-06
doi:10.7668/hbnxb.2017.04.001