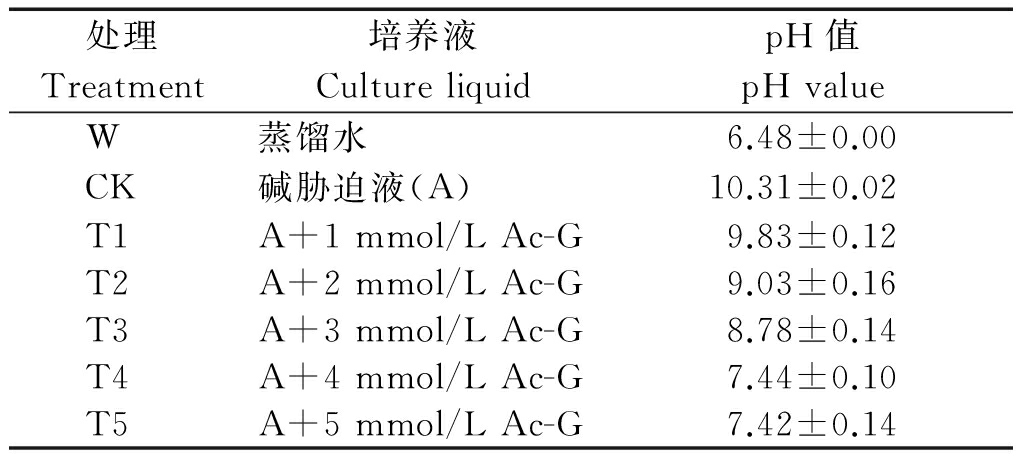
表1 不同处理溶液pH值
Tab. 1 The pH value of different treatments
处理Treatment培养液CultureliquidpH值pHvalueW蒸馏水6.48±0.00CK碱胁迫液(A)10.31±0.02T1A+1mmol/LAc-G9.83±0.12T2A+2mmol/LAc-G9.03±0.16T3A+3mmol/LAc-G8.78±0.14T4A+4mmol/LAc-G7.44±0.10T5A+5mmol/LAc-G7.42±0.14
摘要:为研究乙酰化葡萄糖(Ac-G)对碱胁迫下小麦幼苗生长的影响,揭示其对碱胁迫下小麦幼苗生长的影响机制,以小麦品种山农129为材料,设置7个处理:W(蒸馏水)、CK(碱胁迫液)、T1(碱胁迫液+1 mmol/L Ac-G)、T2(碱胁迫液+2 mmol/L Ac-G)、T3(碱胁迫液+3 mmol/L Ac-G)、T4(碱胁迫液+4 mmol/L Ac-G)、T5(碱胁迫液+5 mmol/L Ac-G),测定了小麦幼苗的生理生态指标。结果表明,缓解胁迫的最适剂量为4 mmol/L乙酰化葡萄糖,碱胁迫液的pH值可降至7.44;随着乙酰葡萄糖剂量的增加,小麦幼苗株高、根长、根冠比、幼苗生物量、叶绿素a含量和叶绿素a/b呈现先增加后减小的变化趋势,在T4处理时达到最大值;随着乙酰化葡萄糖剂量的增加,幼苗叶片可溶性蛋白和可溶性糖的含量逐渐增加,最后趋于稳定;叶片中SOD和POD活性逐渐增强;在T4处理下,幼苗叶片的丙二醛含量和电导率达最小值。结果可为今后盐碱地改良提供重要的理论依据。
关键词:乙酰化葡萄糖;碱胁迫;小麦;生理生态指标
盐碱胁迫抑制农作物生长,造成产量下降,是制约生态环境和农业生产的一个世界性难题[1]。研究表明,盐碱胁迫下植物种子在萌发与出苗阶段死亡率较高,而植物苗期对盐碱胁迫的响应也是研究植物对盐碱胁迫的耐受性及敏感度的关键时期[2-3]。因此,研究作物苗期对盐碱胁迫的响应机制以及如何缓解盐碱胁迫对植物的影响具有重要意义。碱胁迫不仅引起植物的渗透胁迫和离子胁迫,还引起高pH值胁迫,碱胁迫对植物生长发育的危害远大于盐胁迫[4-6]。许多研究表明,外源物浸种能提高作物发芽率,增强幼苗耐盐能力,如适宜浓度的硝普钠、亚精胺、油菜素内酯、硝酸钙、水杨酸和赤霉素等浸种均可以提高种子发芽率和幼苗生理活性[7-14],这些外源物能通过调节作物代谢来缓解盐胁迫的伤害,但对碱胁迫的研究较少,尤其乙酰化葡萄糖作为外源物增强小麦耐碱能力的研究尚未见报道。山西农业大学盐碱地治理研究课题组前期研究发现,新型盐碱地改良剂乙酰化葡萄糖能降低土壤碱性,同时产生的葡萄糖还可增加土壤K和有机质含量,提高土壤肥力,明显缓解盐碱地对作物生长的抑制[15]。但目前乙酰化糖对碱胁迫下作物生长的影响机制尚未进行研究。
本研究选用适合山西省中部冬麦区生长的小麦品种山农129为材料,用添加不同剂量乙酰化葡萄糖的碱培养液培养小麦幼苗,测定小麦幼苗的生理及生态指标,分析乙酰化葡萄糖对碱胁迫下小麦幼苗的影响,探究其对小麦幼苗的作用机制,为今后盐碱地改良提供理论依据。
1.1 试验材料
选用山西农业大学培育的冬小麦品种山农129为供试材料。乙酰化葡萄糖由山西农业大学盐碱地治理研究课题组在实验室合成。Na2CO3和NaHCO3均为分析纯。
1.2 试验设计
将2种碱性盐Na2CO3和NaHCO3按摩尔比1∶1混合,分别配制成总浓度依次为0(CK),30,60,90,120,150 mmol/L的6个处理组用于碱胁迫溶液浓度的选择,每个处理 3次重复。
参照杨春武等[16]的方法将2种碱性盐Na2CO3和NaHCO3按摩尔比1∶1混合,配制浓度为60 mmol/L的溶液作为碱胁迫液,分别添加不同剂量的乙酰化葡萄糖(Ac-G)(表1)。
表1 不同处理溶液pH值
Tab. 1 The pH value of different treatments

处理Treatment培养液CultureliquidpH值pHvalueW蒸馏水6.48±0.00CK碱胁迫液(A)10.31±0.02T1A+1mmol/LAc-G9.83±0.12T2A+2mmol/LAc-G9.03±0.16T3A+3mmol/LAc-G8.78±0.14T4A+4mmol/LAc-G7.44±0.10T5A+5mmol/LAc-G7.42±0.14
1.3 幼苗生长试验方法
将小麦种子放入铺有双层滤纸的蒸馏水中,在20 ℃恒温黑暗培养箱进行发芽培养,当胚长至5 cm时,每次挑选25株长势一致的幼苗,放入盛有胁迫处理液的培养皿中,3次重复,每天称重补水维持盐浓度恒定;胁迫7 d后,将每只培养皿中的小麦幼苗用蒸馏水冲洗3遍,用滤纸吸干表面水分,随机测量10株幼苗的株高和根长,称量苗鲜质量和根鲜质量,分开茎叶与根,105 ℃下杀青15 min,在65 ℃下烘干至恒重,称其干质量,计算单株质量。
1.4 测定项目及方法
胁迫处理小麦幼苗第7天测定叶片中叶绿素含量、可溶性糖含量、可溶性蛋白含量、丙二醛含量、质膜透性、POD活性和SOD活性。其中,叶绿素含量采用分光光度计法测定[17],可溶性糖含量采用蒽酮-硫酸比色法测定[17],可溶蛋白含量采用Lorry法测定[17],丙二醛含量采用硫代巴比妥酸(TBA)比色法测定[17],质膜透性采用相对电导率法测定[17],过氧化物酶(POD)活性采用愈创木酚法测定[17],超氧化物歧化酶(SOD)活性测定采用氮兰四唑(NBT)显色法测定[17]。
1.5 数据处理
采用Excel 2010和SPSS 10.0对数据进行整理和分析,采用LSD法进行多重比较。
2.1 不同浓度碱胁迫对小麦幼苗生长的影响
由图1可知,随着碱胁迫浓度的增大,小麦幼苗的株高逐渐变短、根系逐渐变短变少,碱胁迫对幼苗生长期株高和根系有明显的抑制作用,但对幼苗叶片含水率影响不明显,呈现先减后增的趋势,当碱胁迫浓度为120 mmol/L时,小麦幼苗含水率最低,为82.50%。其中,当碱胁迫浓度为30 mmol/L时,小麦幼苗的株高、茎叶干质量分别为12.13 cm和12.80 mg,与CK相比,株高降低了0.01%,茎叶干质量增加了0.1%,对小麦幼苗株高和茎叶干质量没有明显影响;当碱胁迫浓度为60 mmol/L时,小麦幼苗的株高、茎叶干质量分别为8.95 cm和10.20 mg,与CK相比,分别降低了27.2%,12.6%,碱胁迫对小麦幼苗株高和茎叶干质量有较显著的影响;当胁迫液浓度大于60 mmol/L时,有显著影响;当胁迫浓度达到150 mmol/L时,幼苗茎叶干质量为8.47 mg,比CK降低了27.4%,小麦幼苗株高为5.83 cm,比CK降低了52.6%(表2)。因此,本研究选用60 mmol/L的碱胁迫液为小麦幼苗的处理液。

图1 不同碱胁迫浓度下小麦幼苗的生长情况
Fig. 1 The results of wheat seedlings growth under alkali stresses
表2 不同碱胁迫浓度下小麦幼苗株高、茎叶干质量和叶片含水率
Tab. 2 Plant height,seedling dry quality and leaves water content of wheat seedling under alkali stresses

处理/(mmol/L)Treatment株高/cmPlantheight茎叶干质量/mgSeedlingdryweight叶片含水率/%LeaveswatercontentCK12.30±0.20a11.67±0.41a88.52±0.36a3012.13±0.30a12.80±0.12a84.69±0.80b608.95±0.21b10.20±0.21b84.60±0.43b907.97±0.12c9.63±0.34c83.56±0.39c1206.37±0.38d8.87±0.36d82.50±0.28d1505.83±0.32e8.47±0.12e82.81±0.58cd
注:表中数据均为3次重复的平均值±标准差; 不同小写字母表示不同处理在5%水平上差异显著。表3-5、图3-9同。
Note:Data in the table was the average of three replicates,different letters meant significant difference at 0.05 level among treatments. The same as Tab.3-5,Fig.3-9.
2.2 Ac-G对碱胁迫下小麦幼苗生长的影响
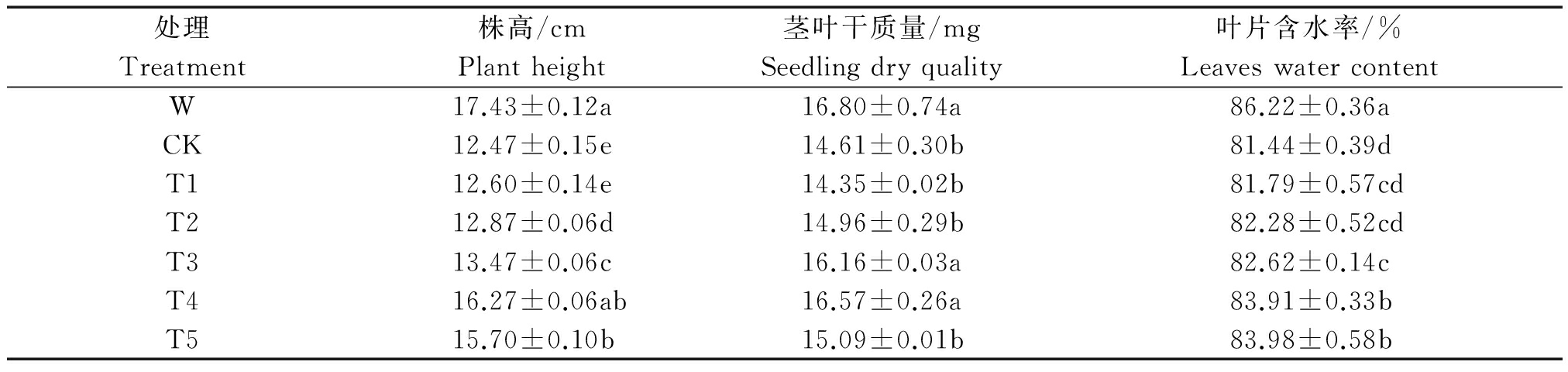
2.2.1 Ac-G对碱胁迫下小麦幼苗株高、茎叶的影响 随着Ac-G剂量的增加,小麦幼苗株高逐渐增加(图2),碱胁迫液的pH值从10.31降到7.42(表1),Ac-G可以通过降低溶液的pH值减轻碱胁迫。碱胁迫下幼苗株高和茎叶干质量比水培W处理分别降低28.5%和13.0%,在T4处理时,小麦幼苗株高、茎叶干质量分别为16.27 cm,16.57 mg,达到最大值,分别比CK处理增加30.5%,13.4%;在T5处理时,小麦幼苗的株高、茎叶干质量又呈现降低的趋势,分别比T4降低3.5%和8.9%;而小麦幼苗的叶片含水率呈逐渐增加的趋势,在T5处理时,幼苗叶片含水率达83.98%,比CK增加3.1% (表3)。

图2 不同处理下小麦幼苗生长情况
Fig.2 The results of wheat seedlings growth under different treatments
表3 不同处理下小麦幼苗株高、茎叶干质量和叶片含水率
Tab. 3 Plant height,seedling dry quality and leaves water content of wheat seedling under different treatments
处理Treatment株高/cmPlantheight茎叶干质量/mgSeedlingdryquality叶片含水率/%LeaveswatercontentW17.43±0.12a16.80±0.74a86.22±0.36aCK12.47±0.15e14.61±0.30b81.44±0.39dT112.60±0.14e14.35±0.02b81.79±0.57cdT212.87±0.06d14.96±0.29b82.28±0.52cdT313.47±0.06c16.16±0.03a82.62±0.14cT416.27±0.06ab16.57±0.26a83.91±0.33bT515.70±0.10b15.09±0.01b83.98±0.58b
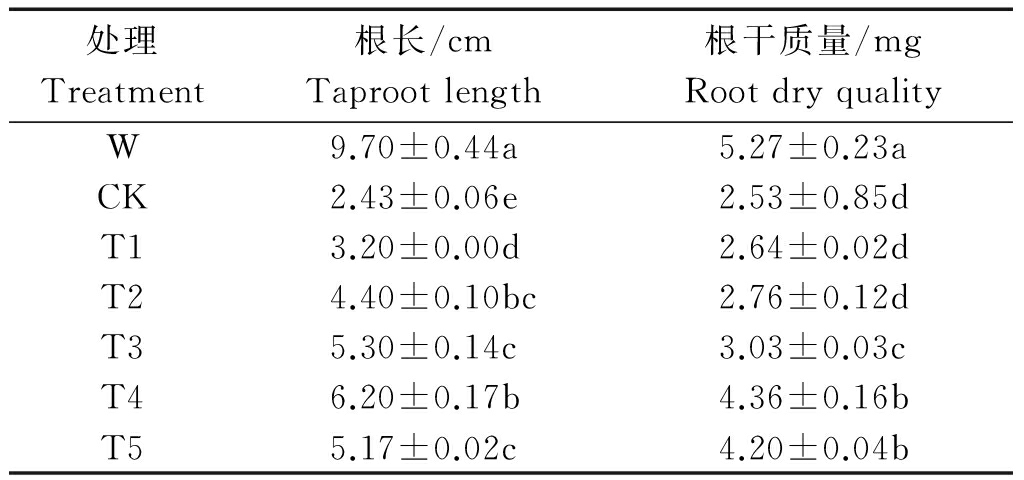
2.2.2 Ac-G对碱胁迫下小麦幼苗根的影响 随着Ac-G剂量的增加,小麦幼苗根长呈现增加趋势(图2)。碱胁迫下,小麦幼苗根长和根干质量比W处理分别降低80.0%和52.0%(表4);经Ac-G处理后,小麦幼苗的根长与根干质量随着Ac-G添加量增加呈现先增后减的趋势,在T4处理时,小麦幼苗的根长和根干质量达到最大值,分别为6.20 cm和4.36 mg,其中,根长是CK处理的2.55倍,根干质量是CK处理的1.72倍(表4)。
表4 不同处理下小麦幼苗的根长和根干质量
Tab.4 Taproot length and root dry weight of wheat seedling under different treatments
处理Treatment根长/cmTaprootlength根干质量/mgRootdryqualityW9.70±0.44a5.27±0.23aCK2.43±0.06e2.53±0.85dT13.20±0.00d2.64±0.02dT24.40±0.10bc2.76±0.12dT35.30±0.14c3.03±0.03cT46.20±0.17b4.36±0.16bT55.17±0.02c4.20±0.04b
2.2.3 Ac-G对碱胁迫下小麦幼苗根冠比的影响 由图3可知,碱胁迫对小麦幼苗的根冠比产生显著影响,CK处理的小麦幼苗根冠比为0.161,比W处理降低75.8%;在添加Ac-G后,小麦幼苗根冠比随着Ac-G剂量的增加而增加,在T5处理时,小麦幼苗根冠比为0.265,比CK处理增加64.6%,且差异达显著水平。试验结果表明,4 mmol/L的Ac-G可以明显改善小麦幼苗根系的生长。
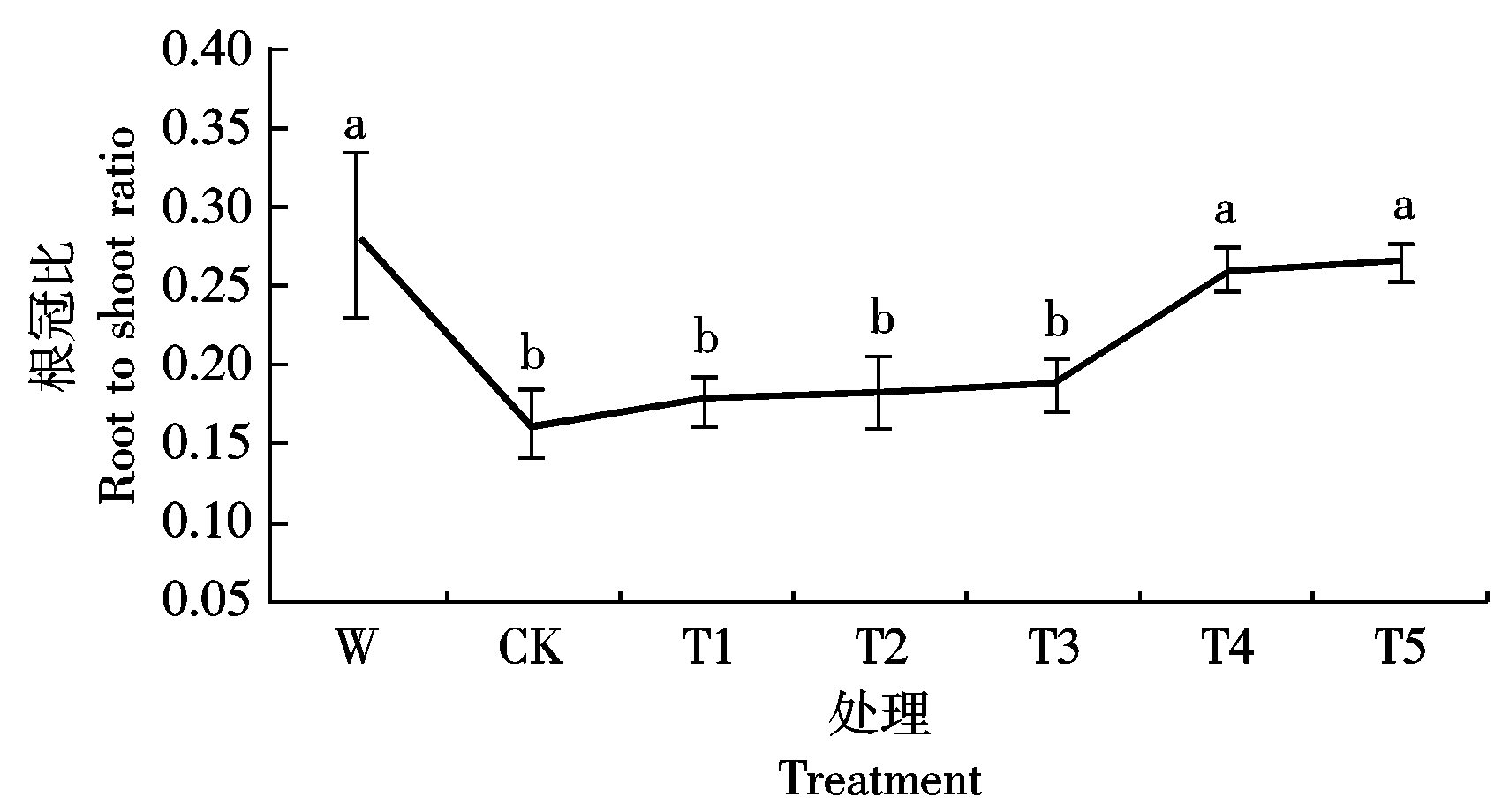
图3 不同处理下小麦幼苗的根冠比
Fig. 3 Root to shoot ratio of wheat seedling under different treatments
2.3 Ac-G对碱胁迫下小麦幼苗叶绿素含量的影响
由表5可知,碱胁迫对小麦幼苗叶绿素含量产生显著影响,CK处理后幼苗叶绿素a含量和叶绿素a/b值分别较W处理降低6.4%和22.9%,而叶绿素b含量较W处理增加了19.8%。加入Ac-G后,小麦幼苗中叶绿素含量产生显著变化,叶绿素a含量随乙酰化葡萄糖添加量的增加呈现出先增加后减小的趋势,在T4时叶绿素a含量达最大,为1.18 mg/g,与CK处理相比,增加了14.6%,并且各处理的叶绿素a含量与CK处理间差异均达显著水平;叶绿素b含量则随Ac-G添加量的增加而减小,在T5处理时,叶绿素b含量最小,为0.323 mg/g,比CK处理降低了11.0%;在碱胁迫条件下,小麦幼苗叶绿素a和叶绿素b的比值减小,CK处理比W处理降低了22.9%,乙酰化葡萄糖使叶绿素a和叶绿素b的比值增加,在T4处理时,叶绿素a和叶绿素b的比值最大,为3.64,比CK处理增加了28.6%。
表5 不同处理下小麦幼苗的叶绿素含量
Tab. 5 Thlorophyll contents of wheat seedling under different treatments
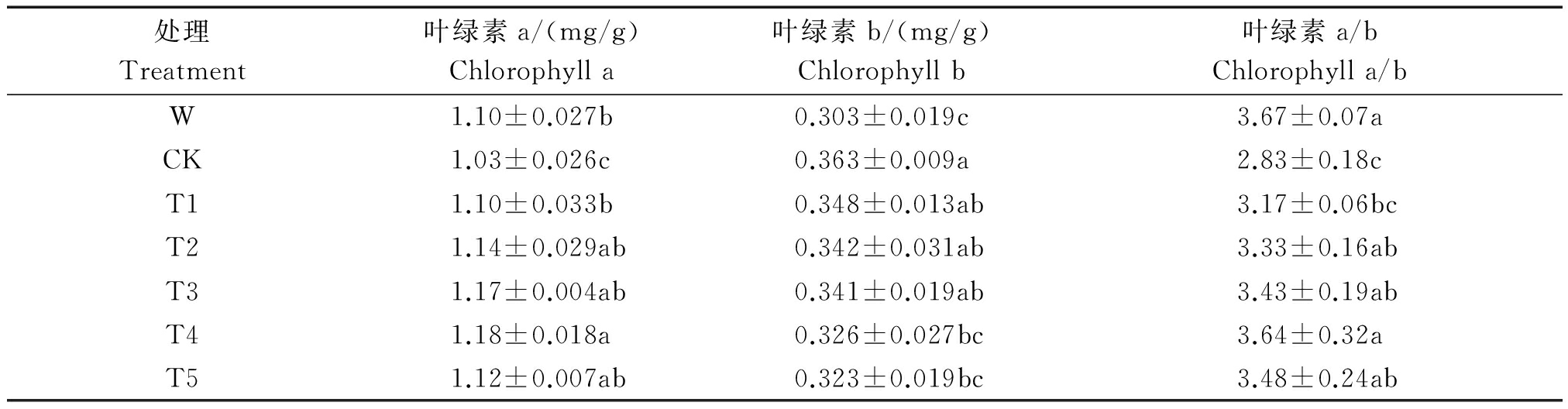
处理Treatment叶绿素a/(mg/g)Chlorophylla叶绿素b/(mg/g)Chlorophyllb叶绿素a/bChlorophylla/bW1.10±0.027b0.303±0.019c3.67±0.07aCK1.03±0.026c0.363±0.009a2.83±0.18cT11.10±0.033b0.348±0.013ab3.17±0.06bcT21.14±0.029ab0.342±0.031ab3.33±0.16abT31.17±0.004ab0.341±0.019ab3.43±0.19abT41.18±0.018a0.326±0.027bc3.64±0.32aT51.12±0.007ab0.323±0.019bc3.48±0.24ab
2.4 Ac-G对碱胁迫下小麦幼苗有机溶质含量的影响
2.4.1 Ac-G对碱胁迫下小麦幼苗可溶性糖含量的影响 从图4可以看出,碱胁迫下,CK处理的小麦叶片中可溶性糖含量是W处理的2.3倍;加入Ac-G后,小麦幼苗可溶性糖含量随着Ac-G含量的增加而增加,在T5处理小麦幼苗可溶性糖含量为40.43 mmol/L,比CK处理增加了14.4%,且差异达显著水平。试验结果表明,Ac-G可以增加小麦幼苗中的可溶性糖含量。
2.4.2 Ac-G对碱胁迫下小麦幼苗可溶性蛋白含量的影响 由图5可知,碱胁迫下,CK处理小麦幼苗
中可溶性蛋白含量是W处理的2.1倍,表明小麦幼苗在碱胁迫下通过酶活性增高来抵抗碱胁迫对小麦生长的影响;添加Ac-G后,小麦幼苗中可溶性蛋白含量增加,在T5处理时,小麦幼苗中的可溶性蛋白含量达到最大,为9.22 mg/g,比CK处理增加了31.5%,且差异达显著水平。
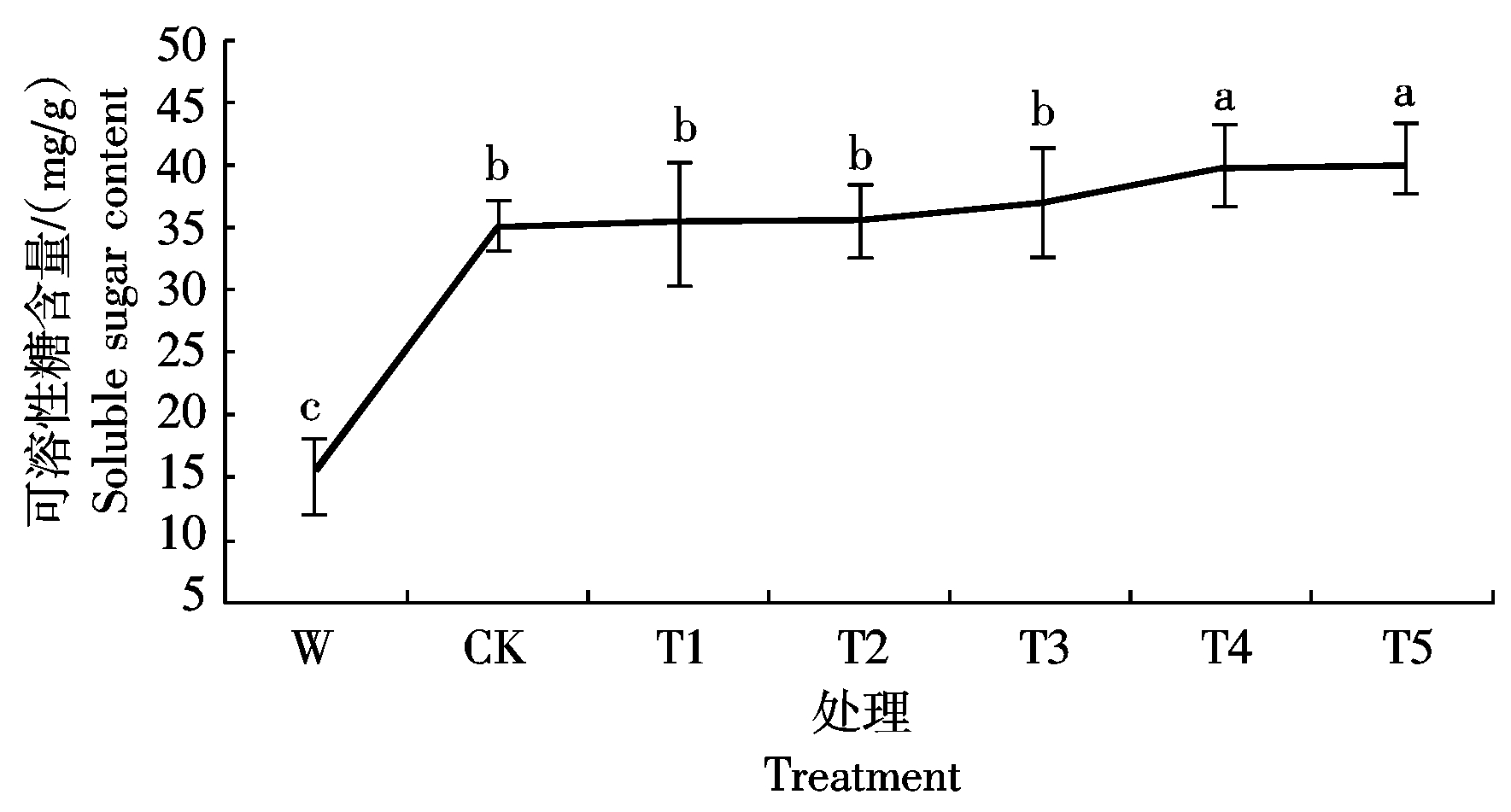
图4 不同处理下小麦幼苗可溶性糖的含量
Fig. 4 Soluble sugar contents of wheat seedling under different treatments
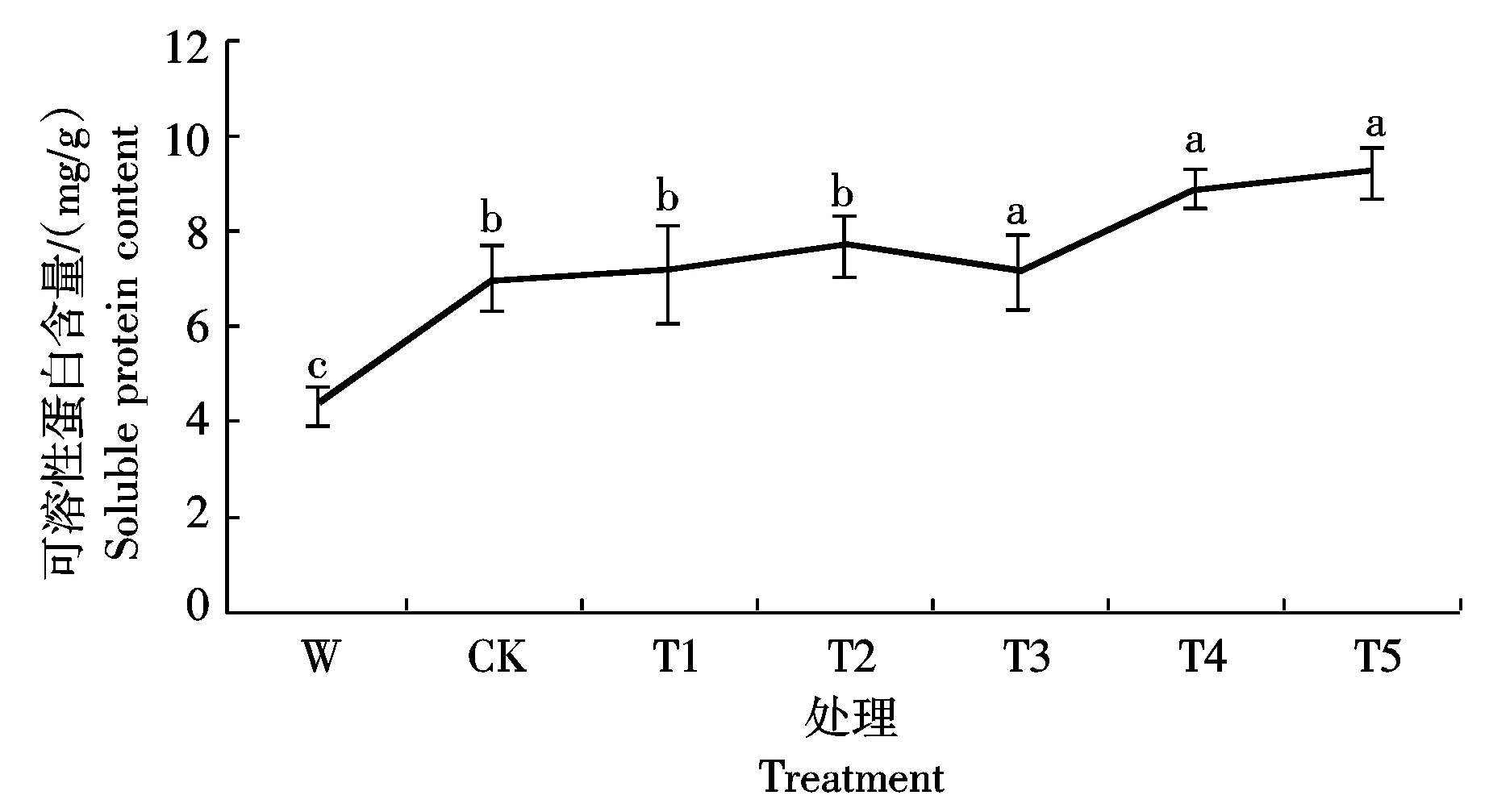
图5 不同处理下小麦幼苗可溶性蛋白的含量
Fig. 5 Soluble protein contents of wheat seedling under different treatments
2.5 Ac-G对碱胁迫下小麦幼苗细胞质膜的影响
2.5.1 Ac-G对碱胁迫下小麦幼苗丙二醛含量的影响 由图6可知,碱胁迫对小麦幼苗的丙二醛含量有显著的影响,CK处理的丙二醛含量比水培W处理的增加79.1%;加入Ac-G后,叶片的丙二醛含量随Ac-G含量的增加呈现先减后增的趋势,在T4处理时,幼苗叶片中丙二醛含量最小,为4.43 μmol/g,与CK处理相比,下降了29.3%(图6)。
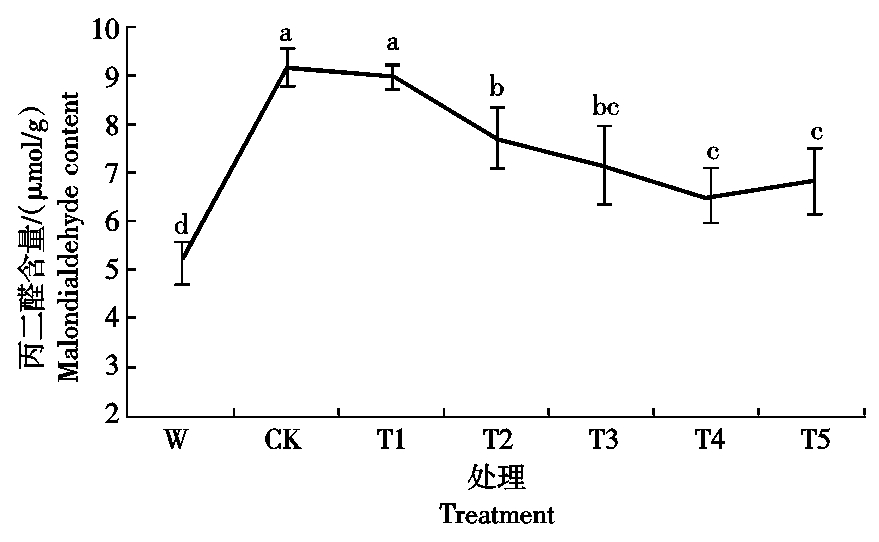
图6 不同处理下小麦幼苗丙二醛的含量
Fig. 6 Malondialdehyde contents of wheat seedling under different treatments
2.5.2 Ac-G对碱胁迫下小麦幼苗质膜透性的影响 由图7可知,碱胁迫对小麦幼苗叶片浸出液的电导率有显著影响,CK处理的叶片浸出液的相对电导率比W处理增加了61.4%;在添加Ac-G后,幼苗叶片的相对电导率比CK处理均有不同程度的降低,T4处理时幼苗叶片相对电导率最小,为12.1,比CK处理降低了29.1%。说明Ac-G可以显著地缓解碱胁迫对小麦幼苗质膜的伤害。
2.6 Ac-G对碱胁迫下小麦幼苗抗氧化酶活性的影响
2.6.1 Ac-G对碱胁迫下小麦幼苗超氧化物歧化酶活性的影响 从图8可以看出,碱胁迫处理小麦幼
苗时,小麦幼苗叶片中的超氧化物歧化酶(SOD)活性显著增高,CK处理比W处理增加了17.1%;加入Ac-G处理后,叶片中SOD的活性随Ac-G含量的增加而增强,T5处理的SOD活性最大,为227.9 U/g,与CK处理相比,活性增加了54.9%。
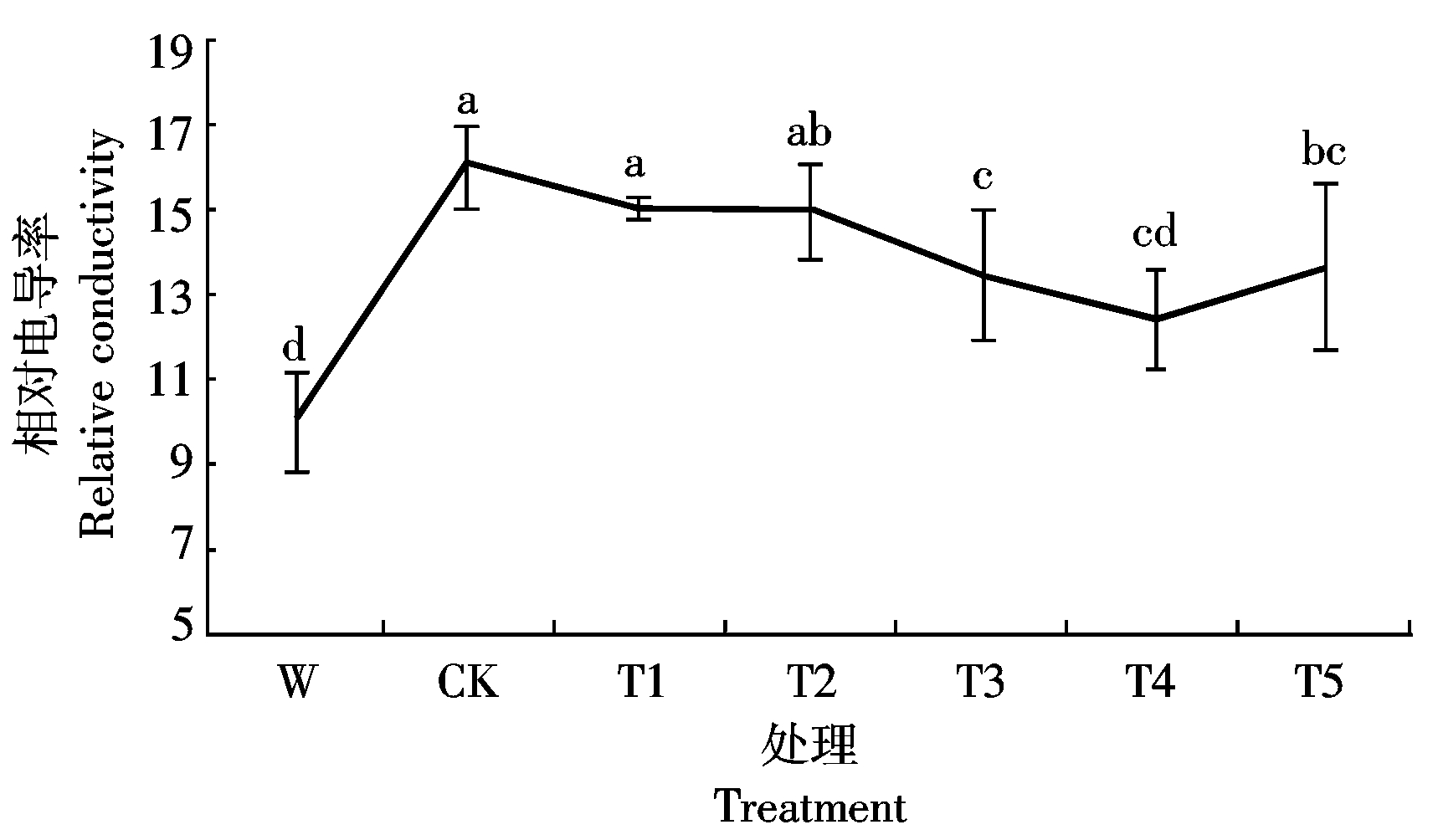
图7 不同处理下小麦幼苗质膜的相对电导率
Fig. 7 Relative conductivity about membrane permeability of wheat seedling under different treatments
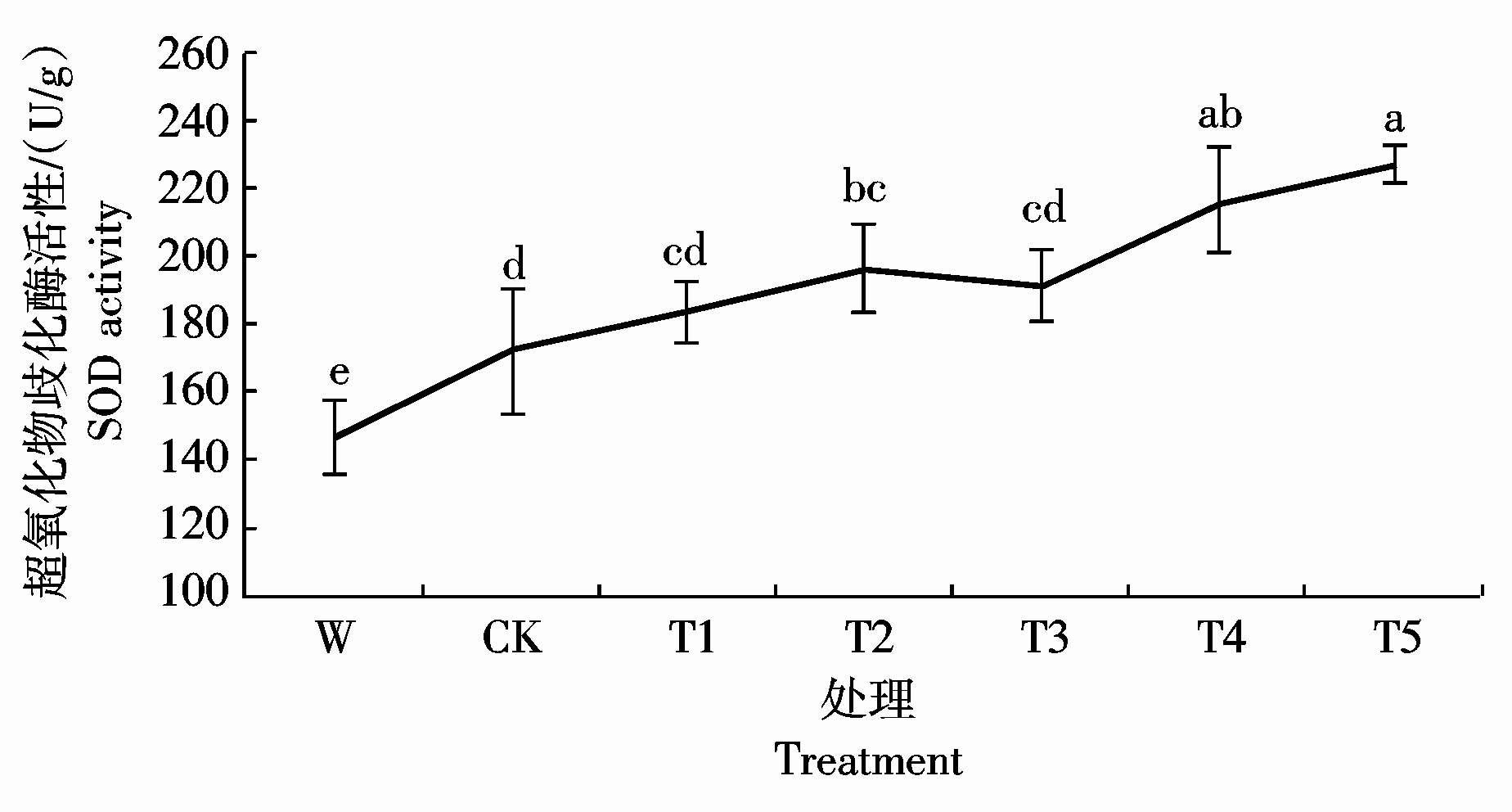
图8 不同处理下小麦幼苗超氧化物歧化酶的活性
Fig. 8 SOD activity of wheat seedling under different treatments
2.6.2 Ac-G对碱胁迫下小麦幼苗过氧化物酶活性的影响 由图9可知,碱胁迫使小麦幼苗的POD活性增强;加入Ac-G后,与CK处理相比,低剂量处理T1的POD活性下降,随Ac-G剂量的增加,POD活性又逐渐增加,在处理T5时,小麦幼苗POD活性达到最大值,为40.42 ΔOD470/(g·min),与CK处理相比,活性增加了21.6%。说明Ac-G可以有效地清除碱胁迫下小麦幼苗产生的自由基。
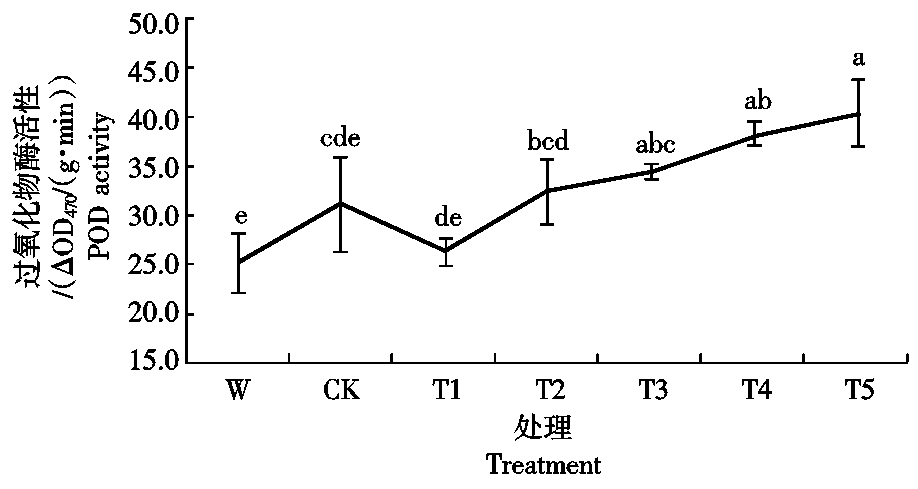
图9 不同处理下小麦幼苗的过氧化物酶活性
Fig. 9 POD activity of wheat seedling under different treatments
Keunen等[18]研究表明,糖类化合物是参与调控植物生长发育以及对逆境响应的一类信号分子。Chaum 等[19]研究指出,水稻叶片中Glc 和Suc 的累积对于稳定光合色素、维持光反应中的电子传递及碳同化等过程具有重要作用。本研究结果发现,乙酰化葡萄糖能显著提高碱胁迫下小麦幼苗的株高、根长以及幼苗根冠比,增加幼苗干物质的积累;乙酰化葡萄糖与碱作用不仅可以降低碱胁迫液的pH值,还可生成葡萄糖,生成的葡萄糖可作为外源糖促进植物的生长,该研究与Sulmon 等[20]研究指出在正常环境下,外源葡萄糖能够促进拟南芥生长的结论相吻合,表明施用乙酰化葡萄糖能够促进植物的生长;但当乙酰化葡萄糖的浓度继续增大后,幼苗生长却相对减弱,可能是由于乙酰化葡萄糖反应产物葡萄糖浓度过高,增大了培养液的渗透压,对小麦幼苗造成了渗透胁迫,本试验未开展此部分研究,结果有待进一步验证。
叶绿素是植物光合作用的关键,其含量的高低直接反映光合能力的强弱,植物受逆境胁迫后导致叶绿素含量下降,因此,提高盐胁迫下植物的光合效率是增强植物耐盐性的重要途径。赵莹等[21]研究发现,葡萄糖能提高细胞中叶绿素含量、提高叶片的光能利用率及光系统Ⅱ的光化学效率。Siringam等[22] 研究指出,盐胁迫下,外源糖能够有效改善水稻的光合作用。本研究结果表明,胁迫液中加入乙酰化葡萄糖后,小麦幼苗细胞的叶绿素a的含量以及叶绿素a与叶绿素b的比值增加,碱胁迫对幼苗的光抑制减弱,提高幼苗细胞的光合作用,从而促进幼苗的生长。但小麦幼苗在碱胁迫下光合作用的增强是乙酰化葡萄糖的直接作用,还是其反应产物葡萄糖对幼苗代谢的调节作用还有待进一步研究。
有机溶质和活性氧清除酶是植物缓解逆境压力的主要物质,对逆境下植物生长发育过程中起着至关重要的作用。本研究结果表明,植物在碱胁迫下细胞内可溶性蛋白和可溶性糖含量增加,活性氧清除酶活性增强,这与武俊英等 [23]的研究结果相符。郜明泉等[24]研究表明,外源葡萄糖还能够提高作物有机溶质含量,提高活性氧清除酶的活性,减少MDA的含量。本研究结果表明,乙酰化葡萄糖通过渗透调节物质的积累与抗氧化能力,达到缓解环境压力,一方面增加可溶性蛋白和可溶性糖含量,降低渗透势,另一方面提高幼苗细胞中SOD和POD的活性,提高抗氧化能力;乙酰化葡萄糖保护幼苗细胞结构和功能完整,防止细胞膜脂的过氧化和细胞内液的外渗,从而使幼苗叶片浸出液的相对电导率以及丙二醛含量降低。
综上所述,乙酰化葡萄糖能够显著促进碱胁迫下小麦幼苗的生长,其影响机制可能是多方面的,但与乙酰化葡萄糖能降低胁迫液碱性、提高有机溶质的含量、提高活性氧清除酶的活性、降低膜脂的氧化有着密切关系,具体机制尚需进一步研究。
本研究结果表明,乙酰化葡萄糖能有效地缓解碱胁迫对小麦幼苗生长的抑制,其中,4 mmol/L乙酰化葡萄糖能显著提高碱胁迫下小麦幼苗的株高、根长以及幼苗根冠比,增加幼苗干物质的积累;胁迫液中加入乙酰化葡萄糖后,小麦幼苗细胞的叶绿素a含量以及叶绿素a与叶绿素b的比值增加,减弱碱胁迫对幼苗的光抑制作用,提高幼苗细胞的光合作用;乙酰化葡萄糖可增加小麦幼苗可溶性蛋白和可溶性糖的含量,提高幼苗细胞中SOD和POD的活性,降低叶片浸提液的相对电导率和丙二醛含量。
参考文献:
[1] 陶 玲,任 珺.模拟盐碱胁迫对小麦幼苗茎长生长的影响[J].种子,2008,27(12):48-51.
[2] Peng Yonglin,Gao Zhanwu,Gao Ying,et al. Eco-physiological characteristics of alfalfa seedlings in response to various mixed salt-alkaline stresses[J]. Journal of Integrative Plant Biology,2008,50(1):29-39.
[3] 管 博,周道玮,田 雨,等. 盐碱及变温条件对花苜蓿种子发芽的影响[J]. 中国草地学报,2010,32 (1):58-63.
[4] 王丽娜,金 勋,齐国超,等.NaCl和Na2CO3胁迫对菊芋幼苗生物量的影响[J].中国农学通报,2014,30(19):215-218.
[5] Jan N E,Jalal-ud-Din J,Kawabata S. Impact of saline-alkali stress on the accumulation of solids in tomato fruits[J]. Pakistan Journal of Botany,2014,46(1):161-166.
[6] SHI Qinghua,DING Fei,WANG Xiufeng,et al. Exogenous nitric oxide protect cucumber roots against oxidative stress induced by salt stress[J]. Plant Physiology and Biochemistry,2007,45(8):542-550.
[7] 徐臣善.钙对盐胁迫下小金海棠幼苗生物量及抗氧化系统的影响[J].植物生理学报,2014,50(6):817-822.
[8] 李堆淑,朱广啟.外源水杨酸对桔梗幼苗铅胁迫的缓解效应[J].山西农业科学,2016,44(8):1165-1168.
[9] 肖小君,黄作喜,陈文年,等.外源NO对铅胁迫下水果黄瓜种子萌发和幼苗生理特性的影响[J].华北农学报,2015,30(3):123-128.
[10] 周万海,师尚礼,寇江涛.一氧化氮对NaCl胁迫下苜蓿种子萌发的影响[J].核农学报,2012,26(4):710-716.[11] Zhang H,Shen W B,Xu L L. Effects of nitric oxide on the germination of wheat seeds and its reactive oxygen species metabolism under osmotic stress[J]. Acta Botanica Sinica,2003,45(8):901-905.
[12] Jiang X Y,Song J,Fang H. Regulations of exogenous calciumand spermidine polyamine levels in maize seedlings under NaCl stress[J]. Acta Phytophysiologica Sinica,2000,26(6):539-544.
[13] Agami R A. Alleviating the adverse effects of NaCl stress in maize seedlings by pretreating seeds with salicylic acid and 24-epibrassinolide[J]. South African Journal of Botany,2013,88(9):171-177.
[14] Nasir Khan M,Siddiqui M H,Mohammad F,et al. Calcium chloride and gibberellic acid protect linseed (Linum usitatissimum L.) from NaCl stress by inducing antioxidative defence system and osmoprotectant accumulation[J]. Acta Physiologiae Plantarum,2009,32(1):121-132.
[15] 崔文明,张中东,赵成萍,等.新型改良剂对盐碱地土壤性质和玉米生长的影响[J].山西农业大学学报,2014,34(6):531-534.
[16] 杨春武,李长有,张美丽,等.盐、碱胁迫下小冰麦体内的pH及离子平衡[J].应用生态学报,2008,19(5):1000-1005.
[17] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].北京:高等教育出版社,2009:263-270.
[18] Keunen E,Peshev D,Vangronsveld J,et al. Plant sugars are crucial players in the oxidative challenge during abiotic stress:extending the traditional concept[J]. Plant,Cell & Environment,2013,36(7):1242-1255.
[19] Chaum S,Charoenpanich A,Roytrakul S,et al. Sugaraccumulation,photosynthesis and growth of two indica rice varietiesin response to salt stress[J]. Acta Physiologiae Plantarum,2009,31:477-486.
[20] Sulmon C,Gouesbet G,Amrani A E,et al. Sugar-induced tolerance to the herbicide atrazine in Arabidopsis seedlings involves activation of oxidative and xenobiotic stress responses[J]. Plant Cell Reports,2006,25(5):489-498.
[21] 赵 莹,杨克军,赵长江,等.外源糖调控玉米光合系统和活性氧代谢缓解盐胁迫[J].中国农业科学,2014,20(10):3962-3972.
[22] Siringam K,Juntawong N,Chaum S A,et al. Salt tolerance enhancement in indica rice (Oryza sativa L. spp. indica) seedlings using exogenous sucrose supplementation[J]. Plant Omics,2012,5(1):52-59.
[23] 武俊英,赵宝平,刘景辉,等.葡萄糖浸种对NaCl胁迫下燕麦幼苗生长和渗透调节的影响[J].麦类作物学报,2014,34(7):983-989.
[24] 郜明泉,赵鹏飞,赵会杰,等.葡萄糖对干旱胁迫下小麦种子萌发及幼苗生长的调节作用[J].生命科学研究,2015,19(1):59-61.
Effects of Acetyl Glucose on the Growth of Wheat Seedlings under Alkali Stress
Abstract:This study aims at exploring the effects of acetyl glucose on the growth and biochemical mechanisms of wheat seedlings under the alkali stress. Shannong 129 wheat varieties was used as experimental material to determine ecophysiological indicators of wheat seedlings,setting 7 experimental treatments,W(Distilled water),CK(60 mmol/L NaHCO3+ Na2CO3),T1(CK+1 mmol/L Ac-G),T2(CK+2 mmol/L Ac-G),T3(CK+3 mmol/L Ac-G),T4(CK+4 mmol/L Ac-G),T5(CK+5 mmol/L Ac-G). The results indicated that the optimal dose to alleviate the inhibition of wheat seedlings growth under alkali stress was 4 mmol/L Ac-G,and the pH value of liquid alkali stress was reduced to 7.44. With the increase of acetyl glucose dose,seedling height,root length,root to shoot ratio,seedling biomass,the content of chlorophyll a and chlorophyll a/b of wheat seedlings reached the highest value under T4 treatments. The soluble sugar and protein in wheat seedlings leaves were substantially increased. The superoxide dismutase and peroxidase activities of wheat seedlings were significantly increased and reached the highest value under T4 treatments,while the accumulation of malondialdehyde (MDA) and the electrical conductivity of leaching solution in wheat seedlings leaves decreased compared to control. The results can provide important theoretical basis for the improvement of saline alkali land in the future.
Key words:Acetyl glucose; Alkali stress; Wheat; Physiological and ecological indexes
收稿日期:2017-03-15
基金项目:山西省专利推广实施项目(131006);山西省农业技术推广示范行动项目(SNJTGSFXD201317);山西省自然科学基金项目(2012011033-7);山西省农业技术推广示范行动项目(SXNKTG05);土壤与农业可持续发展国家重点实验室开放基金课题(0812201222)
中图分类号:S156.2;S512.01
文献标识码:A
文章编号:1000-7091(2017)03-0125-07
doi:10.7668/hbnxb.2017.03.019