
摘要:为了揭示干旱胁迫下外源油菜素内酯对玉米幼苗光合作用的保护机制,采用溶液培养的方法,以驻玉309为试验材料,研究外源油菜素内酯(BR)预处理及20% PEG-6000模拟干旱胁迫后玉米幼苗的生长参数、叶绿素含量、光合参数、叶绿素荧光参数及D1蛋白含量的变化。结果表明,与干旱胁迫处理(PEG)相比,BR+PEG处理的玉米苗株高增加45.87%,根长增加20.56%,总干物质积累增加8.01%,叶片相对含水量提高4.50%,叶绿素a含量增加26.32%,光合参数(Pn、Gs、Ci、Tr)分别提高9.57%,38.23%,30.19%,28.12%,光合系统Ⅱ(ΦPSⅡ)活性提高了20.48%,最大光化学效率提高了0.66%,光合系统Ⅱ绝对电子传递速率(ETR(Ⅱ)和相对电子传递速率rETR(Ⅱ))分别提高20.40%和31.02%;D1蛋白含量增加37.34%(P<0.05)。说明在干旱胁迫条件下叶片喷施BR可以改善玉米幼苗的生长发育,减缓光合系统的损伤,促进D1蛋白质的稳定,从而提高玉米幼苗对干旱胁迫的适应性。
关键词:玉米幼苗;干旱胁迫;外源油菜素内脂;光合作用;D1蛋白;调控效应
干旱胁迫是最主要的非生物胁迫之一,严重影响植物的生长发育、新陈代谢和经济产量[1]。干旱主要损伤植株的生理代谢和光合作用[2],导致植株生长受阻、株高降低、叶面积减少、叶片变黄、根质量下降和根长增加,使叶绿素含量降低、光合作用减弱、细胞膜透性增加[3-4]。光合作用是植物生命活动过程中的重要组成部分,是决定作物产量和品质形成的重要前提,而逆境是光合作用重要的限制因素,尤其是干旱胁迫对光合作用的影响更为频繁。目前,人们普遍认为叶绿体的光系统Ⅱ(PSⅡ)是干旱对光合系统破坏的原初部位[5]。PSⅡ是一种由30多种蛋白质构成的多亚基蛋白复合体,D1蛋白是其中之一,也是逆境损伤的主要靶位[6-8]。在适宜的生长条件下,PSⅡ的活性是通过不断快速降解和重新合成D1蛋白来维持的,但这种降解合成的平衡体系往往会被由干旱引起的光抑制打破,从而破坏了光合作用,最终造成生物产量的减少和经济产量的降低。前人研究表明,病害、盐、衰老、低温、水分亏缺、紫外线照射以及重金属等胁迫条件不仅影响植物的光合作用,还影响植物D1蛋白的表达及其代谢[9-16]。而如何通过调控D1蛋白质的表达来提高植物的抗旱能力成为研究热点。
玉米苗期是整个生育期间的关键,苗全、苗壮、早发是玉米高产的基础,生产上因干旱造成的玉米缺苗断垄、苗迟苗弱等现象十分普遍,除了筛选和培育抗旱性强的品种外,生长调节物质的应用被广泛关注。BR(油菜素甾体类化合物)是在植物界普遍存在的一类生长调节物质,活性较高,类似于动物甾醇类激素。近年来有关BR处理提高作物抗旱能力、抗寒能力、耐热能力、耐药能力和抗毒能力的报道较多[17-23]。而有关BR处理如何调控玉米D1蛋白的表达,是否能提高光合系统对干旱胁迫的抗性方面尚未见报道。为此,本试验采用水分敏感型玉米杂交种,研究外源BR处理对PEG-6000胁迫下玉米D1蛋白的调控效应,旨在探明BR处理提高植物光合系统对干旱适应能力的代谢生理和分子机制,为研发抗旱化学调控技术提供新的理论依据。
1.1 试验材料与处理
试验选用水分敏感型玉米品种驻玉309为试验材料。玉米种子用0.2% NaClO消毒10 min,蒸馏水冲洗后用蒸馏水浸种24 h,然后在盘中28 ℃发芽3 d,转入Hoagland 营养液中培养至2叶完全展开后,用0.2 μmol/L的BR进行预处理3 d 后,进行20% PEG-6000模拟干旱胁迫处理3 d,处理期间每天更换营养液。幼苗生长的条件为:昼/夜温度(27±1)℃/(22±1)℃,光强600 μmol/(m2·s),湿度(75±5)%,光周期12 h/12 h。在前期试验的基础上,试验设为4 个处理:CK(0 PEG-6000,对照)、PEG(20% PEG-6000)、BR(0.2 μmol/(m2·s) BR)、BR+PEG(0.2 μmol/(m2·s) BR+20% PEG-6000)。干旱胁迫后第3天均选取完全展开的第2叶于液氮中保存,进行生理生化指标和D1 蛋白的测定。
1.2 测定方法
1.2.1 生物量的测定 测定完植株的高度及根长后,将植株的地上部和地下部用剪刀分开,分别用自来水3次冲洗干净,用蒸馏水清洗一次后用滤纸吸干,用1‰天平称鲜质量。然后在恒温烘箱中,110 ℃杀青5 min 后于80 ℃烘干至恒重后称干质量,每个处理重复9次,最终计算总干质量及叶片相对含水量。
1.2.2 光合气体交换参数测定 使用LI-6400便携式光合作用测定系统(LI-COR,American)测定不同处理条件下玉米叶片的Pn(光合速率)、Gs(气孔导度)、Ci(胞间CO2浓度)、Tr(蒸腾速率)等。
1.2.3 叶绿素荧光参数测定 使用FMS-2脉冲调制式叶绿素荧光仪(Hansatech,UK)测定ETR:光合电子传递速率、Fo:初始荧光、Fv:暗适应下最大可变荧光、Fm:最大荧光、Fs:稳态荧光、Fm:光打开时的最大荧光产量等荧光参数,通过这些参数可计算出PS Ⅱ的Fv/Fm:最大光量子效率、ФPS Ⅱ:实际光化学效率、Fv/Fo:PS Ⅱ潜在活性、qP:光化学猝灭系数和NPQ:非光化学猝灭系数等值。测定前叶片暗适应时间为20 min,光化学强度为400 μmol/(m2·s),饱和闪光强度为8 000 μmol/(m2·s)。
1.2.4 类囊体膜蛋白提取 叶绿体类囊体膜蛋白的提取参照Guo等[24]的方法。将不同处理条件下玉米幼苗分别剪取10 g,在研钵中加入液氮充分研磨成均匀的粉状,加入A液(蔗糖300 mmol/L,氯化镁5 mmol/L,乙二胺四乙酸二钠1 mmol/L,氟化钠10 mmol/L,HEPES-NaOH 50 mmol/L,pH值7.5)10 mL,在摇床上轻振3 min, 充分混匀后用3层纱布将液体过滤到试管中,分装到离心管中进行离心,离心设置为3 676 r/min,4 min,将离心后的上清去除,保留沉淀,重新加入2 mL B液(蔗糖 5 mmol/L,氯化镁5 mmol/L,氟化钠10 mmol/L,HEPES-NaOH 10 mmol/L,pH值7.5),再次混合均匀后,在5 198 r/min下离心3 min,去上清,将沉淀悬浮于C液中(蔗糖100 mmol/L,氯化钠 5 mmol/L,氯化镁10 mmol/L,氟化钠10 mmol/L,HEPES-NaOH 10 mmol/L,pH值7.5),进行下一步的电泳试验。玉米幼苗的类囊体膜蛋白整个提取过程均在4 ℃避光条件下完成,多余样品可储存于-80 ℃冰箱中以备后续使用。
1.2.5 SDS-PAGE和Western Blotting检测 类囊体膜蛋白的分离主要参考Du等[25]的方法,将类囊体膜蛋白样品按1∶1(体积比)加入蛋白质裂解液(2%十二烷基硫酸钠、5% β-硫基乙醇、20%甘油、0.01%溴酚蓝、Tris-HCl 0.125 mol/L,pH值6.8),在水浴锅中沸腾3 min,冷却后,在 9 492 r/min下离心5 min,吸取上清液,样品浓度为10 μg 蛋白 (类囊体膜蛋白浓度用考马斯亮蓝在紫外分光光度仪下测定),采用15%的分离胶 (pH值8.8) 和5%的浓缩胶 (pH值6.8) 进行蛋白分离。蛋白分离完毕后用考马斯亮蓝R-250染色或将分离得到的蛋白转移到PVDF膜上与D1蛋白抗体进行杂交,以此来进一步分析D1蛋白(分子质量32 kDa)的变化情况,并进行Western Blotting分析。该Western Blotting检测中所使用的一抗为 D1 蛋白抗体(由Agrisera公司提供),二抗为辣根酶标记的山羊抗兔IgG (由中杉金桥公司提供)。
1.3 数据分析
对数据进行方差及相关分析采用SPSS 19.0软件,多重比较以Duncan氏新复极差法进行,并用 Excel 2003进行绘图。
2.1 干旱胁迫下外源BR对玉米幼苗生长的影响
由图1-A看出,干旱胁迫明显抑制了玉米幼苗生长,而外源BR处理可以缓解干旱胁迫对玉米幼苗生长的抑制。图1-B可以看出,BR+PEG处理与PEG处理相比,叶片相对含水量提高4.50%。图1-C可以看出,干旱胁迫抑制了玉米株高和根系的生长,BR+PEG处理比PEG处理株高增加45.87%(P<0.05),根长增加20.56%(P<0.05)。图1-D可以看出,PEG处理比CK的总干物质积累量降低14.32%,BR+PEG处理比PEG处理的总干物质积累量提高8.01%。

A.干旱胁迫3 d及BR处理的表型图;B.干旱胁迫3 d及BR处理对玉米叶片的相对含水量的影响;C.干旱胁迫3 d及BR处理的玉米株高和根长;D.干旱胁迫3 d及BR处理的地上和地下干物质积累;图中数据为9次重复的平均值±标准误。不同字母表示数据差异达5%显著水平。CK.0 PEG-6000; PEG.20% PEG-6000; BR.0.2 μmol/(m2·s) BR; BR+PEG.0.2 μmol/(m2·s) BR+20% PEG-6000。图2,5、表1-2同。
A.The picture of Brassinosteroids treatment on maize seedlings after 3 d drought stress;B. Effects of Brassinosteroids treatment on relative water content of maize seedlings 3 d after drought stress; C.Effects of Brassinosteroids treatment on plant height and root length of maize seedlings 3 d after drought stress;D.Effects of Brassionosteroids theatment on shoot and root dry weight of maize seedlings 3 d after drought stress.Data in the Fig.1 are mean ± SE of 9 replicates. Values followed by a different letter are significantly different at P<5%. CK. 0 PEG-6000; PEG.20% PEG-6000; BR.0.2 μmol/(m2·s) BR;BR+PEG.0.2 μmol/(m2·s) BR+20% PEG-6000. The same as Fig.2,5,Tab.1-2.
图1 干旱胁迫下外源BR对玉米苗期形态特征的影响
Fig.1 Effects of Brassinosteroids treatment on plant parameters of morphological characteristics of maize seedlings after drought stress
2.2 干旱胁迫下外源BR对玉米幼苗叶绿素含量的影响
图2表明,叶绿素a含量BR处理比CK增加18.50%,BR+PEG处理比PEG处理增加26.32%(P<0.05)。叶绿素b含量BR处理比CK增加1.69%,BR+PEG处理比PEG处理增加1.21%。类胡萝卜素含量BR处理比CK降低8.19%,BR+PEG处理比PEG处理增加15.03%。说明干旱胁迫下玉米叶片喷施BR预处理后,叶绿素a含量明显增加,叶绿素b和类胡萝卜素无显著变化。
2.3 干旱胁迫下外源BR对玉米幼苗叶片光合参数的影响
由表1可知:PEG处理后玉米幼苗叶片的Pn、Gs、Ci、Tr与CK相比均呈现下降趋势,分别降低29.84%,28.97%,39.42%,44.30%(P<0.05)。而BR+PEG处理相较于PEG处理在Pn、Gs、Ci、Tr上分别升高9.57%,38.23%,30.19%,28.12%。表明外源BR预处理后能够减少干旱胁迫对植株光合系统造成的伤害。
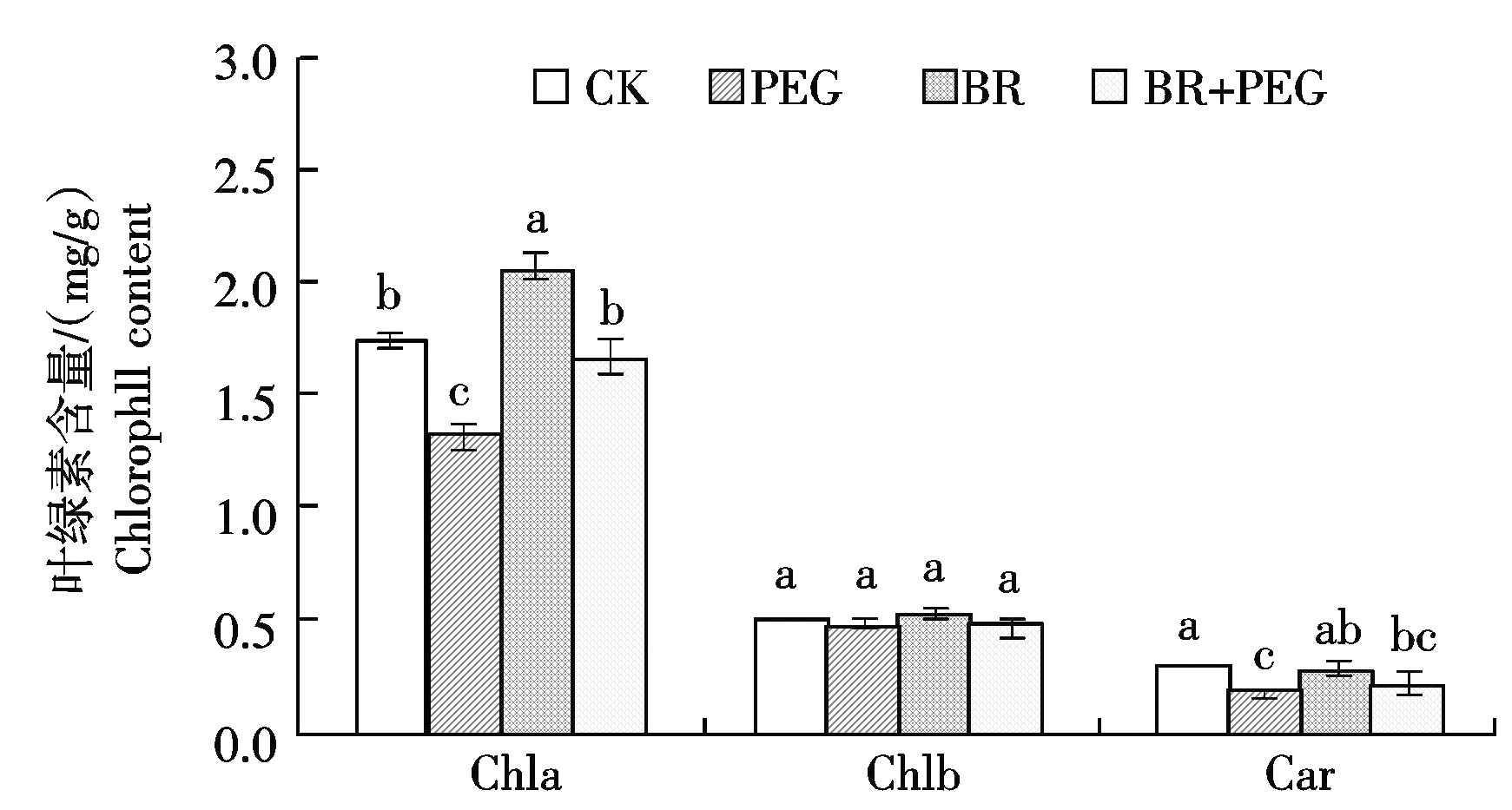
图2 干旱胁迫下外源BR处理对玉米叶片叶绿素含量的影响
Fig.2 Effects of Brassinosteroids treatment on plant chlorophyll content of maize seedlings after drought stress
表1 干旱胁迫下外源BR处理对玉米苗期叶片光合参数的影响
Tab.1 Effects of Brassinosteroids treatment on plant photosynthesis parameters of maize seedlings μmol/(m2·s)
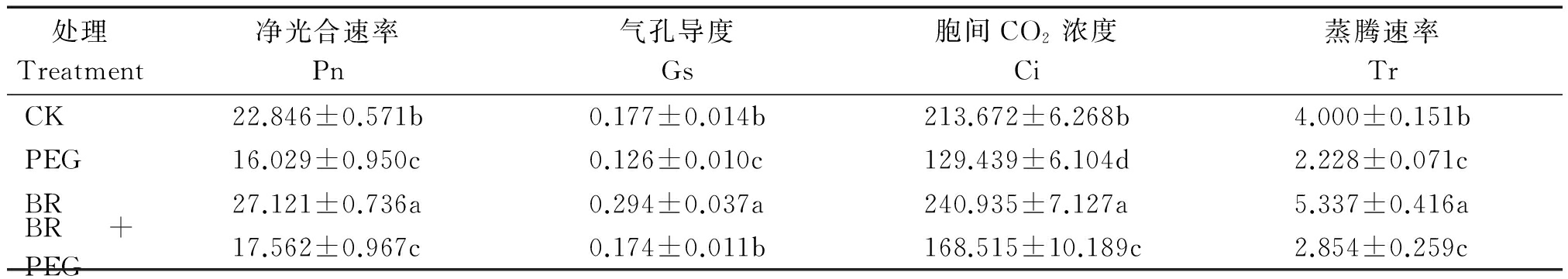
处理Treatment净光合速率Pn气孔导度Gs胞间CO2浓度Ci蒸腾速率TrCK22.846±0.571b0.177±0.014b213.672±6.268b4.000±0.151bPEG16.029±0.950c0.126±0.010c129.439±6.104d2.228±0.071cBR27.121±0.736a0.294±0.037a240.935±7.127a5.337±0.416aBR+PEG17.562±0.967c0.174±0.011b168.515±10.189c2.854±0.259c
2.4 干旱胁迫下外源BR对玉米幼苗叶绿素荧光参数和相对电子传递速率的影响
2.4.1 干旱胁迫下外源BR对玉米幼苗叶绿素荧光参数的影响 由表2可知,光系统Ⅱ(PSⅡ)的活性以BR处理为最优。经干旱胁迫3 d后,绝对光合电子传递速率(ETR(Ⅱ))、PSⅡ最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)和光化学猝灭系数(qP)等比CK分别降低34.26%,3.32%,34.30%,28.99%;而非光化学猝灭系数(qN)升高6.25%(P<0.05);而BR+PEG处理的ETR(Ⅱ)、Fv/Fm、ΦPS Ⅱ、qP等值比PEG处理升高20.40%,0.66%,20.48%,16.73%;光系统Ⅰ(PS Ⅰ)中ΦPS Ⅰ 和ETR(Ⅰ),PEG处理比CK和BR+PEG处理分别降低24.31%,24.18%和8.33%,8.22%;说明干旱胁迫3 d后,损伤了玉米PS Ⅱ和PS Ⅰ二者的活性,从而破坏了光合系统,而喷施BR处理有助于缓解干旱胁迫对PS Ⅱ活性的伤害,使植物光合作用正常进行。
2.4.2 干旱胁迫下外源BR对玉米幼苗相对电子传递速率的影响 图3反映了光系统Ⅱ相对电子传递速率随光强变化的趋势。4个处理在光强0~200 μmol/(m2·s)迅速增加,到200~300 μmol/(m2·s)光系统Ⅱ相对电子传递速率趋向于稳定。玉米幼苗受到干旱胁迫后,相对电子传递速率减慢,而BR+PEG处理,在223 μmol/(m2·s)时,rETR比PEG处理增加31.02%,表明施加外源BR可以提高干旱胁迫下光系统Ⅱ相对电子传递速率。
表2 干旱胁迫下外源BR对玉米苗期叶绿素荧光参数的影响
Tab.2 Effects of Brassinosteroids treatment on plant chlorophyll fluorescence parameters of maize seedlings after drought stress
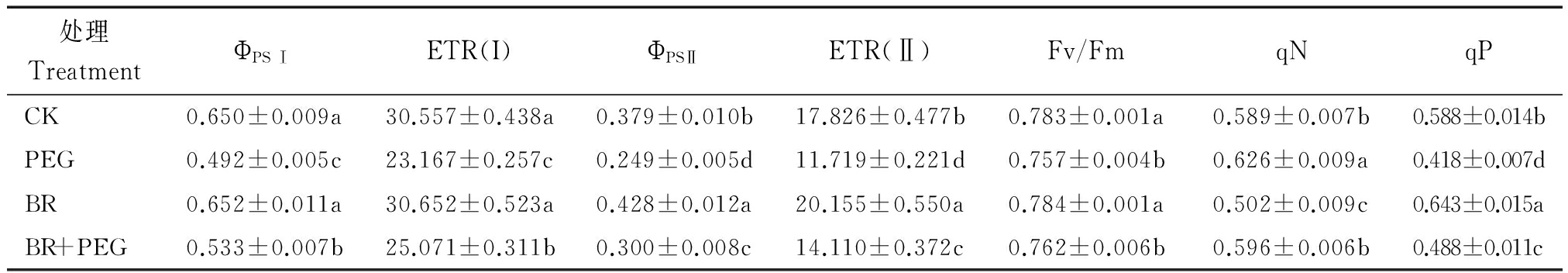
处理TreatmentΦPSⅠETR(I)ΦPSⅡETR(Ⅱ)Fv/FmqNqPCK0.650±0.009a30.557±0.438a0.379±0.010b17.826±0.477b0.783±0.001a0.589±0.007b0.588±0.014bPEG0.492±0.005c23.167±0.257c0.249±0.005d11.719±0.221d0.757±0.004b0.626±0.009a0.418±0.007dBR0.652±0.011a30.652±0.523a0.428±0.012a20.155±0.550a0.784±0.001a0.502±0.009c0.643±0.015aBR+PEG0.533±0.007b25.071±0.311b0.300±0.008c14.110±0.372c0.762±0.006b0.596±0.006b0.488±0.011c
注:ΦPSⅠ.PS Ⅰ的实际量子产量(实际光合能力、实际光合效率);ETR(Ⅰ).PS I的绝对电子传递速率;ΦPSⅡ.PS Ⅰ的实际量子产量(实际光合能力、实际光合效率);ETR(Ⅱ).PSⅡ的绝对电子传递速率;Fv/Fm.PSⅡ最大光能转化效率;qN.非光化学淬灭系数;qP.光化学淬灭系数。
Note:Φ PS Ⅰ. The PS I′s actual quantum yield (actual photosynthetic capacity, the actual photosynthetic efficiency); ETR (Ⅰ) .the PSⅠ′s absolute electron transfer rate; Φ PSⅡ.PS Ⅱ actual quantum yield (actual photosynthetic capacity, the actual photosynthetic efficiency); ETR (Ⅱ) .PS Ⅱ absolute electron transfer rate; Fv/Fm.PS Ⅱ maximum light energy conversion efficiency; qN.Non photochemical quenching coefficient; qP. Photochemical quenching coefficient.
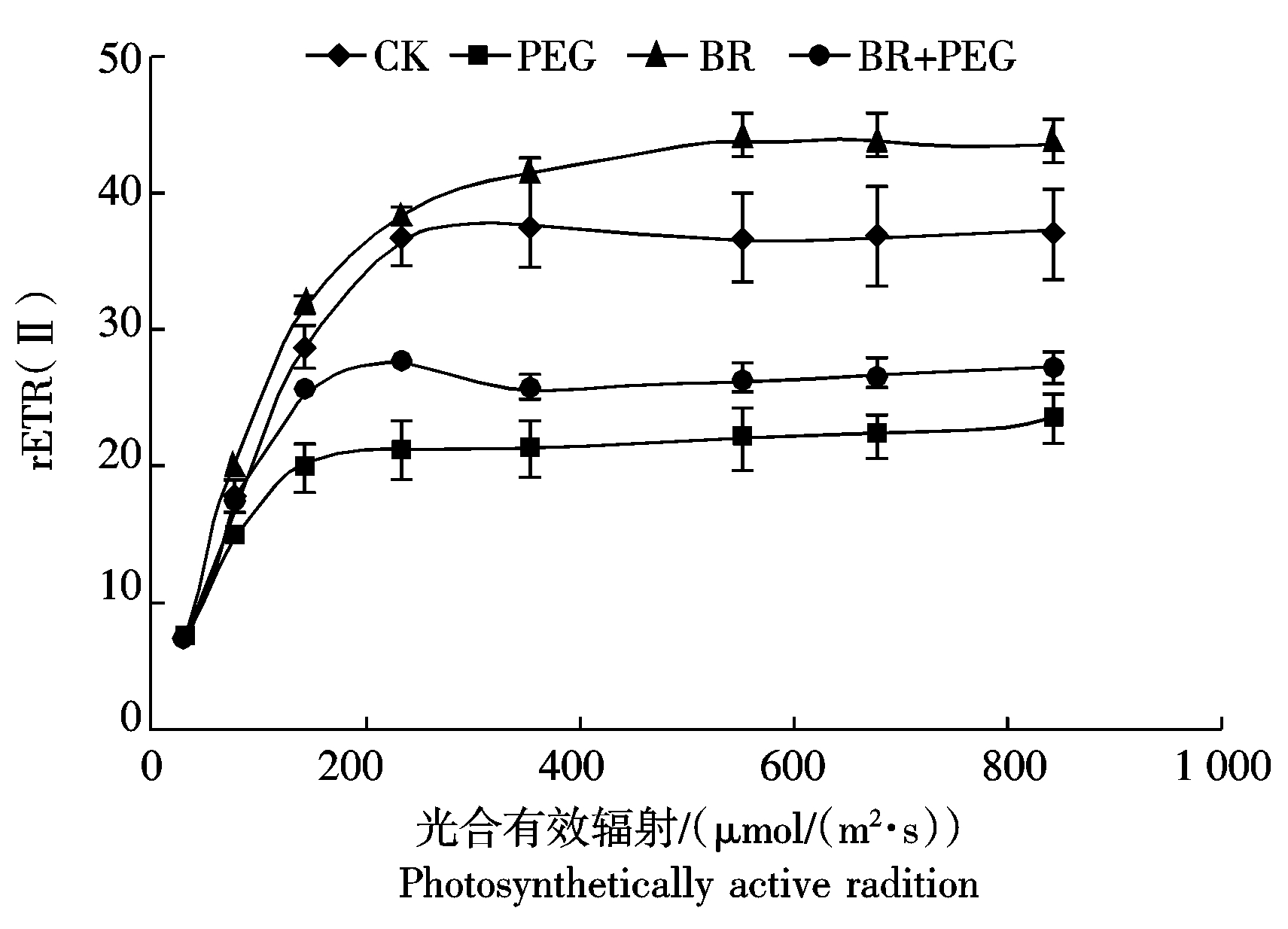
图3 干旱胁迫下外源BR对玉米苗期叶绿素相对电子传递速率的影响
Fig. 3 Effects of Brassinosteroids treatment on the speed of rETR(Ⅱ) of maize seedlings after drought stress
2.5 干旱胁迫下外源BR对玉米幼苗叶片类囊体膜蛋白的影响
从图4可看出,干旱胁迫3 d后,PEG膜蛋白组分水平出现降低趋势,条带较模糊,而BR+PEG处理膜蛋白组分比PEG处理条带清晰。叶绿体光反应中心Ⅱ核心蛋白D1(分子质量32 kDa),内周捕光天线色素蛋白复合体CP43和CP47(47,43 kDa),放氧复合体外周蛋白33,24 kDa处,类囊体膜上的ATP合酶的CFl亚基(55 kDa)等条带处理间差别明显。CK与BR处理在叶绿体类囊体膜蛋白各组分含量差异不大;表明外源BR预处理对干旱胁迫下玉米叶绿体类囊体膜蛋白的表达是有利的,可以使其维持在正常水平,还能够减轻叶绿体类囊体膜蛋白在干旱胁迫下所受到的损害。
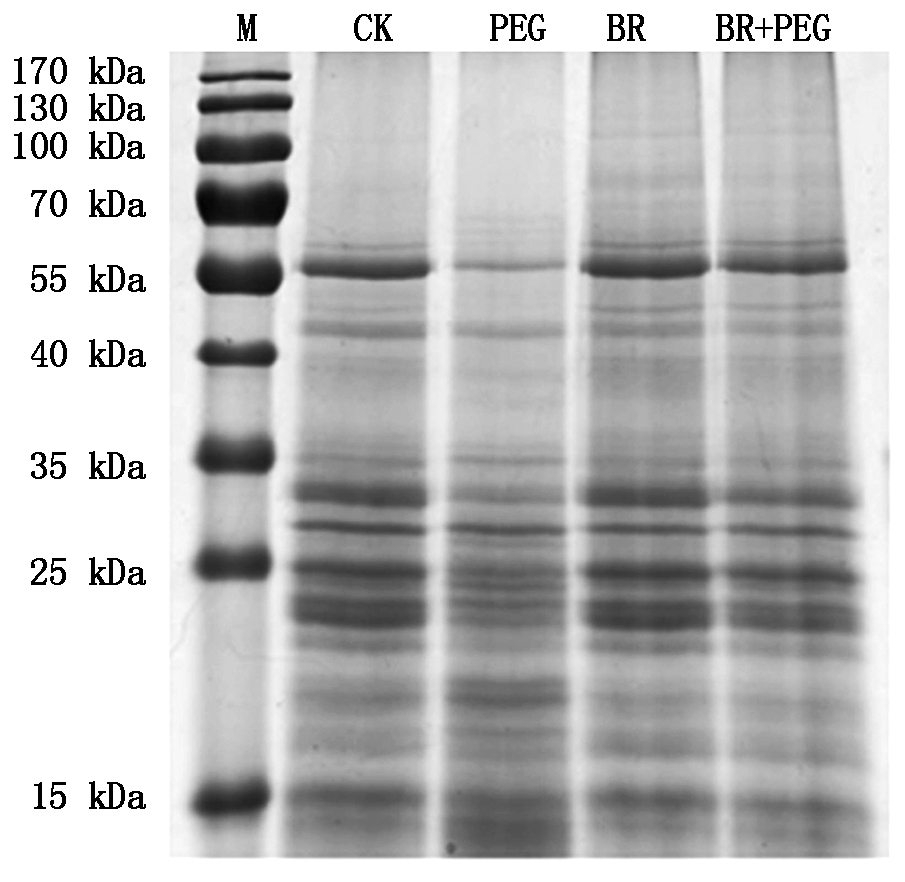
图4 玉米叶绿体类囊体膜蛋白的SDS-PAGE电泳图谱
Fig.4 SDS-PAGE of D1 protein in thylakoids membrane of maize leaves
2.6 干旱胁迫下外源BR对玉米幼苗叶绿体D1蛋白含量的影响
从图5可以看出,BR处理比CK的D1蛋白含量高0.96%;而干旱胁迫3 d后,PEG处理比CK的D1蛋白含量减少了52.40%;BR+PEG处理比PEG处理的 D1蛋白含量增加了37.34%(P<0.05)。说明外源BR处理可以抑制干旱胁迫下玉米叶绿体D1蛋白的降解。
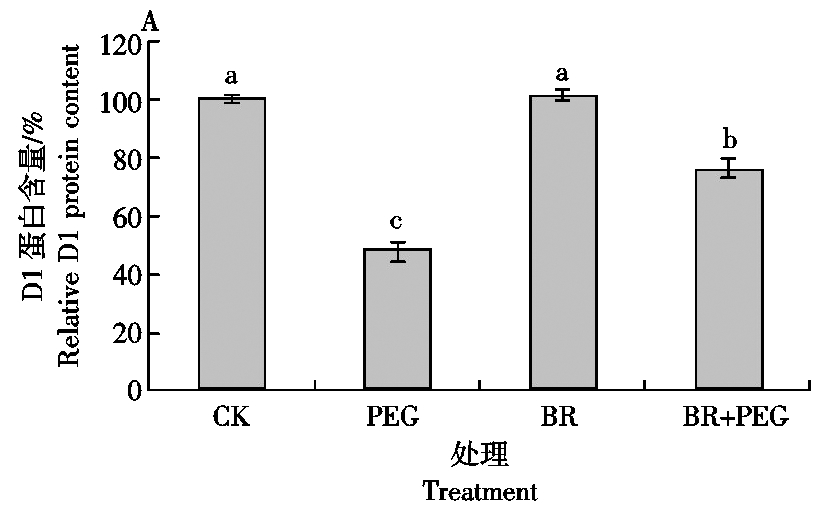
图5 玉米叶绿体D1蛋白的Western Blotting结果
Fig.5 Western Blotting of D1 protein in maize chloroplasts
干旱胁迫是影响植物生长和发育最常见的环境胁迫。水分亏缺引起植株气孔关闭、叶片脱落、细胞壁或质膜组成的改变等,从而引起光合作用和膨压的下降,导致植株生长减慢,产量下降[21,26-28]。有研究表明,BR处理能显著促进干旱条件下植株的生长,增加其鲜质量、干质量及产量[29-30];可有效减缓干旱胁迫后幼苗叶片可溶性蛋白质含量的下降,提高SOD活性,增加脯氨酸和MDA的积累[31]。BR处理浸种后,使高粱的萌发速率和幼苗生长速率都增加,并且提高了幼苗可溶性蛋白和游离脯氨酸的含量[32]。Sairam[33]发现,干旱胁迫处理后油菜素内酯能增加小麦的生物量和产量,主要是通过促使绿叶面积增大、叶绿素含量和可溶性蛋白质的含量增加以及光合能力的提高来实现的。本试验研究表明,与干旱胁迫处理相比,经过BR预处理后进行干旱胁迫处理的玉米幼苗增高45.87%,根长增加20.56%,总干物质积累增多8.01%,叶片相对含水量提高4.50%,叶绿素a含量增加26.32%(P<0.05),叶绿素b含量增加1.21%,类胡萝卜素含量增加15.03%,同时玉米幼苗的净光合速率(Pn)和光合系统Ⅱ的活性(ΦPSⅡ)分别提高9.57%和20.48%,光合系统Ⅱ绝对电子传递速率(ETR(Ⅱ)和相对电子传递速率rETR(Ⅱ))分别升高20.40%和31.02%,因此,外源BR处理能提高干旱胁迫下玉米幼苗的光合作用效率,使玉米幼苗的生长维持正常,最终减轻了干旱胁迫对玉米幼苗造成的伤害。
叶绿素以非共价键和蛋白质结合在一起,并组成色素蛋白复合体,该复合体普遍包埋于高等植物的类囊体膜中。叶绿素与蛋白质的结合在前者遭到破坏后,势必会受到影响,并导致光能的吸收和传递受阻。没有外界不良环境条件时,D1蛋白通过不断地快速降解和重新合成的平衡体系来维持植物PSⅡ的活性,而生长坏境的不良变化往往会引起光抑制效应,此效应会打破这种平衡,因此破坏光合作用,并最终影响生物产量和经济产量[34-37]。有研究表明,水分匮乏使干旱敏感型和不敏感型大麦D1蛋白含量降低,并加速了光抑制进程的速度[38]。本试验结果表明,喷施BR处理可提高干旱胁迫下玉米D1蛋白的含量,PEG处理比CK的D1蛋白相对含量减少了52.40%;BR+PEG处理比PEG处理的 D1蛋白相对含量增加了37.34%,且都达到了显著差异水平。说明喷施适宜浓度的BR处理可以抑制干旱胁迫下玉米叶绿体D1蛋白的降解,但是干旱胁迫下,BR处理对光合作用和D1蛋白影响的具体分子机制还有待深入研究。
参考文献:
[1] Wang Wangxia,Vinocur B,Altman A. Plant responses to drought,salinity and extreme temperatures:towards genetic engineering for stress tolerance[J]. Planta,2003,218(1):1-14.
[2] Bai L P,Sui F G,Ge T D,et al. Effect of soil drought stress on leaf water status,membrane permeability and enzymatic antioxidant system of maize[J]. Pedosphere,2006,16(3):326-332.
[3] Blum A,Ebercon A. Cell membrane stability as a measure of drought and heat tolerance in wheat[J]. Crop Science,1981,21(1):43-47.
[4] Boyer J S.Plant productivity and environment[J]. Science,1982,218(4571):443-448.
[5] 李天来,路 涛,刘玉凤,等.高等植物PSⅠ和PSⅡ光抑制机理的研究进展[J]. 沈阳农业大学学报,2016, 47(5) :513-519.
[6] 闫慧萍,彭云玲,赵小强,等.外源24-表油菜素内酯对逆境胁迫下玉米种子萌发和幼苗生长的影响[J]. 核农学报, 2016, 30(5):988-996.
[7] 李利红,马培芳,杨亚军,等.外源Ca^2+对高温强光胁迫下小麦叶绿体D1蛋白磷酸化及光系统Ⅱ功能的影响[J]. 应用生态学报,2010,21(3):683-688.
[8] 张会慧,张秀丽,李 鑫,等.盐胁迫下桑树叶片D1蛋白周转和叶黄素循环对PSⅡ的影响[J].林业科学,2013,49(1):99-106.
[9] Bate N J,Straaus N A,Thomson J E. Expression of chloroplast photosynthesis genes during leaf senescence[J]. Physiol Plant,1990,80(2):217-225.
[10] Nic G Y,Roberlson E J,Fryer M J,et al. Response of the photosynthisis apparatus in maize leaves grown at low temperature on transfer to normal growth temperature[J]. Plant Cell Environ,1995,18(1):1-12.
[11] He J X,Wang J,Liang H G. Effects of water stress on photochemical function and protein metabolism of photosystern Ⅱ in wheat leaves[J]. Physiol Plant,1995,93(4):771-777.
[12] Hao L M,Liang H G,Wang Z L,et al. Effects of water stress and re-watering on turnover and gene expression of photosystern Ⅱ reaction center polypeptide D1 in Zea mays[J]. Functional Plant Biology,1999,26(4):375-378.
[13] Baker N R. A possible role for photosystern Ⅱ in environmental peturbations of photosynthesis[J].Phsoil Plant,1991,81(4):563-570.
[14] Lutz D,Steiger A,Godd D. Influence of aie pollutants and nutrient deficiency on D1 protein content and photosynthesis in young spruce trees[J]. Physiol Plant,1992,85(4):611-617.
[15] Bredenlamp G J,Baker N R. Temperature-sensitivity of D1 protein metabolism in isolated Zea mays chloroplasts[J]. Plant Cell and Environment,1994,17(2):205-210.
[16] Heidrun D,Herbik A,Godd D. Stressed degradation of the photosynthetic apparatus is accompanied by changes in the thylakoid protein turnover and phosphorylation[J]. Physiol Plant,1995,93(1):179-186.
[17] 尹 博,王秀峰,姜春辉,等.外源油菜素内酯对番茄铜胁迫的缓解效应[J].植物营养与肥料学报,2012,18(1):162-168.
[18] 袁凌云,朱世东,赵冠艳,等.油菜素内酯诱导番茄幼苗抗冷效果的影响[J].中国农学通报,2010, 26(5):205-208.
[19] 李 程,梁宝魁,王晓峰.油菜素内酯提高蔬菜作物抗逆性的研究进展[J].中国蔬菜,2015,1(11):12-18.
[20] 魏 鑫,倪 虹,张会慧,等.外源脱落酸和油菜素内酯对干旱胁迫下大豆幼苗抗旱性的影响[J].中国油料作物学报,2016,38(5):605-610.
[21] Mahesh K, Balaraju P, Ramakrishna B, et al. Effect of Brassinosteroids on germination and seedling growth of radish (L.) under PEG-6000 induced water stress[J].American Journal of Plant Sciences, 2013, 4(12):2305-2313.
[22] Arora P, Bhardwaj R, Kanwar M K. Effect of 24-epibrassinolide on growth, protein content and antioxidative defense system of Brassica juncea L. subjected to cobalt ion toxicity[J].Acta Physiologiae Plantarum, 2012, 34(5):2007-2017.
[23] 吴雪霞,查丁石,朱宗文,等.外源24-表油菜素内酯对盐胁迫下茄子种子萌发和幼苗生理特性的影响[J].植物生理学报,2011,47(6):607-612.
[24] Guo J W,Wei H M,Wu S F. Effects of low temperature on the distribution of excitation energy in photosystem and the phosphorylation of thylakoid membrane proteins in rice[J]. Acta Biophysica Sinica,2006,22(3):197-202.
[25] Du L F,Sun X,Pan Y H,et al. Effect of Calcium ion on O2-evolution activity of PSⅡ[J]. China Science,1995,38(12):1439-1447.
[26] Nielsen D C,Vigil M F,Benjamin J G. The variable response of dryland corn yield to soil water content at planting[J]. Agricultural Water Management,2009,96(2):330-336.
[27] Mirzaee M, Moieni A, Ghanati F. Effects of drought stress on the lipid peroxidation and antioxidant enzyme activities in two canola (Brassica napus L.) cultivars[J].Journal of Agricultural Science & Technology, 2013, 15(3):593-602.
[28] 李 强,张林森,刘 辉,等.水分胁迫对玉米苗期形态及生理指标的影响[J].甘肃农业科技,2014(1):36-38.
[29] Kai R L, Feng C H. Effects of brassinolide on drought resistance of Xanthoceras sorbifolia, seedlings under water stress[J]. Acta Physiologiae Plantarum, 2011, 33(4):1293-1300.
[30] ![]() ová M,Rothová O,Holá D, et al. The effects of brassinosteroids on photosynthetic parameters in leaves of two field-grown maize inbred lines and their F1 hybrid[J].Biologia Plantarum, 2010, 54(4):785-788.
ová M,Rothová O,Holá D, et al. The effects of brassinosteroids on photosynthetic parameters in leaves of two field-grown maize inbred lines and their F1 hybrid[J].Biologia Plantarum, 2010, 54(4):785-788.
[31] 吴晓丽,罗立津,黄 丽,等.水杨酸和油菜素内酷对花椰菜幼苗生长及抗旱性的影响[J].PEG-6000地区农业研究,2011,29(2):168-172.
[32] Vardhini B V,Rao S S R. Amelioration of osmotic stress by brassinosteroids on seed germination and seedling growth of three varieties of sorghum[J].Plant Growth Regulation,2003,41(1):25-31.
[33] Sairam R K. Effects of homobrassinolide application on plant metabolism and grain yield under irrigated and moisture-stress conditions of two wheat varieties[J]. Plant Growth Regulation,1994,14(2):173-181.
[34] 郑静静,赵会杰,胡巍巍,等.高温强光对小麦叶绿体Deg1蛋白酶和D1蛋白的影响及水杨酸的调节作用[J].生态学报,2013,33(9):2930-2935.
[35] Zhao H J,Zhao X J,Ma P F,et al. Effects of salicylic acid on protein kinase activity and chloroplast D1 protein degradation in wheat leaves subjected to heat and high light stress[J]. Acta Ecologica Sinica,2011,31(5):259-263.
[36] Mizusawa N,Tomo T,Satoh K,et al. Degradation of the D1 protein of photosystem Ⅱ under illumination in vivo:two different pathways involving cleavage or intermolecular cross-linking[J]. Biochemistry,2003,42(33):10034-10044.
[37] 郑静静,杨 丽,苏小雨,等.水杨酸对高温强光下小麦叶绿体蛋白酶Deg5和PSⅡ功能的调节作用[J].生态学报,2014,34(24):7350-7355.
[38] Ghotbi-Ravandi A A,M Shahbazi,M Shariati,et al. Effects of mild and severe drought stress on photosynthetic efficiency in tolerant and susceptible barley(Hordeum vulgare L.)genotypes[J]. Journal of Agronomy and Crop Science,2014,200(6):403-415.
Exogenous BR Alleviates Drought Stress by Regulating Photosynthesis and D1 Protein in Maize Seedlings
Abstract:In order to reveal the protective mechanism of exogenous Brassinolide on the photosynthesis of maize seedlings under drought stress,this experiment used the Zhuyu 309 as test materials and adopted the solution culture method,studying the changes of growth parameters,chlorophyll content,photosynthetic parameters,chlorophyll fluorescence parameters and D1 protein content of maize seedlings that used 20% PEG-6000 to simulate drought stress after exogenous Brassinolide (BR) pretreatment. Compared with that of drought stress,the results of corn seedling which after the BR pretreatment showed that its height increased by 45.87%,the root length increased by 20.56%,the total dry matter accumulation increased by 8.01%,the relative water content increased by 4.50%,chlorophyll a content increased by 26.32%,and photosynthetic parameters (Pn,Gs,Ci,Tr) increased by 9.57%,38.23%,30.19% and 28.12% respectively,the activity of photosynthetic system Ⅱ (ΦPSⅡ) increased by 20.48%,and the maximum photochemical efficiency increased by 0.66%. Photosynthetic system Ⅱ absolute electron transport rate (ETR (Ⅱ) and the relative electron transport rate of photosynthetic system Ⅱ(rETR(Ⅱ)) were increased by 20.40% and 31.02% respectively. The content of D1 protein increased by 37.34% (P<0.05). The results showed that BR treatment under drought stress condition could improve the growth and development of maize seedlings,alleviate the damage of photosynthesis system,promote the stability of D1 protein and improve the adaptability of maize seedling to drought stress.
Key words:Maize seedlings; Drought stress; Exogenous BR; Photosynthesis; D1 protein; Regulatory effect
收稿日期:2017-04-02
基金项目:河南省科技创新人才计划支持项目(114100510019)
中图分类号:S513.01
文献标识码:A
文章编号:1000-7091(2017)03-0118-07
doi:10.7668/hbnxb.2017.03.018