设施土壤中微生物生物量碳和脱氢酶活性对镉与邻苯二甲酸酯复合污染的响应
赵 辉,王琳琳,宋宁宁,王芳丽,刘 君,王凯荣,史衍玺
(青岛农业大学,青岛市农村环境工程研究中心,山东 青岛 266109)
摘要:为了揭示设施土壤中Cd与PAEs复合污染效应,通过盆栽试验验证了设施土壤中微生物生物量碳含量和脱氢酶活性对Cd-PAEs复合污染的响应。结果表明:移栽后20 d,施加低浓度Cd(≤2.0 mg/kg),可使土壤中微生物生物量碳含量增加,设施和大田土壤中分别增加了42.7%和96.5%。移栽后20 d时,施加PAEs(40,80 mg/kg)使设施土壤微生物生物量碳含量分别降低了56.2%和46.7%;移栽后30 d时,施加PAEs(40,80 mg/kg)使大田土壤微生物生物量碳含量分别降低了39.8%和提高了21.6%。Cd处理使大田土壤脱氢酶活性降低,但并未使设施土壤脱氢酶活性发生显著变化。施加高浓度PAEs(80 mg/kg)使大田土壤的脱氢酶活性提高了33.6%,但却使设施土壤脱氢酶活性降低了40.0%。Cd-PAEs复合效应对土壤微生物生物量碳表现为协同作用,但土壤脱氢酶活性则产生了拮抗作用。
关键词:邻苯二甲酸酯;土壤镉;微生物生物量碳;脱氢酶活性;复合污染
塑料设施菜地封闭的栽培环境,导致土壤性质发生了重大分异,主要表现为酸化、次生盐渍化,氮磷养分过剩和重金属积累等[1-2]。有研究表明,设施菜地表层土壤中重金属含量(主要是镉(Cd))不仅高于大田土壤,而且随着种植年限延长而显著增加[3-6]。设施土壤重金属的有效性也随种植年限延长而提高[7],且有效态重金属含量与设施土壤pH值呈显著负相关性[8]。由于过量施肥,设施菜地土壤还存在明显的次生盐渍化问题。沈灵凤[9]调查发现,设施菜地土壤全盐量随栽培年限延长而显著升高,有甚者高达8.0 g/kg。土壤酸化和溶解性盐离子浓度过高可能促进植物根系对Cd的吸收积累[10-11]。此外,有研究发现,设施种植环境下Cd从土壤吸附位向植物根系的迁移速率明显高于大田环境[12]。
设施菜地大量使用塑料薄膜(棚膜和地膜),邻苯二甲酸酯类增塑剂(PAEs)的污染风险也显著高于大田环境。调查显示,菜地土壤中邻苯二甲酸二(2-乙基己基)酯(DEHP)和邻苯二甲酸正二丁酯(DBP)含量随蒙棚时间的延长持续上升直至达到稳定[13]。土壤PAEs污染不仅会对作物生长产生毒害[14],而且可能导致农产品营养品质下降[15],甚至通过食物链污染,危害人体健康[16]。
环境中的多种污染物共存形成复合污染,复合污染的结果不是单一污染效果的简单加减。重金属Cd与增塑剂PAEs同步积累是设施栽培土壤中独特的有机-无机复合污染问题,但以往的研究多将Cd污染与PAEs污染问题分别开来,有关设施土壤Cd与PAEs复合污染效应的研究鲜有报道。
土壤酶和微生物生物量是土壤生态系统的重要组成部分,土壤酶活性决定土壤中各种生物化学反应过程的强度,对土壤肥力和生态系统健康具有重要的表征意义。由于土壤酶和土壤微生物对外来化学物质具有较高的敏感性,常用于评价土壤生态环境质量[17]。本试验选取邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)为代表,研究设施菜地中Cd与PAEs复合污染对土壤脱氢酶活性和微生物生物量碳含量的影响,旨在为保护地栽培生态风险评估与污染防控提供科学依据。
1 材料和方法
1.1 供试材料
供试土壤:设施土壤取自山东青岛胶州市胶西镇大行二村蔬菜示范园3号塑料大棚,常年种植芹菜、西红柿等蔬菜作物,棚龄8年;大田土壤取自与3号棚相隔约50 m的小麦-玉米轮作地。供试土壤基本理化性质见表1。
表1 供试土壤的基本理化性质
Tab.1 The physical and chemical properties of the tested soil
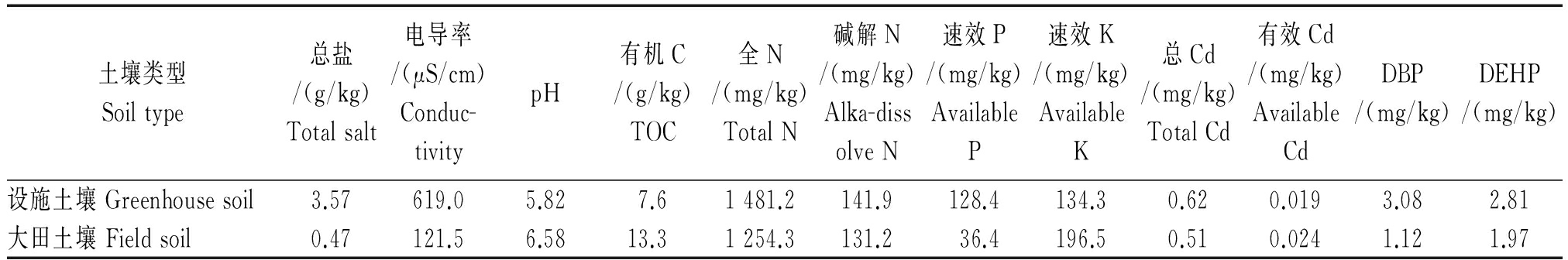
土壤类型Soiltype总盐/(g/kg)Totalsalt电导率/(μS/cm)Conduc-tivitypH有机C/(g/kg)TOC全N/(mg/kg)TotalN碱解N/(mg/kg)Alka-dissolveN速效P/(mg/kg)AvailableP速效K/(mg/kg)AvailableK总Cd/(mg/kg)TotalCd有效Cd/(mg/kg)AvailableCdDBP/(mg/kg)DEHP/(mg/kg)设施土壤Greenhousesoil3.57619.05.827.61481.2141.9128.4134.30.620.0193.082.81大田土壤Fieldsoil0.47121.56.5813.31254.3131.236.4196.50.510.0241.121.97
注:DBP.邻苯二甲酸二丁酯;DEHP.邻苯二甲酸二(2-乙基己基)酯。
Note:DBP.Dibutylphthalate;DEHP.Di-2-ethylhexylphosphate。
供试蔬菜:叶用莴苣(Lactuca sativa var.romana Gars),品种为美国大速生,购自当地蔬菜种苗市场。
1.2 试验处理设计
盆栽试验采用随机区组设计,土壤中Cd的浓度为3个水平(0,0.5,2.0 mg/kg),土壤中PAEs的浓度为3个水平(0,40,80 mg/kg),合计9个处理,重复4次。
表2 室内盆栽试验Cd-PAEs复合污染处理方案
Tab.2 Dosages of Cd-PAEs in combined pollution experiment mg/kg
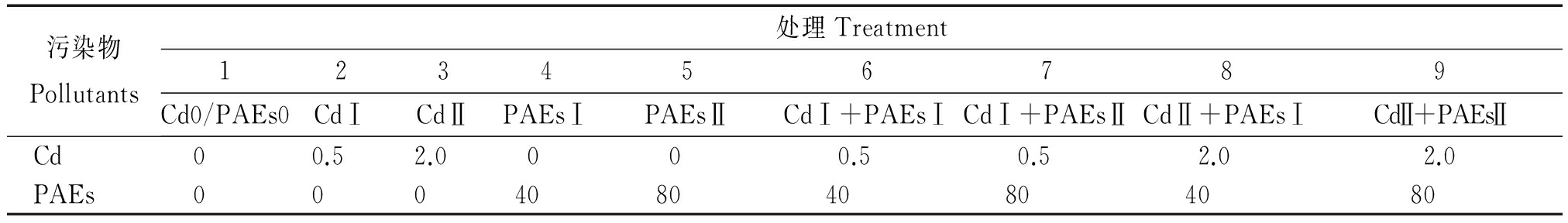
污染物Pollutants处理Treatment123456789Cd0/PAEs0CdⅠCdⅡPAEsⅠPAEsⅡCdⅠ+PAEsⅠCdⅠ+PAEsⅡCdⅡ+PAEsⅠCdⅡ+PAEsⅡCd0 0.5 2.0 0 0 0.5 0.5 2.0 2.0PAEs000408040804080
注:表中数据为各污染物污染水平。
Note:The data in the table are the level of contamination.
Cd在生菜移栽前2个月添加到供试土壤中,添加形态为CdSO4·8/3H2O试剂。DBP和DEHP按重量比1∶1溶解于丙酮溶液中,于生菜移栽前7 d施加到土壤中。
盆栽试验采用不含PAEs和Cd的食品级塑料钵,每钵装供试土壤1.25 kg(风干质量)。将生菜秧苗移植到试验盆钵中,置于玻璃温室内。每2 d向盆钵中加入50 mL去离子水,以保持土壤含水量达到田间最大持水量的70%左右。在生菜移栽后第0,10,20 ,30,50 天分别从试验钵中央根系处采集适量土壤,风干后过2 mm筛进行相关指标测定。
1.3 测定项目及方法
土壤脱氢酶活性采用氯化三苯基四氮唑(TTC)比色法测定[18]。微生物生物量碳含量采用氯仿熏蒸-K2SO4浸提,TOC分析仪测定[19]。
1.4 数据处理
使用Excel 2013和SPSS 17.0对数据进行统计分析,采用Duncan法进行显著性检验,以Pearson系数评价相关性。
2 结果与分析
2.1 土壤微生物生物量碳对镉和邻苯二甲酸酯污染的响应
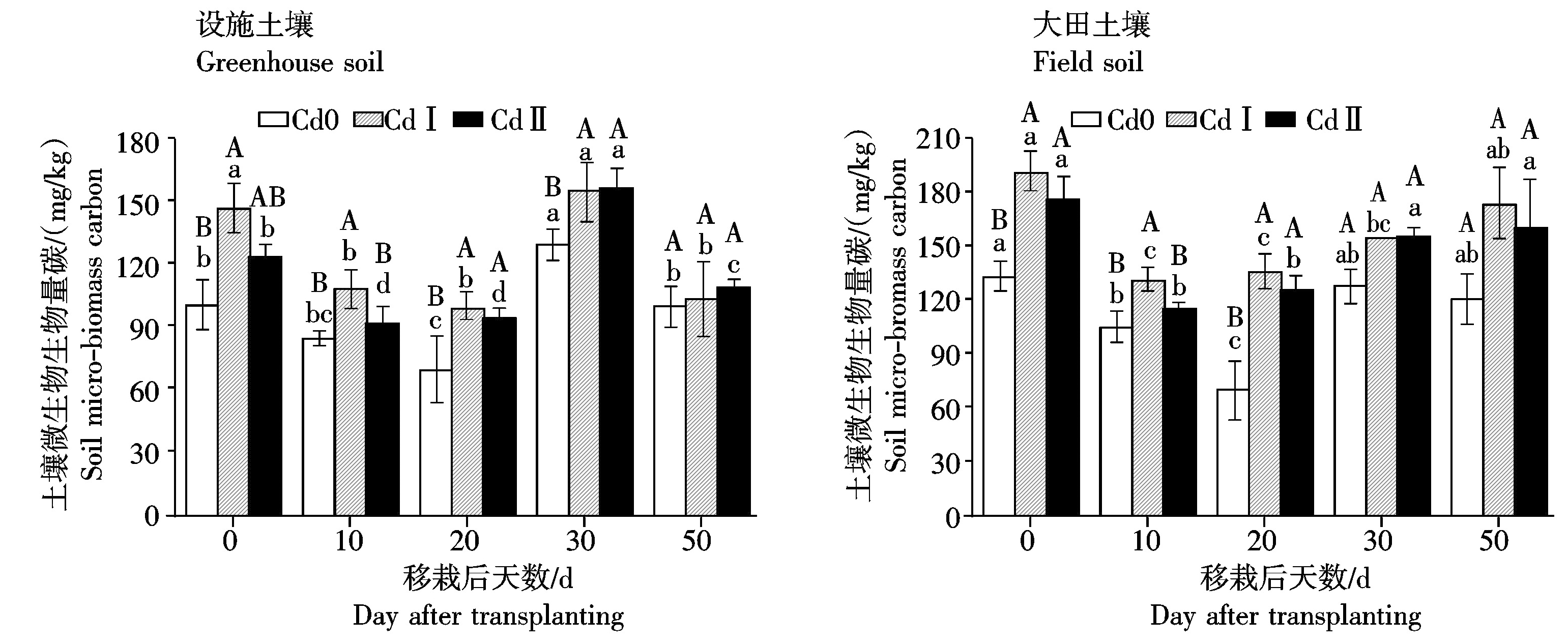
设施和大田土壤中土壤微生物生物量碳含量对Cd单一污染的响应如图1所示。从图1可以看出,与对照相比,低量(Ⅰ)和高量(Ⅱ)Cd处理均可提高设施和大田土壤中微生物生物量碳含量,且大田土壤微生物生物量碳含量提高值高于设施土壤。生菜移栽后20 d设施和大田土壤中低量(Ⅰ)Cd处理分别比对照提高了42.7%和96.5%,设施和大田土壤中高量(Ⅱ)Cd处理分别比对照提高了34.7%和81.0%。
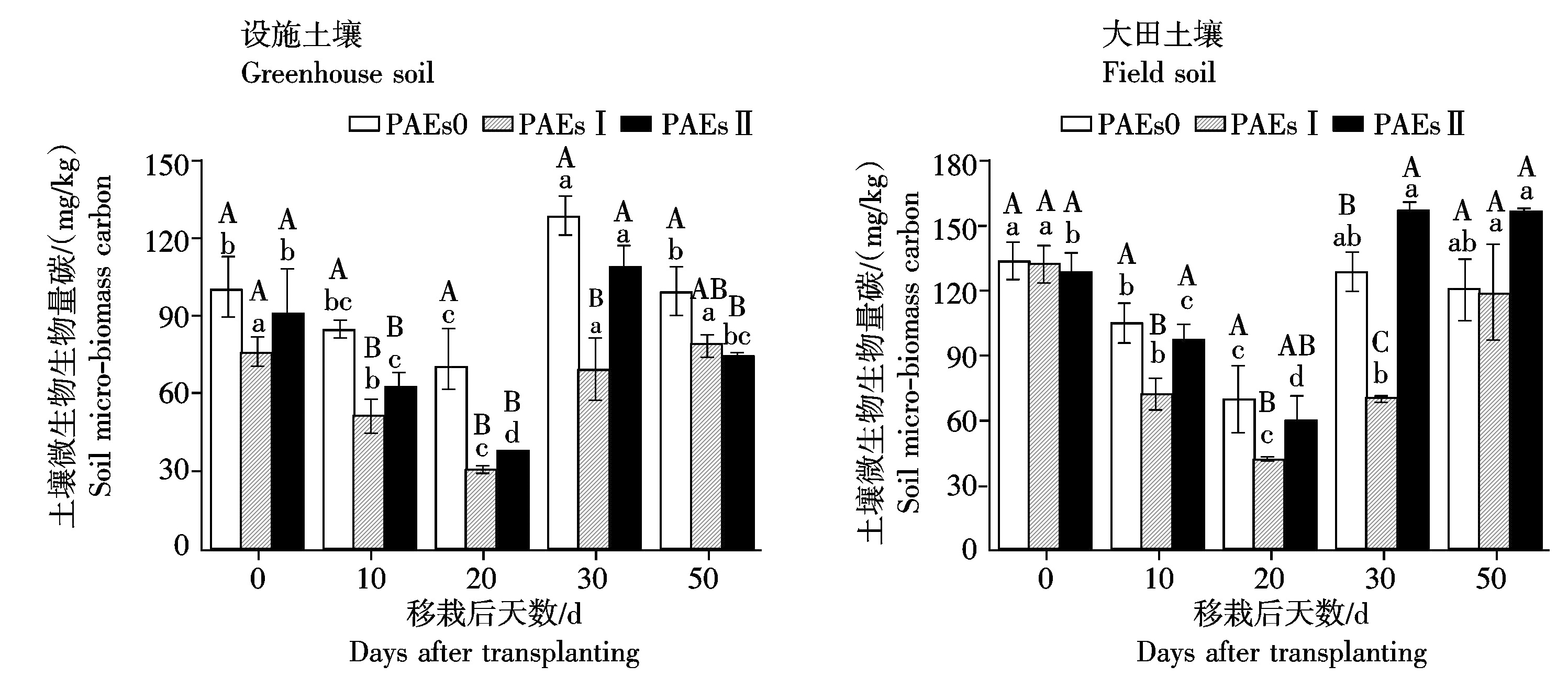
设施和大田土壤中土壤微生物生物量碳含量对PAEs单一污染的响应如图2所示。2种土壤中微生物生物量碳含量均持续下降,直至生菜移栽后20 d时降至最低,后又开始增加。低量(Ⅰ)PAEs处理降低了设施和大田土壤中微生物生物量碳含量,并在移栽后10,20,30 d时分别与对照差异达显著水平;高量(Ⅱ)PAEs处理,除移栽后30,50 d的大田土壤外,均降低了设施和大田土壤中微生物生物量碳含量,并在移栽后30 d时与对照差异显著。生菜移栽后20 d时,设施土壤中低量(Ⅰ)和高量(Ⅱ)PAEs处理的微生物生物量碳含量与对照差异最大,分别降低了56.2%和46.7%。大田土壤中低量(Ⅰ)和高量(Ⅱ)PAEs处理的微生物生物量碳含量在移栽后30 d与对照差异最大,分别降低39.8%和提高了21.6%。
设施和大田土壤中土壤微生物生物量碳含量对Cd和PAEs复合污染的响应如图3所示。Cd和PAEs复合污染对土壤微生物生物量碳含量的影响趋势与单一污染相似,均为先降低后增加,第20天时与对照差异最大。其中CdⅠ+PAEsⅠ、CdⅠ+PAEsⅡ、CdⅡ+PAEsⅠ和CdⅡ+PAEsⅡ处理的设施土壤微生物生物量碳含量分别比对照降低了47.8%,73.8%,80.8%,53.7%,相应的Cd和PAEs单污染效果之和为提高13.5%,4.0%,21.5%,12.0%。大田土壤中Cd Ⅰ+PAEs Ⅰ和Cd Ⅱ+PAEs Ⅰ复合处理分别使微生物生物量碳降低了64.2%和45.9%,Cd Ⅰ+PAEs Ⅱ和Cd Ⅱ+PAEs Ⅱ复合处理分别使微生物生物量碳提高了6.0%和11.5%,相应的Cd和PAEs单污染效果之和为提高56.7%,82.4%,41.2%,66.9%。设施和大田土壤中,复合污染处理对微生物生物量碳含量的抑制作用均显著大于单污染效果之和,表明在设施土壤和大田土壤中,Cd和PAEs复合污染对土壤微生物的抑制具有协同作用。
2.2 土壤脱氢酶活性对镉和邻苯二甲酸酯污染的响应
设施和大田土壤中土壤脱氢酶活性对Cd单一污染的响应如图4所示。2种土壤中脱氢酶活性均呈现出先上升后下降的趋势。其中,高量(Ⅱ)Cd处理对设施土壤脱氢酶活性影响不显著。大田土壤中,低量(Ⅰ)和高量(Ⅱ)Cd处理的土壤脱氢酶活性在生菜移栽后10 d与对照差异最大,分别降低40.2%和52.4%。
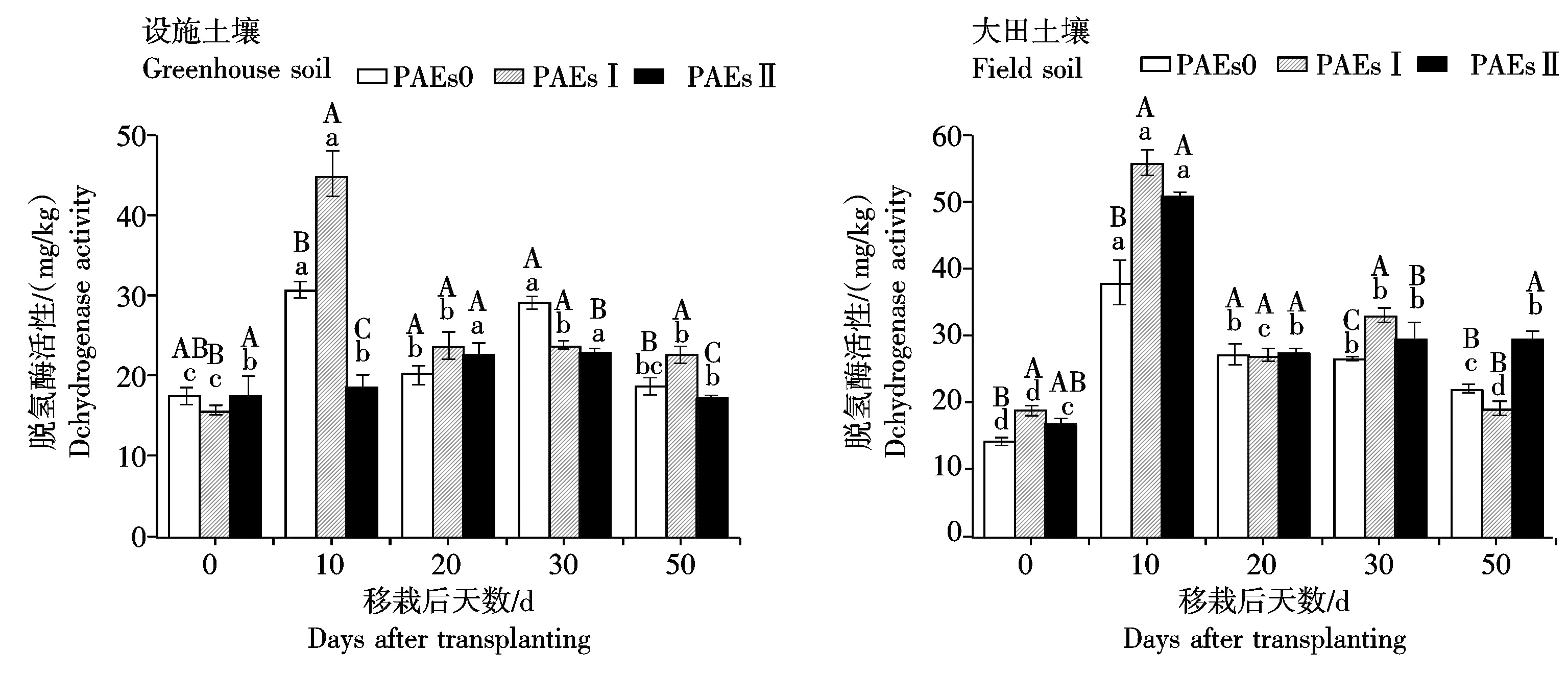
设施和大田土壤中土壤脱氢酶活性对PAEs单一污染的响应如图5所示。2种土壤中脱氢酶活性均呈先上升后下降再平稳的趋势。与对照相比,生菜移栽后10 d低量(I)PAEs处理显著提高了设施和大田土壤中土壤脱氢酶活性,其中生菜移栽后10 d测定值分别比对照高出45.3%和47.2%。与此相反,高量(Ⅱ)PAEs处理则降低了设施土壤中脱氢酶活性,提高了大田土壤脱氢酶活性,移栽后10 d时变化分别为40.0%和33.6%。
设施和大田土壤中脱氢酶活性对Cd和PAEs复合污染的响应如图6所示。生菜移栽后10 d,设施土壤中CdI+PAEsⅡ、CdⅡ+PAEsI和CdⅡ+PAEsⅡ处理的脱氢酶活性分别比对照提高了113.1%,114.8%,22.6%,相应的Cd和PAEs单污染效果之和为降低51.4%,提高47.8%,和降低37.5%。大田土壤中CdI+PAEsⅡ、CdⅡ+PAEsI和CdⅡ+PAEsⅡ处理的脱氢酶活性分别比对照提高了5.5%,11.2%,3.3%,相应的Cd和PAEs单污染效果之和分别为降低5.9%,5.5%,18.0%。复合污染处理对脱氢酶活性的抑制作用显著小于单污染效果之和,说明设施和大田土壤复合污染中的Cd和PAEs对脱氢酶活性的抑制具有拮抗作用,且在设施土壤中更为明显。
3 讨论
添加Cd可提高设施和大田土壤中微生物生物量碳含量。前人研究表明,低浓度的重金属能刺激土壤微生物的生长[20]。如高岩等[21]发现,在水稻盆栽试验中添加Cd浓度小于3 mg/kg情况下,土壤微生物生物量碳含量随Cd添加浓度增大而上升。本试验的最大Cd添加浓度(CdⅡ)只有2 mg/kg,属于对土壤微生物生长产生刺激效应的浓度范围,因而表现出了提高土壤微生物生物量碳含量的环境效应。添加PAEs处理则降低了设施和大田土壤中微生物生物量碳含量,说明PAEs对微生物生长有明显抑制作用。王鑫宏[22]曾发现,向土壤中添加DBP/DEHP浓度在10~100 mg/kg范围内均可导致土壤微生物生物量碳含量的波动性下降,直至第30天后才开始恢复,这与本研究的结果非常相似。
本试验中Cd对设施土壤中微生物生物量碳含量的提升效应明显小于大田土壤,而PAEs对设施土壤微生物生物量碳含量的降低效应则明显高于大田土壤,这可能与设施土壤有机碳含量低、次生盐渍化和酸化环境对微生物的胁迫因子有关。本试验中的设施土壤总盐量为3.57 g/kg,为中度盐渍化土壤,而大田土壤只有0.47 g/kg;设施土壤的pH值为5.82,呈明显的酸性反应,而大田土壤pH值为6.58,呈典型的中性反应;设施土壤有机碳含量只有7.6 g/kg,而大田土壤有机碳含量达到13.3 g/kg,大田土壤的理化性状明显优于设施土壤。土壤微生物对盐分非常敏感,高盐分可以通过影响水分的有效性或微生物细胞的生理和代谢过程,从而抑制微生物活性[23]。Chandra等[24]和Tripathi等[25]的研究均表明,土壤中微生物生物量随盐分增加而呈显著降低的趋势。景宇鹏等[26]也发现,随着盐渍化程度的加重,土壤细菌、真菌和放线菌数量及微生物总数均呈显著下降的趋势。有机质是土壤微生物赖以生存的物质基础,微生物通过分解土壤有机质获得自身生长繁殖所需的能量和养分,因此,土壤微生物生物量碳与土壤有机碳含量之间存在极显著的正相关性[27]。酸性土壤中微生物生物量碳与土壤有机碳含量的相关系数远小于中性和碱性土壤[28]。张昌爱[29]发现土壤酸化会减少微生物菌落。设施菜地因封闭的栽培环境,土壤出现酸化、次生盐渍化、可溶性有机碳降低等问题,从而影响到土壤中微生物的活性,致使设施土壤微生物生物量碳含量降低值大于大田土壤。
本试验结果表明,添加Cd对设施土壤脱氢酶活性影响不明显,显著降低了大田土壤中脱氢酶活性。说明Cd对脱氢酶活性有抑制作用。有研究表明Cd对土壤脱氢酶活性具有抑制作用,且随Cd浓度的增大而加强。也有研究表明Cd能占据脱氢酶活性中心,降低土壤脱氢酶活性[30]。设施土壤添加Cd处理脱氢酶活性与对照差异不显著,可能是因为设施土壤微生态平衡遭到破坏[31],未添加外源污染物时土壤酶活性就处于抑制状态。
低量PAEs处理提高了设施和大田土壤脱氢酶活性,高量PAEs处理提高了大田土壤脱氢酶活性,降低了设施土壤脱氢酶活性。脱氢酶活性提高可能是土壤中的微生物受到PAEs胁迫的应激反应,分泌大量脱氢酶来抵制毒害,或PAEs未达到抑制酶活性所需的浓度,反被微生物作为碳源降解并吸收利用,刺激了此类微生物的生长,提高了脱氢酶活性[32]。PAEsⅡ处理设施土壤脱氢酶活性降低,可能是因为设施土壤的酸化、盐渍化导致微生物多样性和均匀性显著降低,土壤生态系统稳定性下降,对污染物的耐受阈值降低[33],PAEsⅡ(80 mg/kg)超出了微生物的耐受范围,对微生物造成破坏,致使土壤脱氢酶受到抑制[34]。
无论是设施还是大田土壤中,Cd-PAEs复合污染对土壤微生物生物量碳的交互作用表现为协同抑制,而对于土壤脱氢酶则表现为拮抗作用。土壤中有机污染物-重金属复合污染是普遍存在的现象,它们之间往往存在复杂的交互作用。Maliszewska-Kordybach和Smreczak[35]的研究表明,PAHs与重金属复合污染土壤对微生物活性的影响显著高于重金属或PAHs单一污染土壤。程凤侠等[36]研究了铜与草甘膦单一与复合污染对水稻土酶活性的影响,结果发现复合污染显著改变了单一污染对土壤酶活性的作用。沈国清等[37]研究了菲和Cd复合污染对土壤微生物的生态毒理效应,结果发现蔗糖酶、脲酶和脱氢酶均具有协同抑制作用,而对磷酸酶和微生物的数量具有拮抗抑制作用。张慧等[38]在研究Cd与芘单一和复合污染条件下对土壤微生物的生态效应时发现,Cd-芘复合污染对细菌数量具有协同作用,而对真菌和放线菌数量具有拮抗抑制作用。本研究结果显示,Cd-PAEs的交互作用在设施土壤中更显著,说明重金属和有机污染物的交互作用对土壤中微生物活性和土壤酶活性的影响与土壤类型有关。Shen等[39]研究多环芳烃菲、荧蒽和苯并a芘与重金属Cd、Zn和Pb交互作用对土壤脲酶和脱氢酶活性的影响,认为重金属与多环芳烃交互作用对土壤酶活性的影响受污染物类型和土壤受污染时间的影响。因此,在进行重金属-有机物复合污染的毒性效应研究时,必须充分考虑各个因素的影响。
本试验结果表明,Cd提高了设施和大田土壤中微生物生物量碳含量,除高量(Ⅱ)PAEs移栽后30,50 d的大田土壤外,PAEs均降低了设施和大田土壤中微生物生物量碳含量。Cd对设施土壤脱氢酶活性影响不明显,但除移栽后30 d处理外可显著降低大田土壤中脱氢酶活性。移栽后10 d,低量PAEs处理显著提高了设施和大田土壤脱氢酶活性,高量PAEs处理提高了大田土壤脱氢酶活性但降低了设施土壤脱氢酶活性。Cd和PAEs复合污染对土壤中微生物生物量碳含量的影响趋势为先降低后增加,但可提高土壤中脱氢酶活性。复合污染中Cd增强了PAEs对微生物生物量碳的毒害作用和对土壤脱氢酶活性的激活作用,对土壤的微生态平衡的破坏力增强。复合污染效应在设施土壤中更为明显,说明设施土壤较大田土壤更为敏感。脱氢酶活性和微生物生物量碳能够有效地反映土壤生态环境质量,作为土壤生态环境评价指标,脱氢酶活性较微生物生物量碳含量反应更为快速和灵敏。对设施和大田土壤中Cd和PAEs污染对微生物生物量碳和脱氢酶活性含量影响的研究,有助于了解不同土地利用方式下土壤生态环境质量的变化,为保护地栽培生态风险评估以及污染防控研究提供了科学依据。
参考文献:
[1] 李粉茹,于群英,邹长明.设施菜地土壤 pH 值,酶活性和氮磷养分含量的变化[J].农业工程学报,2009,25(1):217-222.
[2] 曾希柏,白玲玉,苏世鸣,等.山东寿光不同种植年限设施土壤的酸化与盐渍化[J].生态学报,2010,30,(7):1853-1859.
[3] 黄 霞,李廷轩,余海英.典型设施栽培土壤重金属含量变化及其风险评价[J].植物营养与肥料学报,2010,16(4):833-839.
[4] 史 静,张乃明,包 立.我国设施农业土壤质量退化特征与调控研究进展[J].中国生态农业学报,2013,21(7):787-794.
[5] 曾希柏,徐建明,黄巧云,等.中国农田重金属问题的若干思考[J].土壤学报,2013,50(1):186-194.
[6] 毛明翠,黄 标,李 元,等.我国北方典型日光温室蔬菜生产系统土壤重金属积累趋势[J].土壤学报,2013,50(4):835-841.
[7] 曾路生.寿光设施蔬菜土壤有效态Hg、As、Cu和Zn含量的变化[J].环境化学,2013,32(9):1743-1748.
[8] Eriksson J E.The influence of pH,soil type and time on adsorbtion and uptake by plants of Cd added to the soil[J].Water,Air,and Soil Pollution,1989,32(9):317-335.
[9] 沈灵凤.设施栽培年限及施肥对土壤盐分和硝态氮累积的影响研究[M].北京:中国农业科学院,2012.
[10] 罗 璇,陈小娇,李取生,等.盐分胁迫下番茄盐分离子和重金属的分布特征[J].农业环境科学学报,2012,31(4):654-660.
[11] 张乾坤,刘亚男,李取生,等.多种盐分离子作用下苋菜对重金属的吸收累积特征[J].生态与农村环境学报,2012,28(1):61-66.
[12] 吴慧梅.大棚种植方式对蔬菜中重金属迁移及富集的影响[D].杭州:浙江工业大学,2012.
[13] 王丽霞.保护地邻苯二甲酸酯污染的研究[D].泰安:山东农业大学,2007.
[14] 王玉蓉,张广才,张 昀,等.增塑剂邻苯二甲酸二异辛酯对土壤两种酶活性的影响 [J].土壤通报,2012(6):1405-1408.
[15] 尹 睿,林先贵,王曙光,等.土壤中DBP/DEHP污染对几种蔬菜品质的影响[J].农业环境科学学报,2004,23(1):1-5.
[16] 王 佳,董四君.邻苯二甲酸二乙基己酯(DEHP)毒理与健康效应研究进展[J].生态毒理学报,2012,7(1):25-34.
[17] 姜虎生,王宏燕.除草剂对土壤脱氢酶活性及呼吸强度的影响[J].吉林农业科学,2011,36(5):53-55.
[18] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
[19] Vance E D,Brooks P C,Jenkinson D S.An extraction method for measuring soil microbial biomass[J].Soil Biology and Biochemistry,1987,19(6):703-707.
[20] Fliebbach A,Martens R.Soil microbial and activity in soil treated with heavy metal contaminated sewage sludge[J].Soil Biol,1994,26(9):1201-1205.
[21] 高 岩,曾路生,李俊良,等.优化施肥对设施番茄根际与非根际土壤养分及酶活性的影响[J].华北农学报,2013,28(S1):347-352.
[22] 王鑫宏.DBP/DEHP 单一及与Pb复合污染对土壤微生物生物量碳及土壤酶的影响研究[D].长春:东北师范大学,2010.
[23] Sardinha M,Müller T,Schmeisky H,et al.Microbial performance in soils along a salinity gradient under acidic conditions[J].Applied Soil Ecology,2003,23(3):237-244.
[24] Chandra S,Joshi H C,Pathak H,et al.Effect of potassium salts and distillery effluent on carbon mineralization in soil[J].Bioresource Technology,2002,83(3):255-257.
[25] Tripathi S,Kumari S,Chakraborty A,et al.Microbial biomass and its activities in salt-affected coastal soils[J].Biology and Fertility of Soils,2006,42(3):273-277.
[26] 景宇鹏,李跃进,年佳乐,等.土默川平原不同盐渍化程度土壤微生物生态特征研究[J].生态环境学报,2013,22(7):1153-1159.
[27] 隋跃宇,焦晓光,高崇生,等.土壤有机质含量与土壤微生物量及土壤酶活性关系的研究[J].土壤通报,2009,40(5):1036-1039.
[28] 马晓霞,王莲莲,黎青慧,等.长期施肥对玉米生育期土壤微生物量碳氮及酶活性的影响[J].生态学报,2012,32(17):5502-5511.
[29] 张昌爱.大棚土壤模拟酸化对蔬菜根系生态环境的影响[D].泰安:山东农业大学,2003.
[30] Hinojosa M B,Garcia-Rui R,Viflegla B,et al.Microbiological rates and enzyme activities as indicators of functionality in soils affected by the Aznalcöllar toxic spill[J].Soil Biology and Biochemistry,2004,36(10):1637-1644.
[31] 高新昊,张英鹏,刘兆辉,等.种植年限对寿光设施大棚土壤生态环境的影响[J].生态学报,2015,35(5):1-12.
[32] 刘明明.邻苯二甲酸二丁酯和镉复合作用对油菜生理生化指标和土壤酶活性的影响研究[D].泰安:山东农业大学,2014.
[33] 董 艳,董 坤,郑 毅,等.设施栽培对土壤化学性质及微生物区系的影响[J].农业环境科学学报,2009,28(3):527-532.
[34] 吴雪峰.DEHP污染对土壤微生物毒理效应研究[D].长春:东北农业大学,2014.
[35] Maliszewska-Kordybach B,Smreczak B.Habitat function of agriculture soils as affected by heavy metals and polycyclic aromatic hydrocarbons contamination[J].Environmental International,2002.28(8):719-728.
[36] 程凤侠,司友斌,刘小红.铜与草甘膦单一和复合污染对水稻土酶活性的影响[J].农业环境科学学报,2009,28(1):84-88.
[37] 沈国清,陆贻通,洪静波,等.菲和镉复合污染对土壤微生物的生态毒理效应.环境化学,2005,24(6):662-665.
[38] 张 慧,党 志,姚丽贤,等.镉芘单一污染和复合污染对土壤微生物生态效应的影响[J].农业环境科学学报,2009,28(1):84-88.
[39] Shen G Q,Lu Y T,Zhou Q X,et al.Interaction of polycyclic aromatic hydrocarbons and heavy metals on soil enzyme[J].Chemosphere,2005,61(8):1175-1182.
Effects of Soil Microbial Biomass Carbon and Dehydrogenase Activity in Greenhouse Soil to Cd-PAEs
ZHAO Hui,WANG Linlin,SONG Ningning,WANG Fangli,LIU Jun,WANG Kairong,SHI Yanxi
(Qingdao Agricultural University,Qingdao Rural Environmental Engineering Research Center,Qingdao 266109,China)
Abstract:A pot experiment was conducted to study the effect of response of microbial biomass carbon and soil dehydrogenase activity facilities on Cd-PAEs composite pollution. In order to reveal the greenhouse soil Cd and PAEs combined pollution effect,through pot experiment to verify the response of microbial biomass carbon and soil dehydrogenase activity facilities on Cd-PAEs composite pollution.Results showed that the soil microbial biomass carbon content increased by 42.7% and 96.5%,respectively,when the application of low concentration Cd(≤2.0 mg/kg).The application of PAEs(40,80 mg/kg)20 d after transplanting reduced the soil biological carbon content by 56.2% and 46.7%.At 30 days after transplanting,PAEs(40,80 mg/kg)30 d after transplanting decreased the total biomass carbon in the field by 39.8% and 21.6%.Cd treatment reduced the dehydrogenase activity in the soil,but did not change the dehydrogenase activity significantly.The application of high concentration of PAEs(80 mg/kg)increased the dehydrogenase activity of field soil by 33.6%,but decreased the soil dehydrogenase activity by 40.0%.There was a synergistic inhibition effect between Cd and PAEs on soil micro-biomass C,but an antagonistic effect on the dehydrogenase activity.
Key words:Phthalic acid ester(PAEs);Cadmium(Cd);Microbial biomass carbon;Dehydrogenase activity;Combined pollution
收稿日期:2017-02-10
基金项目:山东省“黄蓝两区建设”专项资金(No.2011-黄-19)
作者简介:赵 辉(1990-),女,山东济南人,在读硕士,主要从事农业环境保护研究。
通讯作者:王凯荣(1959-),男,山东济南人,教授,博士,博士生导师,主要从事农业生态与环境保护研究。
中图分类号:X154.3
文献标识码:A
文章编号:1000-7091(2017)02-0232-07
doi:10.7668/hbnxb.2017.02.034