两个小麦新品种的耐盐性分析
陆启环1,张 弢1,穆 平2,刘雪华1,董春海1,杨洪兵1
(1.青岛农业大学 生命科学学院,山东省高校植物生物技术重点实验室,山东 青岛 266109;2.青岛农业大学 农学与植物保护学院,山东 青岛 266109)
摘要:为了研究不同浓度NaCl胁迫对小麦生理特性及TaNHX1基因表达的影响,以鲁原502和青麦6号2个小麦新品种为试验材料,50,100,150,200 mmol/L NaCl胁迫下测定2个小麦品种种子发芽率、幼苗鲜质量、根系活力、质膜透性、MDA含量、Na+含量等生理指标,并通过荧光定量PCR方法对小麦耐盐基因TaNHX1在根部和茎基部的表达量进行了比较。结果表明,100 mmol/L以上浓度NaCl胁迫下青麦6号种子发芽率显著高于鲁原502;低浓度NaCl胁迫对青麦6号幼苗生长具有显著促进效应,150 mmol/L NaCl胁迫下青麦6号幼苗鲜质量显著降低,而鲁原502幼苗鲜质量在100 mmol/L NaCl胁迫下就开始显著降低;高浓度NaCl胁迫下鲁原502根系活力下降幅度显著大于青麦6号;相同浓度NaCl胁迫下鲁原502叶片质膜透性和MDA含量均显著高于青麦6号,说明NaCl胁迫对青麦6号叶片细胞质膜伤害较小;高浓度NaCl胁迫下青麦6号根部和茎基部Na+含量均显著高于鲁原502,说明青麦6号根部和茎基部的拒Na+能力显著大于鲁原502,可以有效限制Na+向地上部运输;鲁原502和青麦6号的TaNHX1基因分别在100,150 mmol/L NaCl胁迫下达到最高表达量。以上结果说明青麦6号比鲁原502更耐盐,鲁原502的最高耐盐浓度为100 mmol/L,青麦6号的最高耐盐浓度为150 mmol/L。
关键词:小麦;发芽率;生理特性;Na+含量;TaNHX1表达量;耐盐性
盐胁迫是主要的非生物胁迫之一,它影响植物生长的生化和生理过程,导致生长的抑制和产量的降低[1],盐胁迫是目前制约农作物产量增加的主要逆境因素之一,盐胁迫下植物种子萌发、幼苗生长发育都会受到抑制[2]。土壤盐渍化对全球农业可持续发展和环境质量产生重要影响[3]。小麦是仅次于玉米和水稻第三大粮食作物,早在我国粮食安全战略中占有举足轻重的地位,其播种面积占耕地面积的20%~30%[4]。通过对粮食作物小麦、大麦和玉米,经济作物甜菜和罗布麻,蔬菜作物三角滨藜和黄瓜,牧草植物披碱草和星星草,以及荆条、白蜡等园林植物的研究发现,高浓度盐分对植物生长有明显抑制作用,低浓度盐分对植物生长影响较小,甚至具有一定促进作用[5]。在植物耐盐育种研究中,利用耐盐生理指标筛选耐盐品种十分重要,由于不同植物的耐盐机制不同,衡量不同植物耐盐性的指标也有所差异[6]。小麦富含淀粉、蛋白质、脂肪、维生素A和维生素C等,是三大粮食作物之一,本研究以小麦新品种鲁原502和青麦6号为材料,通过检测种子发芽率、幼苗鲜质量、根系活力、质膜透性、MDA含量、Na+含量及TaNHX1基因的表达量,分析不同浓度NaCl胁迫对2种小麦种子萌发及幼苗耐盐特性的影响,确定其耐盐浓度范围,为小麦抗盐育种研究提供依据。
1 材料和方法
1.1 材料培养与处理
以小麦新品种鲁原502和青麦6号为试验材料,挑选大小一致、籽粒饱满的小麦种子,1 g/L高锰酸钾溶液浸泡消毒10 min,蒸馏水中通气吸涨5 h,种子均匀摆放在铺有滤纸的培养皿中,26 ℃培养箱中培养,NaCl处理浓度分别为0,50,100,150,200 mmol/L;另外一批种子发芽后移至含有1/2 Hoagland营养液的培养皿中,营养液3 d更换1次,自然光照,昼夜温度为26 ℃/16 ℃,相对湿度为60%左右,常规管理,幼苗长至两叶一心期开始用不同浓度NaCl处理(NaCl溶液用1/2 Hoagland营养液配制),连续处理3 d后测定相关生理指标。材料于105 ℃烘箱中杀青10 min,70 ℃烘至恒重,研磨后称取0.05 g用于Na+含量测定。每个处理设3次重复。
1.2 试验方法
每组小麦种子数量121粒,每天记录发芽数,连续记录5 d,计算种子发芽率;幼苗处理前测一次鲜质量,处理3 d后再测1次鲜质量,2次差值即为幼苗鲜质量增加值。根系活力参照TTC比色法测定[7];质膜透性以相对电导率表示,质膜透性和MDA含量测定参照李锦树等[8]的方法;Na+含量的测定参照刘正祥等[9]的方法。
1.3 TaNHX1基因的表达分析
分别取0.1 g样品,利用TRIzol总RNA抽提试剂盒(TaKaRa)步骤提取RNA,电泳检测其质量,利用分光光度计测定RNA浓度,取等量总RNA进行反转录,合成cDNA,参考小麦的TaNHX1(AY040245)序列设计引物,引物序列见表1,通过Agilent Technologies Stratagene Mx3000P仪器进行荧光定量PCR分析,采用2-ΔΔCT的方法计算TaNHX1基因在小麦不同部位的相对表达量[10]。
表1 荧光定量PCR分析所用引物
Tab.1 The primers of RT-qPCR
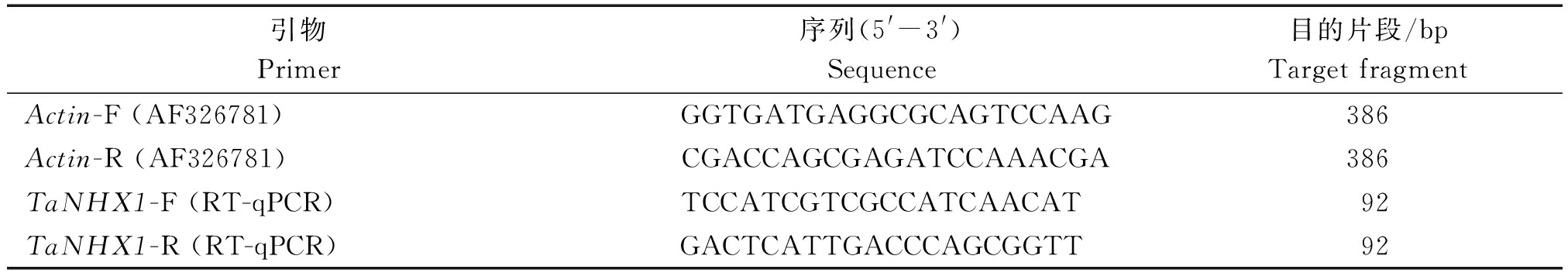
引物Primer序列(5'-3')Sequence目的片段/bpTargetfragmentActin-F(AF326781) GGTGATGAGGCGCAGTCCAAG386Actin-R(AF326781) CGACCAGCGAGATCCAAACGA386TaNHX1-F(RT-qPCR)TCCATCGTCGCCATCAACAT92TaNHX1-R(RT-qPCR)GACTCATTGACCCAGCGGTT92
2 结果与分析
2.1 不同浓度NaCl胁迫对小麦种子发芽率的影响
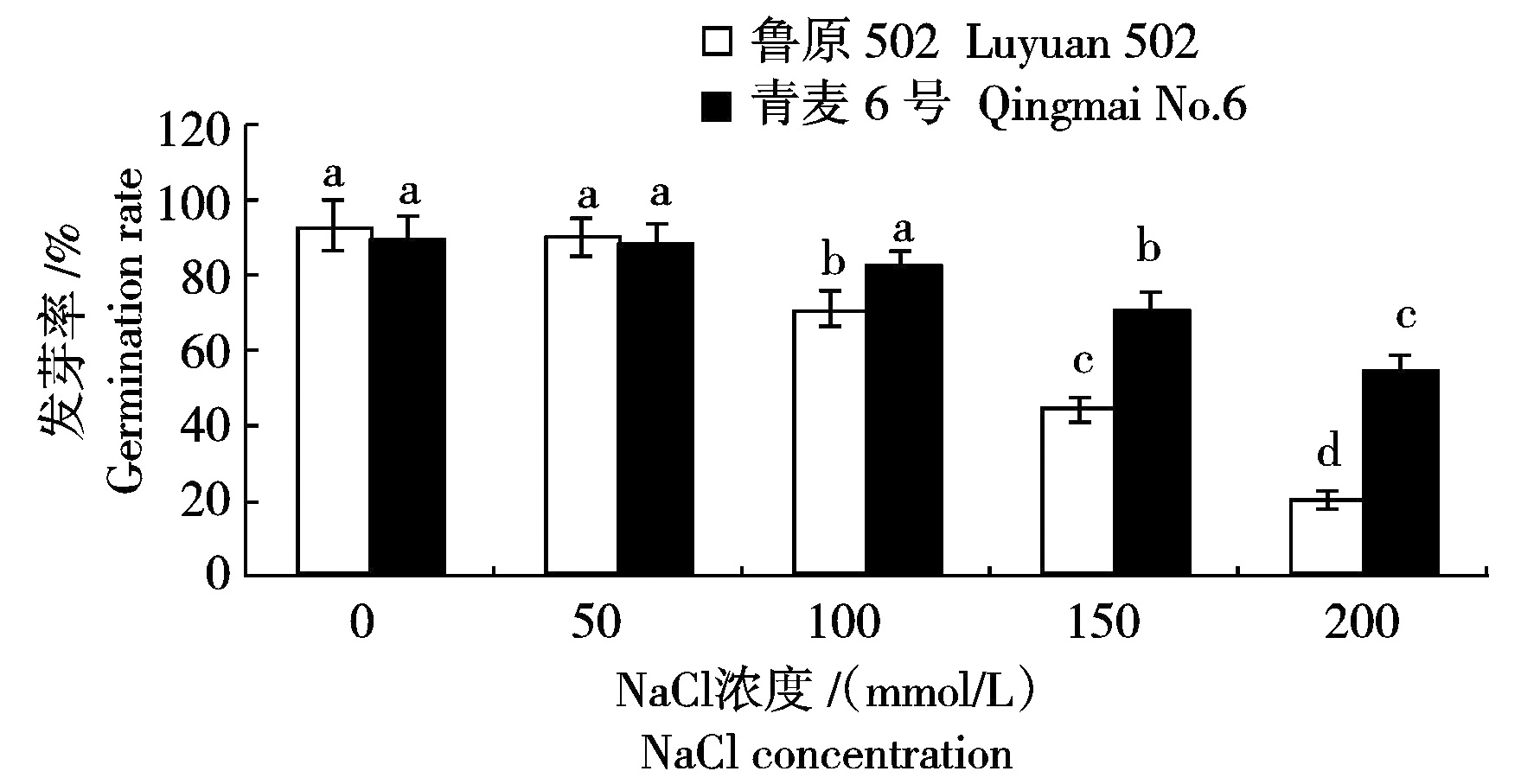
种子能够在盐胁迫下萌发成幼苗,是植物在盐碱条件下生长发育的前提,因此,研究盐胁迫下种子萌发生理具有重要意义[11]。由图1可见,与对照相比,随着NaCl胁迫浓度的增加,2个小麦品种的种子发芽率都有所降低,50,100,150,200 mmol/L NaCl胁迫下,鲁原502种子发芽率分别比对照降低了2.49,21.82,47.76和72.69个百分点,青麦6号种子发芽率分别比对照降低了0.84,7.44,18.62和34.38个百分点。鲁原502种子发芽率在150,200 mmol/L NaCl胁迫下降低幅度较大,青麦6号种子发芽率在200 mmol/L NaCl胁迫下降低幅度较大,且100,150,200 mmol/L NaCl胁迫下,青麦6号种子发芽率均显著大于鲁原502,说明鲁原502种子对NaCl胁迫更敏感。
2.2 不同浓度NaCl胁迫对小麦幼苗鲜质量的影响
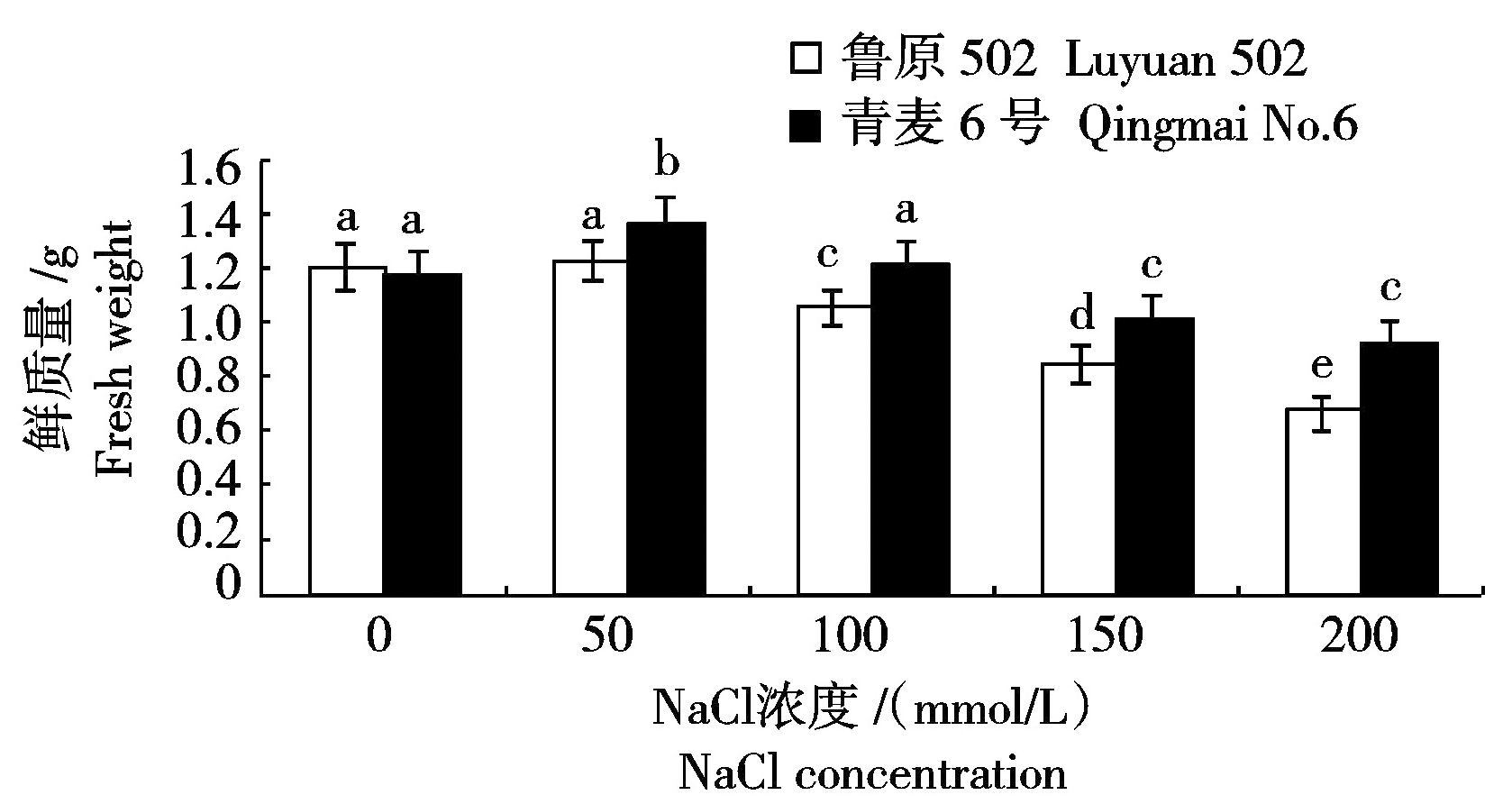
前人通过盆栽方式研究了在不同浓度NaCl胁迫下。冬小麦物质分配和根部特征,结果表明随着盐浓度的增加,小麦地上干质量以及根的长度显著减小[12]。由图2看出,50 mmol/L NaCl胁迫下,鲁原502幼苗鲜质量无显著变化,而青麦6号幼苗鲜质量显著增加,比对照增加了16.10%;100 mmol/L NaCl胁迫下,青麦6号幼苗鲜质量无显著变化,而鲁原502幼苗鲜质量显著降低,比对照降低了12.40%;150,200 mmol/L NaCl胁迫下,2个小麦品种幼苗鲜质量均显著降低,鲁原502分别比对照降低了29.75%和44.63%,青麦6号分别比对照降低了14.41%和21.19%,鲁原502降低幅度显著大于青麦6号。
2.3 不同浓度NaCl胁迫对小麦幼苗根系活力的影响
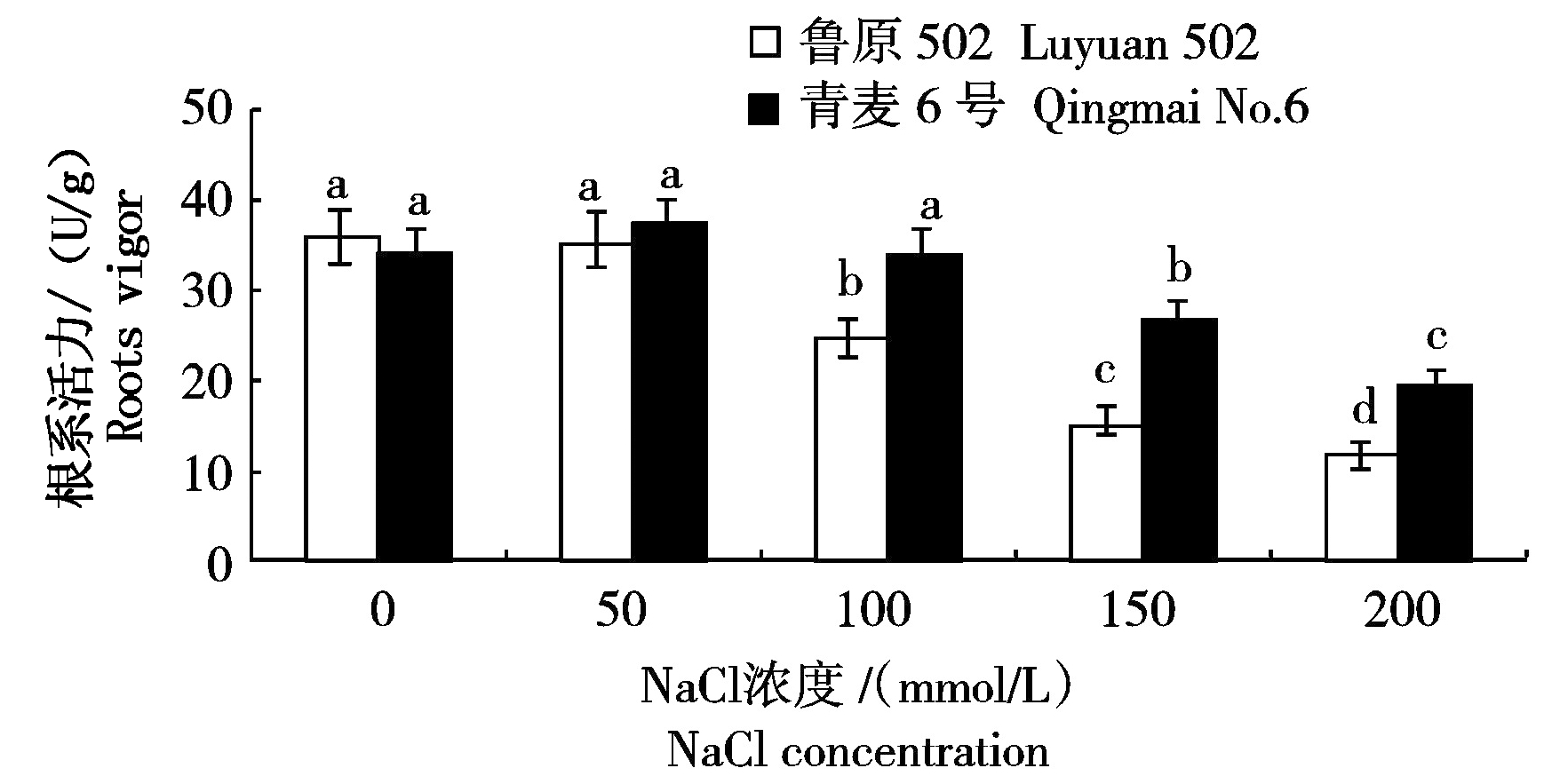
根系是作物吸收水分和养分的主要器官,根系活力是反映植株吸收和代谢功能的重要指标,根系活力变化直接影响地上部生长发育[13]。图3所示,随着NaCl胁迫浓度的增加,鲁原502幼苗根系活力(以鲜质量计)呈持续下降趋势,100,150,200 mmol/L NaCl胁迫下降低幅度较大,分别比对照降低了31.62%,57.75%和68.04%;青麦6号幼苗根系活力在50 mmol/L NaCl胁迫下比对照有小幅增加,100,150,200 mmol/L NaCl胁迫下分别比对照降低了0.93%,23.14%和44.67%,青麦6号根系活力在200 mmol/L NaCl胁迫下降低幅度较大。100,150,200 mmol/L NaCl胁迫下,青麦6号幼苗根系活力显著大于鲁原502。
2.4 不同浓度NaCl胁迫对小麦幼苗叶片质膜透性的影响
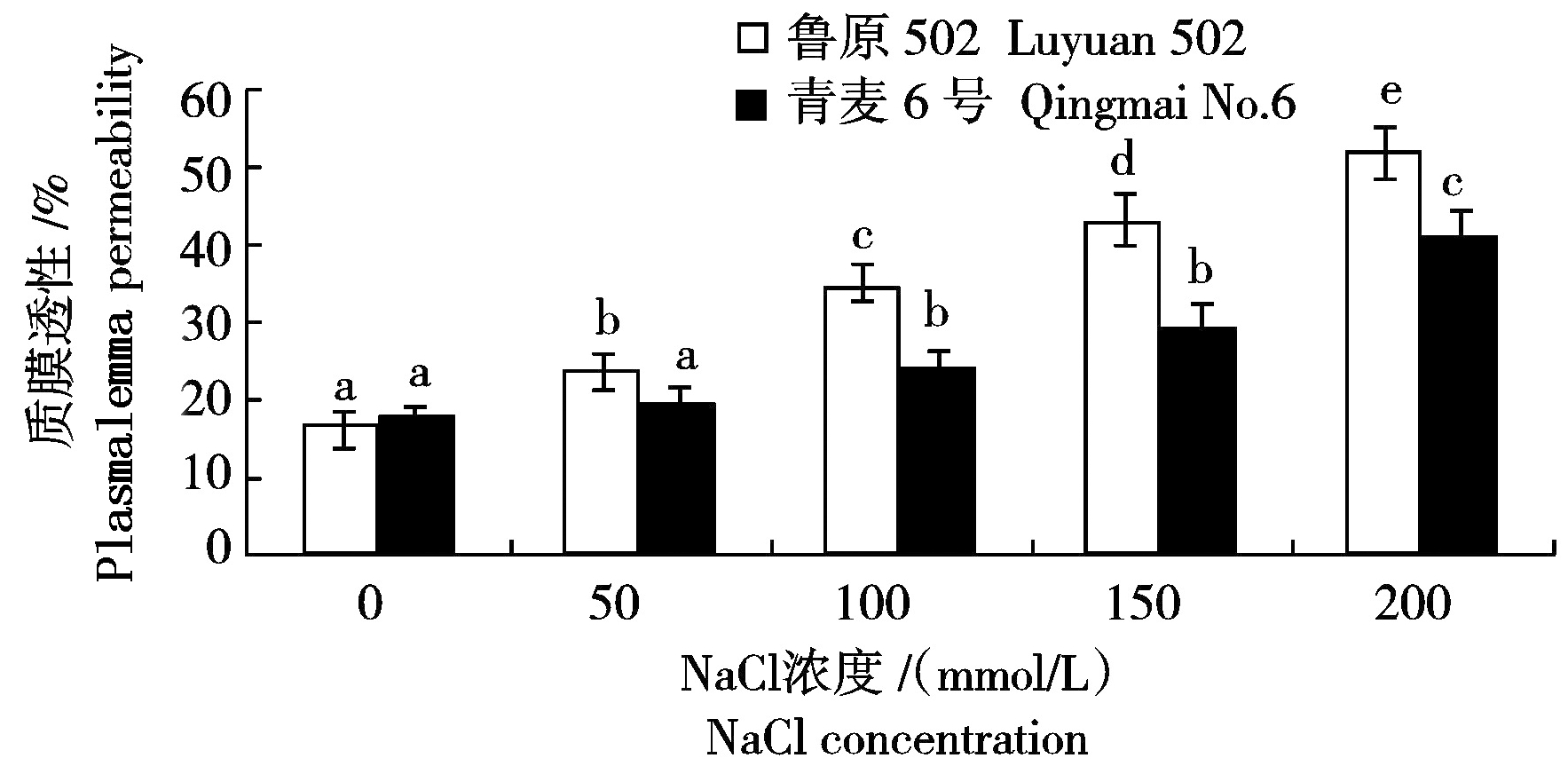
大量研究表明,干旱胁迫会造成玉米膜透性和MDA的显著增加,从而对植物造成氧化胁迫[14-15]。因此,测定植物叶片的电解质渗出率可以作为植物抗逆性的一个重要参考指标。图4看出,随着NaCl胁迫浓度的增加,2个小麦品种叶片质膜透性都随之增加,50,100,150,200 mmol/L NaCl胁迫下,鲁原502叶片质膜透性分别比对照增加了6.85%,18.19%,26.86%和35.19%,青麦6号叶片质膜透性分别比对照增加了1.75%,6.69%,11.39%和23.35%,相同浓度NaCl胁迫下鲁原502叶片质膜透性显著大于青麦6号。
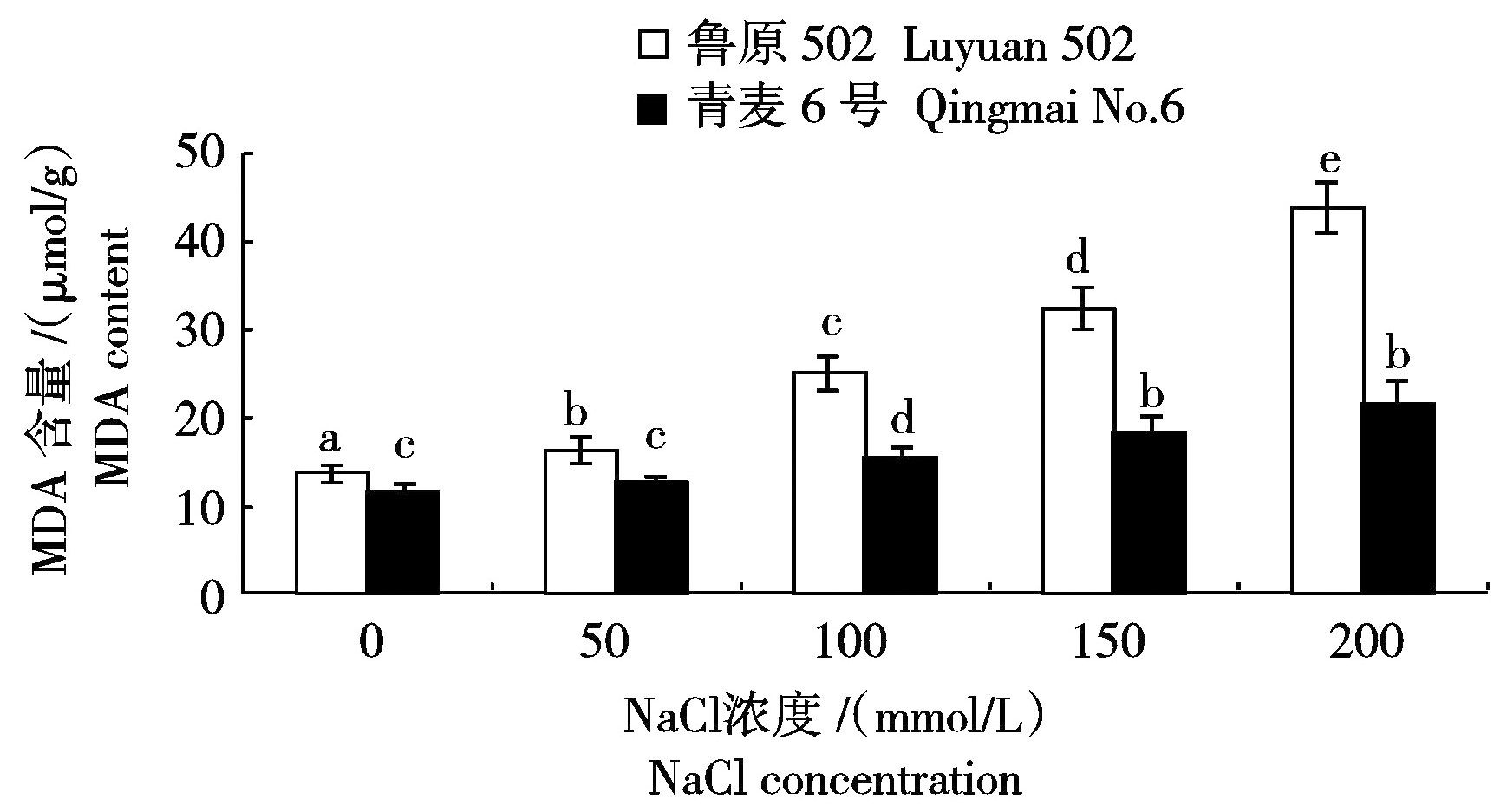
2.5 不同浓度NaCl胁迫对小麦幼苗叶片MDA含量的影响
MDA(丙二醛)是膜脂过氧化的产物,逆境胁迫下MDA含量(以鲜质量计)与膜脂过氧化伤害程度密切相关。图5显示,100,150,200 mmol/L NaCl胁迫下鲁原502叶片MDA含量增加幅度较大,分别比对照增加了85.97%,138.88%和221.80%,青麦6号在150,200 mmol/L NaCl胁迫下叶片MDA含量增加幅度较大,分别比对照增加了63.68%和97.85%。同等盐度胁迫下,鲁原502叶片MDA含量显著大于青麦6号。
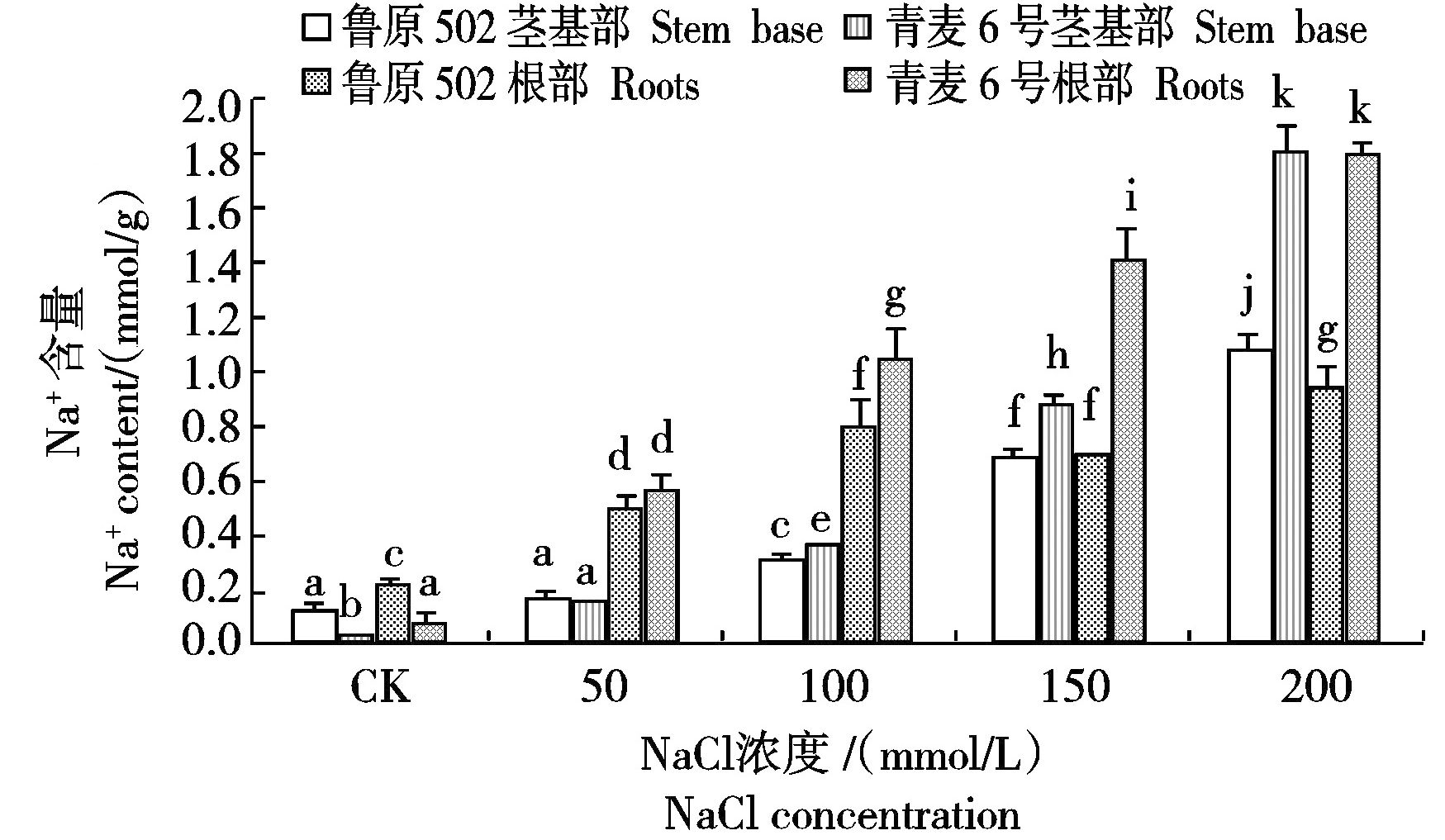
2.6 不同浓度NaCl胁迫对小麦幼苗根部和茎基部Na+含量的影响
图6显示,50 mmol/L NaCl胁迫下,2个小麦品种根部Na+含量(以干质量计)无显著差异,茎基部Na+含量也无显著差异;100,150,200 mmol/L NaCl胁迫下,青麦6号根部Na+含量显著大于鲁原502,根部Na+含量分别高出30.86%,101.43%和84.54%;青麦6号茎基部Na+含量也显著大于鲁原502,茎基部Na+含量分别高出15.63%,28.99%和58.77%。说明盐胁迫下青麦6号根部和茎基部的拒Na+能力明显强于鲁原502。
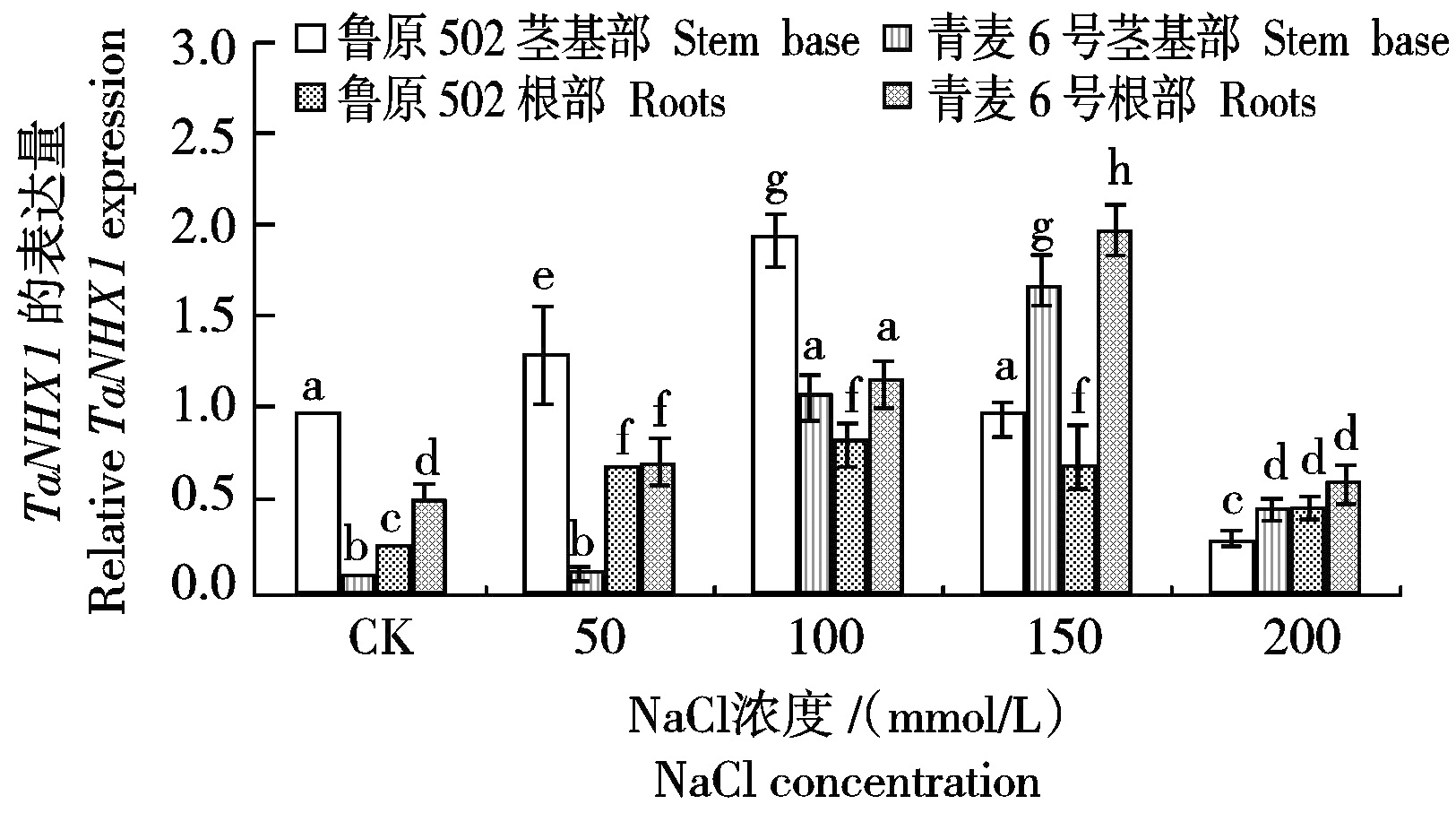
2.7 不同浓度NaCl胁迫对小麦幼苗根部和茎基部TaNHX1表达量的影响
液泡膜蛋白NHX与作物的耐盐性密切相关,其在作物耐盐改良方面的研究较多[16]。本研究对NaCl胁迫下鲁原502和青麦6号2个小麦品种TaNHX1基因的表达水平进行了分析,图7显示,随着NaCl胁迫浓度的增加,2个小麦品种根部和茎基部TaNHX1基因表达量都表现出先增加后降低的趋势,在100 mmol/L NaCl胁迫下鲁原502根部和茎基部TaNHX1表达量最高,分别比对照高出245.83%和94.00%;150 mmol/L NaCl胁迫下青麦6号根部和茎基部TaNHX1表达量最高,表达量分别比对照分别高出266.67%和1 445.45%,且青麦6号根部和茎基部的TaNHX1表达量均显著大于鲁原502,表达量分别高出178.87%和75.26%。这与之前的小麦拒Na+生理研究结果相一致,即耐盐小麦品种的拒Na+部位主要在根部,盐敏感小麦品种的拒Na+部位主要在根茎结合部[17]。
3 讨论与结论
盐胁迫诱导植物产生多种生化和生理反应,几乎影响植物所有的代谢过程[18-19]。多数植物在无盐条件下种子发芽最好,低浓度盐分会延缓种子萌发,高浓度盐分抑制种子萌发[20]。本研究中,100 mmol/L以上NaCl胁迫下青麦6号种子发芽率均显著大于鲁原502,特别是150,200 mmol/L NaCl胁迫下,鲁原502种子发芽率下降趋势更为明显,说明鲁原502种子对高浓度NaCl胁迫更敏感。本研究中,50 mmol/L NaCl胁迫下青麦6号幼苗鲜质量显著增加,说明低盐度胁迫对青麦6号幼苗生长具有显著促进效应,150 mmol/L NaCl胁迫下青麦6号幼苗鲜质量显著降低,而鲁原502幼苗鲜质量在100 mmol/L NaCl胁迫下就开始显著降低,说明鲁原502幼苗对盐更敏感。
根系不仅是植物吸收水分和养分的器官,也是物质同化、转化或合成的重要部位,其生长发育状况和活力强弱对植物的耐盐能力至关重要[21]。在150 mmol/L NaCl胁迫下鲁原502根系活力下降幅度显著大于青麦6号,200 mmol/L NaCl胁迫下鲁原502根系活力下降更为显著,说明青麦6号的根系对于盐胁迫环境的适应能力比鲁原502强。
膜系统是植物盐害的主要敏感部位,盐胁迫下植物细胞结构和功能受到伤害,表现为质膜透性增大[22]。膜透性是衡量细胞中溶质分子渗出状况的指标,盐胁迫下质膜透性变化小的材料耐盐性强。本研究中,相同浓度NaCl胁迫下鲁原502叶片质膜透性显著大于青麦6号,说明NaCl胁迫对青麦6号叶片细胞质膜伤害较小。逆境条件下,植物细胞内活性氧产生与清除的平衡遭到破坏,膜脂过氧化作用增加,导致质膜透性增大,离子平衡失调,代谢紊乱[23]。本研究中,高浓度NaCl胁迫下2种小麦叶片MDA含量增加较多,特别是鲁原502叶片MDA含量增加量显著大于青麦6号,说明高盐度胁迫下鲁原502叶片膜脂过氧化作用明显,对NaCl胁迫更加敏感。
不同植物的拒Na+机理是不同的,大麦通过根的拒Na+作用使运至地上部分的Na+减少,大豆通过茎基部维管组织细胞从木质部汁液中强烈积累Na+[24]。小麦作为一种拒Na+作物,高浓度NaCl胁迫下青麦6号根部和茎基部Na+含量均显著大于鲁原502,说明青麦6号根部和茎基部的拒Na+能力显著大于鲁原502,可以有效地限制Na+向地上部运输,更耐盐。植物细胞液泡膜Na+/H+逆向转运蛋白是一种调控Na+、H+跨膜转运的膜蛋白,可将细胞质中过多的Na+区隔化于液泡中,调节细胞渗透压和离子平衡,从而赋予植物耐盐性。Na+/H+逆向转运蛋白(NHX)活性首次在甜菜根部储藏组织液泡膜上发现,之后许多具有液泡膜Na+/H+逆向转运活性的植物被陆续发现,如大麦中过量表达拟南芥Na+/H+逆向转运蛋白基因能显著提高其耐盐性,而大麦本身并无不良反应[25]。本研究中,随着NaCl胁迫浓度的增加,2个小麦品种根部和茎基部的TaNHX1基因表达量均呈先增后降趋势,鲁原502和青麦6号分别在100,150 mmol/L NaCl胁迫下达到最高表达量,因此,在小麦盐分耐受限度内,TaNHX1基因表达量的增加提高了小麦耐盐性,当盐浓度过高时会抑制TaNHX1基因的表达,从而降低小麦耐盐性,对小麦生长产生抑制作用。
综上所述,从各项生理指标、Na+含量及TaNHX1基因表达分析来看,青麦6号比鲁原502更耐盐,鲁原502的最高耐盐浓度为100 mmol/L,青麦6号的最高耐盐浓度为150 mmol/L。
参考文献:
[1] Yang F, Liang Z W, Wang Z C, et al. Relationship between diurnal changes of net photosynthetic rate and influencing factors in rice under saline sodic stress[J]. Rice Science, 2008, 15(2): 119-124.
[2] Zhu J K. Plant salt tolerance[J]. Trends in Plant Science, 2001, 6(2): 66-71.
[3] Zhou D, Lin Z L, Liu L M. Regional land salinization assessment and simulation through cellular automaton-Markov modeling and spatial pattern analysis[J]. Science of the Total Environment, 2012, 439(22):260-274.
[4] 高辉明,张正斌,徐 萍,等. 2001-2009年中国北部冬小麦生育期和产量变化[J]. 中国农业科学, 2013, 46(11): 2201-2210.
[5] 武俊英, 刘景辉, 李 倩, 等. 盐胁迫对燕麦种子萌发、幼苗生长及叶片质膜透性的影响[J]. 麦类作物学报, 2009, 29(2): 341-345.
[6] 张学云, 袁庆华. 盐胁迫对多花胡枝子种子萌发及生理特性的影响[J]. 作物杂志, 2011(6): 14-18.
[7] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 3版.北京: 高等教育出版社, 2003.
[8] 李锦树, 王洪春, 王文英, 等. 干旱对玉米叶片细胞透性及膜脂的影响[J]. 植物生理学报, 1983, 9(3): 223-229.
[9] 刘正祥, 张华新, 杨秀艳, 等. NaCl胁迫下沙枣幼苗生长和阳离子吸收、运输与分配特性[J]. 生态学报, 2014, 34(2): 326-336.
[10] 郭 强, 孟 林, 李杉杉, 等. 马蔺NHX基因的克隆与基因表达分析[J]. 植物生理学报, 2015, 51(11): 2006-2012.
[11] 沈振荣, 杨万仁, 徐秀梅. 不同盐分胁迫对苜蓿种子萌发的影响[J]. 种子, 2006, 25(4): 34-37.
[12] 王 萍, 杨春桥, 焦 阵. NaCl胁迫对小麦种子萌发与幼苗生长的影响[J]. 中国农学通报, 2010, 26(2): 127-131.
[13] 杨素苗, 李保国, 齐国辉, 等. 根系分区交替灌溉对苹果根系活力、树干液流和果实的影响[J]. 农业工程学报, 2010, 26(8): 73-79.
[14] 王 芳, 赵有军, 王汉宁. 外源NO对干旱胁迫下玉米幼苗膜脂过氧化的调节效应[J]. 干旱地区农业研究, 2015, 33(5): 75-79.
[15] 沈业杰, 尹光华, 佟 娜, 等. 玉米抗旱相关生理生化指标研究及品种筛选[J]. 干旱区资源与环境, 2012, 26(4): 176-180.
[16] 马燕斌, 吴 霞, 蔡永峰, 等.TaNHX1基因的组织特异性表达及生物信息学分析[J]. 山西农业科学, 2013, 41(5): 422-426.
[17] 杨洪兵, 丁顺华, 邱念伟, 等. 耐盐性不同的小麦根和根茎结合部的拒Na+作用[J]. 植物生理学报, 2001, 27(2): 179-185.
[18] Alla M M N, Hassan N M. A possible role for C4 photosynthetic enzymes in tolerance of Zea mays to NaCl[J]. Protoplasma, 2012, 249(4): 1109-1117.
[19] Alla M M N, Khedr A H A, Serag M M, et al. Regulation of metabolomics in Atriplex halimus growth under salt and drought stress[J]. Plant Growth Regulation, 2012, 67(3): 281-304.
[20] 秦峰梅, 张红香, 武 祎, 等. 盐胁迫对黄花苜蓿发芽及幼苗生长的影响[J]. 草业学报, 2010, 19(4): 71-78.
[21] 郭世荣. 无土栽培学[M]. 北京: 中国农业出报社, 2003.
[22] Zhao F G, Sun C, Liu Y L, et al. Effects of salinity stress on the levels of covalently and noncovalently conjugated polyamines in plasma membrane and tonoplast isolated from barley seedlings[J]. Acta Botanica Sinica, 2000, 42(9): 920-926.
[23] 于 翠, 吕德国, 杨 磊, 等. 葡萄糖对盐胁迫下山楂(Crataegus pinnatifida Bge.)幼苗光合荧光特性的影响[J]. 沈阳农业大学学报, 2009, 40(4): 408-412.
[24] Jacoby B. Function of bean roots and stems in sodium retention[J]. Plant Physiology, 1964, 39(3): 445-449.
[25] Garbarino J, Dupont F M. NaCl induces a Na+/H+ antiport in tonoplast vesicles from barley roots[J]. Plant Physiology, 1988, 86(1): 231-236.
《天津农业科学》征订启事
《天津农业科学》是天津市农业科学院信息研究所主办的综合性学术期刊,创刊于1974年。国际刊号:ISSN 1006-6500,国内刊号:CN:12-1256/S。本刊为月刊,大16开,150页,每期定价5元,全年60元。
本刊为美国化学文摘CA收录期刊、中国核心期刊(遴选)数据库收录期刊,中国学术期刊综合评价数据统计源期刊,全国优秀农业期刊。
开设栏目有:植物生理与生物技术、作物栽培与设施园艺、植物保护、土壤肥料与节水灌溉、畜牧兽医与水产养殖、园林绿化、贮藏加工、农产品安全、农业经济与信息技术、农业科研管理、三农问题研究、农业区划等。
适合各级农业科研人员、农技推广人员、农业行政管理干部、农业大中专院校师生参阅。
欢迎订阅,欢迎投稿!
地址:天津市南开区白堤路268号农科大厦1905室
邮编:300192
电话/传真:022-23678601
E-mail:tjnykx@163.com
在线投稿网址:tjnykx.paperopen.com
Analysis of Salt Tolerance Between Two New Wheat Varieties
LU Qihuan1,ZHANG Tao1,MU Ping2,LIU Xuehua1,DONG Chunhai1,YANG Hongbing1
(1.College of Life Sciences,Qingdao Agricultural University,Key Lab of Plant Biotechnology in Universities of Shandong,Qingdao 266109,China;2.College of Agronomy and Plant Protection,Qingdao Agricultural University,Qingdao 266109,China)
Abstract:In order to study the effects of NaCl stress with different concentrations on physiological characteristics and gene expression ofTaNHX1,two new wheat varieties(Luyuan 502 and Qingmai No.6 )were used as the experimental materials.Physiological indexes of seeds germination rate,seedlings fresh weight,roots vigor,plasmalemma permeability,MDA content and Na+ content of the two wheat varieties were determined under above 100 mmol/L NaCl stress of 50,100,150 and 200 mmol/L,and compared the relative expression of tolerant gene TaNHX1 in roots and stem base of wheat through RT-qPCR method.The results showed that the seeds germination rate of Qingmai No.6 was more than that of Luyuan 502 under above 100 mmol/L NaCl stress.Low concentration NaCl stress had significant promoting effect on seedlings growth of Qingmai No.6,and the seedlings fresh weight of Qingmai No.6 significantly decreased under NaCl stress of 150 mmol/L,while that of Luyuan 502 began to decreased significantly under NaCl stress of 100 mmol/L.The roots vigor of Luyuan 502 decreased significantly more than that of Qingmai No.6 under high concentration NaCl stress.Under the same concentration NaCl stress,the leaf plasmalemma permeability and MDA content of Luyuan 502 were significantly more than that of Qingmai No.6,it indicated that NaCl stress had less damage on leaf cell membrane of Qingmai No.6.Na+ content of roots and stem base of Qingmai No.6 were all significantly more than that of Luyuan 502 under high concentration NaCl stress,it indicated that Na+ exclusion capability of roots and stem base of Qingmai No.6 was significantly more than that of Luyuan 502,which could effectively restrict Na+ transporting to shoot.The TaNHX1 gene of Luyuan 502 and Qingmai No.6 respectively reached the highest expression level under NaCl stress of 100,150 mmol/L.It indicated that Qingmai No.6 is more salt tolerant than Luyuan 502,and the maximum concentration of salt tolerance of Luyuan 502 is 100 mmol/L,while that of Qingmai No.6 is 150 mmol/L.
Key words:Wheat;Germination rate;Physiological characteristics;Na+ content;Relative TaNHX1 expression;Salt tolerance
收稿日期:2017-01-17
基金项目:山东省重点研发计划项目(2015GNC110012);山东省自然科学基金项目(ZR2010CL019)
作者简介:陆启环(1990-),女,江苏宿迁人,在读硕士,主要从事植物逆境生理与分子生物学研究。
通讯作者:杨洪兵(1968-),男,山东日照人,教授,博士,主要从事植物逆境生理与分子生物学研究。
中图分类号:Q945.78;S512.01
文献标识码:A
文章编号:1000-7091(2017)02-0151-06
doi:10.7668/hbnxb.2017.02.023