柠条锦鸡儿CkLEA4-1基因的克隆及表达分析
滑璐玢,于秀敏,杨 杞,王瑞刚,宝力德
(内蒙古农业大学 生命科学学院,内蒙古 呼和浩特 010018)
摘要:为研究胚胎发育晚期蛋白(LEA)在柠条中的生物学功能,从已构建的柠条锦鸡儿干旱胁迫抑制削减杂交文库中筛选到一条LEA蛋白编码基因,并采用RT-PCR法进行克隆。所得LEA基因的开放阅读框(ORF)长1 119 bp,编码373个氨基酸的蛋白质,命名为CkLEA4-1。结合序列比对与系统进化分析结果,推断CkLEA4-1属于5族LEA蛋白。利用实时荧光定量PCR技术对CkLEA4-1在干旱、高盐等逆境胁迫条件下的表达情况进行初步研究,结果表明,CkLEA4-1受到不同程度的诱导,推测该基因可能与柠条锦鸡儿响应逆境胁迫有关。研究还成功构建了CkLEA4-1的过表达载体pCanG-CkLEA4-1,得到转基因纯合体株系,为进一步研究柠条锦鸡儿CkLEA4-1基因的功能提供了材料。
关键词:柠条锦鸡儿;LEA;基因克隆;表达分析
在植物整个生命周期中,干旱、盐碱和冻害成为限制植物生长发育的重要逆境因子,在长期的进化过程中植物为抵御这些环境胁迫,形成了特定、复杂的调控机制[1-2]。其中胚胎发育晚期蛋白(Late embryogenesis abundant,LEA)就是植物在遭遇逆境时诱导合成的一系列功能蛋白,具有保护植物体、维持其生命代谢的功能。LEA蛋白最早由Dure等[3]在棉花子叶中发现,由于在胚胎发育晚期大量积累而得名。起初研究者们认为LEA蛋白是广泛存在于高等植物种子中的一类蛋白,可以在种子成熟脱水过程中保护植物的组织细胞免受脱水伤害。经过长期研究发现LEA蛋白并不只在植物种子中大量表达,当植物在受到干旱、高盐、低温、紫外等非生物胁迫时也会大量表达,且并不表现出组织特异性[4]。同样在极端耐辐射异常球菌[5]、蓝藻[6]、线虫[7]等生物中也发现了LEA蛋白,由此可见LEA蛋白不只存在植物中,在微生物甚至一些无脊椎动物中也可能普遍存在。
LEA蛋白分子量较低,一般为10~30 kDa,富含亲水性氨基酸,如甘氨酸、丙氨酸、丝氨酸等,因此具有较高的亲水性和热稳定性[8]。经大量研究发现,在植物抵抗非生物胁迫的过程中,LEA蛋白能起到水分缓冲液、分子屏障、酶保护剂、与金属离子结合、防止细胞聚集、抗氧化性和膜连接的作用[9]。
LEA蛋白家族庞大,分类方法繁多。Baker和Dure等最早提出LEA蛋白的命名方法,即用大写字母“D”为前缀表示从cDNA文库中筛选得到,后面用数字表示不同序列的LEA蛋白,如D-11、D-19、D-29等[10-11];Bray等[12]根据LEA蛋白序列的保守结构将其分为6族,从1族(Group 1)到6族(Group 6);而由于研究不断深入,一些非典型LEA蛋白被发现,之前的分类方法显得有些不足,于是 Hundertmark等 [4]参照Pfam数据库对植物LEA蛋白命名方法及LEA蛋白的基元序列将其分为9类,分别是Dehydrin、LEA_1、LEA_2、LEA_3、LEA_4、LEA_5、SMP、AtM、PvLEA18。
柠条锦鸡儿(Caragana korshinskii Kom.)为锦鸡儿属多年生灌木,根系庞大,具有耐风蚀、不怕沙埋的特点,在内蒙古地区分布极广。柠条锦鸡儿的另一大优势为抗逆性极强,能抵御-30~-40 ℃的严寒,同时其抗旱、抗热能力也极强,开始受热害的温度高达46 ℃,抗热极限温度可达49 ℃,因此柠条锦鸡儿具有广泛的适应性,是荒漠、荒漠草原地区优良的防沙固沙植物[13]。此外,柠条锦鸡儿枝叶繁茂,产量高,营养丰富,适口性好,是家畜的优良饲用灌木[14-15]。由于柠条锦鸡儿具有极强的抗逆性和很大的应用价值,因此,对柠条锦鸡儿的研究受到重视,对其抗逆分子机制的研究也受到更多的关注,一些抗逆相关的基因逐渐被克隆并进行功能研究[16-18]。本试验以柠条锦鸡儿为材料,采用RT-PCR技术克隆得到一条LEA蛋白编码基因,并对该基因进行生物学分析;利用实时荧光定量PCR技术对其在不同逆境胁迫下的表达量进行了定量分析;成功构建了高效植物表达载体,并筛选得到纯合体株系,为后续研究提供了材料。
1 材料和方法
1.1 植物材料及载体
柠条锦鸡儿种子采自内蒙古四子王旗;野生型拟南芥(Arabidopsis thaliana)Columbia-0生态型(Col-0)、植物表达载体pCanG-HA、农杆菌感受态GV3101均由植物分子生物学实验室提供;克隆载体pEASY-Blunt simple、大肠杆菌感受态购于TransGen;T4 DNA连接酶和限制性内切酶等购于Thermo公司。
1.2 植物处理方法
挑选饱满、无虫蛀的柠条锦鸡儿种子播种于装有蛭石和营养土(2/1)的培养钵中,置于25 ℃、16 h光照/8 h黑暗、光照强度7 000~8 000 lx的环境中进行培养。
取长势一致的30 d龄柠条幼苗进行胁迫处理并提取RNA。胁迫处理主要包括干旱、脱水和NaCl 3种处理方式。处理方法:①干旱处理:停止浇水进行干旱处理,当幼苗呈现严重萎蔫的现象时复水,复水时间为干旱14~16 d,在刚停止浇水时取样并设为第0天(0 d),之后分别在停止浇水后的第4天(4 d)、第8天(8 d)、第12天(12 d)、第16天(16 d)、复水后1 d(re-1 d)取样;②脱水处理:将柠条幼苗从蛭石中小心移出并用清水冲洗干净(尽量避免损伤幼苗),摆放于滤纸上置于植物房进行晾晒处理,并分别在晾晒0,3,6,12,24 h取样;③NaCl处理:将小苗根部浸泡于300 mmol/L的NaCl溶液中进行盐胁迫处理,并在浸泡0,3,6,12,24 h时取样。每种处理每个时间点取3株柠条锦鸡儿幼苗,且每种处理需重复3次。取样时采集幼苗地上部分液氮速冻,保存于-80 ℃冰箱用于RNA提取。
1.3 柠条锦鸡儿总RNA提取及反转录
柠条锦鸡儿幼苗样品总RNA提取采用TRIzol试剂(Invitrogen公司),依照说明书进行操作。用超微量紫外分光光度计Q5000检测RNA浓度,1%浓度的琼脂糖凝胶电泳检测RNA质量。选电泳条带清晰完整并且OD260/230值为1.9~2.0的RNA,采用RNA PCR kit(TaKaRa 公司)进行cDNA第一链的合成,以上操作按试剂盒说明进行。
1.4 CkLEA4-1基因全长cDNA的克隆
从本实验室已构建好的柠条锦鸡儿干旱胁迫抑制削减杂交文库(SSH)得到一条LEA基因序列[19],利用Primer5设计引物见表1,小写部分是酶切位点所在位置,正向CkLEA4-1-F所加酶切位点是Sal Ⅰ,反向CkLEA4-1-R所加酶切位点是Sac Ⅰ。
以柠条锦鸡儿cDNA为模板,CkLEA4-1-F和CkLEA4-1-R为引物,用高保真酶Primer STAR(TaKaRa公司)进行PCR扩增。扩增条件:98 ℃预变性3 min;98 ℃变性15 s,58.5 ℃退火30 s,72 ℃延伸1.5 min,72 ℃补充延伸10 min,30个循环。1%琼脂糖凝胶电泳检测扩增产物,切胶后用胶回收试剂盒(GK2043,GENEray公司)进行回收。将胶回收产物连入克隆载体pEASY-Blunt Simple(TransGen公司),热激法转化大肠杆菌感受态Trans5α(TransGen公司),挑取阳性克隆进行菌落PCR验证后将菌液送测序。本试验所用引物(表1)和菌液测序均由上海生工生物工程技术服务有限公司完成。
表1 试验所用引物及序列
Tab.1 Primers used in the study

引物类型Primertype引物名称Primername序列(5'-3')Sequence全长引物CkLEA4-1-FGCgtcgacAGACAGATGATGAGGGACCAAAFull-lengthprimersCkLEA4-1-RGCgagctcCTTAATTATATTTCTGGGCT-GTTCCRT-PCR引物F-CkLEA4-1GTGGACGAAACTTTTGACCGART-PCRprimersR-CkLEA4-1AGCCTTCTCCTTTGCAGCCT内参引物CkEF1αFTGGGTGGGACATTCTCTGATTInternalcontrolprimersCkEF1αRGCACGGTTCACTTCTTCTTAGCAtEF1αFAGAAGGGTGCCAAATGATGAGAtEF1αRGGAGGGAGAGAGAAAGTCACAGA
1.5 CkLEA4-1基因生物信息学分析
CkLEA4-1基因核苷酸序列翻译以及亲水性分析采用DNAMAN软件。利用ExPASy(http://www.expasy.org/proteomics)数据库中ProtParam软件推导氨基酸序列的分子量、理论等电点以及对氨基酸残基数等理化性质进行分析。用NCBI网站GenBank数据库的Blast程序将CkLEA4-1编码的氨基酸序列与其他植物的LEA蛋白进行比对分析,并使用Mega5进行系统进化分析。
1.6 不同胁迫处理CkLEA4-1基因表达分析
用Primer5设计荧光定量引物(表1),使用SYBR Green Ⅱ荧光染料法检测不同胁迫处理下柠条锦鸡儿幼苗LEA基因的转录表达水平,反应体系参照SYBR® Premix Ex TaqTM TaKaRa试剂盒说明书配制,利用LightCycler 480实时荧光定量PCR仪(Roche公司)进行扩增,每个反应重复3次。反应所用内参引物为CkEF1α(表1)。反应体系中含有10 μL SYBR® remix Ex TaqTM,引物各0.4 μL(10 μmol/L),稀释的cDNA模板5 μL,ddH2O 4.2 μL,总体系20 μL。反应程序为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火15 s,72 ℃延伸30 s,40个循环。反应结束后做溶解曲线,用2-ΔΔCt法分析数据。
1.7 植物过表达载体构建
参照质粒小提试剂盒(TIANGEN公司)步骤提取含有目的基因的重组质粒,经内切酶Sal Ⅰ和Sac Ⅰ酶切后,将目的片段插入到由CaMV35S启动子驱动的植物表达载体pCanG-HA中,酶切验证正确后将正确的重组质粒转化农杆菌GV3101,挑取阳性克隆进行PCR鉴定。
1.8 拟南芥遗传转化及纯合体筛选
用浸花法将重组表达载体pCanG-CkLEA4-1转入野生型拟南芥,用卡那霉素(25 mg/L)筛选阳性植株。得到转基因植株T3后取样提取总RNA,反转录为cDNA,通过实时荧光定量PCR检测转基因株系中的基因表达量,具体方法同1.6。
2 结果与分析
2.1 CkLEA4-1基因的克隆及序列分析
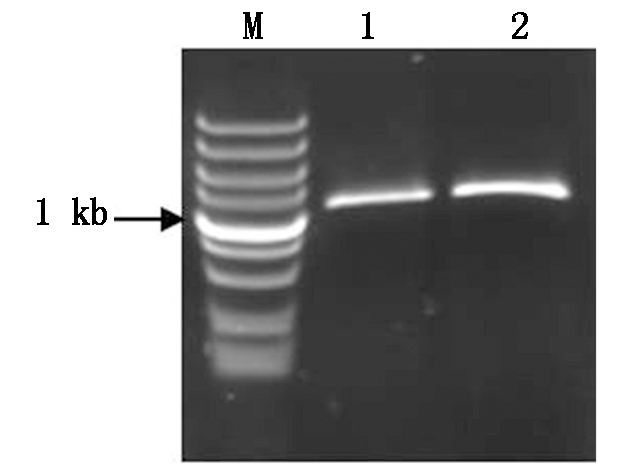
在干旱SSH文库中得到CkLEA4-1基因序列,通过NCBI Blast进行比对后发现该序列具有完整的开放阅读框(ORF),设计基因特异性引物CkLEA4-1-F和CkLEA4-1-R,以柠条锦鸡儿的cDNA为模板,利用高保真酶Prime STAR进行PCR扩增,获得大小约为1 000 bp的片段(图1)。测序结果显示,去除所加保护碱基后,得到的序列长度为1 133 bp(图2),图2中下划线部分是引物及酶切位点。经DNAMAN软件分析,CkLEA4-1基因ORF长1 119 bp,起始密码子为ATG,终止密码子为TAA,共编码373个氨基酸(图2)。
2.2 生物信息学分析
用ExPASy数据库中的ProtParam工具对CkLEA4-1编码的氨基酸序列进行预测,结果显示CkLEA4-1编码的蛋白分子量为40.881 kDa。蛋白质富含丙氨酸(Ala 16.6%)、赖氨酸(Lys 10.7%)、天冬氨酸(Asp 9.7%)、谷氨酸(Glu 8.8%)、丝氨酸(Ser 7.5%),而色氨酸(Trp 0.8%)、半胱氨酸(Cys 0.5%)、脯氨酸(Pro 0.5%)含量较低,该蛋白负电荷氨基酸总数69个,正电荷氨基酸总数55个,是一种酸性蛋白,理论等电点为5.12。
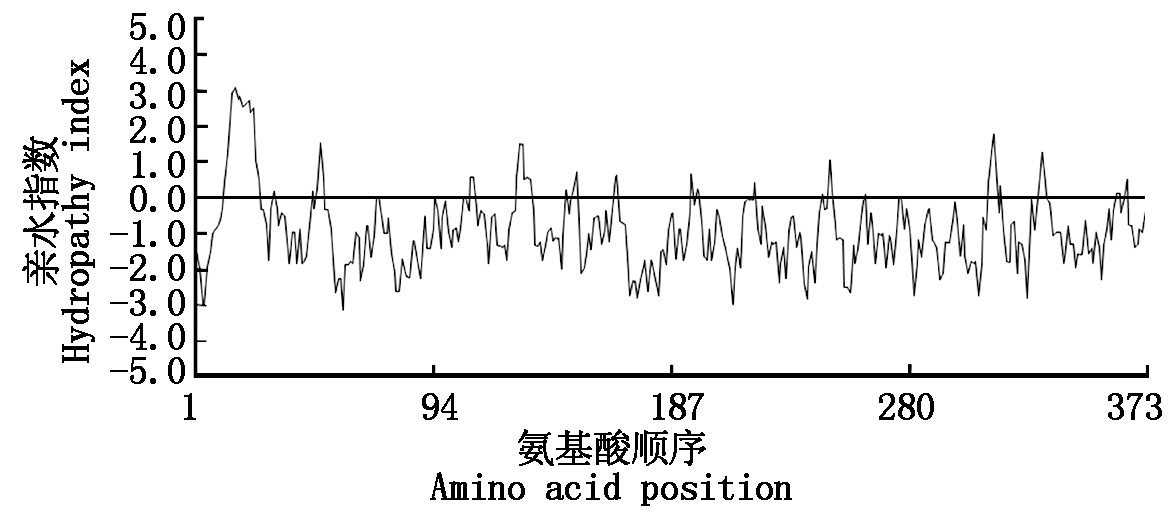
用DNAMAN软件对CkLEA4-1编码的多肽链进行亲水性分析,第20位的亮氨酸(Leu)分值最高为3.044,疏水性最强;第58位的谷氨酸(Glu)分值最低为-2.656,亲水性最强。而且ProtParam程序中该蛋白的平均疏水指数(GRAVY)为-0.923,由此可见该蛋白为亲水蛋白(图3)。
用SOPMA在线软件预测CkLEA4-1蛋白的二级结构,其中292个氨基酸形成α-螺旋,所占比例高达78.28%;47个氨基酸形成无规则卷曲,所占比例为12.60%;18个氨基酸形成延伸链,所占比例为4.83%;16个氨基酸形成β-转角,所占比例为4.29%。
2.3 CkLEA4-1蛋白的系统进化树分析
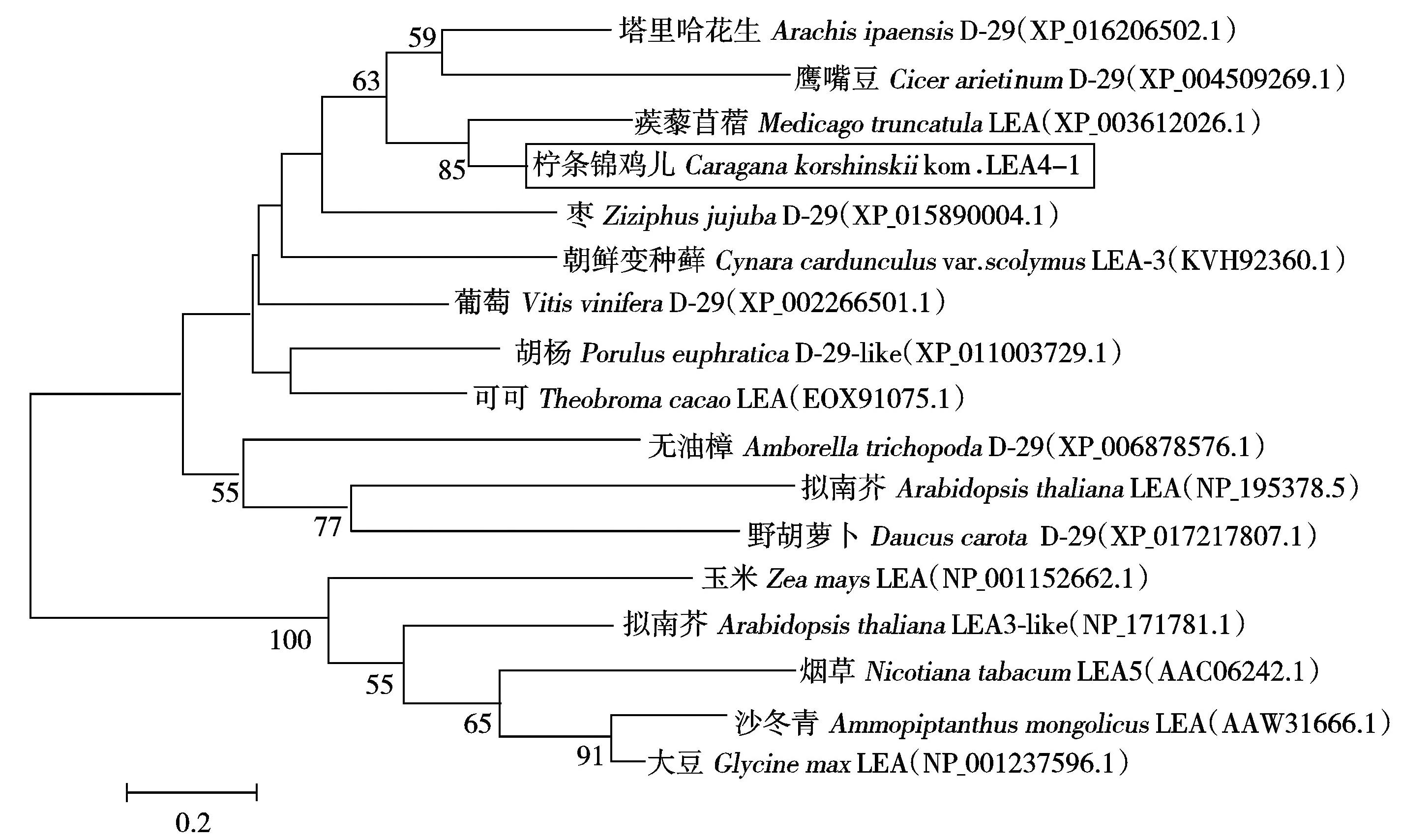
将CkLEA4-1基因编码的氨基酸序列在NCBI上进行Blast比对,发现该LEA蛋白与豆科模式植物蒺藜苜蓿(Medicago truncatula)LEA(XP_003612026.1)的同源性为54%,亲缘关系最近;其次为鹰嘴豆(Cicer arietinum L.)D-29(XP_004509269.1)和塔里哈花生(Arachis ipaensis)D-29(XP_016206502.1),与其他植物中的LEA蛋白,如枣(Ziziphus jujuba)D-29( XP_015890004.1)、朝鲜变种蓟(Cynara cardunculus var.scolymus)LEA-3(KVH92360.1)、葡萄(Vitis vinifera L.)D-29(XP_002266501.1)等的同源性较低,这些序列大部分为第5组LEA蛋白,且第5组LEA蛋白具有物种间同源性低的特点[20]。用MEGA5软件构建系统进化树发现,CkLEA4-1与蒺藜苜蓿LEA(XP_003612026.1)聚类在一起,与同为豆科的鹰嘴豆D-29(XP_004509269.1)亲缘关系也较近(图4),因此,推断CkLEA4-1为第5族LEA蛋白。
2.4 CkLEA4-1基因在不同非生物逆境胁迫下的表达分析
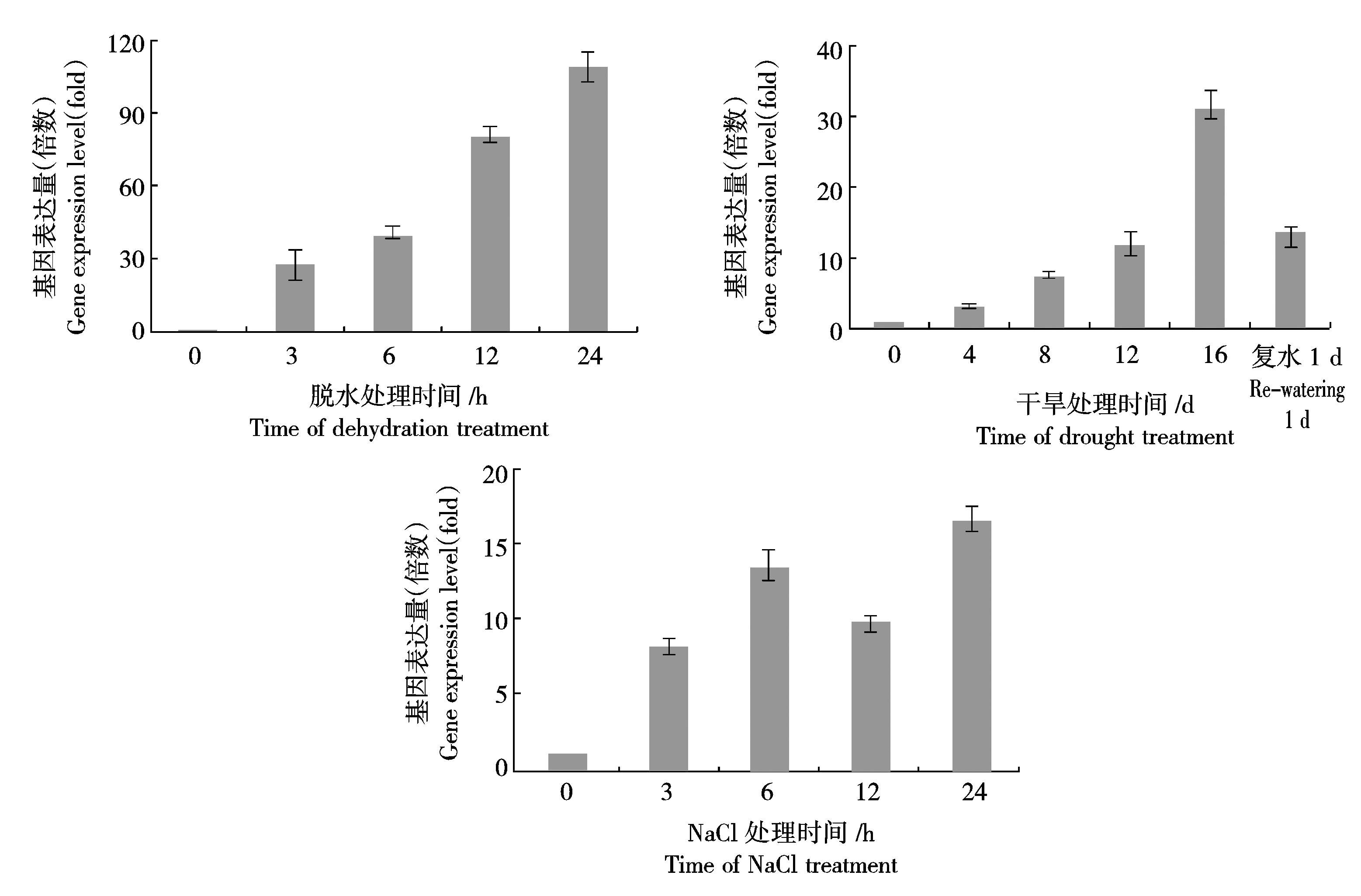
利用荧光定量PCR技术对CkLEA4-1基因在不同胁迫下的表达情况进行分析,结果显示在不同的胁迫条件下CkLEA4-1都被不同程度的诱导表达(图5)。
由图5可以看出,CkLEA4-1对脱水和土壤干旱处理的响应较为明显,脱水处理过程中,CkLEA4-1的表达水平持续上升,24 h达到未处理时的110倍;在土壤干旱处理的过程中,CkLEA4-1的表达水平也持续上升,在16 d时达到最高,为未处理的31倍,并在复水1 d后表达水平又迅速回落;NaCl处理后,CkLEA4-1的表达水平虽没有干旱胁迫下的表达水平高,但在3 h达到未处理时的8倍,并一直保持高水平表达,在24 h达到未处理时的16倍。综上所述,CkLEA4-1在干旱胁迫下可被强烈诱导,对盐胁迫也有一定的响应。
2.5 pCanG-CkLEA4-1植物表达载体的构建
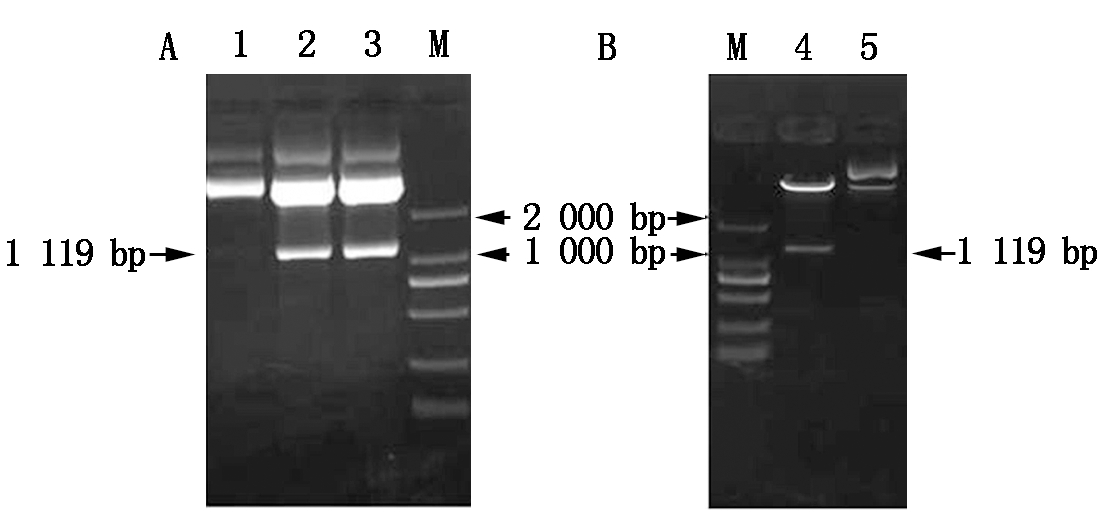
对带有目的基因片段的克隆载体pEASY-CkLEA4-1用Sal Ⅰ和Sac Ⅰ进行双酶切(图6-A),然后将酶切产物连接到线性化的表达载体pCanG-HA中。构建好pCanG-CkLEA4-1重组表达载体后用Sal Ⅰ和Sac Ⅰ双酶切鉴定,能够切出目的片段,说明表达载体构建成功(图6-B)。
A.pEASY-CkLEA4-1酶切结果;B.pCanG-CkLEA4-1酶切鉴定结果;M.DL2000;1,5.质粒对照;2,3.pEASY-CkLEA4-1酶切;4.Sal Ⅰ和Sac Ⅰ酶切鉴定。
A.pEASY-CkLEA4-1enzymes digestion result;B.pCanG-CkLEA4-1 enzymes digestion result;M.DL2000;1,5.Vector control;2,3.pEASY-CkLEA4-1 digestion;4.Digested with Sal Ⅰand Sac Ⅰ.
图6 pCanG-CkLEA4-1表达载体的构建与鉴定
Fig.6 The construction and identification of pCanG-CkLEA4-1 recombinant vector
2.6 转基因纯合体植株鉴定
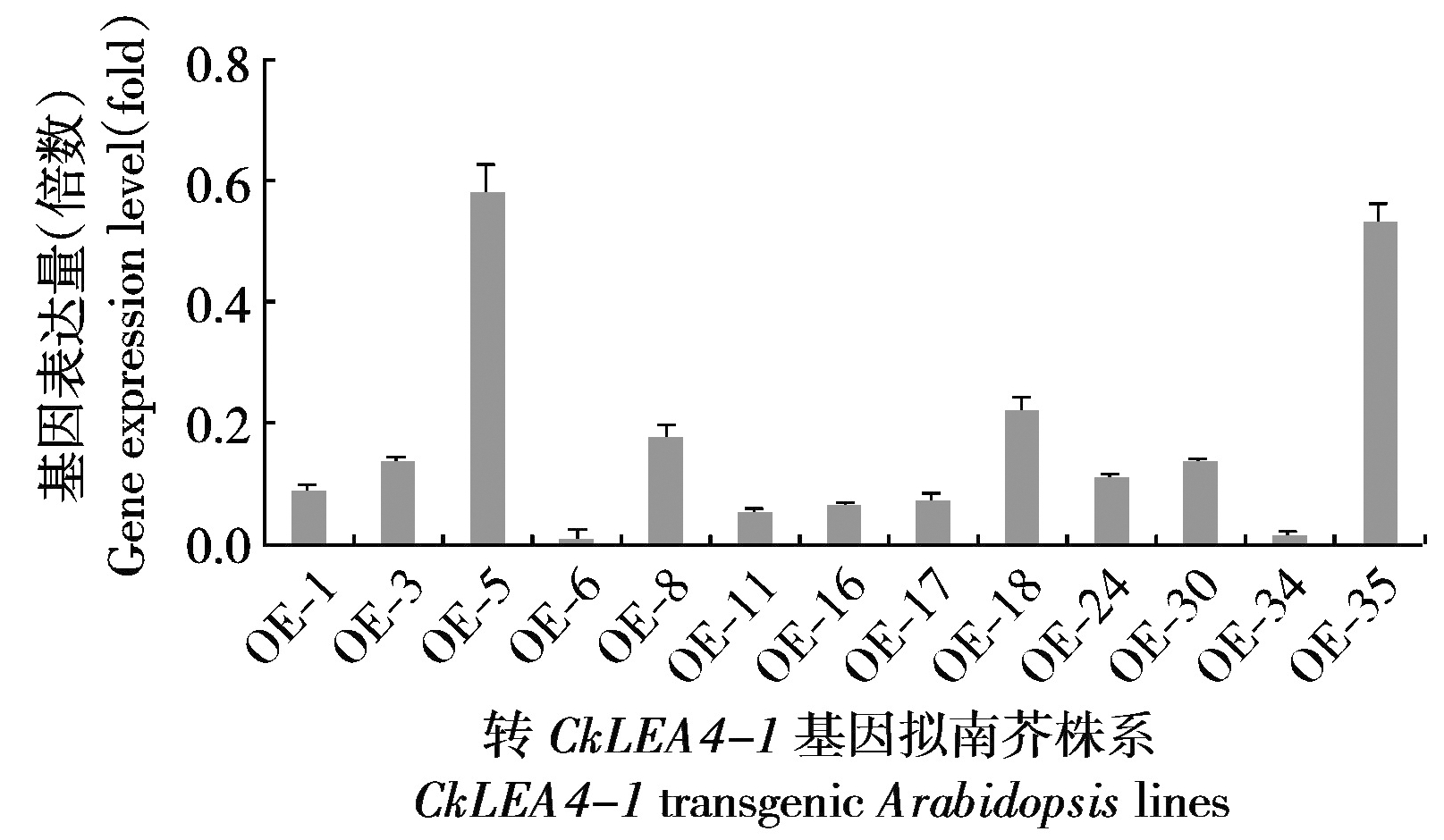
将得到的重组植物表达载体pCanG-CkLEA4-1转入野生型拟南芥,由于pCanG-CkLEA4-1载体带有Kan+抗性,通过卡那霉素筛选得到T3阳性植株13个株系。取T3纯合体转基因拟南芥幼苗的叶片提取总RNA,并反转录为cDNA,通过实时荧光定量PCR检测CkLEA4-1在转基因株系中的相对表达水平(图7)。
3 结论与讨论
LEA蛋白作为一类重要的抗逆蛋白颇受关注,相关研究也日益增多,而柠条锦鸡儿由于具有较强的适应性和抗逆性,已成为中国北方生态环境治理的优选灌木[21],因此,对柠条锦鸡儿LEA基因的研究进行功能分析,不仅可以揭示柠条锦鸡儿抗逆性分子机理,而且可以为抗逆育种提供优良基因。
本试验从杨杞等[19]构建的SSH文库中筛选并克隆得到的柠条锦鸡儿CkLEA4-1基因经NCBI Blast比对后发现,该基因没有明显的保守结构域,比对所得到的同源序列多为其他物种的D-29蛋白,按照Bray等[12]的分类方法D-29蛋白即为5族LEA蛋白,且CkLEA4-1与其他序列的同源性较低,这也符合第5族LEA蛋白间同源性较低的特点[20]。分析其二级结构,发现该蛋白和其他大多数LEA蛋白一样,N端氨基酸残基主要形成α-螺旋,C端氨基酸残基形成无规则卷曲[22]。蛋白结构决定其性质和功能,LEA蛋白富含α-螺旋,在胁迫条件下可能形成高度螺旋折叠,而这样的结构又可以稳定脂膜或功能蛋白,阻止水分大量散失,将外界环境对细胞内代谢的影响降到最低[23]。而在Baker等[24]的研究中发现D29 LEA蛋白中存在由11个氨基酸组成的重复基元序列,此类序列可形成氨基酸盐桥,充实蛋白质结构,提高细胞液中的离子强度,进而使植物抵抗干旱的能力增强或减轻干旱给植物带来的伤害。
LEA蛋白作为一种抗逆蛋白具有多种功能,如大多数LEA蛋白具有稳定细胞膜、清除活性氧自由基、结合金属离子等功能[25]。有研究表明,许多LEA蛋白可以提高植物抗旱、耐盐的能力。Sharma等[26]将一种野花生的第5组C亚组LEA蛋白AdLEA在模式植物烟草中过表达发现,其可通过提高植物叶绿素含量,降低脂质过氧化反应来提高植物对干旱、盐胁迫以及氧胁迫的耐受性。Boucher等[27]发现苜蓿的第5组 LEA蛋白MtPM25在干旱期间可以起到保护作用并在修复机制中也占有重要位置。Amara等[28]发现在渗透胁迫条件下,将玉米基因在玉米中过表达后发现,转基因株系幼苗的叶片和根系比野生型的大,相对含水量也更高,而且在受到氧胁迫时转基因株系叶绿素损失降低、产生的丙二醛更少。Liu等[29]发现低温、渗透胁迫、氧胁迫及一些分子信号如ABA、SA、MeJA可诱导ZmLEA5C的表达,然而高盐却可以明显抑制ZmLEA5C的转录,这与其他LEA蛋白不同。在烟草(Nicotiana tabacum L.)和酵母(Yeast)(GS115)中过表达ZmLEA5C可以提高其对渗透胁迫和低温胁迫的耐受力。Mowla等[30]将拟南芥的AtLEA5转入对氧敏感的酵母突变株Δyap1发现,Δyap1的氧胁迫耐受性提高。AtLEA5不同于其他典型的LEA基因,并不在种子中表达,且在短日照条件下生长的拟南芥,AtLEA5转录水平表现出一定的昼夜节律性,在光照条件下受到抑制而在黑暗条件下富集。在拟南芥中过表达AtLEA5可使植物根长增长,生物量增大。
CkLEA4-1是第5组LEA蛋白,该组LEA蛋白受干旱、盐、紫外等胁迫诱导[31],因此推测其可能与柠条锦鸡儿抗旱性等密切相关。为了验证这一设想,分别检测了CkLEA4-1在干旱等不同逆境胁迫下的表达情况,结果显示CkLEA4-1在干旱、高盐等胁迫下都被不同程度地诱导。其中对干旱胁迫的响应最为显著,在0~16 d CkLEA4-1的表达量持续升高,并在16 d达到峰值,达到未处理水平的30多倍,但re-1 d后出现明显回落,暗示CkLEA4-1在植物对干旱的抵抗过程中可能发挥着重要作用。而在盐胁迫条件下,CkLEA4-1的表达量总体呈上升趋势,胁迫处理6 h的表达量达到了未处理时的13.6倍,之后在胁迫12 h表达水平略有下降,为未处理时的9.8倍,但仍较胁迫3 h时的表达量高,并且在胁迫24 h CkLEA4-1的表达量回升,且达到未处理时的16.8倍,这一趋势与小麦的TaLEA4在盐胁迫条件下的趋势相同[32-33]。因此,CkLEA4-1在受高盐胁迫过程中也发挥一定作用。为了进一步揭示该基因在柠条锦鸡儿抵抗干旱和高盐胁迫的功能,笔者构建了该基因的双元表达载体并在拟南芥中过表达,现已得到纯合体株系。而在检测转基因纯合体株系中CkLEA4-1基因表达量时发现,各株系间CkLEA4-1的表达量存在差异,其中表达量最高的3个株系分别为OE-5、OE-35和OE-18。造成这种株系差异的因素主要有2个,分别为位置效应和转基因沉默,而造成本研究株系差异的主要原因可能是位置效应[34]。位置效应是由于外源基因随机整合到宿主染色体,使目的基因的表达受到不同的染色质结构和表达调控元件的影响[35-36]。因此有的株系CkLEA4-1基因表达量较高而有个别株系CkLEA4-1基因几乎不表达。综上所述,在已得到的纯合体中选表达量最高的3个株系OE-5、OE-35和OE-18进行后续的抗逆性研究。
参考文献:
[1] 高 宇,张晓霞,李 彬,等.国内外旱作农业研究进展[J].北方农业学报,2016,44(1):102-108.
[2] Bartels D,Sunkar R.Drought and salt tolerance in plants[J].Critical Reviews in Plant Sciences,2005,24(1):23-58.
[3] Dure L,Greenway S C,Galau G A.Developmental biochemistry of cottonseed embryogenesis and germination:changing messenger ribonucleic acid populations as shown by in vitro and in vivo protein synthesis[J].Biochemistry,1981,20(14):4162-4168.
[4] Hundertmark M,Hincha D K.LEA(Late Embryogenesis Abundant)proteins and their encoding genes in Arabidopsis thaliana[J].Bmc Genomics,2008,9(9):1-22.
[5] Makarova K S,Aravind L,Wolf Y I,et al.Genome of the extremely radiation-resistant bacterium Deinococcus radiodurans viewed from the perspective of comparative genomics[J].Microbiology and Molecular Biology Reviews,2001,65(1):44.
[6] Tanaka S,Ikeda K,Miyasaka H.Isolation of a new member of group 3 late embryogenesis abundant protein gene from a halotolerant green alga by a functional expression screening with cyanobacterial cells[J].FEMS Microbiology Letters,2004,236(1):41-45.
[7] Browne J,Tunnacliffe A,Burnell A.Plant desiccation gene found in a nematode[J].Nature,2002,416(6876):38-38.
[8] Shih M D,Hoekstra F A,Hsing Y C.Late embryogenesis abundant proteins[J].Advances in Botanical Research,2008,48(2008):211-255.
[9] 白永琴,杨青川.LEA蛋白研究进展[J].生物技术通报,2009(9):1-7.
[10] Iii L D,Crouch M,Harada J,et al.Common amino acid sequence domains among the LEA proteins of higher plants[J].Plant Molecular Biology,1989,12(5):475-486.
[11] Dure L.A repeating 11-mer amino acid motif and plant desiccation[J].The Plant Journal :for Cell and Molecular Biology,1993,3(3):363-369.
[12] Bray E A.Molecular responses to water deficit[J].Plant Physiology,1994,103(4):1035-1040.
[13] 马其东.柠条锦鸡儿[N].中国花卉报,2003-05-20(007).
[14] 吴高升,赵书元,刘 忠.内蒙古柠条种类及利用的调查研究[J].中国草原,1986(1):34-40.
[15] 姜 超,刘 璋,刘根科.不同杀虫剂防除柠条豆象田间药效试验[J].北方农业学报,2016,44(2):60-62.
[16] 杨 杞,尹佳佳,王 颖,等.柠条锦鸡儿CkLEA1基因克隆及表达分析[J].中国生物工程杂志,2013,33(5):93-99.
[17] 张燕娜,于秀敏,杨 杞,等.柠条锦鸡儿CkLEA4基因克隆及表达分析[J].西北植物学报,2014,34(1):47-53.
[18] Wang X E,Chen X F,Liu Y,et al.CkDREB gene in Caragana korshinskii is involved in the regulation of stress response to multiple abiotic stresses as an AP2/EREBP transcription factor[J].Molecular Biology Reports,2011,38(4):2801-2811.
[19] 杨 杞,张 涛,王 颖,等.干旱胁迫下柠条锦鸡儿叶片SSH文库构建及CkWRKY1基因克隆[J].林业科学,2013,49(7):62-68.
[20] Tolleter D,Jaquinod M,Mangavel C,et al.Structure and function of a mitochondrial late embryogenesis abundant(LEA)protein are revealed by desiccation[J].2007,19(5):1580-1589.
[21] 王 赞,李 源,陆景伟,等.中国柠条锦鸡儿资源表型多样性研究[J].华北农学报,2008,23(S1):59-61.
[22] Battaglia M,Olvera-Carrillo Y,Garciarrubio A,et al.The enigmatic LEA proteins and other hydrophilins[J].Plant Physiology,2008,148(1):6-24.
[23] 赵晓鑫,刘美芹,师 静,等.沙冬青AmLEA5基因的生物信息学分析及非生物胁迫下的表达模式[J].植物遗传资源学报,2013,14(3):492-500.
[24] Baker J,Van Dennsteele C,Dure L.Sequence and characterization of 6 Lea proteins and their genes from cotton[J].Plant Molecular Biology,1988,11(3):277-291.
[25] Kosova K,Vitamvas P,Prasil I T.Expression of dehydrins in wheat and barley under different temperatures[J].Plant Science,2011,180(1,SI):46-52.
[26] Sharma A,Kumar D,Kumar S,et al.Ectopic expression of an atypical hydrophobic group 5 LEA protein from wild peanut,arachis diogoi confers abiotic stress tolerance in tobacco[J].PLoS One,2016,11(3):e0150609.
[27] Boucher V,Buitink J,Xiao D L,et al.MtPM25 is an atypical hydrophobic late embryogenesis-abundant protein that dissociates cold and desiccation-aggregated proteins[J].Plant,Cell & Environment,2010,33(3):418-430.
[28] Amara I,Capellades M,Ludevid M D,et al.Enhanced water stress tolerance of transgenic maize plants over-expressing LEA Rab28,gene[J].Journal of Plant Physiology,2013,170(9):864-873.
[29] Liu Y,Wang L,Jiang S S,et al.Group 5 LEA protein,ZmLEA5C,enhance tolerance to osmotic and low temperature stresses in transgenic tobacco and yeast[J].Plant Physiology and Biochemistry,2014,84:22-31.
[30] Mowla S B,Cuypers A,Driscoll S P,et al.Yeast complementation reveals a role for an Arabidopsis thaliana late embryogenesis abundant(LEA)-like protein in oxidative stress tolerance[J].Plant Journal,2006,48(5):743-756.
[31] 刘 洋,邢 鑫,李德金.LEA蛋白的分类与功能研究进展[J].生物技术通报,2011(8):36-43.
[32] 刘露露,陈 雷,张春艳,等.两个小麦LEA基因的特征及其对非生物胁迫的响应[J].中国农业科学,2014,47(19):3736-3745.
[33] 张胜博,刘景辉,李立军,等.燕麦AsNAC1耐盐基因的克隆及初步验证[J].北方农业学报,2016,44(5):1-7.
[34] 孔莹莹.利用新型转基因载体消除植物转基因中的同源共抑制现象[D].杭州:浙江大学,2012.
[35] She W J,Lin W Q,Zhu Y B,et al.The gypsy insulator of drosophila melanogaster,together with its binding protein suppressor of hairy-wing,facilitate high and precise expression of transgenes in Arabidopsis thaliana[J].Genetics,2010,185(4):1141-1150.
[36] Singer S D,Liu Z R,Cox K D.Minimizing the unpredictability of transgene expression in plants:the role of genetic insulators[J].Plant Cell Reports,2012,31(1):13-25.
Clone and Expression Analysis of CkLEA4-1 from Caragana korshinskii Kom.
HUA Lubin,YU Xiumin,YANG Qi,WANG Ruigang,BAO Lide
(College of Life Sciences,Inner Mongolia Agricultural University,Huhhot 010018,China)
Abstract:In order to research the biological function of the LEA protein,a gene encoding LEA protein from the suppression subtractive hybridization library ofCaragana korshinskii Kom.was screened and cloned by using RT-PCR method.The open reading frame(ORF)of the gene length was 1 119 bp,encoded a protein of 373 amino acids,named CkLEA4-1.Based on sequence alignment and phylogenetic analysis,it was inferred that CkLEA4-1 belonged to group 5 late embryogenesis abundant protein(LEA).The expression of CkLEA4-1 under high salt and drought conditions were detected by Real-time quantitative PCR,the results showed that CkLEA4-1 could be induced at different levels,which suggested that the gene might be involved in stress response of Caragana korshinskii Kom..The over-expression vector pCanG-CkLEA4-1 of CkLEA4-1 was constructed successfully,and the transgenic homozygous lines were obtained,which provided materials for the further study of CkLEA4-1 gene function in Caragana korshinskii Kom..
Key words:Caragana korshinskii Kom.;LEA;Gene cloning;Expression analysis
收稿日期:2016-10-14
基金项目:国家自然科学基金项目(31560199;31360169);内蒙古自治区科技创新团队(201503004);内蒙古自治区草原英才团队
作者简介:滑璐玢(1990-),女,山西阳高人,在读硕士,主要从事植物生物化学与分子生物学研究。
通讯作者:宝力德(1961-),男,内蒙古西乌珠穆沁人,副教授,博士,主要从事生物化学与分子生物学研究。
中图分类号:S793.3
文献标识码:A
文章编号:1000-7091(2017)02-0096-08
doi:10.7668/hbnxb.2017.02.015