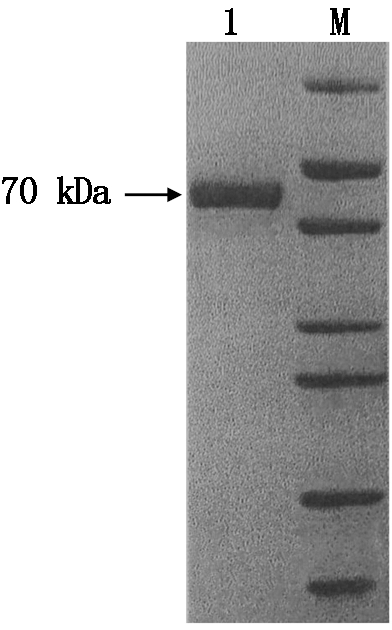
图1 E蛋白纯化后SDS-PAGE检测
Fig.1 SDS-PAGE analysis of E protein
摘要:为了研究坦布苏病毒囊膜蛋白(E蛋白)的免疫原性,利用大肠杆菌表达系统高效表达坦布苏病毒囊膜蛋白(E蛋白)并对其诱导小鼠免疫应答进行了研究。结果表明,E蛋白免疫BALB/c小鼠后,免疫组小鼠血清中抗体效价均可达1∶51 200以上;同时,E蛋白可显著诱导血清中细胞因子IL-2、TNF-α和IFN-γ的表达,免疫组小鼠血清中IL-2、TNF-α的含量均极显著高于对照组(P <0.01),IFN-γ含量则显著高于对照组(P<0.05);此外,与对照组相比,E蛋白还可极显著刺激小鼠脾脏淋巴细胞的增殖,上述结果表明,E蛋白免疫后,小鼠机体可产生显著的体液免疫和细胞免疫反应。攻毒保护性试验结果显示,攻毒后,经荧光定量RT-PCR检测,E蛋白免疫组小鼠脑、肝脏、脾脏、卵巢、肾脏中坦布苏病毒载量均显著低于对照组,表明免疫E蛋白可有效抑制坦布苏病毒在小鼠各个组织中的增殖。结果表明,大肠杆菌表达的坦布苏病毒E蛋白可作为坦布苏病毒亚单位疫苗的候选抗原,为进一步预防和控制坦布苏病毒病奠定理论基础。
关键词:坦布苏病毒;囊膜蛋白;免疫应答;亚单位疫苗
2010年4月以来,在我国福建、山东、江苏、北京等省市的鸭鹅中暴发了一种新型疫病,其主要特征为产蛋量骤降,给鸭鹅养殖业造成了重大经济损失。经过系统的实验室诊断和病原分离,研究者确定该病的病原为黄病毒科、黄病毒属的坦布苏病毒[1-2]。除产蛋量骤降外,坦布苏病毒感染后鸭鹅还可出现食欲急剧减退、生长缓慢和瘫痪等临床症状[3]。坦布苏病毒在感染鸭群内的发病率几乎为100%,死亡率为5%~28%,给鸭鹅养殖业造成了重大经济损失[4]。目前,既无针对该病的特效治疗方法,也没有可临床应用的疫苗。因此,研制用于防控坦布苏病毒感染的特效疫苗迫在眉睫。
坦布苏病毒属于黄病毒科黄病毒属,该属病毒主要包括登革病毒、西尼罗病毒、乙型脑炎病毒和蜱传脑炎病毒等,是一种带有囊膜的单股正链RNA病毒,病毒基因组大小约为11 kb,仅含有一个长的开放阅读框(ORF),可以直接作为mRNA翻译出一条长链前体蛋白[5]。前体蛋白随后在蛋白酶的作用下被切割成10种成熟蛋白,包括3种结构蛋白(衣壳蛋白C、膜蛋白prM/M和囊膜蛋白)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[6-8]。其中囊膜蛋白(E蛋白)是黄病毒表面主要的结构蛋白,其主要功能是介导病毒吸附宿主细胞、促进病毒粒子与宿主细胞膜融合以及参与病毒的组装。此外,E蛋白含有多种抗原表位,可作为黄病毒主要的抗原成分,诱导机体产生中和抗体和保护性免疫应答[9-10]。对E蛋白进行深入研究,将有助于揭示黄病毒的致病机制,为诊断黄病毒病、设计黄病毒特异性抗病毒药物及研制疫苗提供依据。目前,针对黄病毒属其他成员E蛋白的研究表明,大肠杆菌或昆虫细胞表达的E蛋白可在小鼠、兔和猴体内诱导高水平中和抗体,成为研制亚单位疫苗最有效的候选抗原[11]。
坦布苏病毒病属于新发疫病,给鸭鹅养殖业造成巨大经济损失,严重威胁我国水禽养殖业的健康发展。但是作为一种新发疫病,尚无有效的防控措施。截至目前,尚未有可应用的商业化坦布苏病毒疫苗。因此,研制适用于鸭和鹅的坦布苏病毒疫苗迫在眉睫。本研究中利用大肠杆菌表达系统获得重组坦布苏病毒E蛋白,纯化后免疫小鼠,评价了其作为亚单位疫苗抵御坦布苏病毒感染的潜在应用价值。
1.1 试验材料
坦布苏病毒JS804株、表达E蛋白的重组大肠杆菌均由江苏省农业科学院兽医研究所禽病与生物兽药研究室保存[12];健康4周龄BALB/c小鼠购自扬州大学比较医学中心。
1.2 主要试剂
High-Affinity Ni-NTA Resin试剂盒购自Novagen公司;抗His标签抗体购自上海碧云天生物技术有限公司;QuantiNova SYBR GREEN PCR Kit购自QIAGEN公司;液体病毒DNA/RNA抽提试剂盒购自Axygen公司;RNase抑制剂、AMV反转录酶购自大连宝生物有限公司;小鼠细胞因子IL-2、TNF-α、IFN-γ ELISA检测试剂盒购自上海联硕生物科技有限公司;小鼠脾脏淋巴细胞分离液购自天津灏洋生物制品科技有限公司;ConA购自Sigma公司;CCK-8检测试剂盒购自Dojindo公司;根据GenBank中登录的坦布苏病毒JS804株(登录号:JF895923)E基因序列,设计特异性引物用于荧光定量PCR检测,上游引物为E-F:5′-GTGAGATCTTACTGCTATGAG-3′,下游引物为E-R:5′-ACTTGGCACATGTCTGTATGC-3′;以GAPDH为内参,上游引物为GAPDHF:5′-GGCAAGTTCAAAGGCACAGTC-3′,下游引物为GAPDHR:5′-CACCAGCATCACCCCATTT-3′,以上引物由南京金斯瑞生物有限公司合成。
1.3 重组E蛋白的表达及纯化
重组E蛋白的诱导表达及包涵体的纯化参考文献[12]进行操作。纯化的包涵体溶解于8 mol/L尿素中,12 000 r/min离心10 min,取上清。4 ℃下进行透析复性,透析液依次为6,4,2 mol/L尿素,最后为PBS缓冲液,每8 h 更换1 次透析液。复性结束后将蛋白参照Novagen公司High-Affinity Ni-NTA Resin试剂盒说明书进行蛋白纯化。
1.4 纯化E蛋白的Western Blot鉴定
取回收蛋白质样品加2×SDS凝胶上样缓冲液煮沸处理5 min后,进行12%的SDS-PAGE检测,以鉴定蛋白纯度。SDS-PAGE分离后,利用湿法将目的蛋白转印至硝酸纤维(NC)膜上,转印电压为70 V,时间为1 h。取转印好的NC膜置于5% BSA中37 ℃ 封闭2 h,用TBST(0.05% Tween-20)洗涤后加入His标签单抗于4 ℃ 过夜。然后用TBST(0.05% Tween-20)洗涤,加入辣根过氧化物酶标记的羊抗鼠IgG 于37 ℃ 孵育1 h。用TBST(0.05% Tween-20)洗涤后DAB显色。
1.5 免疫方案
将4周龄BALB/c小鼠随机分为2组,其中免疫组以纯化的E蛋白为抗原,与弗式完全佐剂等体积混合,乳化后皮下多点注射,每只免疫70 μg。将纯化的E蛋白与弗氏不完全佐剂等体积混合,于初次免疫后每隔7 d进行加强免疫,每只免疫70 μg,共进行2次加强免疫。对照组仅免疫同等体积的PBS,其余操作相同。最后一次免疫后7 d断尾采血,-20 ℃保存备用。
1.6 ELISA测定抗体效价
利用纯化的E蛋白包被ELISA 板并置于4 ℃过夜。用PBST缓冲液洗涤3 次,每孔加入100 μL 梯度稀释的小鼠血清,37 ℃反应1 h。用PBST 缓冲液洗涤3次,每孔加入1∶10 000稀释的HRP标记的羊抗鼠IgG 100 μL,37 ℃ 作用1 h。用PBST 缓冲液洗涤3次,每孔加入100 μL TMB底物,避光显色15 min。每孔加入50 μL 2 mol/L H2SO4终止反应,于450 nm波长下读取每孔的OD值。
1.7 细胞因子检测
将采集的小鼠血清分别按照IL-2、TNF-α、IFN-γ ELISA检测试剂盒的说明书进行稀释并检测相应细胞因子的含量。
1.8 小鼠脾脏淋巴细胞增殖试验
最后一次免疫后7 d将小鼠断颈处死,于75%酒精中浸泡10 min,腹部朝上,四肢固定于无菌解剖板上;无菌摘取脾脏,在RPMI 1640基本培养基中洗涤数次,用镊子去除附着的结缔组织。无菌微孔滤网置于新鲜RPMI 1640基本培养基中,将处理好的脾脏放在微孔滤网上,用研磨棒轻磨,将脾脏制成单细胞悬液,按照小鼠脾脏淋巴细胞分离液的说明书进行操作,收集淋巴细胞。PBS洗涤2次,用含有10%胎牛血清的RPMI 1640培养液将淋巴细胞稀释至1×106 个/mL,接种于96孔板中。阳性对照孔加入终浓度为5 μg/mL的淋巴细胞丝裂原ConA,空白对照孔为等体积的RPMI 1640培养液。细胞在37 oC 、5% CO2的条件下培养44 h,随后按照说明书每孔加入CCK-8,再在相同条件下培养4 h,450 nm波长下读取OD值,计算淋巴细胞增殖指数SI=(OD样品-OD空白对照)/(OD阳性对照-OD空白对照)。
1.9 攻毒保护试验
20只4周龄BALB/c小鼠随机分为2组,即对照组和免疫组。按照1.5中所述免疫程序进行免疫。最后一次免疫后7 d进行攻毒,每只小鼠肌肉接种103 TCID50坦布苏病毒。攻毒后10 d,剖杀全部小鼠,取脑、肝脏、脾脏、卵巢、肾脏,用荧光定量RT-PCR检测坦布苏病毒核酸含量。荧光定量RT-PCR检测以GAPDH为内参,采用相对定量法(ΔΔCT)。ΔΔCT=(检测样品CTE基因-检测样品CTGAPDH)-(对照组CTE基因-对照组CTGAPDH)。
2.1 E蛋白纯化和鉴定
经SDS-PAGE分离和Western Blot鉴定显示,纯化后蛋白仅在70 kDa出现单一条带,与预期蛋白的大小一致,蛋白纯化获得预期效果(图1,2)。

图1 E蛋白纯化后SDS-PAGE检测
Fig.1 SDS-PAGE analysis of E protein
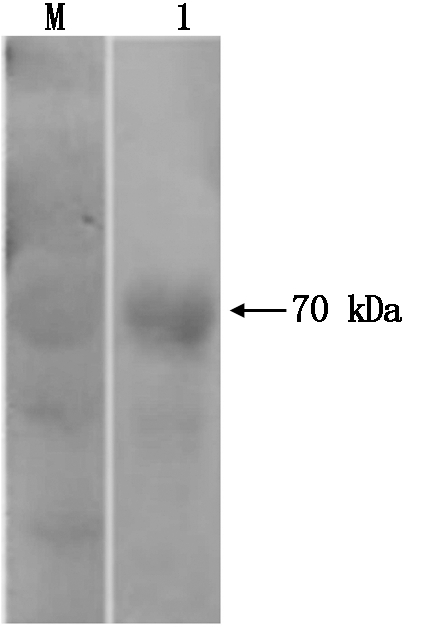
图2 E蛋白纯化后的Western Blot鉴定
Fig.2 Western Blot identification of E protein
2.2 ELISA测定小鼠血清效价
纯化的E蛋白免疫BALB/c小鼠,利用间接ELISA方法检测小鼠血清中特异性抗体水平。结果显示,免疫组小鼠血清中抗体效价均可达1∶51 200以上,表明E蛋白具有良好的抗原性,可诱导机体产生特异性免疫反应。
2.3 细胞因子的检测
对所有小鼠血清中细胞因子IL-2、TNF-α和IFN-γ含量的检测结果显示,E蛋白免疫组小鼠血清中IL-2含量为(6 428.69±309.91) ng/L,极显著高于对照组((5 783.19±230.34)ng/L,P<0.01),IFN-γ的含量为(4 216.27±209.81) ng/L,显著高于对照组((4 049.61±161.98) ng/L,P< 0.05)。3种细胞因子中,TNF-α的含量最低,与对照组(775.82±29.31) ng/L相比,E蛋白免疫组的含量达(930.15±40.51) ng/L,两组之间呈现极显著性差异(P<0.01)。上述结果表明E蛋白可有效诱导小鼠体内的细胞免疫反应(图3)。
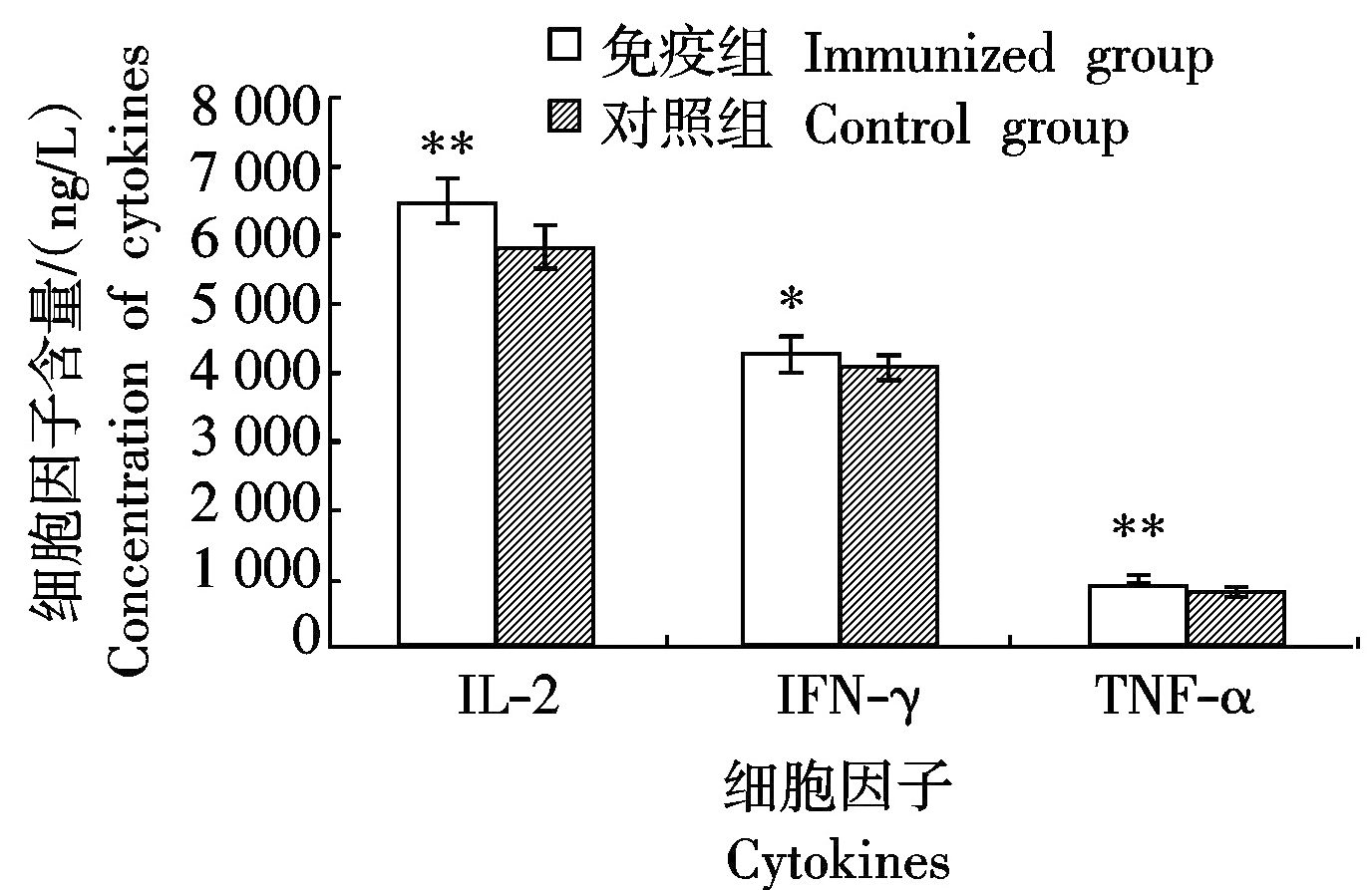
*和**分别表示差异显著(P<0.05)和极显著(P<0.01)。图4-5同。
*and ** indicate significant difference at the 0.05 level and 0.01 level,respectively.The same as
Fig.4-5.
图3 小鼠血清中细胞因子的检测
Fig.3 Cytokine analysis of murine sera
2.4 脾脏淋巴细胞增殖试验
脾脏中淋巴细胞增殖主要与细胞免疫相关。为了明确E蛋白在诱导细胞免疫中的作用,本研究进行了脾脏淋巴细胞增殖试验(图4)。与对照组相比,E蛋白免疫组小鼠脾脏淋巴细胞增殖反应极显著增强(P<0.01)。
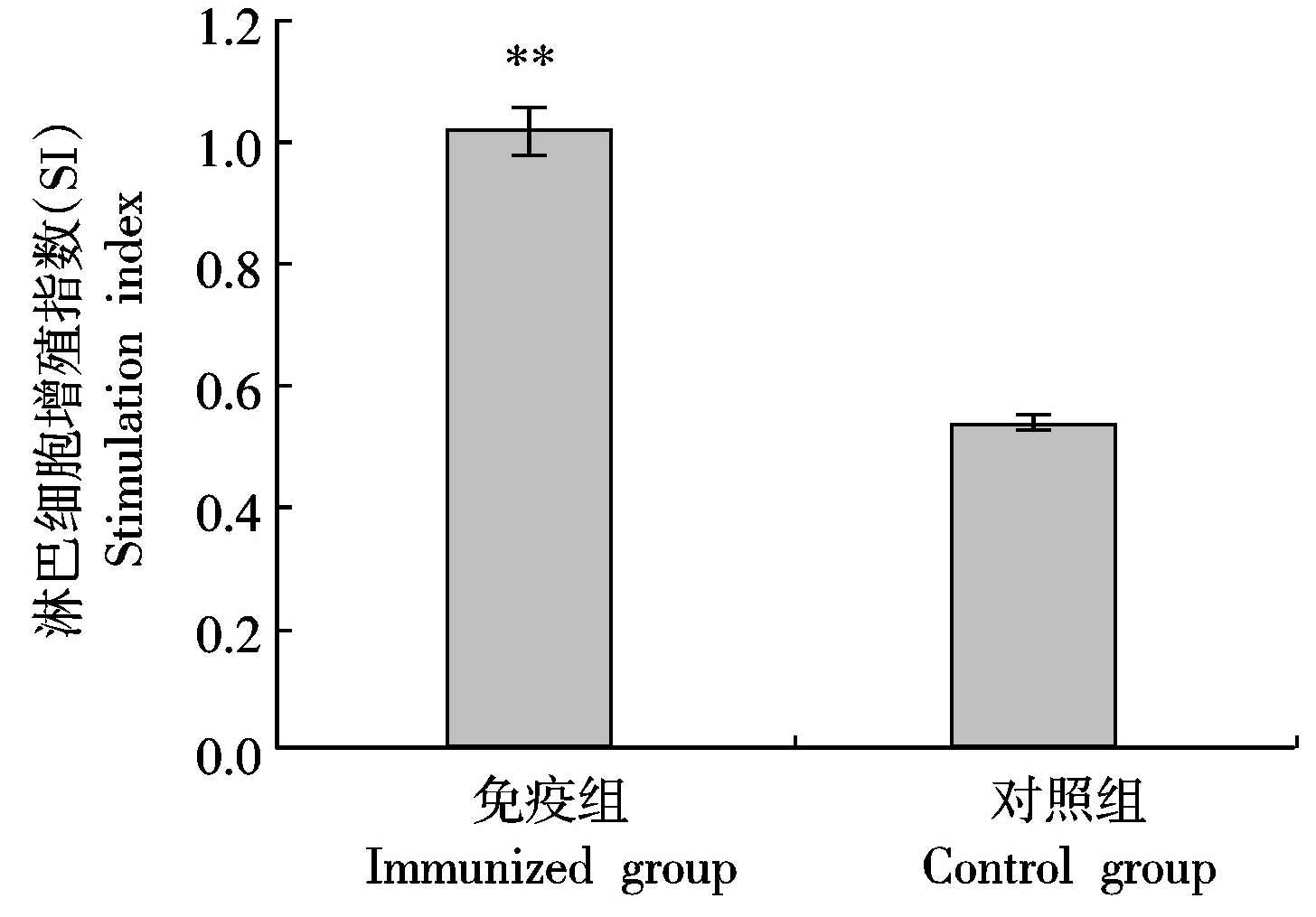
图4 小鼠脾脏淋巴细胞增殖试验
Fig.4 Proliferation of mouse spleen lymphocytes
2.5 攻毒保护性试验
攻毒后第10天,所有小鼠剖杀,取脑、肝脏、脾脏、卵巢、肾脏,用荧光定量RT-PCR检测坦布苏病毒核酸含量,采用相对定量法进行分析。结果显示,E蛋白免疫组小鼠脑、肝脏、脾脏、卵巢、肾脏组织中坦布苏病毒载量均显著低于对照组(P<0.05,图5)。
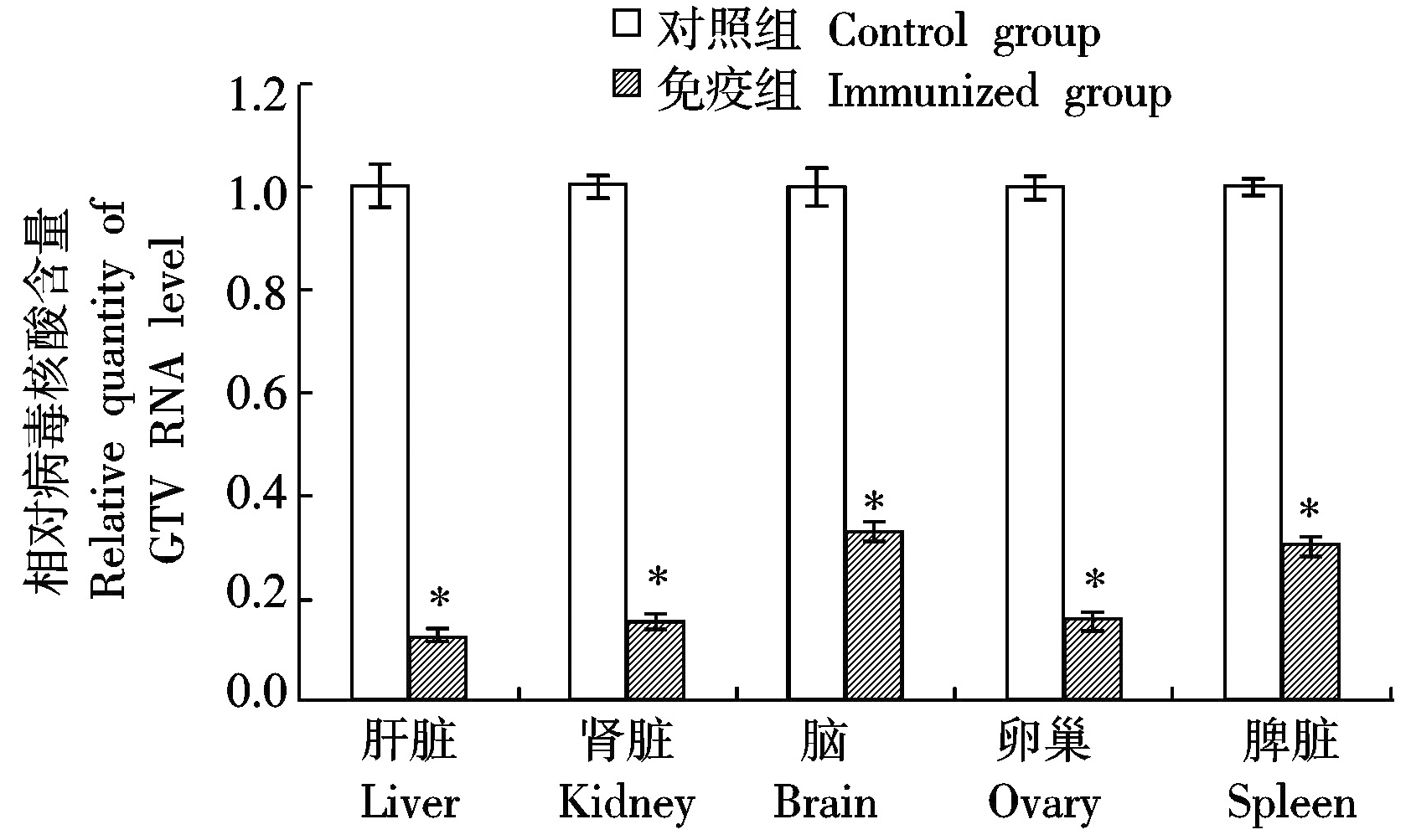
图5 小鼠攻毒后组织中病毒含量检测
Fig.5 Detection of virus nucleic acidin mice tissues after challenge
坦布苏病毒在我国主要鸭鹅养殖地区大面积暴发和快速流行造成了严重的经济损失。除鸭和鹅以外,坦布苏病毒还可以感染其他禽类,包括鸡和麻雀[13-14]。与黄病毒属其他病毒类似,坦布苏病毒对哺乳动物健康具有潜在的威胁,包括人类[15-17]。截至目前,坦布苏病毒已在我国广大地区流行,但是对其还没有有效的防控措施。
之前的研究表明,体液免疫和细胞免疫在防止黄病毒感染中共同发挥作用[18]。细胞免疫反应主要负责清除宿主中被病毒感染的细胞并产生多种促炎症反应细胞因子,如IFN和TNF。这些细胞因子在细胞培养和动物模型中被证实可通过阻止病毒感染性RNA的翻译和复制抑制黄病毒感染[19-20]。本研究中,与对照组相比,E蛋白免疫组小鼠体内细胞因子水平(IL-2、IFN-γ和TNF-α)增高,淋巴细胞增殖刺激指数极显著升高,表明E蛋白可有效刺激小鼠体内淋巴细胞免疫反应。此外,免疫组小鼠血清中特异性抗体的效价均可达1∶51 200以上。上述结果说明,E蛋白在小鼠体内可同时诱导显著的细胞免疫和体液免疫。本研究通过攻毒保护试验进一步研究了E蛋白的免疫保护性,结果显示,E蛋白免疫组小鼠组织中坦布苏病毒核酸含量显著低于对照组(P<0.05),表明在不需要免疫任何病毒粒子的情况下,仅免疫E蛋白即可诱导小鼠产生保护性免疫应答,抵抗坦布苏病毒的攻击。
综上所述,E蛋白免疫后可诱导显著的体液免疫和细胞免疫反应,保护小鼠免受坦布苏病毒的攻击,为基于E蛋白的坦布苏病毒重组亚单位疫苗的研制提供了理论支持。
参考文献:
[1] Su J, Li S, Hu X, et al. Duck egg-drop syndrome caused by BYD virus, a new Tembusu-related flavivirus[J]. PLoS One, 2011, 6(3):e18106.
[2] Huang X, Han K, Zhao D, et al. Identification and molecular characterization of a novel Flavivirus isolated from geese in China[J]. Research in Veterinary Science, 2013, 94(3):774-780.
[3] Yan P, Zhao Y, Zhang X, et al. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China[J]. Virology, 2011, 417(1):1-8.
[4] Niu H M, Huang X M, Han K K, et al. Development of double antibody sandwich ELISA for detection of duck or goose flavivirus[J]. Journal of Integrative Agriculture, 2013, 12(9):1638-1643.
[5] Zou G, Puig-Basagoiti F, Zhang B, et al. A single-amino acid substitution in West Nile virus 2K peptide between NS4A and NS4B confers resistance to lycorine, a flavivirus inhibitor[J]. Virology, 2009, 384(1):242-252.
[6] Bai X, Lü R, Liu C, et al. Molecular characterization of a duck Tembusu virus from China[J]. Virus Genes, 2013, 47(3):478-482.
[7] Lindenbach B, Rice C. Molecular biology of flaviviruses[J]. Advances in Virus Research, 2003, 59(7):23-61.
[8] Mukhopadhyay S, Kuhn R, Rossmann M. A structural perspective of the flavivirus life cycle[J]. Nature Reviews Microbiology, 2005, 3(1):13-22.
[9] Youn S, Cho H, Fremont D, et al. A short N-terminal peptide motif on flavivirus nonstructural protein NS1 modulates cellular targeting and immune recognition[J]. Journal of Virology, 2010, 84(18):9516-9532.
[10] Yu K, Sheng Z, Huang B, et al. Structural, antigenic, and evolutionary characterizations of the envelope protein of newly emerging Duck tembusu virus[J]. PLoS One, 2013, 8(8):e71319.
[11] Martínez C, Giulietti A, Talou J. Research advances in plant-made flavivirus antigens[J]. Biotechnology Advances, 2012, 30(6):1493-1505.
[12] 黄欣梅,李 银,赵冬敏,等.鹅黄病毒囊膜蛋白的原核表达及抗原性分析[J].华北农学报, 2012, 27(5):33-37.
[13] Liu M, Chen S, Chen Y, et al. Adapted tembusu-like virus in chickens and geese in China[J]. Journal of Clinical Microbiology, 2012, 50(8):2807-2809.
[14] Tang Y, Diao Y, Yu C, et al. Characterization of a Tembusu virus isolated from naturally infected house sparrows (passer domesticus) in northern China[J]. Transboundary and Emerging Diseases, 2013, 60(2):152-158.
[15] Li S, Li X, Zhang L, et al. Duck tembusu virus exhibits neurovirulence in BALB/c mice[J]. Virology Journal, 2013, 10(1):260.
[16] Liu Z, Ji Y, Huang X, et al. An adapted duck Tembusu virus induces systemic infection and mediates antibody-dependent disease severity in mice[J]. Virus Research, 2013, 176(1/2):216-222.
[17] Tang Y, Gao X, Diao Y, et al. Tembusu virus in human, China[J]. Transboundary and Emerging Diseases, 2013, 60(3):193-196.
[18] Diamond M, Shrestha B, Marri A, et al. B cells and antibody play critical roles in the immediate defense of disseminated infection by West Nile encephalitis virus[J]. Journal of Virology, 2003, 77(4):2578-2586.
[19] Diamond M. Evasion of innate and adaptive immunity by flaviviruses[J]. Immunology and Cell Biology, 2003, 81(3):196-206.
[20] Monath T P. Treatment of yellow fever[J]. Antiviral Research, 2008, 78(1):116-124.
Envelope Protein of Goose Tembusu virus Induces Immune Response in Mice
Abstract:In order to research the immunogenicity ofGoose tembusu virus(GTV) envelope protein (E protein),GTV E protein was expressed in Escherichia coli, and administered to BALB/c mice via subcutaneous injection to study the immune responses. After immunization by recombinant E protein, the titres of neutralizing antibody in immunized BALB/c mice were all above 1∶51 200. Cytokine analysis of the serum of mice immunized with recombinant E protein revealed antigen-specific IL-2, TNF-α and IFN-γ responses. IL-2 and TNF-α in serum from immunized mice were extremely significantly higher than control mice (P< 0.01) and IFN-γ was significantly higher than that of control mice (P<0.05).Additionally, the proliferation of lymphocytes from spleen of mice immunized with recombinant E protein was stimulated. The results indicated that recombinant GTV E protein could effectively stimulate humoral and lymphocyte immune responses in mice. Moreover, when mice were challenged with GTV, by using Real-time RT-PCR, the loads of virus in tissues from mice immunized with recombinant E protein were significantly decreased, revealing that recombinant E protein contributed to protection against GTV challenge. This study demonstrated that the E.coli-expressed recombinant GTV E protein could serve as a potential subunit vaccine candidate against GTV and provided a theoretical basis for the prevention and control of Tembusu virus.
Key words:Tembusu virus; Envelope protein; Immune response; Subunit vaccine
收稿日期:2016-10-14
基金项目:江苏省自然科学基金项目(BK20160064); 江苏省农业科技自主创新资金项目(CX(14)2091)
中图分类号:S432.4+2
文献标识码:A
文章编号:1000-7091(2017)02-0050-05
doi:10.7668/hbnxb.2017.02.008