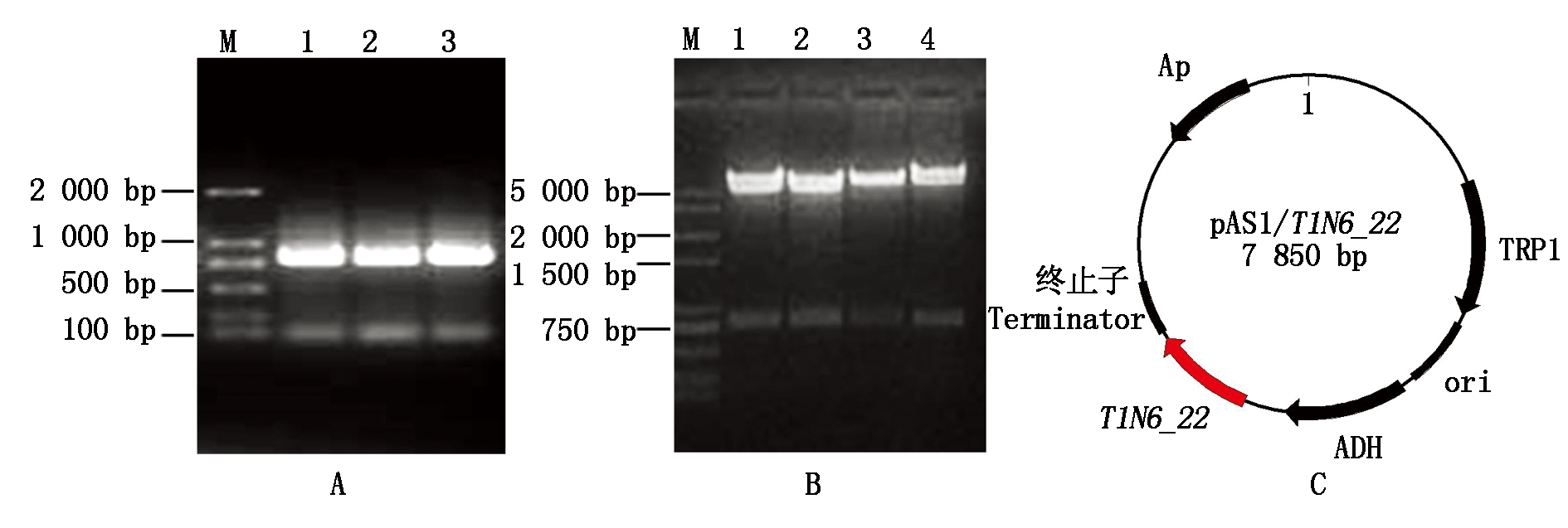
A.目的基因PCR扩增结果;B.双酶切(Sma Ⅰ和Sal Ⅰ)验证结果;C.pAS1/T1N6_22载体图谱。A.Gene amplification;B.Enzyme digestion analysis;C.Map of vector pAS1/T1N6_22.
图1 pAS1/T1N6_22载体的构建
Fig.1 Construction of yeast expression vector pAS1/T1N6_22
摘要:前期研究中从拟南芥突变体库中筛选获得一株对灰霉病菌侵染表现为感病的突变体。利用TAIL-PCR等技术克隆获得拟南芥抗灰霉病基因T1N6_22。为了进一步明确T1N6_22在拟南芥抗灰霉病过程中的调控机制,利用酵母双杂交技术(Y2H),以构建成功的pAS1/T1N6_22蛋白为诱饵,筛选拟南芥的cDNA文库。通过酵母双杂交筛选,共获得28个酵母克隆。利用T1N6_2基因特异性引物鉴定酵母阳性克隆,并进行测序。共获得了4个可能与T1N6_22互作的蛋白AT2G19480、AT1G06050、AT5G34780和AT1G21400。Blast分析发现,AT2G19480、AT1G06050、AT5G34780和AT1G21400分别为核小体装配蛋白、功能未知蛋白、假定的泛酸还原酶和硫胺二磷酸盐结合折叠超家族蛋白,分别参与到核糖体装配、泛酸盐合成、植物代谢等过程中。研究结果为确定T1N6_22蛋白的互作蛋白,阐明其调控拟南芥抗灰霉病的分子机制奠定了基础。
关键词:拟南芥;T1N6_22;酵母双杂交;互作蛋白
灰霉病是一种菌物性病害,其病原为有丝分裂真菌的葡萄孢属灰葡萄孢(Botrytis cinerea)。该病发生和流行时能够降低植物的产量及品质,影响农民的经济收入[1-3]。利用化学防治是目前生产中控制灰霉病的主要措施。然而随着长期、大量、频繁使用化学药剂不仅在环境、植物产品中引起农药残留现象,污染大气和土壤环境,危害人类健康,而且灰葡萄孢极易发生变异,导致病菌的抗药性增强[4]。因此,发掘抗灰霉病基因,培育抗灰霉病植物是目前防治灰霉病的最经济、有效和环保的方法。
关于抗灰霉病基因的克隆及功能分析在拟南芥中研究的较为深入。迄今为止,已经获得了ERF1、MYB30、BOS1等20多个拟南芥抗灰霉病相关基因。据文献报道,已克隆拟南芥抗灰霉病相关基因调控拟南芥的抗病性多数是通过激活水杨酸(SA)或茉莉酸/乙烯(JA/ET)信号传导途径来实现的。如拟南芥ERF1位于ET信号转导途径的下游,能够调控防卫反应基因b-CHI、PDF1.2等的表达[5];拟南芥R2R3-MYB类型转录因子AtMYB30位于SA调控途径的下游。该基因表达能够促进水杨酸合成、积累,从而激发植物产生过敏性坏死反应[6-7];拟南芥突变体bos1对灰葡萄孢侵染更加敏感,但对丁香假单胞杆菌抗性增强。功能研究表明BOS1基因参与JA诱导的抗病途径[8];拟南芥bos2、bos3和 bos4是3个对灰霉病菌侵染表现感病的突变体。3个突变体受灰霉病菌侵染后,PDF1_2基因(JA/ET信号转导途径标志基因)的表达均受到明显的影响。功能互补试验结果表明BOS2、BOS3和BOS4基因的表达能够调控植株体内植保素合成,进而影响拟南芥对灰葡萄孢的抗病性[9];BIK1基因(Botrytis-induced kinase1)定位于膜上,受灰葡萄孢侵染后诱导表达。接种灰霉病菌后,bik1植株表现为严重感病症状,但对丁香假单孢杆菌番茄致病变种无毒菌株的侵染却表现为抗性增强。同时研究还发现,bik1突变体中PDF1.2基因表达受到抑制[10]。
真菌毒素与植物分子病理学实验室前期研究中,克隆获得一个新的拟南芥抗灰霉病基因T1N6_22。T1N6_22编码蛋白属于短链脱氢/还原酶家族蛋白(Short-chain dehydrogenase/reductase,SDR),含有NADB_Rossmann保守结构域。利用功能互补试验已明确在灰葡萄孢侵染拟南芥过程中,T1N6_22基因起正调控作用。同时SA处理拟南芥后,能够诱导T1N6_22基因的表达[11]。为了进一步研究T1N6_22基因在拟南芥抗灰霉病过程中的作用机制,本研究构建了T1N6_22基因的酵母诱饵表达载体pAS1/T1N6_22,利用酵母双杂交技术,筛选拟南芥cDNA文库,以期获得能够与拟南芥抗灰霉病基因T1N6_22互作的蛋白,为确定T1N6_22蛋白的互作蛋白及其调控拟南芥对灰霉病菌侵染的抗性机制奠定理论基础。
1.1 试验材料
拟南芥野生型Columbia(Col-0)由河北农业大学真菌毒素与植物分子病理学实验室提供;拟南芥cDNA文库CD4-22、酵母菌株Y190、E.coli 菌株LE392和BNN132购于拟南芥种质资源中心(Arabidopsis Biological Resource Center,ABRC)。
1.2 试验方法
1.2.1 T1N6_22基因诱饵表达载体的构建 利用Primer 5.0软件,根据拟南芥抗灰霉病基因T1N6_22的CDS序列和pAS1的载体序列设计基因特异性引物。引物序列为F:5′-CCCGGGTTTGAGATTTGCAGGCAACTAG-3′(下划线:SmaⅠ的酶切位点)和R:5′-GTCGACTTTAGGGACCAAAGCCAGTTTC-3′(下划线:SalⅠ的酶切位点)。以拟南芥野生型Col-0的第一链cDNA为模板,克隆T1N6_22的CDS序列。将测序正确的T1N6_22基因序列与pAS1载体连接,构建诱饵表达载体pAS1/T1N6_22。
1.2.2 酵母转化 将pAS1/T1N6_22诱饵载体与pAS1空载体通过PEG/LiAC介导的转化方法,分别转入Y190菌株中,涂布SD/-Trp培养基上,置于30 ℃培养。利用基因的特异性引物,通过PCR鉴定阳性转化子。
1.2.3 T1N6_22基因诱饵表达载体的自激活检测 利用含有3-AT的二缺培养基(SD/-Trp-His),进行诱饵载体的自激活检测。选取直径为2~3 mm的酵母单克隆,用20 μL无菌水进行梯度稀释后,吸取1.5 μL菌液滴加到3-AT浓度分别为0,5,10,50,100,200 mmol/L的二缺培养基上(SD/-Trp-His),30 ℃培养条件下,倒置培养3 d。通过观察有无菌落生长,从而确定载体的自激活活性。
1.2.4 拟南芥cDNA文库的扩繁和制备 将含有拟南芥cDNA文库的噬菌体(100 μL)加入到300 μL的LE392中,混匀后37 ℃静置15 min,加入6 mL 0.7%的琼脂糖,混匀后倒入LB固体培养基(含0.2%麦芽糖)上,37 ℃倒置培养6~8 h,即有噬菌斑产生。将噬菌体(108pfu)加到E.coli BNN132菌株感受态细胞中,30 ℃条件下静置培养30 min;然后再加入2 mL LB液体培养基,置于30 ℃摇床中振荡培养(220 r/min)1 h;涂布于LB固体培养基上(含50 μg/mL Amp和0.2%葡萄糖),37 ℃过夜;选取阳性的单一克隆,进行扩大培养后,提取拟南芥cDNA文库的质粒。
1.2.5 T1N6_22蛋白的互作蛋白筛选与分析 将cDNA文库质粒DNA转化含pAS1/T1N6_22的酵母Y190中,涂于SD/-Trp-His-Leu培养基(含100 mmol/L 3-AT)上,置于30 ℃条件下培养3~5 d。选取单克隆进行扩大培养,提取质粒DNA。利用pACT质粒引物pACT-F(5′-CTATCTATTCGATGATGAAG-3′)及pACT-R(5′-ACAGTTGAAGTGAACTTGCG-3′)进行PCR扩增,鉴定阳性克隆。回收阳性克隆,进行转化和测序(上海生工)。利用生物信息学分析技术对所获得的序列进行分析,明确基因类型及其功能。
2.1 T1N6_22基因诱饵表达载体的构建
以拟南芥野生型Col-0第一链cDNA为模板,利用T1N6-22基因的特异引物扩增基因的CDS序列。图1-A为检测结果,表明扩增获得条带与目的片段大小(786 bp)一致。将目的条带进行回收,进行克隆和测序。用SmaⅠ和SalⅠ对测序正确的阳性克隆质粒和pAS1质粒同时进行双酶切,分别回收目的条带。图1-B、C为双酶切鉴定结果,可以看出经双酶切后均获得2个条带,条带大小分别与T1N6-22基因和载体大小一致。表明pAS1/T1N6_22载体构建成功。

A.目的基因PCR扩增结果;B.双酶切(Sma Ⅰ和Sal Ⅰ)验证结果;C.pAS1/T1N6_22载体图谱。A.Gene amplification;B.Enzyme digestion analysis;C.Map of vector pAS1/T1N6_22.
图1 pAS1/T1N6_22载体的构建
Fig.1 Construction of yeast expression vector pAS1/T1N6_22
2.2 诱饵表达载体的酵母转化
将构建成功诱饵表达质粒pAS1/T1N6_22通过醋酸锂(LiAc)小量转化法转化酵母菌Y190。以阳性克隆质粒DNA为模板,利用T1N6_22基因特异性引物进行扩增检测转化子。图2为检测结果,表明pAS1/T1N6_22质粒已成功转入酵母细胞。
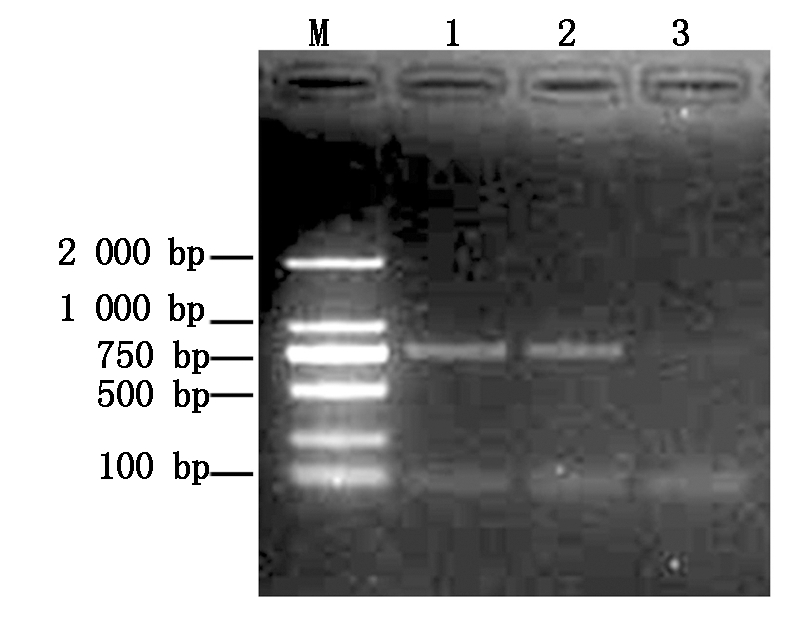
M.DNA Marker;1,2.pAS1/T1N6_22转化子;3.pAS1转化子。M.DNA Marker;1,2.pAS1/T1N6_22 transformants;3.pAS1 transformant.
图2 酵母转化子的PCR鉴定
Fig.2 PCR identification of yeast transformants
2.3 pAS1/T1N6_22载体的自激活活性检测
将含pAS1/T1N6_22质粒载体的Y190酵母菌株接种到含不同浓度3-AT的二缺培养基上(SD/-Trp-His),于30 ℃条件下培养3 d。图3为培养结果,酵母Y190(pAS1/T1N6_22)在含有100 mmol/L的3-AT的培养基能够正常生长,而在250 mmol/L的3-AT培养基上酵母菌Y190(pAS1/T1N6_22)生长受到明显抑制。表明拟南芥T1N6_22蛋白转录激活活性很强。据文献报道,当培养基中添加3-AT的浓度高于100 mmol/L时对酵母菌株具有毒性,因此,在本试验中培养基中添加3-AT浓度均为100 mmol/L。
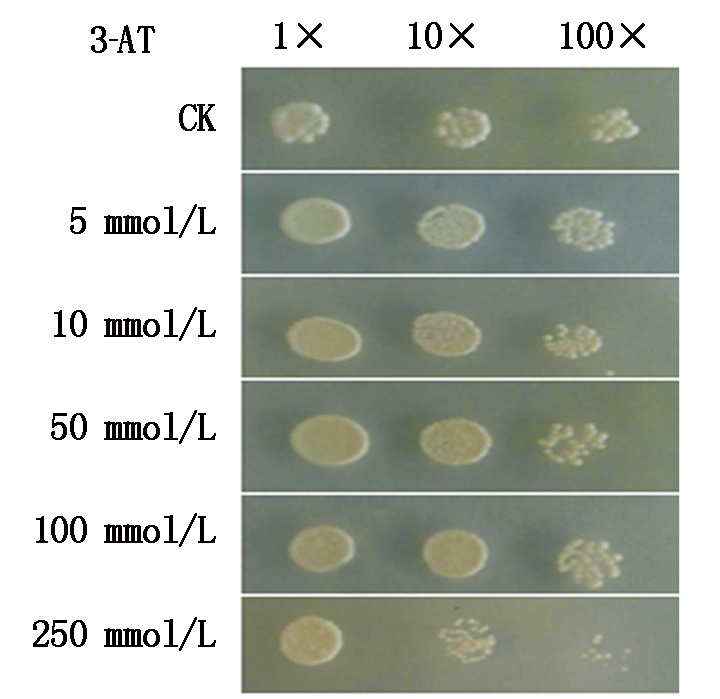
图3 pAS1/T1N6_22的自激活活性检测结果
Fig.3 The self-activation activity of pAS1/T1N6_22
2.4 T1N6_22蛋白的互作蛋白筛选
通过筛选拟南芥cDNA文库,在SD/-Trp-His-Leu培养基上(含100 mmol/L 3-AT)共获得了28个酵母克隆(图4-A)。将阳性克隆挑于三缺液体培养基中,30 ℃振荡培养2 d。以提取的酵母质粒DNA为模板,利用基因特异性引物pACT-F和pACF-R进行PCR扩增。图4-B为扩增结果,分别将目的条带进行回收、转化和测序。
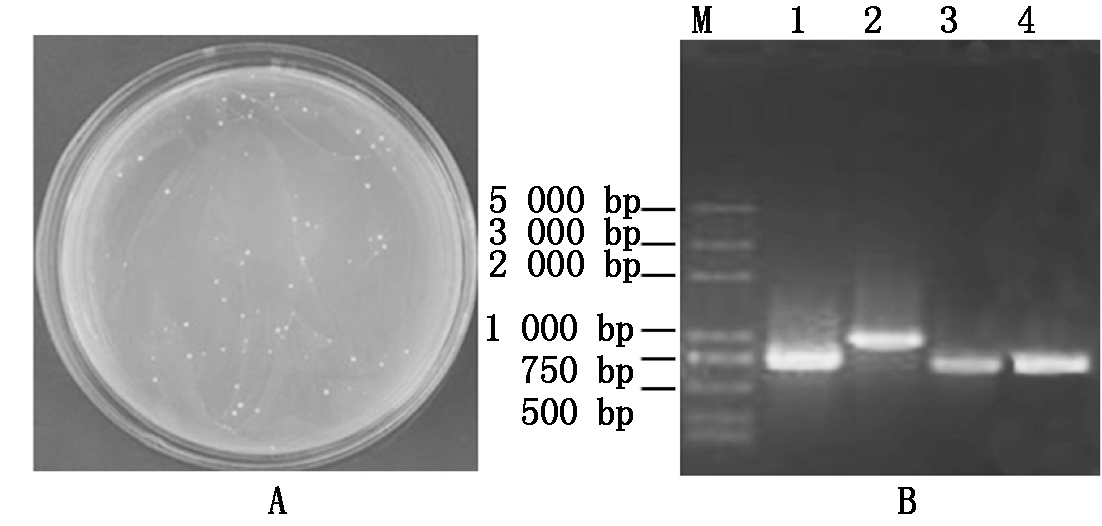
A.筛选文库所获得的阳性克隆;B.阳性克隆的PCR鉴定。A.Positive clones screened from the cDNA library;B.PCR identification of the positive clones.
图4 T1N6_22蛋白互作蛋白的筛选
Fig.4 Screening of T1N6_22-interacting proteins
2.5 T1N6_22蛋白互作蛋白的功能分析
利用Blast软件,将筛选获得的互作蛋白序列与NCBI中的已知蛋白序列进行对比分析。表1为分析结果。根据分析结果初步推测4个蛋白(基因ID分别为AT2G19480、AT1G06050、AT5G34780和AT1G21400)可能与T1N6_22蛋白具有相互作用。AT2G19480基因编码核小体装配蛋白,具有DNA修复、核糖体装配、参与镉离子信号传导过程等功能[12];AT1G06050基因编码功能未知的蛋白;AT5G34780基因编码泛酸还原酶,定位于线粒体,具有氧化还原酶活性,参与泛酸盐合成过程[13];AT1G21400基因编码硫胺二磷酸盐结合折叠超家族蛋白,具有氧化还原酶活性、作用于受体的醛基或氧基等功能,参与到植物代谢途径中[14-15]。
表1 T1N6_22蛋白互作蛋白的功能分析
Tab.1 Functional analysis of T1N6_22 interacting proteins

基因IDGeneID功能分析FunctionannotationAT2G19480核小体装配蛋白AT1G06050功能未知AT5G34780假定的泛酸还原酶AT1G21400硫胺二磷酸盐结合折叠超家族蛋白
蛋白质与蛋白质之间的相互作用构成了细胞生化反应的网络,促使蛋白质分子发挥生物学效应。酵母双杂交系统由Fields和Song首次建立,利用该方法可以从cDNA文库中直接筛选到与已知蛋白质具有相互作用的蛋白质。目前该方法已广泛应用于蛋白质互作研究中。如在水稻抗病蛋白筛选中,通过酵母双杂交系统筛选获得了Pita的互作蛋白为Avr-Pita蛋白,Pita通过与Avr-Pita蛋白LRR区域结合进而发生相互作用[16];拟南芥转录因子AtMYB73参与调控拟南芥响应干旱、低温和盐胁迫过程中[17]。樊锦涛等[18]构建了AtMYB73的酵母诱饵表达载体,从拟南芥cDNA文库中筛选获得了与MYB73互作的蛋白F12F1.4;王加峰等[19]以水稻抗稻瘟病基因Pik-h的2个紧密连锁且功能独立的 Pikh-1 和Pikh-2 蛋白为诱饵,利用酵母双杂交技术从水稻叶片靶标cDNA文库中获得18个与 Pikh-1、Pikh-2具有互作的蛋白。孙海桃等[20]利用酵母双杂交技术从小麦cDNA文库中筛选获得了TaDREB6的互作蛋白,功能预测结果表明TaDREB6可能参与了多条信号转导途径,在抗逆境调控中具有重要作用;Vander等[21-22]通过酵母双杂交分析,明确了EIL3蛋白与MYB72具有相互作用,MYB72蛋白在ET介导信号转导途径中具有重要作用。本研究以构建成功的载体pAS1/T1N6_22为诱饵,利用酵母双杂交技术筛选拟南芥cDNA文库。共获得4个可能与T1N6_22具有相互作用的蛋白(编码基因分别为AT2G19480、AT1G06050、AT5G34780和AT1G21400)。功能预测发现,筛选获得的互作蛋白分别参与到核糖体装配、泛酸盐合成、植物代谢等多种过程中,推测T1N6_22基因是通过参与多种过程调控拟南芥的抗病性核糖体蛋白是蛋白质生物合成过程中的重要分子,在植物生长发育、抗病、抵抗逆境胁迫等过程起着重要作用。Wu等[23]研究已证实核糖体RPL15和RPL4基因参与花生抗青枯病菌侵染过程中;王立丰等[24]从巴西橡胶树中克隆获得了核糖体HbRPL14基因。利用荧光定量分析技术证实了核糖体HbRPL14基因可以受逆境调控。在干旱、机械伤害和白粉菌侵染过程中,该基因的表达量显著增加。核糖体HbRPL14基因表达后通过增加植株体内核糖体蛋白的含量来调控橡胶树对干旱等逆境的响应;曹广英等[25]采用荧光定量技术(qRT-PCR)发现花生核糖体基因RPL29-1在青枯菌胁迫0.5 h表达量增加并达到最大值,从而表明该基因在花生抗青枯病过程中发挥作用;Kim等[26]在经低温处理3 d后的大豆中,发现3个表达量增加的核糖体基因GmRPS13、GmRPS6和GmRPL373。推测3个核糖体基因表达量增加能够促进蛋白翻译过程或协助核糖体功能正常发挥,从而提高了大豆抗低温胁迫能力。本研究中获得的与T1N6_22蛋白互作的AT2G19480编码核小体装配蛋白,参与核糖体装配过程。由此可以推测拟南芥T1N6_22与AT2G19480互作通过促进核糖体蛋白的合成来调控拟南芥对灰霉病菌的抗性,但这还需要进一步的试验证实。
参考文献:
[1] Keller M,Viret O,Cole F M.Botrytis cinerea infection in grape flowers:Defense reaction,latency,and disease expression[J].Phytopathology,2003,93(3):316-322.
[2] Zhu B,Zhou Q,Xie G,et al.Interkingdom gene transfer may contribute to the evolution of phytopathogenicity in Botrytis cinerea[J].Evolutionary Bioinformatics Online,2012,8(7):105-117.
[3] Shah P,Powell A L,Orlando R,et al.Proteomic analysis of ripening tomato fruit infected by Botrytis cinerea[J].Journal of Proteome Research,2012,11(4):2178-2192.
[4] Espino J J,Gutierrez-Sanchez G,Brito N,et al.The Botrytis cinerea early secretome[J].Proteomics,2010,10(16):3020-3034.
[5] Robles L M,Wampole J S,Christians M J,et al.Arabidopsis enhanced ethylene response 4 encodes an EIN3-interacting TFIID transcription factor required for proper ethylene response,including ERF1 induction[J].Journal of Experimental Botany,2007,58(10):2627-2639.
[6] Canonne J,Marino D,Jauneau A,et al.The Xanthomonas type Ⅲ effector XopD targets the Arabidopsis transcription factor MYB30 to suppress plant defense[J].Plant Cell,2011,23(9):3498-3511.
[7] Li L,Yu X,Thompson A,et al.Arabidopsis MYB30 is a direct target of BES1 and cooperates with BES1 to regulate brassinosteroid-induced gene expression[J].The Plant Journal,2009,58(2):275-286.
[8] Veronese P,Chen X,Bluhm B,et al.The BOS loci of Arabidopsis are required for resistance to Botrytis cinerea infection[J].The Plant Journal,2004,40(4):558-574.
[9] Denby K J,Kumar P,Kliebenstein D J.Identification of Botrytis cinerea susceptibility loci in Arabidopsis thaliana[J].The Plant Journal,2004,38(3):473-486.
[10] Veronese P,Nakagami H,Bluhm B,et al.The membrane-anchored BOTRYTIS-INDUCED KINASE1 plays distinct roles in Arabidopsis resistance to necrotrophic and biotrophic pathogens[J].Plant Cell,2006,18(1):257-273.
[11] Jihong X,Qiaoyu W,Congcong H,et al.T1N6-22 gene is required for biotic and abiotic stress responses in Arabidopsis[J].Russian Journal of Genetics,2012,48(12):1191-1198.
[12] Ziqiang L,Yan Z,Juan G,etal.Molecular and reverse genetic characterization of NUCLEOSOMEASSEMBLY PROTEIN1(NAP1)genes unravels their function in transcription and nucleotide excision repair in Arabidopsis thaliana[J].The Plant Journal,2009,59(59),27-38.
[13] Harald H O,Jennifer L A,Heather M W,et al.Organisation of the pantothenate(vitamin B5)biosynthesis pathway in higher plants[J].The Plant Journal,2004,37(1):61-72.
[14] He X J,Mu R L,Cao W H,et al.AtNAC2,a transcription factor downstream of ethylene and auxin signaling pathways,is involved in salt stress response and lateral root development[J].The Plant Journal,2005,44(6):903-916.
[15] Kerry A L,Jessica R F,Jeremy M E,et al.Peroxisomal metabolism of propionic acid and isobutyric acid in plants[J].The Journal of Biological Chemistry,2007,282(34):24980-24989.
[16] Jia Y L,MeAdams S A,Bryan G T,et al.Direct interaction of resistance gene and avirulence gene products confers rice blast resistance[J].The EMBO Journal,2000,19(15):4004-4014.
[17] Kim J H,Nguyen N H,Jeong C Y,et al.Loss of the R2R3 MYB,AtMyb73,causes hyper-induction of the SOS1 and SOS3 genes in response to high salinity in Arabidopsis[J].Journal of Plant Physiology,2013,170(16):1461-1465.
[18] 樊锦涛,贾 娇,蒋琛茜,等.拟南芥转录因子AtMYB73转录活性区域分析及互作蛋白的筛选[J].中国农业科学,2014,47(23):4754-4762.
[19] 王加峰,刘 浩,王 慧,等.水稻NBS-LRR类抗稻瘟病蛋白Pik-h的互作蛋白筛选[J].中国农业科学,2016,49(3):482-490.
[20] 孙海桃,徐兆师,侯建华,等.小麦TaDREB6转录因子互作蛋白的筛选[J].中国农业科学,2011,44(22):4740-4747.
[21] Vander E S,Verhagen B W,Van D R,et al.MYB72 is required in early signaling steps of rhizobacteria-induced systemic resistance in Arabidopsis[J].Plant Physiology,2008,146(3):1293-1304.
[22] Garcí a M J,Su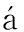 rez V,Romera F J,et al.A new model involving ethylene,nitric oxide and Fe to explain the regulation of Fe-acquisition genes in Strategy I plants[J].Plant Physiology and Biochemistry,2011,49(5):537-544.
rez V,Romera F J,et al.A new model involving ethylene,nitric oxide and Fe to explain the regulation of Fe-acquisition genes in Strategy I plants[J].Plant Physiology and Biochemistry,2011,49(5):537-544.
[23] Wu Q,Wang X Z,Tang Y Y,et al.Molecular cloning,genomic organization and functional analysis of the ribosomal protein L4/L1(RPL4)gene from from Arachishypogaea[J].Canadian Journal of Plant Science,2014,94(1):85-97.
[24] 王立丰,王纪坤,安 锋,等.巴西橡胶树核糖体蛋白HbRPL14基因逆境响应机制[J].西南林业大学学报,2016,36(2):67-77.
[25] 曹广英,吴 琪,唐月异,等.花生核糖体蛋白 L29-1(RPL29-1)基因克隆表达分析及载体构建[J].分子植物育种,2016,14(7):1730-1736.
[26] Kim K Y,Park S W,Chung Y S,et al.Molecular cloning of low-temperature-inducible ribosomal proteins from soybean[J].Gene Note,2004:1153-1155.
Screening and Analysis of Interacting Proteins of T1N6_22 Gene from Arabidopsis Against Botrytis cinerea
Abstract:Botrytis susceptible mutant named T1N6_22 was achieved from Arabidopsis mutant library.Through the method of TAIL-PCR,resistance-related gene T1N6_22 of Arabidopsis thaliana against Botrytis cinerea infection was cloned.In order to further clarify the regulation mechanism of T1N6_22 gene in Arabidopsis thaliana against Botrytis cinerea infection,vector pAS1/T1N6_22 of T1N6_22 gene was constructed.Taking pAS1/T1N6_22 fusion protein as bait,Arabidopsis cDNA library were screened by the method of yeast two-hybrid system.A total of 28 yeast clones were obtained by yeast two hybrid screening.The positive clones were identified by T1N6_22 gene specific primers and sequenced.Four interacting proteins(AT2G19480,AT1G06050,AT5G34780 and AT1G21400)were obtained by screening Arabidopsis cDNA library.Blast analysis showed that four interacting proteins encoded nucleosome assembly protein,function unknown protein,putative ketopantoate reductase,and oxidoreductase,respectively.These interacting proteins were related to process,biosynthesis of pantothenate,and plant metabolic process.These results would provide foundation for identifying interacting protein of T1N6_22 and clarifying the regulation mechanism of T1N6_22 gene in Arabidopsis resistance.
Key words:Arabidopsis;T1N6_22;Yeast two-hybrid;Interacting protein
收稿日期:2017-01-15
基金项目:河北省自然科学基金项目(C2014405010)
中图分类号:Q78;S432
文献标识码:A
文章编号:1000-7091(2017)02-0045-05
doi:10.7668/hbnxb.2017.02.007