同步检测PMWaV-1、PMWaV-2和PMWaV-3的三重RT-qPCR方法的初步建立
胡加谊1,2,罗志文1,何 凡1,李向宏1,胡福初1,范鸿雁1,刘志昕3,张治礼1
(1.海南省农业科学院 热带果树研究所,农业部海口热带果树科学观测实验站,海南省热带果树生物学重点实验室,海南 海口 571100;2.黄埔出入境检验检疫局,广东 广州 510730;3.中国热带农业科学院 热带生物技术研究所,海南 海口 571101)
摘要:目前我国菠萝产区已相继报道3种菠萝凋萎相关病毒(PMWaV-1、PMWaV-2和PMWaV-3)。通过建立这3种菠萝凋萎相关病毒实时荧光定量RT-PCR(RT-qPCR)同步定量检测方法,为菠萝凋萎病毒的定性定量研究提供技术手段。根据这3种菠萝凋萎相关病毒的外壳蛋白基因序列分别设计特异性引物和TaqMan水解探针,在优化PMWaV-1、PMWaV-2、PMWaV-3三重RT-qPCR反应体系后,以PMWaV-1、PMWaV-2、PMWaV-3 CP基因目的片段的重组质粒为标准品绘制标准曲线,初步建立了PMWaV-1、PMWaV-2、PMWaV-3三重RT-qPCR检测方法。其中PMWaV-1标准曲线为y=-3.283logx+39.02,其扩增效率达101.7%,线性相关系数R2=0.999;PMWaV-2标准曲线为y=-3.393logx+37.53,其扩增效率为97.1%,线性相关系数R2=0.998;PMWaV-3标准曲线为y=-3.171 logx+38.48,其扩增效率为106.7%,线性相关系数R2=0.996;这表明3种菠萝凋萎相关病毒质粒标准品在同一反应体系中可稳定扩增,且线性关系表现良好,可用于后续试验。灵敏度试验数据表明,该方法对PMWaV-1、PMWaV-2、PMWaV-3的最低检测线分别为99,98,868拷贝;重复性试验表明PMWaV-1、PMWaV-2、PMWaV-3三重RT-qPCR扩增曲线的标准差小于0.267,变异系数小于1.44%。这表明建立的三重RT-qPCR检测方法可快速、准确、稳定地定量检测PMWaV-1、PMWaV-2、PMWaV-3等3种病毒,为PMWaV的定性定量研究和复合侵染机制的探索提供了技术基础。
关键词:菠萝凋萎病;检测方法;实时荧光定量RT-PCR;PMWaV;TaqMan探针
菠萝凋萎病是世界上主要菠萝产区最为严重的病害之一,也是中国最严重的菠萝病害之一,调查发现我国海南、广东、广西等菠萝主产区均有MWP发生,在发病严重的菠萝园中,植株发病率可达60%,造成25%~30%的经济损失。菠萝凋萎相关病毒(Pineapple mealybug wilt associated virus,PMWaV)为菠萝凋萎病的主要致病因子,属于长线形病毒科(Closteroviridae)葡萄卷叶病毒属(Ampelovirus)[1-2]。目前,世界各地学者已从菠萝植株中发现了5种PMWaV[3],李运河等和吴丽亭等[4-5]在对广东、广西和海南等地的菠萝样品检测中仅发现PMWaV-1、PMWaV-2、PMWaV-3,而PMWaV-4 和PMWaV-5仅分别报道于夏威夷、澳大利亚[6-7]。澳大利亚的Gambley等[7]的研究发现PMWaV-1、PMWaV-2、PMWaV-3与菠萝凋萎病均存在一定的相关性,且PMWaV-3与菠萝凋萎病的相关性明显高于PMWaV-1和PMWaV-2,而PMWaV-2早已被证明是MWP的病原之一,它与菠萝粉蚧共同作用引起菠萝凋萎病[8];此外,有研究表明,PMWaV-1阳性菠萝植株的平均单果重明显降低、早熟果比率上升,严重时可导致30%的田间损失[9]。由此可见,PMWaV-1、PMWaV-2、PMWaV-3对MWP发生和危害均有着重要影响,果树种质资源与遗传育种研究室对海南田间的菠萝样品检测结果表明MWP样品存在明显的复合侵染现象。目前,基于单一PMWaV检测方法的建立与应用屡见报道,包括免疫电镜、血清学方法、普通RT-PCR[6]方法和实时荧光定量RT-PCR(RT-qPCR)方法[10-12];也有一些学者针对几种不同PMWaV建立起可同步检测几种PMWaV的方法,罗志文[13]也建立了可以同步检测PMWaV-1、PMWaV-2和PBCoV的三重RT-PCR检测技术。然而,可同时检测并定量多种PMWaV的检测方法在国内外还未见报道,鉴于菠萝凋萎病对我国菠萝产业造成较大损失和病毒的快速定量检测对无毒种苗筛选过程的重要性,本研究针对目前在我国屡见报道的PMWaV-1、PMWaV-2和PMWaV-3,并以海南省农业科学院热带果树研究所基地的菠萝凋萎病阳性样品作为研究对象,针对病毒CP基因序列设计引物和探针,通过制备重组质粒作为标准品,构建标准曲线,初步建立并优化了PMWaV-1、PMWaV-2、PMWaV-3的三重RT-qPCR检测方法,以期为菠萝无毒种苗繁育产业发展和菠萝凋萎病毒复合侵染作用机制的揭示打下扎实的技术铺垫。
1 材料和方法
1.1 试验材料
试验于2013年5月-2014年6月在海南省农业科学院热带果树研究所和中国热带农业科学院热带生物技术研究所进行。
1.1.1 病毒材料 试验中用于建立PMWaV-1、PMWaV-2、PMWaV-3的三重RT-qPCR检测方法所用的PMWaV-1、PMWaV-2和PMWaV-3阳性菠萝植株材料均由海南省农业科学院热带果树研究所提供。
1.1.2 主要试剂 多糖多酚植物总RNA 提取试剂盒(Bioteke公司)、反转录酶(TransGen公司)、Trans5αCell(TransGen 公司);pMD18-T 载体(TaKaRa公司)、Taq DNA 聚合酶(TaKaRa公司)、Real Master Mix(Prob)(TaKaRa 公司)、琼脂糖凝胶回收试剂盒(AXYGEN)、质粒提取试剂盒(AXYGEN公司)。
1.1.3 主要设备 TP600 PCR 仪(TaKaRa公司);MX3005 荧光PCR 仪(Stratagene公司);NanoDrop ND-2000C 微量紫外分光光度计(Thermo公司)。
1.2 特异性引物和TaqMan探针的设计合成
根据GenBank中登录的PMWaV-1 CP基因序列的保守区域(登录号为:HE983617、EU769114、JN995532、JN995531)、PMWaV-2 CP基因序列的保守区域(登录号为:HE983618、EU769116、JN995535、JN995534、DQ225114、JX645775、JN995533)和PMWaV-3 CP基因序列的保守区域(登录号为:JN995536、FJ209048),分别设计扩增3种病毒CP的特异性引物和TaqMan 水解探针,用于建立PMWaV-1、PMWaV-2、PMWaV-3的三重RT-qPCR检测方法。引物和探针均由上海生工合成。引物和探针序列见表1。
表1 PMWaV-1、PMWaV-2、PMWaV-3实时荧光定量RT-PCR引物和探针
Tab.1 Primers and probes designed for detection and quantification of PMWaV-1,PMWaV-2,PMWaV-3 by RT-qPCR

引物Primersorprobes引物的序列(5'-3')Sequenceofprimersandprobes目的片段/bpAmplificatesizePMWaV-1-FGGAGAGGTTTTACTTCCACAAT205PMWaV-1-RGAGTTTGCTCTGTTTATGGCTACPMWaV-1-probeHEX-ACTGAGTTCTGGGAAGTTGGTGGT-BHQ2PMWaV-2-FCGTGAGTGAGGTGGTTGAG168PMWaV-2-RGCAAAGAACTGCTTGGGTPMWaV-2-probeFAM-TGGCTCATCACGGAGTACCCAAGC-TAMRAPMWaV-3-FGGATAGTGGCGAAAGAACAT144PMWaV-3-RTACTTAGCAGTTATTGTACGGTTCPMWaV-3-probeCY5-AGGGAGCCCAAAGCATTATGGGAACT-BHQ2
1.3 三重RT-qPCR标准品的制备
参考百泰克公司多糖多酚植物总RNA 快速提取试剂盒(离心柱型)的说明书提取PMWaV-1、PMWaV-2、PMWaV-3阳性菠萝叶RNA和PMWaV-free菠萝叶RNA,并参照康为世纪有限公司的TransScript Ⅱ Reverse Transcriptase说明书反转录制备cDNA,置于-20 ℃ 冰箱保存备用。以PMWaV-1、PMWaV-2和PMWaV-3阳性的cDNA为PCR扩增模板,利用表1所列引物分别进行PCR扩增。20 μL PCR扩增反应体系包含Trangen Taq(5 U/μL)0.2 μL,dNTP Mixture(2.5 mmol/L)1 μL,10 × PCR Buffer(含Mg2+)2 μL,上游引物(10 μm/μL)和下游引物(10 μm/μL)各0.5 μL,cDNA 1 μL和ddH2O 14.8 μL。PCR扩增反应程序为:94 ℃预变性3 min;94 ℃变性30 s,57 ℃ 退火30 s,72 ℃ 延伸20 s,循环35次;72 ℃ 延伸10 min,4 ℃保存。
DNA凝胶回收试剂盒回收PMWaV-1、PMWaV-2、PMWaV-3 CP基因的PCR产物,将PCR产物连接pMD18-T 载体,连接产物转化Trans5α Cell,然后根据3种病毒分别随机挑取3个重组克隆,37 ℃振荡培养过夜,参照说明书提取质粒,菌液送上海Invitrogen公司测序,并经DNAMAN分析鉴定。利用核酸蛋白测定仪测定阳性重组质粒的浓度,并根据公式C = A/B×6.02×1014(其中C代表质粒浓度(单位为拷贝/μL),A 代表以OD260分析得到的浓度(单位为ng/μL),B为质粒DNA 的分子量)计算重组质粒浓度的拷贝数,-20 ℃冷冻保存备用。
1.4 三重RT-qPCR反应体系的优化
将分别含PMWaV-1,PMWaV-2和PMWaV-3 CP基因目的片段的重组质粒稀释相同倍数,等比例混匀为混合质粒标准品,并以此作为三重RT-qPCR反应体系优化的模板。根据单因子变量的原则,分别优化三重实时RT-qPCR反应体系中的探针浓度、引物浓度和缓冲液比例。反应体系优化设置见表2,选取三重RT-qPCR中扩增曲线Ct值最小、荧光信号最强的使用浓度作为优化结果。
表2 PMWaV-1、PMWaV-2、PMWaV-3三重RT-qPCR检测方法反应体系优化
Tab.2 Reaction system optimization of triple RT-qPCR for simultaneous detecting PMWaV-1,PMWaV-2,PMWaV-3
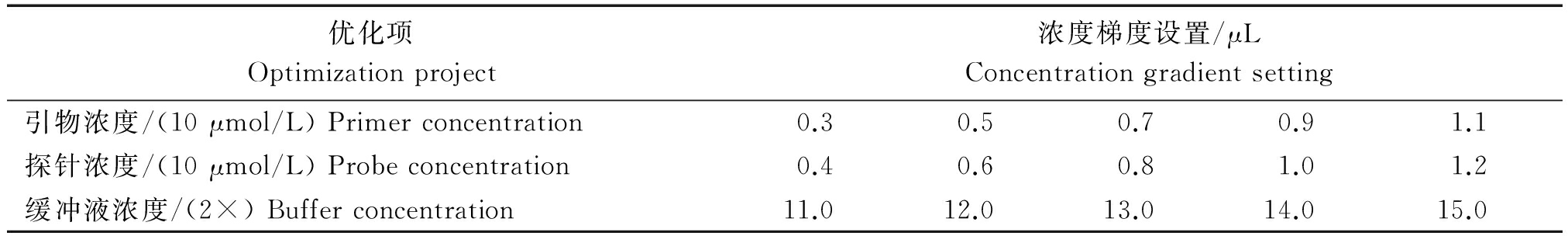
优化项Optimizationproject浓度梯度设置/μLConcentrationgradientsetting引物浓度/(10μmol/L)Primerconcentration0.30.50.70.91.1探针浓度/(10μmol/L)Probeconcentration0.40.60.81.01.2缓冲液浓度/(2×)Bufferconcentration11.012.013.014.015.0
1.5 构建三重RT-qPCR标准曲线
将3种病毒目的基因的重组质粒(其中,PMWaV-1、PMWaV-2、PMWaV-3浓度分别为0.990×109,0.980×108,0.868×108 拷贝/μL)等比例混成三重质粒模板,并用超纯水以10倍的梯度,稀释三重质粒模板,按照1.4优化后的三重RT-qPCR反应体系进行检测,得出检测3种菠萝凋萎相关病毒的三重RT-qPCR标准曲线。
1.6 三重RT-qPCR检测方法的测评
1.6.1 抗干扰测评试验 将三重RT-qPCR扩增体系按模板成分不同分为4组,第1组的模板为PMWaV-1 CP目标片段的重组质粒(浓度:0.99×105 拷贝/μL),第2组的模板为PMWaV-2 CP目标片段的重组质粒(浓度:0.98×105 拷贝/μL),第3组的模板为PMWaV-3 CP目标片段的重组质粒(浓度:0.868×105 拷贝/μL),第4组的模板为混合质粒标准品(105倍稀释的重组质粒等比例混合),按照1.4优化的三重RT-qPCR反应体系进行扩增试验。
1.6.2 灵敏度测评试验 按照1.5所述步骤制备10倍梯度稀释的三重质粒模板,并按照1.4优化后的三重RT-qPCR反应体系在Mx3005荧光定量PCR仪上检测,得出三重RT-qPCR对PMWaV-1、PMWaV-2、PMWaV-3的最低检测限。
1.6.3 重复性测评试验 利用1.5所述制备三重质粒模板,并根据1.4优化的反应体系进行RT-qPCR检测,每个梯度的浓度均设置3个重复,并根据各个RT-qPCR扩增曲线的Ct值计算平均Ct值、标准差(SD)和变异系数(CV)。
2 结果与分析
2.1 普通RT-PCR检测与重组质粒测序
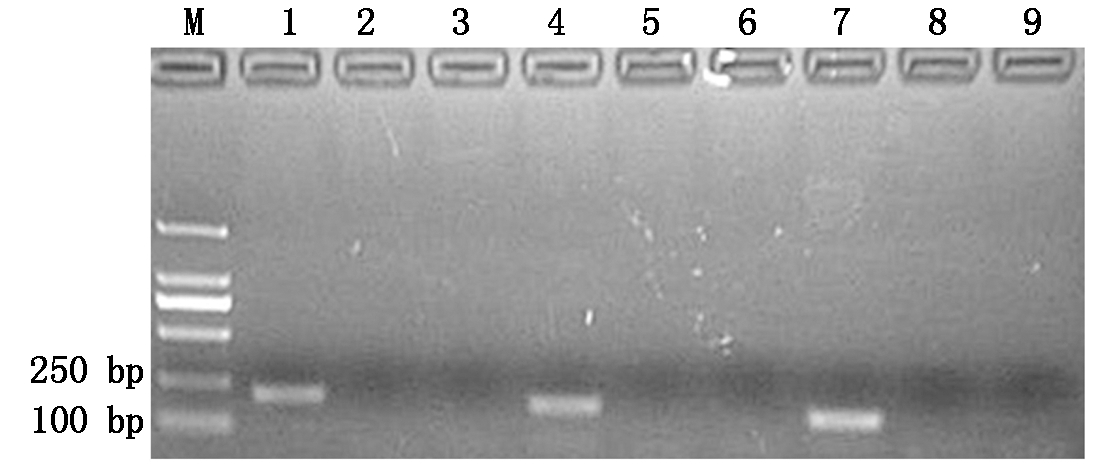
以PMWaV-1、PMWaV-2和PMWaV-3阳性的cDNA为扩增进行PCR反应,结果表明,PMWaV-1、PMWaV-2、PMWaV-3 CP基因的目的片段均得到有效扩增(图1),本试验设计的病毒引物均能扩增出相应的目的片段,条带清晰,而空白对照和阴性对照均未有扩增。回收PCR产物,纯化后作为靶标片段制备重组质粒,并经英潍捷基公司测序。Blast分析表明,重组质粒插入的序列与目标序列一致。
M.Marker DL2000;1.PMWaV-1 外壳蛋白扩增片段;2.PMWaV-1 外壳蛋白扩增阴性对照;3.PMWaV-1 外壳蛋白扩增空白对照;4.PMWaV-2 外壳蛋白扩增片段;5.PMWaV-2 外壳蛋白扩增阴性对照;6.PMWaV-2 外壳蛋白扩增空白对照;7.PMWaV-3 外壳蛋白扩增片段;8.PMWaV-3 外壳蛋白扩增阴性对照;9.PMWaV-3 外壳蛋白扩增空白对照。M.Marker DL2000;1.PMWaV-1 CP gene fragment;2.PMWaV-1 negative control;3.PMWaV-1 blank control;4.PMWaV-2 CP gene fragment;5.PMWaV-2 negative control;6.PMWaV-2 blank control;7.PMWaV-3 CP gene fragment;8.PMWaV-3 negative control;9.PMWaV-3 blank control.
图1 PCR扩增PMWaV-1、PMWaV-2、PMWaV-3 目的片段
Fig.1 Target fragment of PMWaV-1,PMWaV-2,PMWaV-3amplificated by PCR
2.2 三重RT-qPCR反应条件优化结果
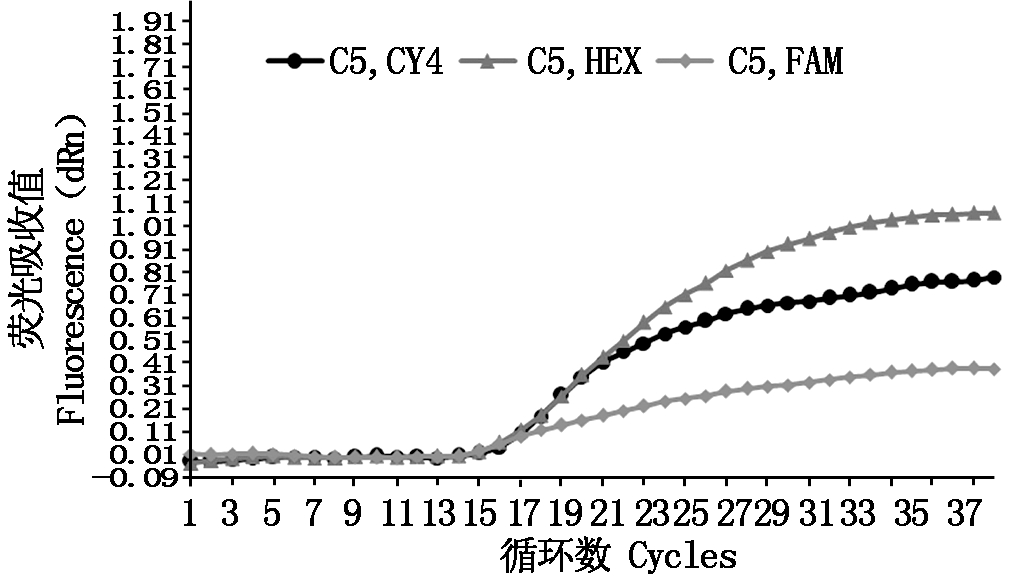
三重RT-qPCR检测方法的优化是为保证在同一反应体系中可同时稳定地扩增3种菠萝凋萎相关病毒CP基因的靶标片段,从而实现同步、定量检测3种菠萝凋萎相关病毒。三重RT-qPCR反应体系的优化结果表明,在25 μL的三重RT-qPCR反应体系中,当Premix Ex Taq(2×)为13.0 μL,PMWaV-1 目的基因上下游各360 nmol/L,PMWaV-2目的基因上下游各440 nmol/L,PMWaV-3目的基因上下游各360 nmol/L,PMWaV-1、PMWaV-2 和PMWaV-3目的基因扩增所用探针分别为320,360,320 nmol/L时,3种病毒的CP基因目的片段均可稳定扩增(图2)。
2.3 三重RT-qPCR标准曲线
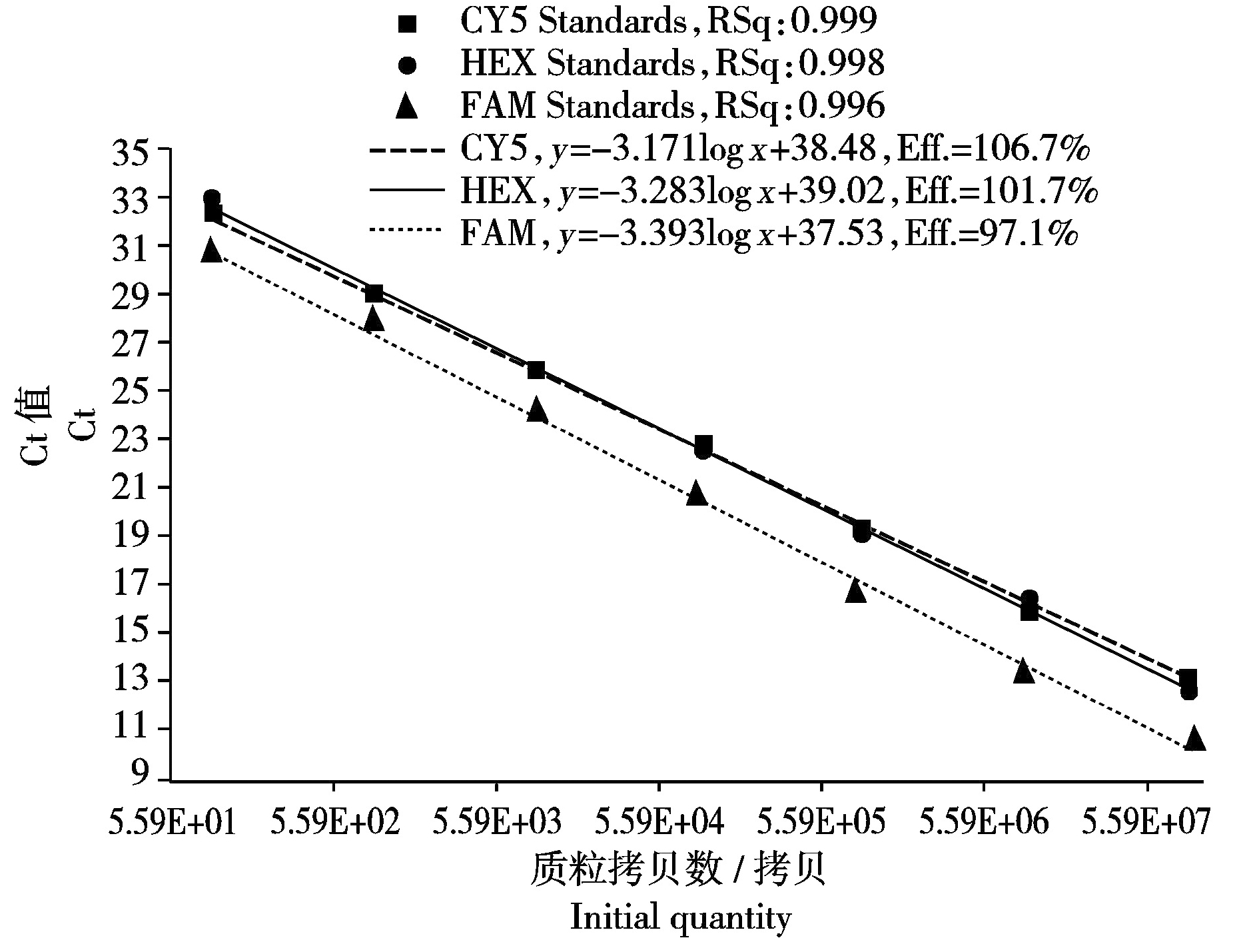
以质粒标准品浓度的log值为横坐标,实时荧光定量RT-PCR扩增曲线Ct值作为纵坐标,以10倍梯度稀释的质粒标准品作为模板进行三重RT-qPCR检测,根据不同的扩增曲线构建3种PMWaVs的标准曲线(图3)。其中,PMWaV-1扩增的标准曲线是y=-3.283logx+39.02,扩增效率和线性扩增的标准曲线是y=-3.393logx+37.53,相关系数(R2)分别是101.7%和0.999;PMWaV-2扩增效率和线性相关系数(R2)分别是97.1%和0.998;PMWaV-3扩增的标准曲线是y=-3.171logx+38.48,扩增效率和线性相关系数(R2)分别是106.7%和0.996。试验数据表明PMWaV-1、PMWaV-2和PMWaV-3的CP基因目的片段均可在同一反应体系中稳定扩增,且线性相关系数表现良好,可信度较高,可用于进一步的相关试验。
2.4 三重RT-qPCR检测方法的测评结果
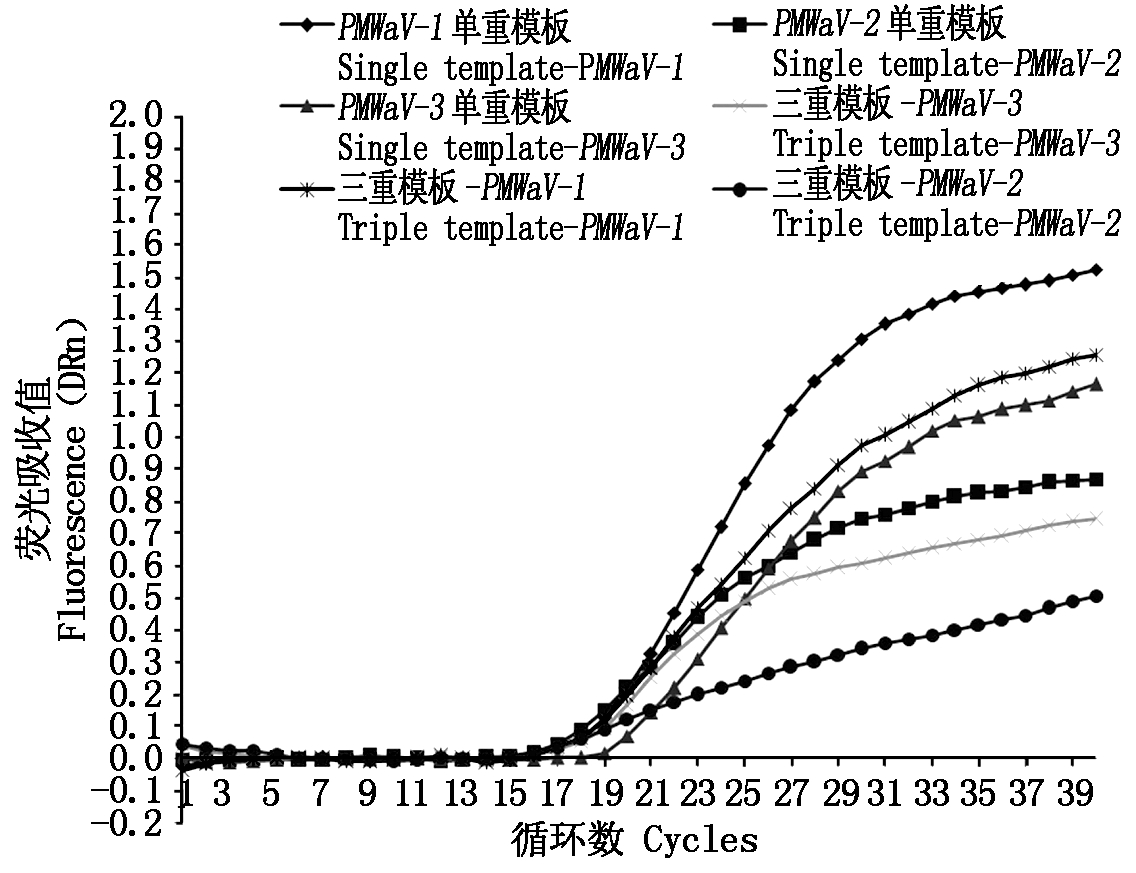
2.4.1 抗干扰性测评结果 三重RT-qPCR抗干扰试验结果表明,在三重实时荧光定量RT-PCR反应体系中只加入单一病毒目的基因的重组质粒模板和同时加入3种病毒目的基因的重组质粒模板进行检测,相同病毒在不同反应体系下的扩增曲线都较为接近(图4),而Ct值差距均在1.48之内(表3)。
2.4.2 灵敏度测评结果 实时荧光定量研究中,当Ct值大于35时,定量检测结果不准确,可视为阴性14-15,所以,由图5可以看出,三重RT-qPCR检测方法对PMWaV-1、PMWaV-2和PMWaV-3的最低检测限分别为99,98,868拷贝/μL(图5)。这表明本研究初步建立的三重实时荧光定量RT-PCR检测方法对PMWaV-1、PMWaV-2、PMWaV-3都具有良好的灵敏度。
表3 三重RT-qPCR检测方法抗干扰试验数据
Tab.3 The anti-interference test data of triple RT-qPCR

试验模板 Template Ct值(PMWaV-1检测)CtofdetectingPMWaV-1Ct值(PMWaV-2检测)CtofdetectingPMWaV-2Ct值(PMWaV-3检测)CtofdetectingPMWaV-3pMDTM-18T-PMWaV-1-CP19.41--pMDTM-18T-PMWaV-2-CP-17.71-pMDTM-18T-PMWaV-3-CP--20.28混合质粒模板(3种病毒)19.5418.5318.80Mixedplasmidtemplate(3PMWaVs)
2.4.3 重复性 三重RT-qPCR检测方法重复性试验的结果表明,试验设置的3个浓度梯度,每个浓度的3次重复中,含PMWaV-1、PMWaV-2、PMWaV-3目的片段的三重混合质粒模板均能获得稳定扩增。由表4可见,RT-qPCR扩增曲线Ct值的分析结果表明,三重实时荧光定量RT-PCR扩增曲线的Ct值标准差(SD)都在0.267以内,变异系数(CV)都在1.44%以内,这说明本研究建立的三重实时荧光定量检测方法稳定性良好。
3 讨论与结论
3.1 PMWaV检测技术
PMWaV是菠萝凋萎病的主要病原物之一,为减少菠萝凋萎病造成的田间损失,专家学者们针对PMWaV研发出一系列检测手段,包括免疫电镜检测[16]、酶联免疫吸附[17]、组织免疫印记[18]和RT-PCR等方法。相对于前人的研究只专注于病毒的定性分析和单一病毒的定量分析,本研究建立的三重实时荧光定量RT-PCR方法不仅可在同一反应体系中同时定性检测PMWaV-1、PMWaV-2和PMWaV-3,还可根据构建的标准曲线对3种病毒进行定量分析。根据文献检索结果,本研究首次报道同步定量检测PMWaV-1、PMWaV-2和PMWaV-3的三重RT-PCR方法,为PMWaV的定性定量分析提供技术基础,也丰富了PMWaV的检测技术体系。
表4 PMWaV-1、PMWaV-2、PMWaV-3三重实时荧光定量RT-PCR检测方法重复性试验统计结果
Tab.4 Statistical analysis results of reproducibility test of triple RT-qPCR for PMWaV-1,PMWaV-2,PMWaV-3
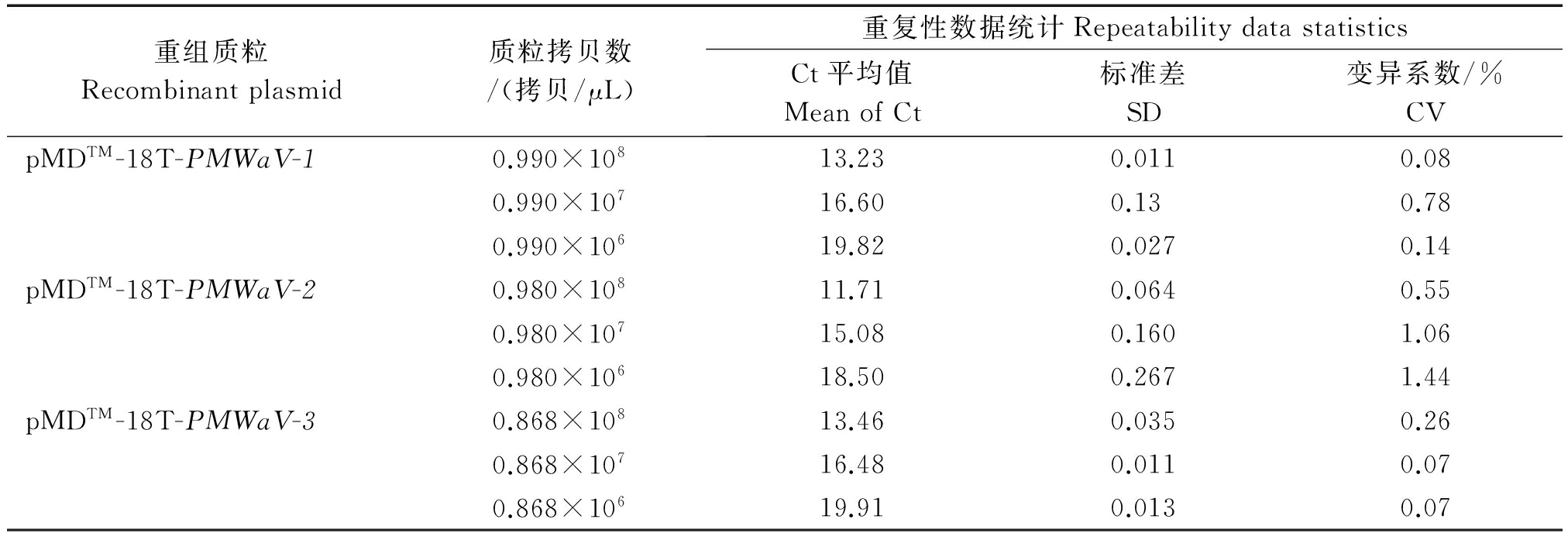
重组质粒Recombinantplasmid质粒拷贝数/(拷贝/μL)重复性数据统计RepeatabilitydatastatisticsCt平均值MeanofCt标准差SD变异系数/%CVpMDTM-18T-PMWaV-10.990×10813.230.0110.080.990×10716.600.130.780.990×10619.820.0270.14pMDTM-18T-PMWaV-20.980×10811.710.0640.550.980×10715.080.1601.060.980×10618.500.2671.44pMDTM-18T-PMWaV-30.868×10813.460.0350.260.868×10716.480.0110.070.868×10619.910.0130.07
3.2 多重RT-qPCR反应体系优化
多重实时荧光定量RT-PCR技术是指可在同一反应体系中同时扩增数个不同的片段,从而实现对不同种类的植物病毒进行同步定性定量分析。反应体系的优化是多重实时荧光定量PCR检测方法建立的关键技术之一,因为在同一个反应体系里同时扩增不同的靶标片段,这一反应体系里不仅需要常规PCR中的反应因子(如DNA聚合酶、缓冲液、dNTPs等),还需要在这一反应体系中具有不同目标基因片段的不同模板,还有针对各个靶标基因的引物和探针等。同一反应体系中多个引物和探针形成二聚体或发卡结构的概率明显增高,而多重RT-qPCR的扩增效率也易被影响。郭立新等[19]在试验中优化了实时荧光定量PCR的模板、Mg2+、引物和探针等因子的使用浓度,使其更有效的应用于苹果茎沟病毒的定量、定性检测。Henegariu等[20]通过多个试验研究PCR反应因子(包括使用浓度、退火温度等)对多重PCR的影响,结果发现引物的浓度、缓冲液用量和退火温度等因子均对多重PCR的反应效率有影响。Johnson等[21]在建立同步定量检测番茄细菌性溃疡病病原菌和凤果花叶病毒的双重qPCR技术时,发现引物和探针使用浓度比例对目标基因的扩增效率影响较大,而探针浓度对目标片段的扩增效率没有影响,但是探针与引物浓度的比率对扩增效率影响很大。参照前人的研究策略,本研究在建立PMWaV-1、PMWaV-2、PMWaV-3三重RT-qPCR检测方法的过程中,着重优化了三重RT-qPCR反应体系中的探针浓度、缓冲液浓度和引物浓度。优化后的三重RT-qPCR反应体系可稳定地扩增目标病毒的靶标片段,且3种病毒目标片段的扩增效率均符合Arezi等[22]提出的合理扩增效率(80%~115%),可用于同步定量检测PMWaV-1、PMWaV-2和PMWaV-3。
本研究根据PMWaV-1、PMWaV-2和PMWaV-3的CP基因分别设计引物和TaqMan探针(携带不同荧光标记),通过制备重组质粒标准品和优化反应体系,初步建立PMWaV-1、PMWaV-2、PMWaV-3三重RT-qPCR检测方法,可用于PMWaV-1、PMWaV-2,PMWaV-3 3种病毒快速同步定量检测。本方法的初步建立可为菠萝无毒种苗生产过程中的病毒快速定性定量检测技术的进一步研发和改进提供试验基础,也可为菠萝凋萎病毒复合侵染作用机制的进一步研究提供技术支持。
参考文献:
[1] Melzer M,Karasev A,Sether D,et al.Nucleotide sequence,genome organization and phylogenetic analysis of pineapple mealybug wilt-associated virus-2[J].The Journal of General Virology,2001,82(Pt 1):1-7.
[2] Melzer M,Sether D,Karasev A,et al.Complete nucleotide sequence and genome organization of pineapple mealybug wilt-associated virus-1[J].Archives of Virology,2008,153(4):707-714.
[3] 徐迟默.菠萝凋萎病毒研究进展[J].热带作物学报,2009,30(5):718-724.
[4] 李运合,莫忆伟,习金根,等.应用RT-PCR方法检测菠萝凋萎病病毒[J].热带作物学报,2010,31(6):1003-1008.
[5] 吴丽亭,杨晓琪,杨贞爱,等.我国南方三省菠萝病毒种类的分子鉴定[C]//中国植物病理学会2010年学术年会论文集,厦门:中国农业科学技术出版社,2010:455.
[6] Sether D M,Melzer M J,Busto J,et al.Diversity and mealybug transmissibility of ampeloviruses in pineapple[J].Plant Disease,2005,89(5):450-456.
[7] Gambley C F,Steele V,Geering A ,et al.The genetic diversity of ampeloviruses in Australian pineapples and their association with mealybug wilt disease[J].Australasian Plant Pathology,2008,37(2):95-105.
[8] Sether D,Hu J.Closterovirus infection and mealybug exposure are necessary for the development of mealybug wilt of pineapple disease[J].Phytopathology,2002,92(9):928-935.
[9] Sipes B S,Sether D M,Hu J S.Interactions between Rotylenchus reniformis and Pineapple mealybug wilt associated virus-1 in pineapple[J].Plant Disease,2002,86(9):933-938.
[10] 胡加谊,罗志文,范鸿雁,等.菠萝凋萎相关病毒-2实时荧光定量RT-PCR检测方法的建立[J].园艺学报,2014,41(6):1257-1266.
[11] 胡加谊,李向宏,罗志文,等.菠萝凋萎相关病毒-3实时荧光定量PCR检测方法的建立[J].果树学报,2015(1):156-162.
[12] 胡加谊,罗志文,李向宏,等.菠萝凋萎相关病毒-1实时荧光定量RT-PCR检测体系的建立与应用[J].植物保护,2014(6):116-121, 125.
[13] 罗志文.海南省菠萝主要病原真菌鉴定及病原病毒多重RT-PCR检测体系的建立[D].海口:海南大学,2011.
[14] 苗立中, 沈志强, 韩文瑜. 副猪嗜血杆菌荧光定量PCR检测方法的建立[J].动物医学进展, 2012, 33(11):85-89.
[15] 伍妙梨, 袁 文, 饶 丹,等. 胆汁螺杆菌实时荧光定量PCR检测方法的建立[J].中国比较医学杂志, 2015(10):59-63.
[16] Gunasinghe U B,German T L.Purification and partial characterization of a virus from pineapple[J].Phytopathology,1989(70):1337-1341.
[17] Hu J S,Sether D M,Liu X P,et al.Use of a tissue blotting immunoassay to examine the distribution of pineapple closterovirus in Hawaii[J].Plant Disease,1997,81(10):1150-1154.
[18] Hu J S,Sether D M,Ullman D E.Detection of pineapple closterovirus in pineapple plants and mealybugs using monoclonal antibodies[J].Plant Pathology,1996,45(5):829-836.
[19] 郭立新,向本春,朱水芳.苹果茎沟病毒实时荧光RT-PCR反应体系的优化[J].北方园艺,2009(3):8-11.
[20] Henegariu O,Heerema N,Dlouhy S,et al.Multiplex PCR:critical parameters and step-by-step protocol[J].BioTechniques,1997,23(3):504-511.
[21] Johnson K L,Walcott R R.Progress towards a Real-time PCR assay for the simultaneous detection of clavibacter michiganensis subsp michiganensis and pepino Mosaic virus in tomato seed[J].Journal of Phytopathology,2012,160(7/8):353-363.
[22] Arezi B,Xing W,Sorge J,et al.Amplification efficiency of thermostable DNA polymerases[J].Analytical Biochemistry,2003,321(2):226-235.
Establishment of a Triple RT-qPCR Method for the Simultaneous Detecting of PMWaV-1,PMWaV-2 and PMWaV-3
HU Jiayi1,2,LUO Zhiwen1,HE Fan1,LI Xianghong1,HU Fuchu1,FAN Hongyan1,LIU Zhixin3,ZHANG Zhili1
(1.Institute of Tropical Fruit Trees in Hainan Academy of Agricultural Sciences,Haikou Investigation Station of Tropical Fruit Trees in Ministry of Agriculture,Key Laboratory of Tropical Fruit Tree Biology of Hainan Province,Haikou 571100,China;2.Huangpu Entry-Exit Inspection and Quarantine Bureua,Guangzhou 510730,China;3.Institute of Tropical Bioscience and Biotechnology,Chinese Academy of Tropical Agricultural Sciences,Haikou 571101,China)
Abstract:The objective of this paper was to provide a technique for quantitative and quanlitative studies of PMWaV by establishing the method of Real-time Fluorescent Quantitative RT-PCR(RT-qPCR)for simultaneous quantitative detection ofPMWaV-1,PMWaV-2 and PMWaV-3.Primers and probes were designed and synthesized according to the CP gene of PMWaV-1,PMWaV-2 and PMWaV-3,respectively.After optimized the reaction system of triple RT-qPCR,the standard curves were generated by purified DNA of the recombined plasmid of PMWaV-1,PMWaV-2,PMWaV-3 coat protein gene,respectively.And the method of RT-qPCR for the simultaneous detection of PMWaV-1,PMWaV-2,PMWaV-3 had been improved.The amplification efficiency of PMWaV-1,PMWaV-2,PMWaV-3 in the RT-qPCR method was up to 101.7%,97.1%,106.7%,respectively.Meanwhile ,with the R2 between 0.996 and 0.999.The sensibility test of triple RT-qPCR syetem showed the detection limit of quantification for PMWaV-1,PMWaV-2,PMWaV-3 was 99,98 and 868 copies,respectively.Moreover,repeats experiment datas showed that standard deviation was below 0.26 and variable coefficient was below 1.44%.This study indicated that the method for simultaneous detection and quantification of PMWaV-1,PMWaV-2,PMWaV-3 was a fast,sably and sensitive reaction system,which could be the technological base for quantitative and quanlitative studies of PMWaV.
Key words:Mealybug Wilt of Pineapple;Dctection method;RT-qPCR;PMWaV;TaqMan probe
收稿日期:2017-01-20
基金项目:海南省重点研发项目(ZDYF2016035); 公益性行业(农业)科研专项经费项目(201203021);国家自然科学基金项目(31260460)
作者简介:胡加谊(1988-),男,广东梅州人,研究实习员,硕士,主要从事果树植物病理学研究。
通讯作者:张治礼(1970-),男,安徽临泉人,研究员, 博士,主要从事果树生理与分子生物学研究。
中图分类号:S432.4;Q78
文献标识码:A
文章编号:1000-7091(2017)02-0038-07
doi:10.7668/hbnxb.2017.02.003