蓝莓VcMYB启动子克隆及其功能初步分析
史文君1,滕 珂2,陈 露1,侯智霞1,苏淑钗1
(1.北京林业大学,省部共建森林培育与保护重点实验室,蓝莓研究与发展中心,北京 100083;2.北京林业大学 林学院,草坪研究所,北京 100083)
摘要:为探究VcMYB启动子在转录过程中如何发挥调控作用,利用FPNI-PCR法从蓝莓中克隆到调控原花青素合成相关的转录因子VcMYB的768 bp启动子序列。用PLACE和Plant CARE在线启动子预测工具分析了该启动子,结果表明其序列中存在启动子的基本元件CAAT-box和TATA-box,还包含一系列的响应元件,如光响应元件、低温响应元件、防御与胁迫响应元件和茉莉酸甲酯响应元件等。为进一步分析该启动子的功能,构建了该基因启动子与GUS基因融合的植物表达载体VcMYBpro::GUS,并用农杆菌转化拟南芥。对转基因拟南芥进行GUS组织化学染色分析,结果表明该VcMYB启动子能驱动GUS基因在转基因拟南芥中表达,并且经脱落酸(ABA)、4 ℃低温、LED光照和持续光照处理后,转基因拟南芥中GUS的表达活性增强,推测该基因受ABA、低温和光的调控。
关键词:蓝莓;VcMYB;启动子;GUS基因;原花青素
高等植物基因表达受到复杂的调控,根据基因调控在同一事件中发生的先后顺序分为转录前调控、转录水平调控、转录后水平调控和翻译水平调控等。启动子(Promoter)是位于结构基因5′端上游的DNA序列,能活化RNA聚合酶,使其与模板准确结合,从而起始转录,是转录调控的中心[1-2]。因此,对启动子的结构、功能进行研究有着非常重要的理论意义。
MYB转录因子广泛存在于植物中,是植物中最大的转录因子家族之一。根据所含MYB结构域的数量,MYB转录因子可以分为4个亚类:1R(R1/2,R3-MYB)、2R(R2R3-MYB)、3R(R1R2R3-MYB)和4R(4个类似R1/R2结构的重复)[3-4]。其中R2R3-MYB蛋白是植物中最大的一类,其参与初生和次生代谢反应(类黄酮,如原花青素)、激素信号转导、发育调控,以及对生物和非生物胁迫应答等生物学过程[5]。MYB转录因子作为反式作用因子调控下游基因的表达,其表达也受上游基因的调控。在拟南芥中,WD40蛋白TTG1调控各途径中的MYB基因,形成的MBW复合体(MYB-bHLH-WD40 transcription factors,MBW complex)结合到花青素或原花青素生物合成基因的启动子上,从而调控MYB下游结构基因的表达[6]。另外,研究发现有MYB蛋白直接调控转录因子。拟南芥中参与细胞分化的转录因子CAPRICE(CPC)是R3型MYB,R2R3-MYB蛋白WEREWOLF(WER)通过结合到启动子区域的方式直接调控CPC转录因子[7]。因此,研究MYB启动子的结构和功能,对于研究代谢调控有重要意义。
原花青素(Proanthocyanidin,PA),又称为缩合单宁(Condense tannin),是植物类黄酮次生代谢的末端产物之一,是由黄烷酮类形成的寡聚或多聚化合物。原花青素在自然界中广泛存在,被认为有利于抵御生物和非生物胁迫。近年来,关于植物中参与原花青素代谢调控的R2R3-MYB转录因子的研究逐渐增多。首先在拟南芥中报道,AtTT2调控拟南芥种子中原花青素的合成[8]。后续在葡萄(VvMYBPA1、VvMYBPA2)[9-10]、柿(DkMyb2和DkMyb4)[11-13]、油桃(PpMYBPA1)[14]、杨树(PtMYB134)[15]等植物中得到的R2R3-MYB转录因子激活原花青素的合成。另外,有研究发现FaMYB1 和VvMYBC2-L1等转录因子的表达下调原花青素合成基因,从而减少了原花青素的积累[16-17]。这些研究大多关注MYB转录因子对原花青素合成途径中的关键酶基因的调控及其对原花青素积累的影响,而关于原花青素合成相关的MYB转录因子启动子的报道较少。柿果实中含有大量的PA,DkMyb4是柿中调控PA合成途径基因的MYB转录因子。研究发现DkbZIP5识别DkMyb4启动子区的ABA响应元件ABRE,作为ABA依赖的DkMyb4的直接调节因子。ABA信号很可能通过DkbZIP5激活DkMyb4的方式参与柿果实原花青素的合成[13]。桃中调节PA合成的R2R3-MYB转录因子PpMYB7能激活PpLAR1的转录,而不能激活PpANR。通过双荧光素酶报告基因检测发现,存在外源ABA时PpZIP5能激活PpMYB7的启动子[18]。
原花青素是积累在蓝莓果实中的3种常见类黄酮之一[19]。目前,已有研究报道从高丛蓝莓(Vaccinium corymbosum)中分离得到了一个R2R3-MYB转录因子VcMYBPA1,其与原花青素的合成有关[20]。白色变异越橘属浆果(Vaccinium uliginosum)中的VuMYBPA1与VcMYBPA1同源,属于MYBPA1型MYB家族成员,与果实中原花青素合成有关[21]。笔者已发表的VcMYB序列与VcMYBPA1和其他物种中与原花青素合成调控有关的MYB序列(DkMyb4,GenBank登录号为AB503701)的一致性较高。然而,对参与蓝莓原花青素代谢调控的R2R3-MYB转录因子启动子的报道较少。启动子控制基因的表达,研究蓝莓原花青素代谢调控相关的R2R3-MYB转录因子的启动子对于了解蓝莓原花青素合成的调控机制有重要意义。本研究利用FPNI-PCR(Fusion primer and nested integrated PCR)法从蓝莓中克隆得到与原花青素合成相关的R2R3-MYB类转录因子VcMYB的启动子,使用在线工具分析其序列特征,构建该启动子驱动GUS基因的表达载体并转化拟南芥。初步分析转基因拟南芥对光、低温、ABA等非生物胁迫和激素的响应情况,为进一步研究蓝莓原花青素合成相关的MYB基因的表达调控及其启动子的应用提供基础和理论依据。
1 材料和方法
1.1 试验材料
1.1.1 植物材料 供试蓝莓品种为蓝丰,采自北京林业大学苗圃。野生型拟南芥(Arabidopsis thaliana,Columbia ecotype)种子购自美国拟南芥生物资源中心(Arabidopsis Biological Resource Center,ABRC)。
1.1.2 生化试剂 植物表达载体pCAMBIA1391Z由北京林业大学草坪研究所惠赠。pEASY-T1载体购自北京全式金生物技术(TransGen Biotech)有限公司。引物的合成委托生工生物工程(上海)股份有限公司北京分公司完成。测序由北京六合华大基因科技股份有限公司完成。内切酶购自TaKaRa公司。大肠杆菌(E.coli)DH10B感受态细胞和Seamless Assembly Cloning Kit购自中美泰和生物技术(北京)有限公司。农杆菌GV3101由本实验室保存。其他生化试剂均为国产分析纯。
1.2 试验方法
1.2.1 植物培养 将拟南芥种子经70%的乙醇表面灭菌,吸除乙醇,加入1 mL无菌水洗1次,再加入2%次氯酸钠溶液处理10 min,吸出次氯酸钠溶液,用无菌水洗5次。将无菌的拟南芥种子播种在MS培养基上,4 ℃暗培养3 d,然后放在(22 ± 1)℃,16 h光照/8 h黑暗的人工气候箱中培养。生长14 d后,将拟南芥幼苗移栽到草炭土∶蛭石∶珍珠岩=1∶2∶1的混合基质中,置于人工气候箱中培养。
1.2.2 启动子序列的获得与分析 以生长健壮的蓝莓植株上的嫩叶为试验材料,用植物基因组提取试剂盒(北京天根生化科技有限公司)提取DNA。采用改良后的FPNI-PCR法[22]扩增蓝莓MYB的启动子序列,以已发表的蓝莓VcMYB(GenBank登录号:KT869024)的5′端序列为基础,设计3条特异引物M-265、M-110和M-48(表1),结合9条随机简并引物(FAD1-9)及特异引物S-1和S-2[22](表1)进行3轮PCR扩增反应,扩增条件参考Wang等[22]描述的设置。分别用引物FAD1-9、M-265和蓝莓基因组DNA进行第1轮扩增;分别用引物S-1、M-110和上一轮PCR产物为模板进行第2轮扩增;用引物S-2、M-48和第2轮扩增产物为模板进行第3轮扩增。回收第3轮PCR扩增所得的特异产物,TA克隆于pEASY-T1载体,送测序。利用DNAMAN分析所得结果。
表1 引物名称与序列
Tab.1 List of primers and sequences
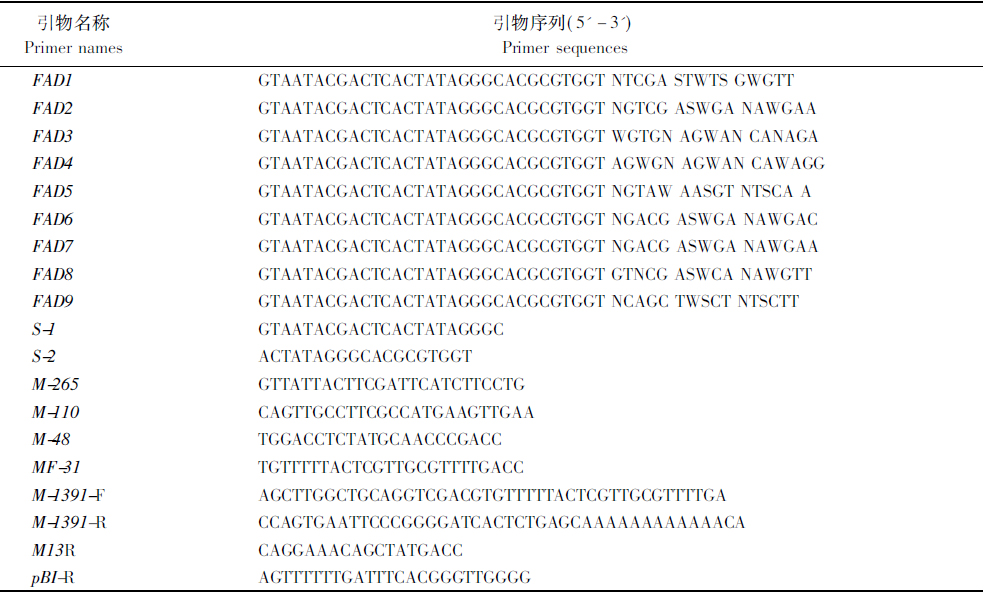
引物名称Primernames引物序列(5'-3')PrimersequencesFAD1GTAATACGACTCACTATAGGGCACGCGTGGTNTCGASTWTSGWGTTFAD2GTAATACGACTCACTATAGGGCACGCGTGGTNGTCGASWGANAW-GAAFAD3GTAATACGACTCACTATAGGGCACGCGTGGTWGTGNAGWANCANAGAFAD4GTAATACGACTCACTATAGGGCACGCGTGGTAGWGNAGWANCAWAGGFAD5GTAATACGACTCACTATAGGGCACGCGTGGTNGTAWAASGTNTSCAAFAD6GTAATACGACTCACTATAGGGCACGCGTGGTNGACGASWGANAW-GACFAD7GTAATACGACTCACTATAGGGCACGCGTGGTNGACGASWGANAW-GAAFAD8GTAATACGACTCACTATAGGGCACGCGTGGTGTNCGASWCANAWGTTFAD9GTAATACGACTCACTATAGGGCACGCGTGGTNCAGCTWSCTNT-SCTTS-1GTAATACGACTCACTATAGGGCS-2ACTATAGGGCACGCGTGGTM-265GTTATTACTTCGATTCATCTTCCTGM-110CAGTTGCCTTCGCCATGAAGTTGAAM-48TGGACCTCTATGCAACCCGACCMF-31TGTTTTTACTCGTTGCGTTTTGACCM-1391-FAGCTTGGCTGCAGGTCGACGTGTTTTTACTCGTTGCGTTTTGAM-1391-RCCAGTGAATTCCCGGGGATCACTCTGAGCAAAAAAAAAAAACAM13RCAGGAAACAGCTATGACCpBI-RAGTTTTTTGATTTCACGGGTTGGGG
所得序列经分析确定为VcMYB 5′端序列后,以基因组DNA为模板,引物MF-31和M-48进行PCR扩增。PCR反应条件为:94 ℃预变性2 min;94 ℃变性30 s,61 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃最终延伸5 min。得到的PCR产物经凝胶回收,TA克隆于pEASY-T1载体,送测序。测序结果正确的菌液提取质粒,-20 ℃保存。
启动子序列分析采用在线启动子预测工具PLACE(http://www.dna.affrc.go.jp/PLACE/)和Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)。
1.2.3 载体构建及拟南芥转化 以含VcMYB启动子序列的pEASY-T1质粒为模板,用引物M-1391-F和M-1391-R(表1)扩增启动子。用Seamless Assembly Cloning Kit将获得的PCR产物与pCAMBIA1391Z载体连接。VcMYB的启动子插入到pCAMBIA1391Z载体的GUS报告基因上游,与GUS融合,构建植物表达载体VcMYBpro::GUS。将构建好的重组质粒通过液氮冻融法转入农杆菌GV3101,然后用花序浸蘸法转化拟南芥[23]。
1.2.4 转基因拟南芥的获得及其检测 将收获的拟南芥种子消毒后播种于含潮霉素(Hygromycin,25 mg/L)的MS固体培养基上,4 ℃避光培养3 d后,置于人工气候箱培养(温度(22±1)℃,光/暗周期为16 h/8 h,相对湿度65%)。14 d后初步认定长出真叶、生长良好、根正常伸长的苗为阳性苗,并将其移栽到基质中培养。生长21 d后,取拟南芥植株少量叶片提取基因组DNA,以野生型拟南芥为阴性对照,以pCAMBIA1391Z-VcMYBpro质粒为阳性对照,进行PCR检测,引物为M13R和pBI-R。PCR反应体系:DNA模板1 μL,2 × Master mix 5 μL,正反向引物各1 μL,ddH2O 2 μL。PCR反应程序为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测。幼苗继续培养至种子采收,再次进行筛选,将得到的幼苗(T2)进行后续试验。
1.2.5 拟南芥处理和GUS组织化学染色 转基因拟南芥萌发9 d后,分别进行处理。试验以转化pCAMBIA1391Z空载的拟南芥为阴性对照,以转化pBI121(CaMV35S∷GUS)载体的转基因拟南芥为阳性对照,各样品均设置3个重复,每个重复5株。转基因苗处理过程为:第1组,未做处理的对照植株,于正常条件下培养3 d;第2组,将转基因拟南芥转移到含有10 μmol/L ABA的MS培养基上,于正常条件下培养3 d;第3组,将转基因拟南芥苗置于4 ℃培养箱中培养3 d;第4组,将转基因拟南芥在LED灯光下(红光∶蓝光=3∶1,光强同正常条件)培养3 d,其他条件同对照组;第5组,将转基因拟南芥在白光下持续光照培养3 d,其他条件同对照组。将不同处理的拟南芥幼苗进行GUS染色[24]。放置在37 ℃培养箱中过夜,染色后吸出GUS染液,加入70%乙醇脱色2~3次,使植物绿色完全褪去。用体视显微镜(LEICA M205FA)观察,拍照。
2 结果与分析
2.1 VcMYB的启动子克隆
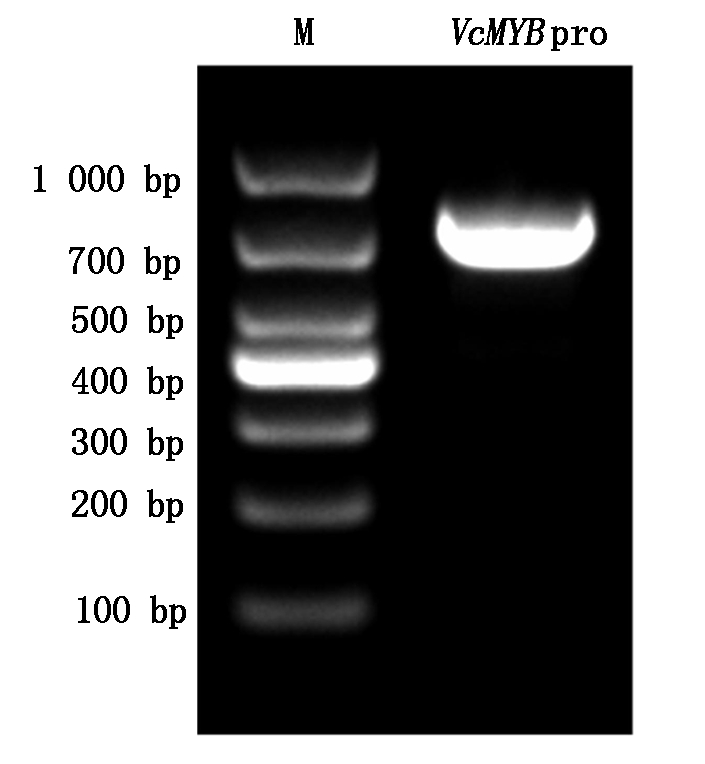
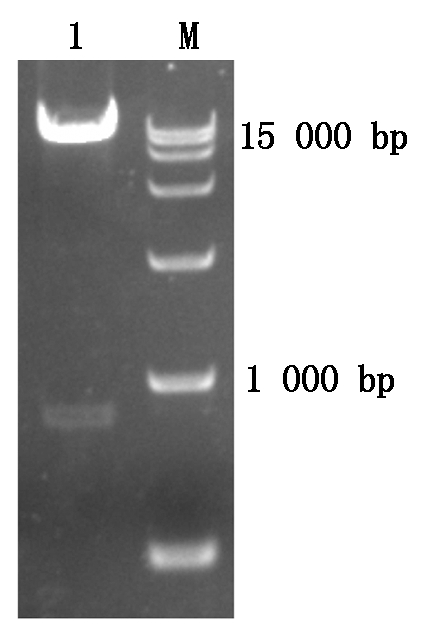
将3轮PCR产物在1%琼脂糖凝胶电泳上检测,第1轮的PCR产物呈弥散形的非特异带。将第2,3轮的PCR产物如图1分别点入相邻泳道。以引物FAD4和M-265扩增得到的第1轮产物为模板再进行第2轮PCR,以第2轮PCR产物为模板,用引物S-2、M-48进行第3轮扩增,其PCR扩增效率比其他的扩增效率高,得到如图1泳道FAD4-3中的特异片段,约1 000 bp。回收该特异产物,经序列分析确定其为VcMYB的5′端序列。用引物MF-31和M-48通过PCR扩增得到768 bp启动子序列(图2),将其命名为VcMYBpro。
2.2 VcMYB启动子序列分析
利用预测工具对克隆得到的序列进行分析,结果如表2所示,该启动子除了含有TATA-box和CAAT-box等基本顺式元件,还有低温顺式元件(LTR)、防御与胁迫响应元件(TC-rich repeats)、光响应元件(GT1-motif)、蛋白结合位点(BoxⅢ),以及茉莉酸甲酯响应顺式元件(CGTCA-motif和TGACG-motif)等。
2.3 表达载体鉴定
重组载体VcMYBpro::GUS经HindⅢ和EcoR Ⅰ 双酶切,电泳结果如图3所示,得到的片段大小与预期结果一致,目的片段约800 bp,表明表达载体构建成功。
2.4 转基因拟南芥鉴定
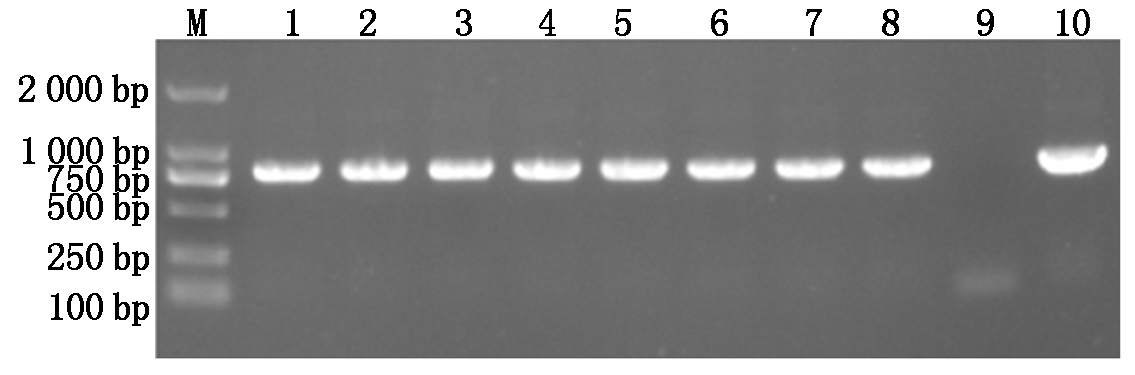
挑选生长良好的抗性植物并对其进行检测,结果如图4,PCR扩增出预期的特异片段,与阳性对照大小一致,而野生型拟南芥未扩增出任何片段,说明获得了转VcMYB启动子的拟南芥。
表2 VcMYB启动子序列中的顺式作用元件
Tab.2 Cis-acting elements of the VcMYB promoter
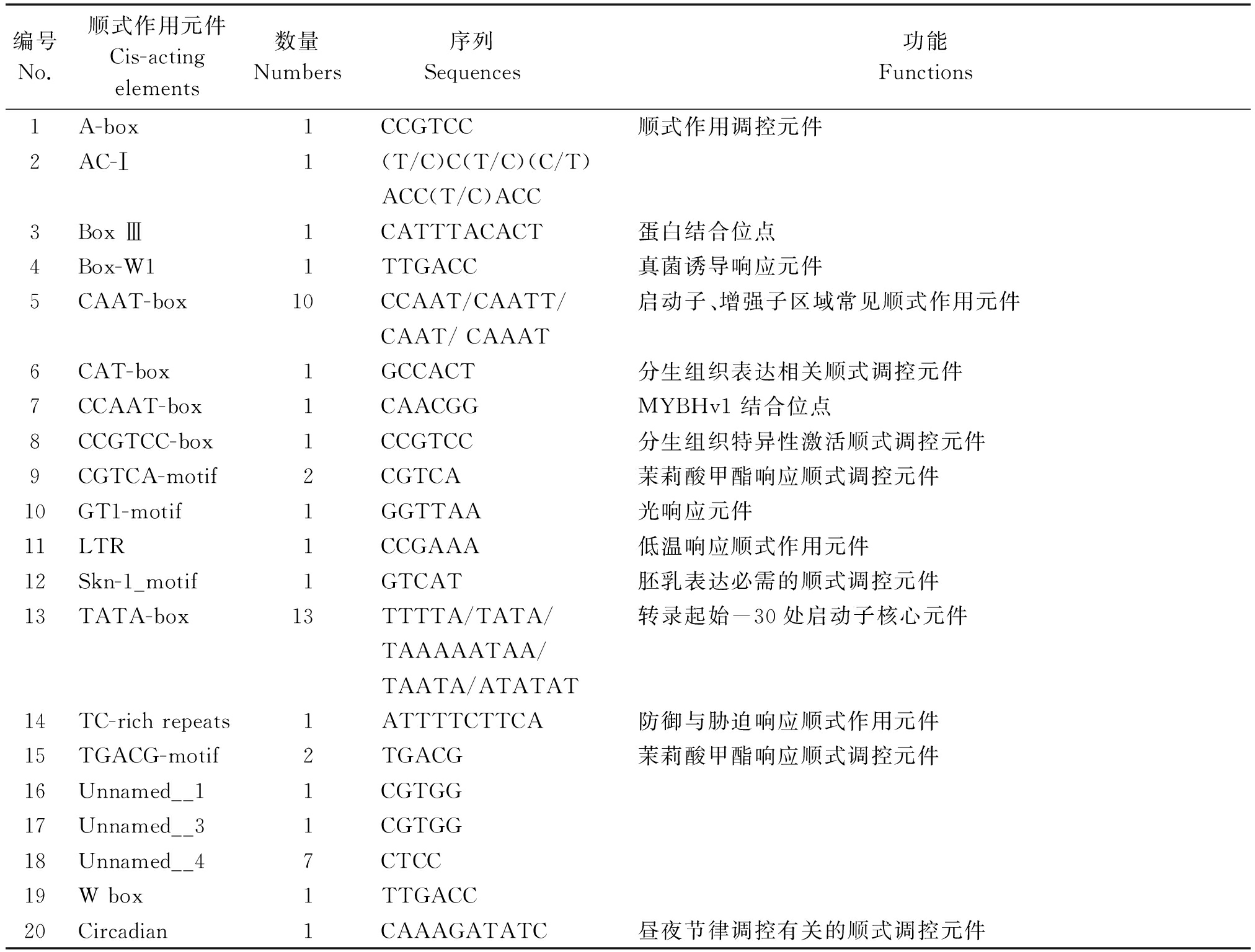
编号No.顺式作用元件Cis-actingelements数量Numbers序列Sequences功能Functions1A-box1CCGTCC顺式作用调控元件2AC-Ⅰ1(T/C)C(T/C)(C/T)ACC(T/C)ACC3BoxⅢ1CATTTACACT蛋白结合位点4Box-W11TTGACC真菌诱导响应元件5CAAT-box10CCAAT/CAATT/启动子、增强子区域常见顺式作用元件CAAT/CAAAT6CAT-box1GCCACT分生组织表达相关顺式调控元件7CCAAT-box1CAACGGMYBHv1结合位点8CCGTCC-box1CCGTCC分生组织特异性激活顺式调控元件9CGTCA-motif2CGTCA茉莉酸甲酯响应顺式调控元件10GT1-motif1GGTTAA光响应元件11LTR1CCGAAA低温响应顺式作用元件12Skn-1_motif1GTCAT胚乳表达必需的顺式调控元件13TATA-box13TTTTA/TATA/转录起始-30处启动子核心元件TAAAAATAA/TAATA/ATATAT14TC-richrepeats1ATTTTCTTCA防御与胁迫响应顺式作用元件15TGACG-motif2TGACG茉莉酸甲酯响应顺式调控元件16Unnamed__11CGTGG17Unnamed__31CGTGG18Unnamed__47CTCC19Wbox1TTGACC20Circadian1CAAAGATATC昼夜节律调控有关的顺式调控元件
2.5 转基因拟南芥胁迫处理及GUS组织化学染色
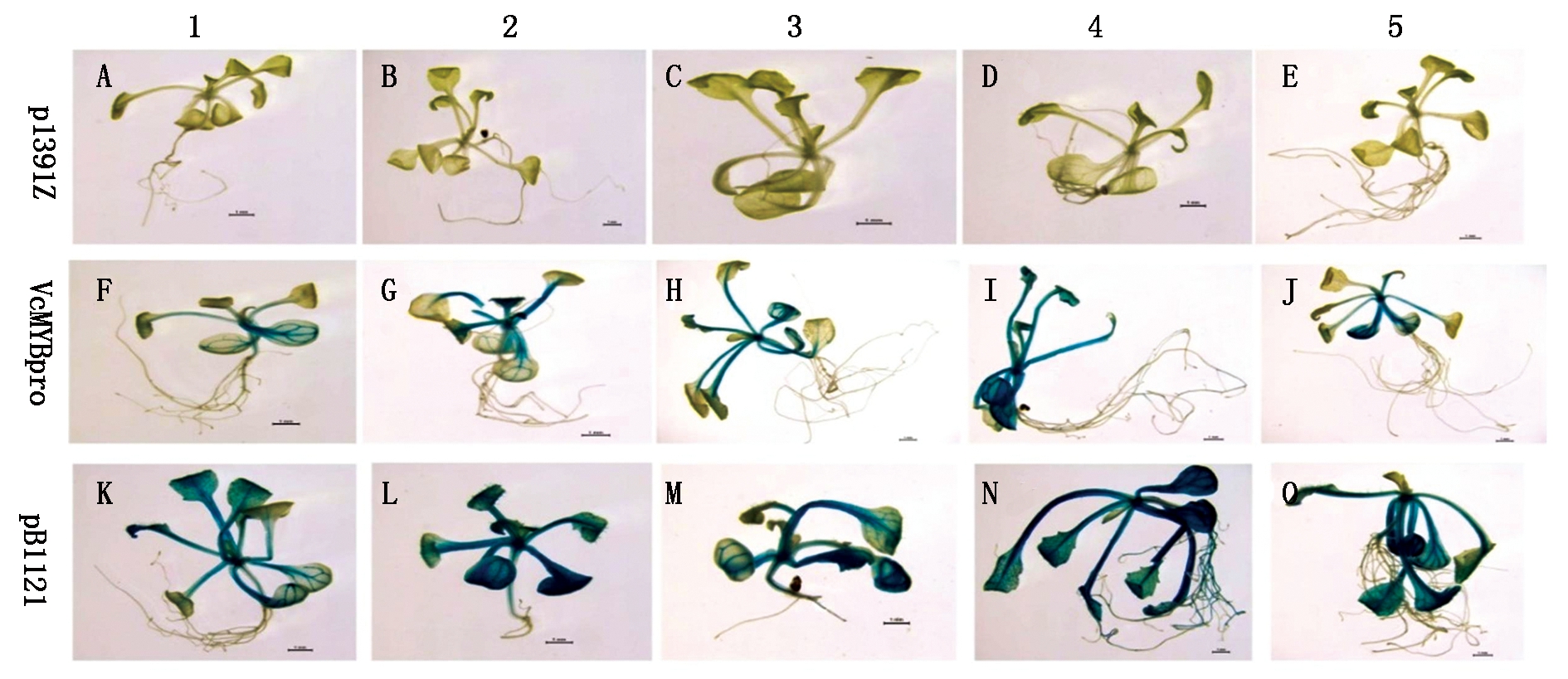
为了检测VcMYBpro启动子在拟南芥植株胁迫条件下的表达特性,将胁迫处理后的转基因植株进行GUS染色观察。转基因拟南芥的组织化学检测结果(图5)显示,正常条件和任何非生物胁迫条件下的转p1391Z空载体的拟南芥各组织均无着色,而转pBI121载体的拟南芥都着色。含VcMYBpro载体的转基因拟南芥的叶片、叶柄和根均检测到不同程度的着色,说明其叶片、叶柄和根均有GUS活性。
转VcMYBpro启动子的拟南芥在非生物胁迫处理后,叶片和叶柄的蓝色明显加深。
3 讨论与结论
近年来,在不同物种中鉴定出了调控原花青素生物合成的R2R3-MYB转录因子,而关于PA响应光条件的调控研究较少。葡萄果实中的VvMYBPA1和VvMYBPA2对光环境响应[25]。从苹果中克隆得到的PA合成调控相关的MYB转录因子MdMYB9光条件的调控研究较少。葡萄果实中的VvMYBPA1和VvMYBPA2
A~E. 阴性对照, 转pCAMBIA1391Z空载的拟南芥植株; F~J. 转VcMYBpro::GUS载体的转基因拟南芥苗; K~Q. 阳性对照, 转pBI121空载的转基因拟南芥苗; 1. 对照组, A、F和K不做任何处理; 2~5分别为经ABA、4 ℃低温、LED光、持续光照处理3 d后的拟南芥苗。
A-E. Negative control, pCAMBIA1391Z empty vector control transgenic A.thaliana; F-J.VcMYBpro::GUS transgenic A. thaliana; K-Q. Positive control, pBI121(CaMV35S::GUS)transgenic A. thaliana;1.Control(A, F and K), without treatment; 2.ABA treatment; 3.4 ℃low-temperature treatment; 4. LED light; 5.Continuous light.
图5 转基因拟南芥GUS组织化学染色
Fig.5 Results of GUS histochemical staining for transgenic Arabidopisis thaliana
对光环境响应[25]。从苹果中克隆得到的PA合成调控相关的MYB转录因子MdMYB9和MdMYB11能被强光诱导[26]。大多数已鉴定的类黄酮生物合成的R2R3-MYB转录因子与bHLH和WD40重复蛋白形成MBW调控复合体,其中bHLH和WD40在光调控类黄酮生物合成过程中的作用不清楚。不仅在类黄酮结构基因启动子含有光调控单元(LRU)及其他光响应元件,在R2R3-MYB转录因子的启动子中也含有光响应元件。比如荔枝LcMYB1的启动子中含有ACE、Box4、G-Box、GA-motif和GAG-motif等光响应顺式作用元件[27]。另外,葡萄R2R3-MYB转录因子VvMYBF1的表达受到光的诱导,VvMYBF1控制黄酮醇合酶1基因(VvFLS1)的转录。分析VvMYBF1启动子序列,发现其含有光调控单元(LRU)[28]。启动子中存在的LRU是基因光响应的指示器,该单元内含bZIP识别元件(ACE)[29]。迄今为止,从光感到通过R2R3-MYB转录因子诱导果实中特定的类黄酮化合物合成的类黄酮生物合成的信号途径尚不清楚。研究发现柿果实中的DkbZIP5识别PA合成相关的MYB转录因子DkMyb4启动子区域的ABA响应元件,作为ABA依赖的DkMyb4的直接调节因子。ABA信号可能通过DkZIP5激活DkMyb4的方式参与柿果实原花青素积累[13]。Eun等[30]获得了蜜柑类胡萝卜素异构酶基因启动子序列,并构建启动子及其2个缺失序列与GUS报告基因的融合载体,转化拟南芥。结果表明,含最短启动子序列的转基因拟南芥响应低温胁迫,GUS活性增强。本研究中克隆得到蓝莓R2R3-MYB转录因子的启动子序列,该序列所含光响应顺式作用元件为GT1-motif(GGTTAA)、防御和胁迫响应元件(TC-rich repeats)、低温顺式元件LTR(CCGAAA)。对转基因拟南芥用LED光照、持续光照、ABA、低温处理,GUS表达活性明显增强,启动GUS基因在转基因拟南芥不同组织中的表达,说明该启动子能驱动GUS基因,该基因受光、ABA和低温的调控。该基因响应光信号和外源激素ABA的方式,与其他转录因子的相互作用,该启动子的功能及其在PA合成过程的调控等仍需进一步深入地研究。
本试验在之前克隆蓝莓原花青素合成相关的R2R3-MYB转录因子的基础上,利用FPNI-PCR法分离得到了VcMYB上游768 bp的启动子序列,通过在线分析软件分析,发现其除了存在基本元件CAAT-box和TATA-box等常见作用元件外,还有光响应、低温响应、防御与胁迫响应和MeJA响应的作用元件。构建了VcMYB启动子驱动GUS的表达载体VcMYBpro::GUS,并转化拟南芥。转基因拟南芥组化染色结果显示,VcMYBpro能驱动GUS基因在转基因拟南芥植株中表达,并且在低温、ABA、LED光和持续光处理3 d后,转基因植株叶片和叶柄的蓝色明显加深,说明GUS表达活性增强,很可能是启动子上的作用元件对光、低温和激素等非生物胁迫条件的响应。后续研究中将进行启动子系列缺失试验,通过不同的缺失启动子转化植物确定特定序列的功能,从而为深入研究蓝莓原花青素代谢调控的分子机理奠定基础。
参考文献:
[1] 朱丽萍,于 壮,邹翠霞,等.植物逆境相关启动子及功能[J].遗传,2010,32(3):229-234.
[2] 朱玉贤,李 毅.现代分子生物学[M].2版.北京:高等教育出版社,2002.
[3] Liu J Y,Osbourn A,Ma P D.MYB transcription factors as regulators of phenylpropanoid metabolism in plants[J].Molecular Plant,2015,8(5):689-708.
[4] 牛义岭,姜秀明,许向阳.植物转录因子MYB基因家族的研究进展[J].分子植物育种,2016(8):2050-2059.
[5] Dubos C,Stracke R,Grotewold E,et al.MYB transcription factors in Arabidopsis[J].Trends in Plant Science,2010,15(10):573-581.
[6] Petroni K,Tonelli C.Recent advances on the regulation of anthocyanin synthesis in reproductive organs[J].Plant Science,2011,181(3):219-229.
[7] Koshino-Kimura Y,Wada T,Tachibana T,et al.Regulation of CAPRICE transcription by MYB proteins for root epidermis differentiation in Arabidopsis[J].Plant and Cell Physiology,2005,46(6):817-826.
[8] Nesi N,Jond C,Debeaujon I,et al.The Arabidopsis TT2 gene encodes an R2R3 MYB domain protein that acts as a key determinant for proanthocyanidin accumulation in developing seed[J].The Plant Cell,2001,13(9):2099-2114.
[9] Bogs J,Jaffé F W,Takos A M,et al.The grapevine transcription factor VvMYBPA1 regulates proanthocyanidin synthesis during fruit development[J].Plant Physiology,2007,143(3):1347-1361.
[10] Terrier N,Torregrosa L,Ageorges A,et al.Ectopic expression of VvMybPA2 promotes proanthocyanidin biosynthesis in grapevine and suggests additional targets in the pathway[J].Plant Physiology,2009,149(2):1028-1041.
[11] Akagi T,Ikegami A,Yonemori K.DkMyb2 wound-induced transcription factor of persimmon(Diospyros kaki Thunb.),contributes to proanthocyanidin regulation[J].Planta,2010,232(5):1045-1059.
[12] Akagi T,Ikegami A,Tsujimoto T,et al.DkMyb4 is a Myb transcription factor involved in proanthocyanidin biosynthesis in persimmon fruit[J].Plant Physiology,2009,151(4):2028-2045.
[13] Akagi T,Katayama-Ikegami A,Kobayashi S A,et al.Seasonal abscisic acid signal and a basic leucine zipper transcription factor,DkbZIP5,regulate proanthocyanidin biosynthesis in persimmon fruit[J].Plant Physiology,2012,158(2):1089-1102.
[14] Ravaglia D,Espley R V,Henry-Kirk R A,et al.Transcriptional regulation of flavonoid biosynthesis in nectarine(Prunus persica)by a set of R2R3 MYB transcription factors[J].BMC Plant Biology,2013,13(1):1-14.
[15] Mellway R D,Tran L T,Prouse M B,et al.The wound-,pathogen-,and ultraviolet B-Responsive MYB134 gene encodes an R2R3 MYB transcription factor that regulates proanthocyanidin synthesis in poplar[J].Plant Physiology,2009,150(2):924-941.
[16] Paolocci F,Robbins M P,Passeri V A,et al.The strawberry transcription factor FaMYB1 inhibits the biosynthesis of proanthocyanidins in Lotus corniculatus leaves[J].Journal of Experimental Botany,2011,62(3):1189-1200.
[17] Huang Y F,Vialet S,Guiraud J ,et al.A negative MYB regulator of proanthocyanidin accumulation,identified through expression quantitative locus mapping in the grape berry[J].New Phytologist,2014,201(3):795-809.
[18] Zhou H,Lin-Wang K,Liao L,et al.Peach MYB7 activates transcription of the proanthocyanidin pathway gene encoding leucoanthocyanidin reductase,but not anthocyanidin reductase[J].Frontiers in Plant Science,2015,6:908.
[19] Prior R L,Lazarus S A,Cao G,et al.Identification of procyanidins and anthocyanins in blueberries and cranberries(Vaccinium spp.)using high-performance liquid chromatography/mass spectrometry[J].Journal of Agricultural and Food Chemistry,2001,49(3):1270-1276.
[20] Zifkin M,Jin A,Ozga J A,et al.Gene expression and metabolite profiling of developing highbush blueberry fruit indicates transcriptional regulation of flavonoid metabolism and activation of abscisic acid metabolism[J].Plant Physiology,2012,158(1):200-224.
[21] Primetta A K,Karppinen K,Riihinen K R.Metabolic and molecular analyses of white mutant Vaccinium berries show down-regulation of MYBPA1-type R2R3 MYB regulatory factor[J].Planta,2015,242(3):631-643.
[22] Wang Z,Ye S F,Li J J,et al.Fusion primer and nested integrated PCR(FPNI-PCR):a new high-efficiency strategy for rapid chromosome walking or flanking sequence cloning[J].BMC Biotechnology,2011,11(1):16697-16702.
[23] Clough S J,Bent A F.Floral Dip:a simplified method for agrobacterium-mediated transformation of Arabidopsis thaliana[J].The Plant Journal,1998,16(6):735-743.
[24] Jefferson R A,Kavanagh T A,Bevan M W.GUS fusions:beta-glucuronidase as a sensitive and versatile gene fusion marker in higher-plants[J].EMBO Journal,1987,6(13):3901-3907.
[25] Koyama K,Ikeda H,Poudel P R.Light quality affects flavonoid biosynthesis in young berries of Cabernet Sauvignon grape[J].Phytochemistry,2012,78(6):54-64.
[26] Gesell A,Yoshida K,Tran L T,et al.Characterization of an Apple TT2-type R2R3 MYB transcription factor functionally similar to the poplar proanthocyanidin regulator PtMYB134[J].Planta,2014,240(3):497-511.
[27] Lai B,Li X J,Hu B,et al.LcMYB1 is a key determinant of differential anthocyanin accumulation among genotypes,tissues,developmental phases and ABA and light stimuli in Litchi chinensis[J].PLoS One,2014,9(1):e86293.
[28] Czemmel S,Stracke R,Weisshaar B,et al.The grapevine R2R3-MYB transcription factor VvMYBF1 regulates flavonol synthesis in developing grape berries[J].Plant Physiology,2009,151(3):1513-1530.
[29] Zoratti L,Karppinen K,Escobar A L,et al.Light-controlled flavonoid biosynthesis in fruits[J].Frontiers in Plant Science,2014,5(5):534.
[30] Eun C H,Kim S U,Kim I J.The promoter from the Citrus unshiu carotenoid isomerase gene directs differential GUS expression in transgenic Arabidopsis[J].Molecular Breeding,2015,35(5):116.
Cloning and Functional Analysis of VcMYB Promoter from Vaccinium corymbosum
SHI Wenjun1,TENG Ke2,CHEN Lu1,HOU Zhixia1,SU Shuchai1
(1.Beijing Forestry University,Key Laboratory for Silviculture and Conservation of Ministry of Education,Research & Development Center of Blueberry,Beijing 100083,China;2.Turfgrass Research Institute,College of Forestry,Beijing Forestry University,Beijing 100083,China)
Abstract:In order to study the regulatory role ofVcMYB promoter during the transcription,the promoter sequence of the VcMYB gene,regulated the proanthocyanidin synthesis genes from highbush blueberry,was cloned by the methods of FPNI-PCR.The 768 bp promoter sequence was analyzed by PLACE and Plant CARE.The analysis revealed that the promoter sequence contained CAAT-box,TATA-box and some cis-acting element such as light responsive element,cis-acting element involved in low-temperature,MeJA,defense and stress responsiveness.In order to study the function of VcMYB promoter,a promoter-reporter vector VcMYBpro::GUS was constructed,and introduced into Arabidopisis thaliana by Agrobacterium-mediated method.The result of GUS histochemical staining showed that GUS reporter gene expression was driven by VcMYB promoter in transgenic plants,and GUS enzyme activity of transgenic plants has increased after different treatments,including ABA(Abscisic acid),4 ℃ low temperature,LED light and continuous light.These results indicated that VcMYB promoter was regulated by ABA,low temperature and light.
Key words:Vaccinium corymbosum;VcMYB;Promoter;GUS gene;Proanthocyanidin
收稿日期:2017-02-02
基金项目:中央高校基本科研业务费专项资金资助项目(YX2013-12)
作者简介:史文君(1985-),女,青海民和人,在读博士,主要从事植物组织培养及分子生物学研究。
通讯作者:侯智霞(1973-),女,河北石家庄人,副教授,博士,硕士生导师,主要从事果树花果发育及品质调控研究。
中图分类号:Q78;S668.03
文献标识码:A
文章编号:1000-7091(2017)02-0014-07
doi:10.7668/hbnxb.2017.02.003