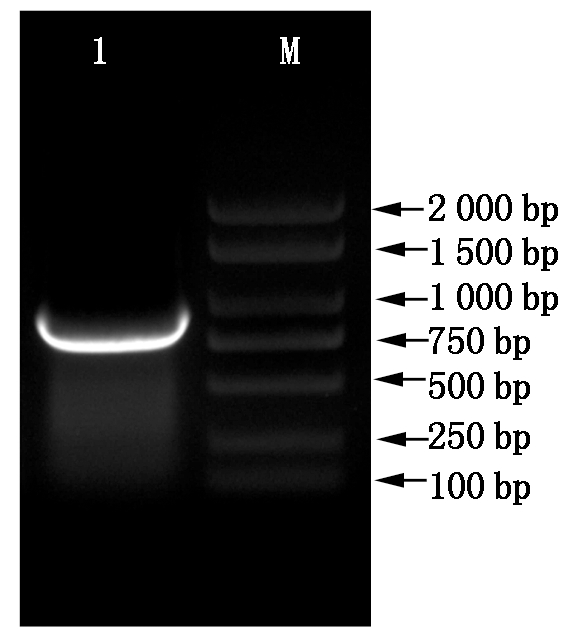
1.目的基因;M.DL2000 plus DNA Marker。1.Target gene;M.DL2000 plus DNA Marker.
图1 大豆GmZHD1基因的PCR扩增产物检测
Fig.1 Agarose gel electrophoresis of PCR amplification of GmZHD1 gene in soybean
摘要:为了揭示大豆ZF-HD基因的生物学功能,通过PCR的方法,从大豆栽培豆科丰1号中克隆了ZF-HD转录因子Glyma.02g040100,命名为GmZHD1。生物信息学分析表明,该基因的cDNA全长为888 bp,编码295个氨基酸,GmZHD1蛋白分子量约为32.64 kDa,等电点为7.69;序列分析表明,GmZHD1含有ZF-HD家族保守的锌指结构域和同源异形盒结构域,GmZHD1与FtHB2蛋白序列一致性最高,为44.4%;亚细胞定位结果显示GmZHD1定位于细胞核;荧光定量PCR结果表明,GmZHD1在大豆不同组织中都有表达,其中,花、种子和叶片中表达较高。此外,将GmZHD1基因连接到植物过表达载体pBA002上,为进一步研究大豆GmZHD1基因的功能奠定了基础。
关键词:大豆;GmZHD1;亚细胞定位;RT-PCR
同源异形盒基因(Homeobox gene,HB)是一类广泛存在于真核生物中的转录因子,与生物的生长发育密切相关。HB基因含有一段高度保守的大约180 bp的DNA序列,编码的60~63个氨基酸称为同源异形盒结构域(Homeobox domain),有螺旋-转角-螺旋基序,可以与DNA特异结合[1-2]。自从同源异形盒基因在果蝇中首次被发现以来[3],科学家们在其他生物如线虫、斑马鱼、小鼠、人类和植物中相继发现了同源异形盒基因[4-5]。研究表明,植物HB转录因子在响应环境变化[6]、花发育的调控[7]、胚胎和叶片发育[8-9]及激素应答[10-12]等方面发挥着重要作用。
同源异形盒基因在植物中是一个庞大的基因家族,由多个成员组成,如拟南芥中有大约100个成员[13]。根据HB基因中同源异形盒的序列、位置以及其他结构域,可以将HB家族分为6种类型:HD-Zip、PHD finger、BELL、ZF-HD、WOX和KNOX[14]。其中,ZF-HD为Zinc finger homeodomain,也称为PLINC(Plant Zinc Finger)[13],含有一个锌指结构域和同源异形盒结构域,是陆生植物特有的基因家族[15-16]。目前,在多个物种如拟南芥[13]、水稻[16]、杨树[15]、小立碗藓[16]、豆科植物[17-18]和葡萄[10]中鉴定了ZF-HD家族的基因。Windhövel等[19]在C4植物黄花菊(Flaveria trinervia)中发现4个ZF-HD基因可以特异结合叶肉细胞特异表达的PEPCase基因的启动子,暗示着这些基因可以调控PEPC基因的表达。Tan等[16]以拟南芥花特异表达基因的启动子序列为诱饵载体,通过酵母单杂交实验筛选到了一系列ZF-HD转录因子,这些ZF-HD转录因子在花中的表达高于其他组织。最近有研究发现,在拟南芥中过量表达AtHB25后,花期提前,细胞和种子变大,并且种子寿命延长[20]。Figueiredo等[21]通过酵母单杂交筛选到7个调控OsDREB1B基因表达的转录因子,其中有4个为ZF-HD基因(包括OsZHD1和OsZHD2),表明这些转录因子参与调控基因对逆境胁迫的响应。Xu等[9]从一个水稻卷叶突变体中定位到了OsZHD1,过表达OsZHD1及其同源基因OsZHD2都可以使水稻叶片发生卷曲,进一步的研究表明,OsZHD1在水稻叶片形态发生尤其是泡状细胞的形成和分布中行使功能。GmCAM4是大豆响应病原菌胁迫的钙调蛋白家族成员之一,Park等[22]发现,大豆GmZF-HD1和GmZF-HD2可以结合GmCAM4的启动子进而调控基因的表达。这些研究表明,ZF-HD基因在植物叶片和花的生长发育、种子贮藏以及病原菌胁迫方面具有重要的作用。需要指出的是,根据序列的多态性ZF-HD家族成员被划分为7个Class,其中AtHB22、AtHB25和OsZHD1属于Class Ⅰ,而GmZF-HD1和GmZF-HD2属于Class VI[15]。
本研究克隆了OsZHD1、AtHB22和AtHB25在大豆中的同源基因Glyma.02g040100,命名为GmZHD1,对其编码蛋白进行了生物信息学分析;同时,研究了GmZHD1在洋葱表皮细胞中的定位以及GmZHD1在大豆不同组织中的表达情况。此外,构建了植物过表达载体pBA002-GmZHD1,旨在为今后在大豆中过表达GmZHD1基因来研究其功能奠定基础。
1.1 试验材料及试剂
试验材料为大豆栽培豆科丰1号,由南京农业大学国家大豆改良中心提供。取大豆的根、茎、叶、花、荚和种子,迅速用液氮冷冻后保存于-80 ℃冰箱。
载体与试剂:pMD19-T载体购于宝生物工程(大连)有限公司;亚细胞定位载体HBT-sGFP(S65T)-NOS(http://www.ncbi.nlm.nih.gov/nucleotide/118640535)由南京农业大学大豆实验室保存;植物过表达载体pBA002(10 182 bp)含有bar基因,具有草丁膦抗性,由中国科学院遗传与发育生物学研究所陈受宜研究员惠赠[23];大肠杆菌感受态DH5α、植物总RNA提取试剂盒(DP437)和质粒大提试剂盒(DP117)购于天根生化科技有限公司;高保真酶Phanta® Max Super-Fidelity DNA Polymerase(P505)、菌液PCR所用的普通Taq酶2×Taq Plus Master Mix(P212-01)、反转录试剂盒(R232-01)和荧光定量试剂盒(Q141-02)均购于南京诺唯赞生物科技有限公司;胶回收试剂盒和质粒小提试剂盒购于Axygen公司;限制性内切酶BamH Ⅰ、Xho Ⅰ、Sac Ⅰ和T4连接酶购于Thermofisher公司。引物合成及测序工作由华大公司完成。
1.2 总RNA提取和cDNA合成
使用RNA提取试剂盒提取大豆不同组织的总RNA,1%的琼脂糖凝胶电泳确定RNA质量后,将RNA储存于-80 ℃冰箱备用。使用反转录试剂盒将大约2 μg RNA反转录成cDNA,保存于-20 ℃冰箱。
1.3 GmZHD1基因的克隆
根据Phytozome网站(https://phytozome.jgi.doe.gov/pz/portal.html#)上大豆GmZHD1(Glyma.02g040100)基因序列,使用Primer Premier 5.0软件设计引物用于GmZHD1基因的扩增。上下游引物分别为:sense:5′-ATGAACGAATACACCTTTGGAC-3′,anti-sense:5′-CTAGGGCTTCTTACCGAGGG-3′。以大豆叶片cDNA为模板,进行PCR扩增。反应体系为50 μL:2×Phanta Max Buffer 25 μL,dNTP Mix(dATP、dCTP、dGTP和dTTP的预混溶液,各自的浓度为10 mmol/L)1 μL,模板2 μL,上下游引物(10 μmol/L)各2 μL,Phanta Max Super-Fidelity DNA Polymerase(1 U/μL)1 μL,ddH2O 17 μL。PCR扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,33个循环;72 ℃延伸5 min,4 ℃保存。使用1%琼脂糖凝胶对PCR产物进行电泳,割胶回收后加A接头连接至pMD19-T载体,转化大肠杆菌DH5α感受态细胞,筛选阳性克隆后测序。
1.4 GmZHD1的生物信息学分析
利用网站http://web.expasy.org/protparam/分析GmZHD1蛋白的理化性质;使用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)和GOR4(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_gor4.html)分别对磷酸化位点和蛋白二级结构进行分析;使用ProtComp 9.0(http://www.softberry.com/berry.phtml)预测蛋白的亚细胞定位。
利用NCBI CDD数据库预测GmZHD1蛋白的功能结构域;在NCBI网站下载ZF-HD蛋白序列,使用Clustal X 2.0[24]进行蛋白质序列多重比对。使用MEGA 6.0[25]绘制进化树,使用邻接法进行分析,主要参数设置为:距离模型,p-distance;稳健性检测,Bootstrap法,1 000次重复;空位缺失数据的处理,Pairwise deletion。构建进化树的蛋白包括:水稻OsZHD1-11[15];拟南芥ZF-HD:AtHB21-34[16];黄花菊:FtHB1-4[19];大豆GmZF-HD1和GmZF-HD2[22]。
1.5 亚细胞定位载体HBT-GmZHD1的构建
为构建亚细胞定位载体,在引物的5′端添加酶切位点和保护碱基,GmZHD1-F:5′-CGCGGATCCAT GAACGAATACACCTTTGGAC-3′,GmZHD1-R: 5′-CG CGGATCCGGGCTTCTTACCGAGGGT-3′(去掉终止密码子TAG),下划线为BamHⅠ酶切位点序列。以测序正确的上述质粒为模板,进行PCR扩增,反应体系和扩增程序如上所述。将PCR产物和亚细胞定位载体HBT-sGFP(S65T)-NOS分别用BamH Ⅰ进行单酶切,电泳后的胶回收产物在T4连接酶作用下22 ℃连接30 min。连接产物转化大肠杆菌DH5α,涂布含有Amp(50 μg/mL)的LB固体平板。挑选单克隆进行菌液PCR,阳性菌液提取质粒后进行酶切验证,含有目的基因片段的菌液送测序,查看连接方向是否正确。将测序正确的菌液用试剂盒大提质粒,并对质粒进行浓缩。
1.6 亚细胞定位
亚细胞定位参考Campo等[26]的方法。首先用基因枪(Bio-Rad)将含有目标基因的载体HBT-GmZHD1和不含目标基因的空载HBT-sGFP(S65T)-NOS分别转化至洋葱(Allium cepa)表皮细胞,然后将洋葱表皮放置在光照培养箱中,24 ℃黑暗条件培养16~24 h,最后用激光共聚焦显微镜(LSM780,Zeiss)查看GmZHD1的亚细胞定位情况。
1.7 GmZHD1基因表达特性分析
采用RT-PCR(Real-time PCR)检测GmZHD1基因在大豆不同组织中的表达情况。根据GmZHD1基因序列设计定量引物:sense: 5′-ATGCTTGAACTT GCTGAAAAACTA-3′,anti-sense:5′-GCTTCTTACCGA GGGTGTGC-3′。大豆基因Tubulin(GenBank:AY907703.1)为内参,引物序列为sense:5′-GGAGT TCACAGAGGCAGAG-3′,anti-sense:5′-CACTTACGC ATCACATAGCA-3′。RT-PCR反应体系为20 μL:10 μL 2×Master Mix,2.5 μL 0.5 mmol/L primer 1,2.5 μL 0.5 mmol/L primer 2,5 μL cDNA(反转录获得的cDNA用ddH2O稀释10倍)。RT-PCR扩增条件为:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。所用仪器为ABI7500,每个样品设3次重复,数据用ABI 7500 Sequence Detection System(SDS)software分析。使用2-ΔΔCt法[27]计算GmZHD1基因的表达,使用Origin 9.0软件绘图。
1.8 植物过表达载体pBA002-GmZHD1的构建
为构建植物过表达载体,设计含有酶切位点的引物,GmZHD1-XF:5′-CCGCTCGAGATGAACGAATA CACCTTTGGACA-3′,GmZHD1-SR:5′-CCGGAGCTCC TAGGGCTTCTTACCGAGGGT-3′(含终止密码子),下划线分别为XhoⅠ和SacⅠ酶切位点序列。以测序正确的质粒为模板,进行PCR扩增反应。将扩增的片段连接到植物过表达载体pBA002上,将PCR检测和酶切鉴定为阳性的质粒测序,测序正确的质粒用于后续植物转基因研究。
2.1 GmZHD1基因序列的扩增
利用PCR方法从大豆叶片cDNA中扩增GmZHD1基因,经PCR扩增得到了1 000 bp左右条带(图1),该片段与预期目的片段大小一致。对PCR产物电泳回收后,将回收产物克隆到pMD19-T载体,转化大肠杆菌DH5α后挑选阳性克隆测序。测序结果表明GmZHD1基因全长CDS为888 bp,与Phytozome中大豆Glyma.02g040100的CDS序列完全一致,即目的基因克隆成功,将该基因命名为GmZHD1。

1.目的基因;M.DL2000 plus DNA Marker。1.Target gene;M.DL2000 plus DNA Marker.
图1 大豆GmZHD1基因的PCR扩增产物检测
Fig.1 Agarose gel electrophoresis of PCR amplification of GmZHD1 gene in soybean
2.2 大豆GmZHD1的生物信息学分析
ProtParam分析表明,GmZHD1编码295个氨基酸,理论上GmZHD1蛋白分子质量为32.64 kDa,等电点为7.69,不稳定系数为49.12,为不稳定蛋白。磷酸化是一种普遍的蛋白质修饰方式,与绝大多数细胞活动密切相关[28]。NetPhos 3.1 Server预测结果表明,GmZHD1蛋白存在19个苏氨酸、9个丝氨酸和3个酪氨酸的磷酸化位点(图2),暗示着蛋白的翻译后修饰可能对GmZHD1蛋白功能的实现具有重要作用。
使用GOR4 对GmZHD1的二级结构进行预测,结果表明,α螺旋(Hh)占39.66%,伸展链(Ee)占12.88%,无规则卷曲(Cc)占47.46%。此外,ProtComp 9.0预测GmZHD1定位在细胞核。
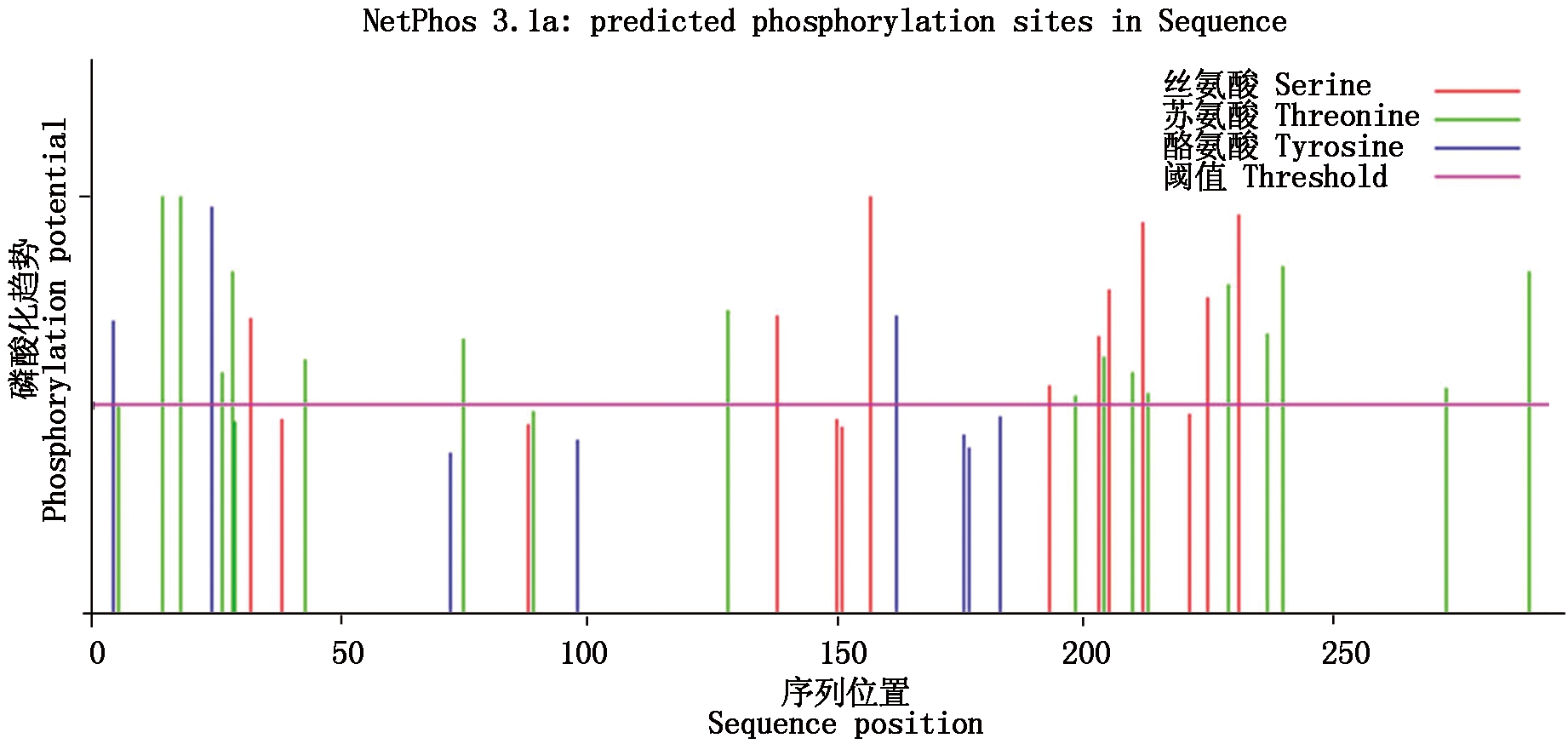
图2 GmZHD1蛋白的磷酸化位点预测
Fig.2 Phosphorylation prediction of GmZHD1 protein
将拟南芥、水稻和黄花菊中的ZF-HD蛋白与GmZHD1构建系统进化树,结果表明,GmZHD1与FtHB2、AtHB22、AtHB25、OsZHD1、OsZHD2为一个分支,表明它们亲缘关系较近(图3);而GmZF-HD1和GmZF-HD2处于进化树外围位置的另外一个分支上,表明它们与GmZHD1亲缘关系较远。将FtHB2、AtHB22、AtHB25、OsZHD1和OsZHD2与GmZHD1的蛋白序列进行比对,发现这些蛋白含有2个保守结构域(图4),即GmZHD1的97-147AA和232-295AA区域,分别为锌指结构域(Zinc finger domain)和同源异形盒结构域(Homeodomain),前者介导蛋白二聚体的形成,后者可以与DNA特异结合。此外,GmZHD1与FtHB2序列一致性最高,为44.4%;GmZHD1与AtHB22、AtHB25、OsZHD1和OsZHD2序列一致性较高,分别为41.6%,36.9%,43.4%,42.2%。
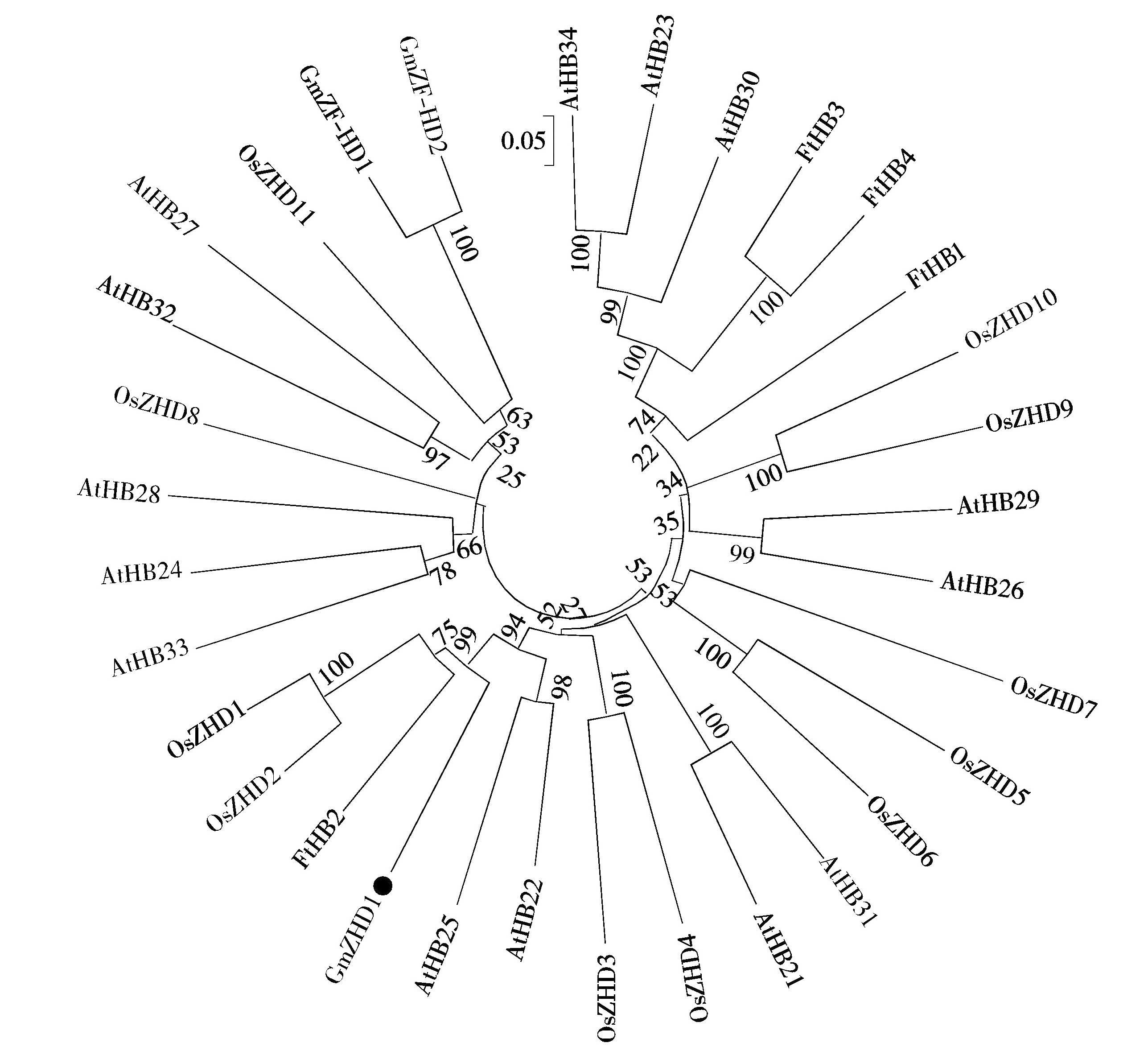
图3 GmZHD1和其他物种ZHD蛋白的系统进化树
Fig.3 The phylogenetic tree between GmZHD1 and other ZHD proteins in plants

图4 四种植物中ZHD的氨基酸序列比对
Fig.4 Multiple sequence alignments of amino acids of the ZHD proteins from four plants
2.3 GmZHD1的亚细胞定位
利用单酶切方法构建了亚细胞定位载体HBT-GmZHD1(图5),然后用基因枪将HBT-GmZHD1载体转化洋葱表皮细胞,空载HBT-sGFP(S65T)-NOS作为阳性对照。亚细胞定位显示在洋葱表皮细胞的细胞核中可以检测到GFP信号(图6),初步证明GmZHD1定位于细胞核。
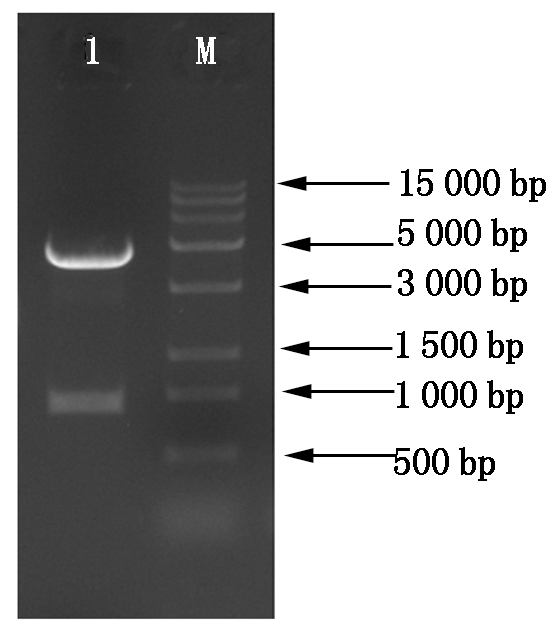
1.BamH Ⅰ单酶切片段;M.DL15000 DNA Marker。1.Fragments of vector digested by BamHⅠ;M.DL15000 DNA Marker.
图5 HBT-GmZHD1的酶切鉴定
Fig.5 Restriction enzyme digestion of HBT-GmZHD1
2.4 GmZHD1的组织表达分析
为了研究GmZHD1基因的表达模式,利用RT-PCR技术分析了GmZHD1在大豆不同组织中的表达情况。结果表明,GmZHD1在根、茎、叶、花、荚和种子中都有表达,但是不同组织的表达存在明显差异(图7)。其中,花中表达量最高,其次是种子和叶片,根、茎和荚中表达量较低,推测GmZHD1可能在大豆花、叶片和种子发育过程中具有重要作用。

1.暗场;2.明场;3.融合;上.阳性对照;下.GmZHD1。1.Dark field;2.Bright field;3.Merge;Upper panel.Positive control;Lower panel.GmZHD1.
图6 GmZHD1的亚细胞定位
Fig.6 Subcellular location of GmZHD1
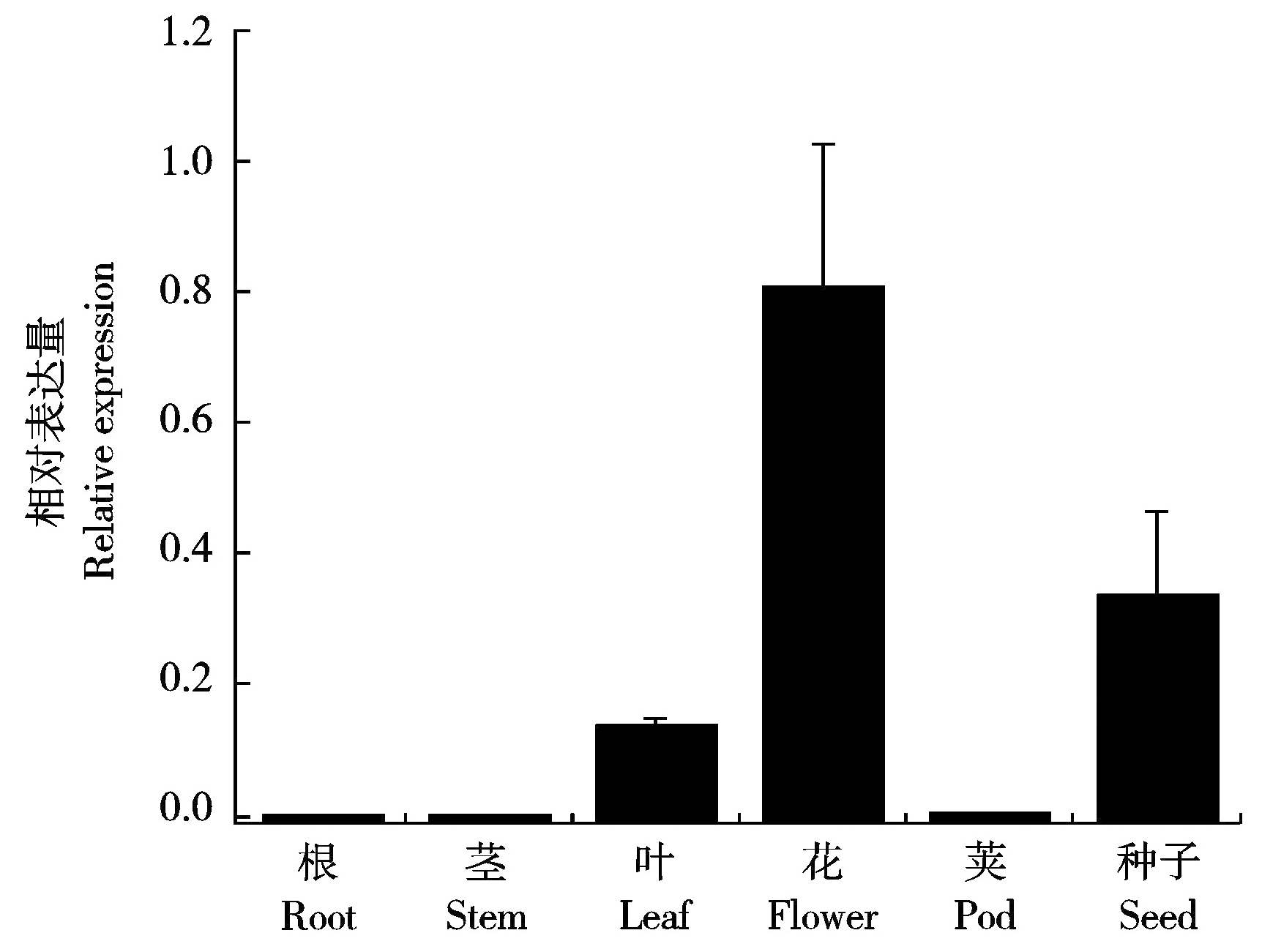
图7 GmZHD1在大豆不同组织中的表达分析
Fig.7 Expression analysis of GmZHD1 in different tissues of soybean
2.5 GmZHD1植物过表达载体的构建
利用双酶切方法构建了植物过表达载体pBA002-GmZHD1,利用限制性内切酶Xho Ⅰ和SacⅠ将载体切为2个片段,分别为10 134,888 bp,表明载体构建成功(图8)。
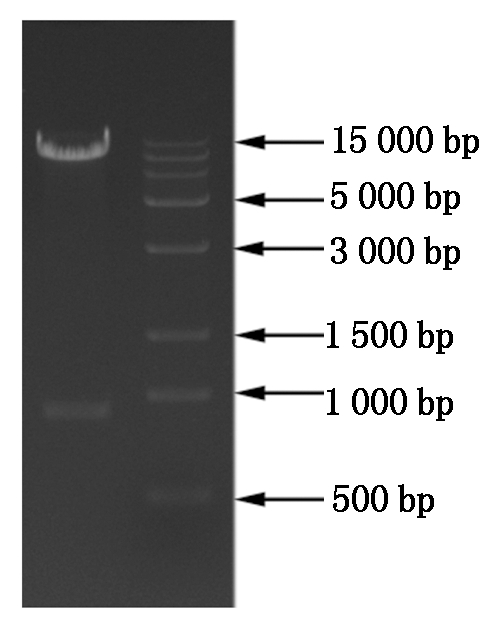
1.XhoⅠ/SacⅠ酶切片段;M.DL15000 DNA Marker。1.Fragments of vector digested by Xho Ⅰ/Sac Ⅰ;M.DL15000 DNA Marker.
图8 pBA002-GmZHD1的酶切鉴定
Fig.8 Restriction enzyme digestion of pBA002-GmZHD1
植物在生长发育过程中,可以产生一系列从细胞到生理水平的应答反应来适应外界环境的变化,这些反应通常由转录因子通过抑制或激活基因的表达来完成[29]。HB基因家族是植物众多转录因子家族之一,在植物生长发育过程中发挥作用。本研究从大豆中克隆了1个ZF-HD家族基因Glyma.02g040100,将其命名为GmZHD1。该基因编码295个氨基酸,蛋白序列分析发现其具有典型的ZF-HD家族的锌指结构域和同源异形盒结构域。前人的研究表明,OsZHD1含锌指结构域的N端1-111AA序列具有转录自激活活性,而含同源异形盒结构域的C端112-279AA并不存在自激活[9];黄花菊中ZF-HD基因的N端结构域与其同源蛋白可以形成二聚体,N端结构域则主要负责结合DNA[19]。进化分析结果表明,同一个分支中同时包含拟南芥和水稻的基因,推测基因组复制可能发生在基因功能分化之前;相比黄花菊、拟南芥和水稻ZF-HD家族的其他成员,GmZHD1与FtHB2、AtHB22、AtHB25、OsZHD1和 OsZHD2亲缘关系更近,推测它们可能具有相似的功能。亚细胞定位结果表明,GmZHD1定位在细胞核,这与其同源蛋白OsZHD1的定位结果是一致的[9-21],预示着GmZHD1作为转录因子行使功能,对于下一步GmZHD1基因功能的研究具有指导意义。
ZF-HD家族基因在植物的各个组织器官中都有表达,但是不同基因之间的表达水平存在差异。如在拟南芥ZF-HD基因(AtHB21-34)中,AtHB24和AtHB29在根中的表达明显高于其他基因,AtHB22和AtHB25在花中表达量较高,其中AtHB22在开放的花中表达较高,而AtHB25在花序中表达较高[16];水稻OsZHD1在根、叶片、小穗和节间都有表达,并且基因的转录水平随着叶片和小穗发育时期的变化而有所不同[9];黄花菊FtHB22在叶片和茎中表达,而在根中的表达几乎检测不到。荧光定量结果显示,GmZHD1在大豆花、叶片和种子中表达较高,其中花中表达最高,暗示GmZHD1可能在这些组织中发挥作用。
ZF-HD家族成员之间具有相似的结构域,可能存在功能冗余的现象。如拟南芥AtHB22、AtHB23、AtHB25、AtHB29、AtHB31、AtHB32、AtHB33和AtHB34的T-DNA插入突变体,与野生型拟南芥相比,Tan和Irish[17]并没有观测到发育和形态学方面的差异。同时,水稻中OsZHD1干扰转基因植株和T-DNA插入突变体中,尽管OsZHD1表达明显降低,但是并没有导致形态学上的变化[9]。不过,在拟南芥中过量表达AtHB25后,拟南芥种子变大,花期提前,转录组学分析结果表明一些GA诱导的基因上调表达,同时一些GA抑制(如响应ABA、脱水和非生物胁迫)的基因下调表达[20]。有意思的是,水稻OsZHD1和OsZHD2不仅与叶片卷曲有关,而且可以抑制胁迫响应基因OsDREB1B的表达[21],这些研究表明AtHB25、OsZHD1和OsZHD2可能在种子和花朵发育和/或植物响应胁迫过程中发挥作用。本研究构建了植物过表达载体pBA002-GmZHD1,为后续通过转基因来研究大豆GmZHD1基因的功能奠定了基础。
参考文献:
[1] 刘国振, 朱立煌. 植物同源盒基因的克隆与功能研究[J]. 遗传,1998,20(3):42-47.
[2] 郝 好, 崔永涛,钱 前, 等. 水稻同源异形盒基因的研究进展[J]. 中国稻米, 2016(1): 1-9.
[3] Gehring W J, Affolter M, Burglin T. Homeodomain proteins[J]. Annual Review of Biochemistry, 1994, 63(1): 487-526.
[4] Vollbrecht E, Veit B, Sinha N, et al. The developmental gene Knotted-1 is a member of a maize homeobox gene family[J]. Nature, 1991, 350(6315): 241-243.
[5] Nam J, Nei M. Evolutionary change of the numbers of homeobox genes in bilateral animals[J]. Molecular Biology and Evolution, 2005, 22(12): 2386-2394.
[6] Shu Y, Tao Y, Wang S, et al. GmSBH1, a homeobox transcription factor gene, relates to growth and development and involves in response to high temperature and humidity stress in soybean[J]. Plant Cell Rep, 2015, 34(11): 1927-1937.
[7] Nakamura M, Katsumata H, Abe M, et al. Characterization of the class IV homeodomain-leucine zipper gene family in Arabidopsis[J]. Plant Physiology, 2006, 141(4): 1363-1375.
[8] Nakata M, Matsumoto N, Tsugeki R, et al. Roles of the middle domain-specific WUSCHEL-RELATED HOMEOBOX genes in early development of leaves in Arabidopsis[J]. Plant Cell, 2012, 24(2): 519-535.
[9] Xu Y, Wang Y, Long Q, et al. Overexpression of OsZHD1 , a zinc finger homeodomain class homeobox transcription factor, induces abaxially curled and drooping leaf in rice[J]. Planta, 2014, 239(4): 803-816.
[10] Wang H, Yin X, Li X, et al. Genome-wide identification, evolution and expression analysis of the grape (Vitis vinifera L.) zinc finger-homeodomain gene family[J]. Int J Mol Sci, 2014, 15(4): 5730-5748.
[11] Zhang S, Haider I, Kohlen W, et al. Function of the HD-Zip I gene Oshox22 in ABA-mediated drought and salt tolerances in rice[J]. Plant Mol Biol, 2012, 80(6): 571-585.
[12] Turchi L, Baima S, Morelli G, et al. Interplay of HD-Zip Ⅱ and Ⅲ transcription factors in auxin-regulated plant development[J]. J Exp Bot, 2015, 66(16): 5043-5053.
[13] Mukherjee K, Brocchieri L, Bürglin T R. A comprehensive classification and evolutionary analysis of plant homeobox genes[J]. Molecular Biology & Evolution, 2009, 26(12): 2775-2794.
[14] Ariel F D, Manavella P A, Dezar C A, et al. The true story of the HD-Zip family[J]. Trends Plant Sci, 2007, 12(9): 419-426.
[15] Wei H, Depamphilis C W, Ma H. Phylogenetic analysis of the plant-specific zinc finger-homeobox and mini zinc finger gene families[J]. Journal of Integrative Plant Biology, 2008, 50(8): 1031-1045.
[16] Tan Q K, Irish V F. The Arabidopsis zinc finger-homeodomain genes encode proteins with unique biochemical properties that are coordinately expressed during floral development[J]. Plant Physiol, 2006, 140(3): 1095-1108.
[17] Bhattacharjee A, Ghangal R, Garg R, et al. Genome-wide analysis of homeobox gene family in legumes: identification, gene duplication and expression profiling[J]. PLoS One, 2015, 10(3): e0119198.
[18] 张大勇, 王长彪, 易金鑫, 等. 大豆ZF-HD蛋白家族的全基因组序列特征分析[J]. 江苏农业学报,2011,
27(3): 675-677.
[19] Windhövel A, Hein I, Dabrowa R, et al. Characterization of a novel class of plant homeodomain proteins that bind to the C4 phosphoenolpyruvate carboxylase gene of Flaveria trinervia[J]. Plant Molecular Biology, 2001, 45(2): 201-214.
[20] ![]() l. Arabidopsis thaliana HOMEOBOX25 uncovers a role for Gibberellins in seed longevity[J]. Plant Physiology, 2014, 164(2): 999-1010.
l. Arabidopsis thaliana HOMEOBOX25 uncovers a role for Gibberellins in seed longevity[J]. Plant Physiology, 2014, 164(2): 999-1010.
[21] Figueiredo D D, Barros P M, Cordeiro A M, et al. Seven zinc-finger transcription factors are novel regulators of the stress responsive gene OsDREB1B[J]. J Exp Bot, 2012, 63(10): 3643-3656.
[22] Park H C, Kim M L, Lee S M, et al. Pathogen-induced binding of the soybean zinc finger homeodomain proteins GmZF-HD1 and GmZF-HD2 to two repeats of ATTA homeodomain binding site in the calmodulin isoform 4 (GmCaM4) promoter[J]. Nucleic Acids Res, 2007, 35(11): 3612-3623.
[23] 宁爱玲, 杜海平, 喻德跃, 等. GmAOC3基因转化载体构建及转化大豆的初步研究[J]. 大豆科学,2015,34(4): 588-596.
[24] Larkin M A, Blackshields G, Brown N P, et al. Clustal W and Clustal X version 2.0[J]. Bioinformatics, 2007, 23(21): 2947-2948.
[25] Tamura K, Stecher G, Peterson D, et al. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0[J]. Mol Biol Evol, 2013, 30(12): 2725-2729.
[26] Campo S, Segundo B S. Overexpression of a calcium-dependent protein kinase confers salt and drought tolerance in rice by preventing membrane lipid peroxidation[J]. Plant Physiology, 2014, 165(2): 688-704.
[27] Schmittgen T D, Livak K J. Analyzing Real-time PCR data by the comparative CT method[J]. Nature Protocols, 2008, 3(6): 1101-1108.
[28] Humphrey, James, David E, et al. Protein phosphorylation: A major switch mechanism for metabolic regulation[J]. Trends in Endocrinology & Metabolism, 2015, 26(12): 676-687.
[29] Harris J C, Hrmova M, Lopato S, et al. Modulation of plant growth by HD-Zip class Ⅰ and Ⅱ transcription factors in response to environmental stimuli[J]. New Phytol, 2011, 190(4): 823-837.
Cloning and Expression Analysis of ZF-HD Transcription Factor GmZHD1 in Glycine max
Abstract:The ZF-HD(Zinc finger homeodomain)transcription factors,which belong to Homeobox protein family,are unique to plant kingdom and play an important role in the development of flowers and leaves in plants.The Glyma.02g040100 gene,a ZF-HD transcription factor,was isolated from soybean cultivar Kefeng No.1 by PCR method and was named asGmZHD1.Bioinformatics analysis showed that this gene contained 888 bp encoding 295 amino acid residues and the molecular weight of GmZHD1 protein was 32.64 kDa with a theoretical isoelectric point(pI)7.69.Sequence analysis indicated that GmZHD1 possessed two conserved domains,a zinc finger domain and a homeobox domain,and shares highest sequence similarity with FtHB2(44.4%);The result of subcellular localization indicated that GmZHD1 was located in nucleus;And RT-PCR results showed that GmZHD1 expressed in all tissues detected,and with relatively higher transcript expression levels in flower,seed and leaf.In addition,the GmZHD1 was linked to the plant over-expression vector pBA002 successfully,providing foundation for further study on the function of GmZHD1 in soybean.
Key words:Glycine max;GmZHD1;Subcellular localization;RT-PCR
收稿日期:2017-02-03
基金项目:国家自然科学基金项目(31371644)
中图分类号:S565.1;Q78
文献标识码:A
文章编号:1000-7091(2017)02-0001-07
doi:10.7668/hbnxb.2017.02.001